需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
的剪切粘合地图使用SynVivo合成微血管网络代
摘要
Flow chambers used in adhesion experiments typically consist of linear flow paths and require multiple experiments at different flow rates to generate a shear adhesion map. SynVivo-SMN enables the generation of shear adhesion map using a single experiment utilizing microliter volumes resulting in significant savings in time and consumables.
摘要
细胞/颗粒附着测定是了解参与了疾病的病理生理生化相互作用的关键,并有在追求新颖的治疗学的发展的重要应用。使用静态条件下测定无法捕捉粘附于剪切的依赖性,限制了其在体内环境的相关性。该量化生理流体流动下黏附平行平板流动腔室需要多个实验进行的剪切粘合地图的产生。另外,它们并不代表本体内规模和形态以及需要的试剂的大体积(〜毫升),用于实验。在这项研究中,我们证明了剪切粘合地图的生成使用基于微流体装置,SynVivo-SMN微血管网络中的一个实验。这个装置重现体内脉管系统的复杂的包括几何尺度,形态元素,流动特性和在细胞相互作用体外格式,从而提供基本的生物学现实环境中,在细胞行为,药物输送和药物发现应用研究。证实该检测方法通过研究2μm的生物素包被的颗粒与微芯片的抗生物素蛋白包被的表面的相互作用。在一个单一的检测使粘着与剪切地图为在生理条件下的颗粒,得到的剪切在微血管观察到的整个范围。
引言
电流测定来研究细胞 - 细胞和粒子与细胞的相互作用典型地涉及在其中的颗粒或细胞被培养于基质蛋白或细胞贴壁静态孔板形式。在指定的温育时间结束时,粘附的颗粒或细胞的数量正在使用显微镜1量化。尽管这些测定提供显著洞察这些相互作用背后的生化过程,一个关键限制是缺乏生理流体流(典型的微循环)和其上的粒子粘附的影响。
为了克服这一限制, 在体外流动室已被开发,近年来。这些流室常见的元素是灌注在低雷诺数相匹配的血管观察体内 2壁面剪切率的透明设备。血管壁的上的流量C一个表面模拟了生物分子的任涂层或细胞生长汉伯3。颗粒4-7或8-16细胞中,然后流入在流率的所需范围来量化在各种剪切速率下附着粒子的数量。
然而,使用平行板流动室来研究和验证生物化学现象是相当昂贵和费时的。这主要是由于这样的事实:多个实验需要被用于产生所述流体剪切力与附着粒子/细胞数目的地图进行。此外,平板流室需要大量的试剂由于其大尺寸(高度> 250微米,宽度> 1毫米)。最后,这些设备没有精确地模拟几何特征( 例如 ,分叉)和流量条件( 如 ,会聚与发散流)存在于体内 。
基于光刻微细17-19的最新进展,加快实验室上的一个芯片领域设备20-21。这些设备已经在开发工具的平行板流动腔与在微米政权尺寸的小型化版本。在尺寸减少量也在试剂,细胞或所需的实验粒子的体积方面产生显著效益。然而,目前可用的设备的一个关键限制是使用线性信道模型微血管,其中不模仿复杂的微脉管系统的体内观察到的。
最近,我们开发了一种新颖的方法,用于重建微血管网络上的一次性塑料基板造成的体内条件下合成的表示。这些设备被称为SynVivo - 合成微血管网(SMN)采用基于软光刻工艺的PDMS发展。 SynVivo-SMN设备可用于获得细胞/颗粒附着22剪切粘合地图,研究靶向给药23和hAVE被证实在体内对数据24-25。在本文中,我们提出了一个协议,使一代剪切粘合地图从体积小到1-5微升从而导致显著节省资源和时间的一次实验。
Access restricted. Please log in or start a trial to view this content.
研究方案
1,底漆的SynVivo-SMN微流体装置
- 该设备的每个端口(进/出)是由两个并行端口-一个用于在表面涂层的部分流(粘附分子,生长基质,等)和/或细胞的播种和其它用于运行试验( 图1A中 )。
- 完全浸没SynVivo-SMN微流体装置( 图1B)在含有无菌去离子(DI)水的培养皿中,然后将培养皿放入真空干燥器中。使干燥器运行,直到所有的空气从设备的信道被去除。这大约需要15分钟。
- 之前,从水中除去该装置中,将聚乙烯管(0.06 OD“和0.02 ID”)引物与水进入设备用细点钳子的每个端口。油管长度应该在大约1英寸。该装置现在可以从水中取出。 图1C表示德维克的图像E使用的管材。
2,涂层的微流体装置与所需的蛋白质( 例如 ,抗生物素蛋白)
- 使用移液管,将周围的一个输入口管的基极一滴水(约100微升)。小心地取出用来总理设备管路。水滴将防止空气进入设备。
- 制备1ml注射器装载有抗生物素蛋白以20微克/ ml的浓度。将注射器接到一个24政不锈钢针及导管。管插入到该装置的入口端口中的一个。夹持不被利用用颚夹进气口。
- 注射抗生物素蛋白在1微升/分钟和10分钟的流速,以允许该设备的完整的灌注。在流动结束时,夹持与爪钳油管和放置设备,在4℃过夜。
3,流动的生物素颗粒的附着力实验
- 允许设备恢复到室温。放置在装置上配备有电动载物台和一个高性能相机的倒置荧光显微镜。
- 准备2微米的生物素化的粒子的溶液以5×10 6个颗粒/在磷酸盐缓冲盐水(PBS)ml的浓度。加载粒子成1ml注射器。准备第二次1ml注射器的PBS只。加载每个注射器的注射泵,并连接到针头和导管。
- 使用移液管,将围绕所述入口管道的所述基座一滴水(约100微升)。小心取出用于涂层设备的油管。水滴将防止空气进入设备。
- 小心地将管子的对生物素化的颗粒及PBS从步骤3.2到各进气口。 图2A示出的设立图像。
- 开始以2.5微升/分钟的流速注入生物素化的颗粒。监视在显微镜进气口。在第一个迹象颗粒,开始定时器,并继续3分钟流动。
- 在该3分钟结束时,停止生物素化的颗粒的流动的同时,凝视的PBS中以2.5微升/分钟的流速流动。允许PBS中流动的设备中持续3分钟,洗掉未结合的颗粒。
4,获取图像,并且使之利息(AOI)测量面积使用映像软件(NIKON元素)
- 使用在成像软件的“扫描大图”函数来获取整个设备的图像。
- 顺序编号在设备中的分岔,并创建一个圆形AOI与通道直径的两倍。在这种情况下,AOI直径设定为200μm以下,因为该通道直径为100微米。
- 使用在成像软件自动计数功能,以在每个AOI粒子数导出到MS Excel表。
- 同样,使用自动计数功能的粒子数导出的整个设备。
5,采用计算流体动力学(CFD)模型的粒子通量分析
- CFD模拟使用市售软件(CFD-ACE +,ESI公司)为SynVivo-SMN设备拓扑运行。结果被存储在数据库中,用于分析的实验观察。上壁的剪切速率,速度,粒子通量,并在该装置粘附仿真结果存储信息。
- 仿真结果被用于确定输入基于给定的入口的粒子浓度每AOI颗粒的数目。
6。产生剪切粘合地图
- 由流过如公式6.1分岔颗粒中分岔的附着粒子除以计算%的附着性。
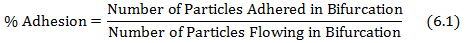
其中从对得到的粒子附着和流过的粒子的个数rotocol步骤4.3和5.2,分别。 - 积使用的剪切速率在从数据库中的步骤(5.1)中获得的网络和从方程6.1中得到的%粘合力值的每个分叉的剪切粘合地图。
Access restricted. Please log in or start a trial to view this content.
结果
图1A示出SynVivo-SMN装置的示意和明视场图象。 图1B示出了SynVivo-SMN装置安装在载玻片上。 图1C示出了该装置与管道下吸水在真空干燥器中。
图2A示出了实验,建立了图2B的图像显示了典型的抗生物素蛋白包被的SynVivo-SMN设备以下2μm的生物素化的颗粒的结合。注意,粒子附近的网络中的分岔优先附着。
Access restricted. Please log in or start a trial to view this content.
讨论
平行平板流动腔室,同时提供显著见解细胞 - 细胞和细胞 - 颗粒相互作用,存在一些限制,如高消耗的试剂和需要多次实验中,以产生剪切粘合地图。使用SynVivo -合成微血管网络(SynVivo -脊髓运动神经元)的使之从模仿条件在体内条件下一次实验的剪切附着力地图的生成。此外,显著节省(> 95%)的试剂也得到。
在运行的粒子黏附实验SynVivo-SMN最重要的一步是确保?...
Access restricted. Please log in or start a trial to view this content.
披露声明
发行手续费本文利用CFD研究公司赞助。
致谢
SynVivo技术被授予下#2R44HL076034从NHLBI发展。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| SynVivo-SMN | CFD Research | SMN-001 | Exclusive at CFDRC |
| CFD-ACE+ | ESI Inc. | N/A | |
| Avidin | Invitrogen | 43-4401 | Any avidin source will work for this assay |
| Biotinylated Particles | Polysciences | 24173-1 | Any source of biotinylated particles will work for the assay |
| Tygon Tubing | VWR | 63018-044 | Size is typical for use with SynVivo-SMN |
| NIKON Elements | NIKON Instruments | N/A | Any other imaging software can be used |
参考文献
- Weitz-Schmidt, G., Chreng, S. Cell adhesion assays. Methods Mol Biol. 757, 15-30 (2012).
- Parsons, S. A., Jurzinsky, C., Cuvelier, S. L., Patel, K. D. Studying leukocyte recruitment under flow conditions. Methods Mol Biol. 946, 285-300 (2013).
- Luscinskas, F. W., Gimbrone, M. A. Jr Endothelial-dependent mechanisms in chronic inflammatory leukocyte recruitment. Annu Rev Med. 47, 413-421 (1996).
- Adriani, G., et al. The preferential targeting of the diseased microvasculature by disk-like particles. Biomaterials. 33, 5504-5513 (2012).
- Decuzzi, P., et al. Flow chamber analysis of size effects in the adhesion of spherical particles. Int J Nanomedicine. 2, 689-696 (2007).
- Zou, X., et al. PSGL-1 derived from human neutrophils is a high-efficiency ligand for endothelium-expressed E-selectin under flow. Am J Physiol Cell Physiol. 289, 415-424 (2005).
- Sakhalkar, H. S., et al. Leukocyte-inspired biodegradable particles that selectively and avidly adhere to inflamed endothelium in vitro and in vivo. Proc Natl Acad Sci U S A. 100, 15895-15900 (2003).
- Van Kruchten, R., Cosemans, J. M., Heemskerk, J. W. Measurement of whole blood thrombus formation using parallel-plate flow chambers - a practical guide. Platelets. 23, 229-242 (2012).
- Ganguly, A., Zhang, H., Sharma, R., Parsons, S., Patel, K. D. Isolation of human umbilical vein endothelial cells and their use in the study of neutrophil transmigration under flow conditions. J Vis Exp. 66 (66), (2012).
- Shirure, V. S., Reynolds, N. M., Burdick, M. M. Mac-2 binding protein is a novel E-selectin ligand expressed by breast cancer cells. PLoS One. 7, (2012).
- Ploppa, A., Schmidt, V., Hientz, A., Reutershan, J., Haeberle, H. A., Nohé, B. Mechanisms of leukocyte distribution during sepsis: an experimental study on the interdependence of cell activation, shear stress and endothelial injury. Crit Care. 14, 201(2010).
- Oh, H., Diamond, S. L. Ethanol enhances neutrophil membrane tether growth and slows rolling on P-selectin but reduces capture from flow and firm arrest on IL-1-treated endothelium. J Immunol. 181, 2472-2482 (2008).
- Resto, V. A., Burdick, M. M., Dagia, N. M., McCammon, S. D., Fennewald, S. M., Sackstein, R. L-selectin-mediated lymphocyte-cancer cell interactions under low fluid shear conditions. J Biol Chem. 283, 15816-15824 (2008).
- Enders, S., Bernhard, G., Zakrzewicz, A., Tauber, R. Inhibition of L-selectin binding by polyacrylamide-based conjugates under defined flow conditions. Biochim Biophys Acta. 1770, 1441-1449 (2007).
- Prabhakarpandian, B., Goetz, D. J., Swerlick, R. A., Chen, X., Kiani, M. F. Expression and functional significance of adhesion molecules on cultured endothelial cells in response to ionizing radiation. Microcirculation. 8, 355-364 (2001).
- Brown, D. C., Larson, R. S. Improvements to parallel plate flow chambers to reduce reagent and cellular requirements. BMC Immunology. 2, 9(2001).
- Zheng, W., Zhang, W., Jiang, X. Precise control of cell adhesion by combination of surface chemistry and soft lithography. Adv Healthc Mater. 2, 95-108 (2013).
- Qian, T., Wang, Y. Micro/nano-fabrication technologies for cell biology. Med Biol Eng Comput. 48, 1023-1032 (2010).
- Biswas, A., Bayer, I. S., Biris, A. S., Wang, T., Dervishi, E., Faupel, F. Advances in top-down and bottom-up surface nanofabrication: techniques, applications & future prospects. Adv Colloid Interface Sci. 170, 2-27 (2012).
- Whitesides, G. M., Ostuni, E., Takayama, S., Jiang, X., Ingber, D. E. Soft lithography in biology and biochemistry. Annu Rev Biomed Eng. 3, 335-373 (2001).
- McDonald, J. C., et al. Fabrication of microfluidic systems in poly(dimethylsiloxane). Electrophoresis. 21, 27-40 (2000).
- Prabhakarpandian, B., et al. Synthetic microvascular networks for quantitative analysis of particle adhesion. Biomed Microdevices. 10, 585-595 (2008).
- Rosano, J. M., et al. A physiologically realistic in vitro model of microvascular networks. Biomed Microdevices. 11, 1051-1057 (2009).
- Tousi, N., Wang, B., Pant, K., Kiani, M. F., Prabhakarpandian, B. Preferential adhesion of leukocytes near bifurcations is endothelium independent. Microvasc Res. 80, 384-388 (2010).
- Prabhakarpandian, B., et al. Bifurcations: focal points of particle adhesion in microvascular networks. Microcirculation. 18, 380-389 (2011).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。