A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
دراسة الحمض النووي عن طريق حلقات جزيء واحد الحنق
In This Article
Summary
تقدم هذه الدراسة إجراء التجارب مفصلة لقياس ديناميكية حلقات من الحمض النووي المزدوج تقطعت بهم السبل باستخدام جزيء واحد نقل الإسفار الرنين الطاقة (الحنق). يصف البروتوكول أيضا كيفية استخراج كثافة الاحتمال حلقات يسمى عامل J.
Abstract
الانحناء من الحمض النووي المزدوج تقطعت بهم السبل (dsDNA و) ويرتبط مع العديد من العمليات البيولوجية الهامة مثل التعرف على الحمض النووي والبروتينات والحمض النووي في التعبئة والتغليف Nucleosomes لل. وقد تمت دراسة الديناميكا الحرارية من dsDNA والانحناء بطريقة تسمى سيكليزيشن التي تعتمد على الحمض النووي يغاز للانضمام تساهميا نهايات لزجة قصيرة من dsDNA و. ومع ذلك، يمكن أن تتأثر كفاءة ربط العديد من العوامل التي لا ترتبط dsDNA وحلقات مثل بنية الحمض النووي المحيطة نهايات لزجة انضم، ويغاز يمكن أن يؤثر أيضا على معدل حلقات اضحا من خلال آليات مثل الربط غير محددة. هنا، وتبين لنا كيفية قياس حركية dsDNA وحلقات من دون يغاز عن طريق الكشف عابرة تشكيل حلقة الحمض النووي عن طريق الحنق (الإسفار الرنين نقل الطاقة). هي التي شيدت جزيئات dsDNA وباستخدام بروتوكول بسيطة PCR القائم مع زوج الحنق ورابط البيوتين. يتم استخراج كثافة الاحتمال حلقات المعروفة باسم عامل J من معدل حلقات ومعدل الصلب بين اثنين disconnecتيد نهايات لزجة. عن طريق اختبار اثنين dsDNAs مع الانحرافات الجوهرية المختلفة، وتبين لنا أن العامل J حساسة لشكل جوهري من dsDNA و.
Introduction
فهم الخواص الميكانيكية للdsDNA وغير ذات أهمية أساسية في العلوم الأساسية والتطبيقات الهندسية. هيكل dsDNA وأكثر تعقيدا من سلم حلزوني على التوالي بسبب زوايا لفة، والميل، وتطور بين أزواج قاعدة المتعاقبة يمكن أن تختلف مع التسلسل. يمكن أن تسبب التقلبات الحرارية dsDNA والخضوع وسائط متنوعة من تقلبات بتكوين مثل الانحناء، واللف والتمدد. التحولات مثل ذوبان ومجعد يمكن أن يحدث أيضا في الظروف القاسية.
من بين هذه الاقتراحات، dsDNA والانحناء له الأثر البيولوجي أكثر ما يلفت الانتباه 1. ويرتبط dsDNA والانحناء مع القمع الجينات أو التنشيط من خلال جلب اثنين من مواقع بعيدة قريبة من بعضها البعض. كما أنها تلعب دورا هاما في التعبئة و التغليف الحمض النووي داخل نواة الخلية أو قفيصة الفيروسية. الانحناء تشوه dsDNA ويمكن تصور تجريبيا بواسطة عالية الدقة المجهر (AFM 2 و 3 TEM)، وthermodynamics وحركية يمكن دراستها بواسطة حلقات المقايسات، التي تربط كيميائيا المواقع جنبا إلى جنب من dsDNA و.
واحدة من هذه الاختبار هو تعتمد على يغاز سيكليزيشن 4. في هذا الاختبار، يتم circularized جزيئات dsDNA ومع "لزجة" (متماسكة) أو نهايات dimerized بواسطة يغاز الحمض النووي. من خلال مقارنة معدلات دائرة وتشكيل ديمر، يمكن للمرء الحصول على التركيز المولي الفعلي لنهاية واحدة من الحمض النووي في محيط الطرف الآخر، والذي يعرف باسم عامل J. هذا العامل J ما يعادل الأبعاد لكثافة احتمال العثور على واحدة نهاية من الحمض النووي على مسافة قصيرة من الطرف الآخر، وبالتالي يعكس المرونة من الحمض النووي. قياس عامل J بوصفها وظيفة من طول الحمض النووي يكشف خصائص كثيرة عن ميكانيكا الحمض النووي بما في ذلك طول استمرار 4،5.
فقد كان ينظر على نطاق واسع سلسلة مثل دودة (WLC) نموذج كنموذج البوليمر الكنسي للميكانيكيين dsDNA وبناء على نجاحها في تفسيراining منحنيات القوة والإرشاد في الحمض النووي التي تم الحصول عليها سحب تجارب 6، وتوقع بشكل صحيح العوامل J من dsDNAs أطول من 200 سنة مضت 7. ومع ذلك، باستخدام مقايسة سيكليزيشن على جزيئات dsDNA وقصيرة بقدر 100 سنة مضت، ويدوم كلوتير وقياس العوامل J أن تكون عدة أوامر من حجم أعلى من التنبؤ WLC نموذج 8. وبعد ذلك بعام، دو وآخرون. أنتج عوامل J بالاتفاق مع نموذج WLC باستخدام مقايسة سيكليزيشن مع تركيزات أقل من يغاز وعزا نتيجة الشاذة من مجموعة ويدوم لتركيزات عالية تستخدم يغاز 9. هذا الجدل تجسد تأثير لا مفر منه من يغاز الحمض النووي على حركية سيكليزيشن عند استخدام الفحص التقليدية 9. علاوة على ذلك، يمكن أن تؤثر أيضا على الحمض النووي يغاز بنية الحمض النووي وصلابة عن طريق غير محددة 10،11 ملزمة.
للقضاء على المخاوف من المقايسات الفنية التي تعتمد على البروتين حلقات، أثبتنا مؤخرا البروتوكول الاضافيعين خالية مقايسة حلقات على أساس نقل الإسفار الرنين الطاقة (الحنق) 12. في هذه الطريقة، يتم الكشف عن التشكل يحلق بواسطة الحنق بين المانحين ومتقبل تعلق بالقرب من نهايات لزجة من جزيء الحمض النووي. يستخدم هدفا من نوع مجموع المجهر مضان التأمل الداخلي (TIRFM) لتسجيل مسارات حلقات عكسها والأحداث unlooping من جزيئات الحمض النووي واحد يجمد السطح لفترة طويلة من الزمن. يتميز هذا الأسلوب التجمع PCR القائم من جزيئات الحمض النووي لتوليد جزيئات الحمض النووي خالية من عدم التوافق، وهو تحسن حاسم على أسلوب مماثل من قبل Vafabakhsh وها 13. على جانب واحد جزيء من هذا البروتوكول يسمح قياس توزيعات بالإضافة إلى فرقة المتوسطات في حين أن الجانب الحنق يسمح احد لقياس ديناميكية حلقات الحمض النووي مرارا وتكرارا من نفس الجزيء، حتى في الظروف التي يمكن أن يضعف النشاط يغاز.
يظهر الإعداد TIRFM في الشكل رقم 1. A مخصصةيتم وضع تصميم المرحلة العينة على هيئة المجهر أوليمبوس IX61. يتم إدخال 532 نانومتر و 640 نانومتر ليزر من الجانب والتي تعكسها المرايا بيضاوي الشكل صغيرة 14 من زمن الهدف NA عالية لتحقيق زاوية حرجة من الإصابة في واجهة المياه ساترة. نلاحظ أن أكثر انتشارا النقل البري الدولي من خلال الهدف باستخدام المرايا مزدوج اللون أو الاجهزة النقل البري الدولي القائم على منظور يمكن أن تستخدم أيضا لهذا التطبيق الحنق. يتم تقسيم الصورة التي شكلتها مضان المجهر في الصور المانحة ومتقبل بواسطة مرآة مزدوج اللون. ثم يتم إعادة تصويرها، فهم على نصفين من EMCCD. وتستخدم مرشحات إضافية الانبعاثات تمريرة طويلة للحد من إشارة الخلفية.
التحكم في درجة الحرارة أمر ضروري للحصول على البيانات الحركية استنساخه. لمراقبة درجة الحرارة، ويتم فصل الهدف من الأنفية من الجسم المجهر لتقليل انتقال الحرارة، والماء من درجة الحرارة التي تسيطر عليها المبرد / سخان يعمم من خلال طوق النحاس أن يناسب بإحكامحول المعدنية الداخلية تحت سترة الهدف. هذا الإعداد هو قادرة على تحقيق التحكم في درجة الحرارة قوية على السطح ساترة بين 15 و 50 درجة مئوية (الشكل 2). في هذا العمل، والحفاظ على درجة حرارة العينة في 24 درجة مئوية.
ويقدم البروتوكول باتباع الإجراء خطوة بخطوة لبناء الحمض النووي، وتقدير شكل الحمض النووي، وتجربة واحدة جزيء، وJ تحديد عامل.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. إعداد dsDNA وعينة
- تصميم منحني السلطات الوطنية المعينة على الصعيد العالمي من خلال تكرار تسلسل 10 مير. على سبيل المثال، 5'-GTGCCAGCAACAGATAGC - (TTTATCATCCTTTATCATCC X) 7 - TTTCATTCGAGCTCGTTGTTG-3 'هو الحمض النووي منحني 186-BP حيث X هو قاعدة اضافية عشوائية وتسلسل المرافقة تكرار تسلسل 10 مير هي متواليات محول.
ملاحظة: في هذا المثال اثنين من 10 السائدة مع تفضيلات المعاكس لتشكيل جسيم نووي استنادا إلى دراسة الإشغال جسيم نووي على نطاق واسع من قبل كابلان وآخرون تم اختيار 15. منذ تكرار حلزونية من dsDNA وبالقرب من 10 سنة مضت، فإن أي انحراف صافي محور حلزونية من مير 10 تتراكم لإنتاج شكل مثل قوس دائري (الشكل 3A). منذ فترة حلزونية هو أقرب إلى 10.5 نقطة أساس، يتم إدراج قاعدة اضافية بعد كل اثنين يكرر للحفاظ على هيكل منحني كما مستو ممكن. هذه المتتاليات أقصر من 200 سنة مضت يمكن طلبها من الشركة أو المؤسسةو هذا العرض الجين خدمة التوليف. أنها مريحة لتطويق هذه المتتاليات مع تسلسل محول مشتركة للخطوات اللاحقة. وschematized الإجراء في الشكل 3B. - أداء PCR مع التمهيدي 1 (GTGCCAGCAACAGATAGC) والتمهيدي 2 (/ 5Cy3/TAAATTCCTACAACAACGAGCTCGAATG). ملاحظة: يسمى التمهيدي 2 مع CY3 المانحة الحنق في نهاية 5 '. يتم عرض وصفة نموذجية PCR وبروتوكول ركوب الدراجات في الجدولين 1 و 2.
- أداء PCR مع التمهيدي 3 (/ 5BioTEG/GAAACATAG/iCy5/GAATTTACCGTGCCAGCAACAGATAGC) والتمهيدي 4 (CAACAACGAGCTCGAATG). ملاحظة: يسمى التمهيدي 3 مع متقبل Cy5 الحنق من خلال العمود الفقري والبيوتين-رابط في نهاية 5 '. PCR صفة وبروتوكول ركوب الدراجات هي على النحو الوارد أعلاه.
- تنقية المنتجات PCR باستخدام طقم تنظيف PCR.
- مزيج المنتج CY3 المسمى والمنتج Cy5 المسمى في منطقة عازلة لتبادل حبلا (100 ملي مول كلوريد الصوديوم، و 10 ملي تريس، حمض الهيدروكلوريك درجة الحموضة 7.0، 1 ملم EDTA) بتركيزات النهائي من 0.4 و# 181؛ M و 0.1 ميكرومتر، على التوالي. ملاحظة: الزائدة CY3 الحمض النووي يزيد من تركيز كلا الوجهين يحمل CY3 وCy5 نتيجة الصرف حبلا.
- فروع الصرف التي يحتضنها في 98.5 درجة مئوية لمدة 2 دقيقة، والتبريد تدريجيا إلى 5 درجة مئوية مع معدل زيادة قدرها 0.1 درجة مئوية / ثانية، وتفرخ في 5 ° مئوية لمدة 2 ساعة.
2. جل الكهربائي لكشف dsDNA وتقوس
- صب جل بولي أكريلاميد 16،17 عن طريق خلط مادة الأكريلاميد وحلول مكرر الأكريلاميد في نسبة 29.2:0.8، 5٪ (ث / ت) في 1X تريس / البورات / EDTA (TBE) العازلة في درجة الحموضة 8.0. ملاحظة: 10 مل من محلول هلام يحتوي على: 1.217 مل 40٪ الأكريلاميد، 0.667 مل 2٪ مكرر الأكريلاميد، 1 مل TBE 10X، و 100 فوق كبريتات الأمونيوم L (APS) 10٪، 10 L TEMED، والباقي هو درهم 2 O. التصلب الكامل من هلام يستغرق حوالي 30 دقيقة.
- تحميل هلام بولي أكريلاميد مع عينات الحمض النووي والحمض النووي في سلم 1X العازلة تحميل (5٪ الجلسرين، 0.03٪ (ث / ت) برموفينول BLرق) وتشغيل هلام في 5-8 V / سم عند 4 درجة مئوية لمدة 45 دقيقة أو حتى الجبهة صبغ تقترب من نهاية هلام.
- وصمة عار الجل باستخدام 1X TBE العازلة التي تحتوي على بروميد 0.5 جم / مل إيثيديوم لمدة 30 دقيقة. تحديد نطاقات الحمض النووي تحت إضاءة فوق البنفسجية. قارن بين مواقف الفرقة مع علامة الحجم (100 غليان الحمض النووي سلم) لحساب الأحجام واضح من جزيئات الحمض النووي. ملاحظة: منحني السلطات الوطنية المعينة التحرك عموما أبطأ من السلطات الوطنية المعينة على التوالي.
3. تدفق خلية التحضير
- حفر 6-7 أزواج من الثقوب على طول حافتي نقيض شريحة زجاجية (3'''' × 1) باستخدام الحفر الصحافة ولقم الثقب الماس. بعد الحفر، وفرك الشريحة في المياه المتدفقة لإزالة مسحوق الزجاج مرئية. ملاحظة: الثقوب بمثابة مداخل ومنافذ التروية. أثناء الحفر، والتبريد الشريحة مع الماء مهم لمنع التشقق.
- وضع الشرائح تستقيم في وعاء زجاجي وملئه بالماء. يصوتن لمدة 15 دقيقة ونقلها إلى أخرى عاء زجاجي ديdicated لتنظيف الأسيتون. ملء مع الأسيتون ويصوتن لمدة 15 دقيقة. شطف الشرائح مع الإيثانول باستخدام زجاجة رذاذ ثم بالماء. وضعها في جرة البولي بروبلين، وملء مع 5 هيدروكسيد البوتاسيوم M، ويصوتن لمدة 15 دقيقة. أخيرا، يصوتن الشرائح في الماء لمدة 15 دقيقة. تنظيف لل coverslips (رقم 1، 24 × 40 مم) باستخدام نفس البروتوكول. ملاحظة: الشرائح تنظيفها وcoverslips يمكن تخزينها في DH 2 O للاستخدام على المدى الطويل.
- مزيج 1 ملغ من البيوتين-PEG-سيلاني (MW 3400) مع 80 ملغ من MPEG-سيلاني (MW 2000) في 340 L 0.1 M الصوديوم بيكربونات الحل. تخلط جيدا وأجهزة الطرد المركزي لفترة وجيزة الخليط للتخلص من الفقاعات. ملاحظة: إن functionalization السطح مع البولي ايثيلين جلايكول (PEG) يساعد في تقليل ملزم غير محددة من الحمض النووي إلى السطح.
- وضع 80 L من الحل PEG على كل شريحة وخفض بلطف ساترة أكثر من ذلك. الانتظار لمدة 45 دقيقة. فصل ساترة من الشريحة مع ملاقط، شطف لهم مع كمية وفيرة من DH 2 O والسماح رتنحنح الجافة في الهواء الطلق.
- وضع شرائح رقيقة من الشريط المزدوج عصا عبر الشريحة لتشكيل قنوات. محاذاة ساترة أكثر من ذلك وتضغط بقوة ضد ساترة الشريحة لتشكيل قنوات السائل ضيقة. استخدام الايبوكسي 5 دقائق لختم حواف القنوات.
4. إعداد Trolox الحل
- وضع ~ 30 ملغ Trolox و 10 مل درهم 2 O في قارورة واستخدام شريط المغناطيس لاثارة ضجة الحل في الهواء الطلق لمدة 18 ساعة.
- تحديد الحل باستخدام فلتر 0.2 ميكرومتر وضبط درجة الحموضة إلى 7 بإضافة ~ 6 ميكرولتر من 1 M تريس قاعدة (الرقم الهيدروجيني 11). ملاحظة: Trolox هو كاشف المضادة للتطرف الذي يستخدم عادة في جزيء واحد يدرس 18. العمل antifading من Trolox يأتي من مشتقات أكسدة والتي هي موجودة في المتدهورة جزئيا حل Trolox 19. حل بسرعة Trolox في الميثانول أو ارتفاع درجة الحموضة تريس الحل يجب تجنبها بسبب الأكسدة غير فعالة.
5. واحدة مولالتصوير ecule
- ضخ 15 ميكرولتر من الحل NeutrAvidin (0.5 ملغ / مل) في القناة والانتظار لمدة 2 دقيقة قبل الشطف مع 100 ميكرولتر من العازلة T50 (10 ملي تريس، حمض الهيدروكلوريك، 50 مم كلوريد الصوديوم، ودرجة الحموضة 7.0).
- ضخ 50 ميكرولتر من عينة الحمض النووي (50-100 م) في القناة. الانتظار لمدة 5 دقائق ويشطف الحمض النووي غير منضم بعيدا مع 100 L العازلة T50. ملاحظة: سوف تربط جزيئات الحمض النووي على وجه التحديد إلى السطح من خلال التفاعل NeutrAvidin البيوتين.
- ملء القناة مع المخزن المؤقت التصوير الذي يحتوي على نظام الكسح الأكسجين 20 (100 ملي PCD، 5 ملي PCA، 1 ملم Trolox، و 500 ملي مول كلوريد الصوديوم).
- تعيين EMCCD في وضع الإطار نقل لتيار 2 × 2 صورة اهمال (256 × 256) إلى الكمبيوتر عند 25 لقطة في الثانية.
- نضع الزيت الغمر على الهدف المجهر، وإصلاح الخلية تدفق على المسرح المجهر باستخدام مقاطع العينة. الخشنة ضبط التركيز من خلال النظر في نمط انعكاس الليزر على الحائط. غرامة ضبط التركيز باستخدام طريقة العرض المباشر لمضان ايمالأعمار على الشاشة.
- تبدأ الحصول على البيانات مع الليزر 532 نانومتر جرا. تحقق من عرض لايف وضبط التركيز إذا لزم الأمر. وقف الحصول على البيانات عندما photobleached معظم الجزيئات.
ملاحظة: في هذا المرفق، يتم استخدام برنامج C مكتوبة بخط مختبر للسيطرة على المجهر وعرض صورا حية على الشاشة كما يتم حفظ إلى القرص الثابت.
6. معالجة الصور وتحليل البيانات
ملاحظة: تتم معالجة سلسلة من الساعة 256 × 256 الصور عن طريق رمز MATLAB لتوليد آثار مرة واحدة جزيء من CY3 وCy5 شدة. لإقران بكسل بين قناة وقناة المانحة متقبل للصورة انقسام الرأي، 6-7 أزواج من CY3 وCy5 البقع، كل زوج من نفس الجزيء فرقت بالتساوي على مجال الرؤية، يتم انتقاؤها يدويا، والتحول أفيني يتم حسابها باستخدام إحداثيات هذه البقع كما نقاط الربط.
- باستخدام برنامج نصي MATLAB، ننظر من خلال كل العصور واحدة جزيء يتتبع رالمعرض قبعة التحولات متعددة بين الإشارات المنخفضة والعالية الحنق. تحديد الدول يحلق وunlooped.
ملاحظة: يتم تعريف إشارة الحنق كما كثافة Cy5 (لي) مقسوما على مجموع CY3 وCy5 شدة (لي + I D). الدولة يحلق له قيمة عالية في حين الحنق الدولة unlooped له قيمة الحنق منخفضة. الرسم البياني من الإشارات الحنق من جزيء واحد يتم توزيع bimodally بسبب حلقات عكسها وunlooping. - العثور على العتبة التي تفصل بين توزيعات اثنين من خلال تحديد تقاطع بين اثنين من منحنيات جاوس المجهزة.
- حساب الكفاءة الحنق كما
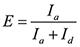 وتعيين الدول يحلق مع القيم العالية والحنق الدول unlooped مع القيم الحنق منخفضة.
وتعيين الدول يحلق مع القيم العالية والحنق الدول unlooped مع القيم الحنق منخفضة. - باستخدام برنامج نصي MATLAB، وتحليل العدد التراكمي للجزيئات (N (ر)) أن يحلق (أووصلت إلى حالة عالية الحنق) في هفوات زمنية مختلفة منذ بداية الحصول على البيانات. ملاحظة: منذ جزيء dsDNA ويمكن أن تبدأ في أي التشكل الدولة unlooped في بداية الحصول على البيانات، ومعدل الزيادة في عدد السكان يحلق يعكس متوسط معدل المتوسط حلقات على التشكل الأولي. استخراج حلقات معدل ك حلقة من المناسب N (ر) مع الدالة الأسية:
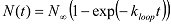 إذا زيادات biphasically، فإنه يمكن تركيبها مع الدالة الأسية مزدوجة:
إذا زيادات biphasically، فإنه يمكن تركيبها مع الدالة الأسية مزدوجة: 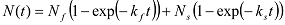 في هذه الحالة، يتم الحصول ك حلقة من:
في هذه الحالة، يتم الحصول ك حلقة من: 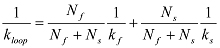 ملاحظة: من الناحية النظرية، واحتمال البقاء على قيد الحياة أن البوليمر لم يحلق في الوقت t ليس وظيفة واحدة أو مزدوج الأسي 12. FITT الأسييستخدم جي كوسيلة عملية لاستخراج متوسط الوقت حلقات.
ملاحظة: من الناحية النظرية، واحتمال البقاء على قيد الحياة أن البوليمر لم يحلق في الوقت t ليس وظيفة واحدة أو مزدوج الأسي 12. FITT الأسييستخدم جي كوسيلة عملية لاستخراج متوسط الوقت حلقات.
7. تحديد عامل J
ملاحظة: عامل J يمثل كيف المركزة واحدة من نهاية dsDNA وحوالي الطرف الآخر. فإنه يمكن تحديده من خلال التحريف تركيز الجزء نهاية واحدة من الحمض النووي التي من شأنها أن تنتج نفس معدل التفاعل مع شريحة الطرف الآخر، حيث وصل سعر حلقات قياسها. تجريبيا، ويجمد جزء نهاية واحدة على السطح، ويتم عرض الجزء الطرف الآخر في تركيز معين ج. إذا كان معدل قياس الصلب بين طرفي هو ك يصلب، ثم يتم إعطاء العامل J 21 بواسطة 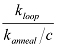 . ثابت معدل الصلب (ك = ك يصلب يصلب / C) مستقلة عن تركيز التحقيق.
. ثابت معدل الصلب (ك = ك يصلب يصلب / C) مستقلة عن تركيز التحقيق.
- تدفق 20 ميكرولتر من 30-50 من مساء البيوتين-Cy5 بنسبة ضئيلة (التمهيدي 3) طn لقناة NeutrAvidin المغلفة. شطف القناة مع 100 ميكرولتر T50 ليغسل oligos غير منضم.
- إعداد المخزن المؤقت التصوير كما هو موضح في الجزء 5 مع إضافة CY3 بنسبة ضئيلة (التمهيدي 2) في تركيز النهائي من 50 نانومتر. تدفق هذا المخزن المؤقت التصوير في القناة.
- مع الحفاظ على الليزر 532 نانومتر على، تتحول لفترة وجيزة ليزر 640 نانومتر إلى تحديد مواقع محددة سطح oligos Cy5. إيقاف تشغيل الليزر 640 نانومتر، وبدء مراقبة إشارة الحنق.
ملاحظة: عند التهجين بنسبة ضئيلة من CY3 إلى Cy5 جزئية محددة السطح، وسوف Cy5 مضان تنشأ من الحنق. - باستخدام برنامج نصي MATLAB، وتحليل عدد من الجزيئات التي تبدأ في دولة غير منضمة (منخفض الكثافة Cy5) ولكن تتحول لاحقا إلى صلب الدولة (كثافة عالية Cy5) بوصفها وظيفة من الوقت من آثار شدة Cy5.
- رسم هذا العدد من الجزيئات مقابل الوقت صلب. تناسب هذا المنحنى مع الدالة الأسية واحد (
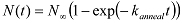 ) للحصول على سعر الصلب (ك يصلب).
) للحصول على سعر الصلب (ك يصلب). - تكرار هذه التجربة في تركيزات مختلفة CY3 بنسبة ضئيلة (60، 100، 180 نانومتر) لتأكيد الخطي بين معدل الصلب وتركيز المتفاعلة. استخراج معدل الدرجة الثانية الصلب ثابتة (ك يصلب ) من المنحدر.
- حساب معامل J من
 ، حيث k هو معدل حلقة حلقات يقاس في نفس حالة العازلة.
، حيث k هو معدل حلقة حلقات يقاس في نفس حالة العازلة.
Access restricted. Please log in or start a trial to view this content.
النتائج
تتكون جزيئات الحمض النووي المستخدمة في الدراسة حلقات من المنطقة المزدوجة من تسلسل متغير وطول واحد يتدلى الذين تقطعت بهم السبل التي هي مكملة لبعضها البعض. ويتدلى، والتي هي 7 قاعدة طويلة، يمكن أن يصلب مع بعضها البعض لالتقاط حالة يحلق. كل عبء يحتوي إما CY3 أو Cy5 مرتبط في ال...
Access restricted. Please log in or start a trial to view this content.
Discussion
واستخدمت مقايسة بسيطة جزيء واحد يعتمد على الحنق لدراسة حركية حلقات من السلطات الوطنية المعينة من الأشكال الجوهرية المختلفة. يمكن السلطات الوطنية المعينة منحني بتكرار تسلسل 10 مير في مرحلة مع الفترة حلزونية من 10.5 نقطة أساس على استعداد، ويمكن تقدير الانحرافات الخاصة ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب تعلن أي تضارب في المصالح.
Acknowledgements
نشكر جيمس واترز، وادز ورث غيبل وبو برودواتر لقراءة نقدية للمخطوطة. نشكر أيضا أربعة المراجعين المجهولين لتوفير تعليقات مفيدة. نحن نعترف الدعم المالي من معهد جورجيا للتكنولوجيا، وجائزة صندوق ويلكوم بوروز الوظيفي في واجهة العلمي، ومنحة شبكة البحوث طالب من جبهة الخلاص الوطني الفيزياء نظم المعيشة.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Small DNA FRAG Extract Kit-100PR | VWR | 97060-558 | |
| Acrylamide 40% solution 500 ml | VWR | 97064-522 | |
| Bis-acrylamide 2% (w/v) solution 500 ml | VWR | 97063-948 | |
| GeneRuler 100 bp DNA Ladder, 100-1,000 bp | Fermentas | SM0241 | |
| Mini Vertical PAGE System | VWR | 89032-300 | |
| Syringe filter 0.2 μm CS50 | VWR | A2666 | |
| Trolox | Sigma-Aldrich | 238813-1G | triplet state quencher |
| Protocatechuic acid (PCA) | Sigma-Aldrich | 08992-50MG | oxygen scavenging system |
| Protocatechuate 3,4-Dioxygenase (PCD) | Sigma-Aldrich | P8279-25UN | oxygen scavenging system |
| mPEG-silane, MW 2,000 1 g | Laysan Bio | MPEG-SIL-2000-1g | |
| Biotin-PEG-Silane, MW 3,400 | Laysan Bio | Biotin-PEG-SIL-3400-1g | |
| Avidin, NeutrAvidin Biotin-binding Protein | Invitrogen | A2666 | |
| Phusion Hot Start High-Fidelity DNA Polymerase | New England Biolabs | F-540L | |
| Gel/PCR DNA Fragments Extraction Kit | IBI Scientific | IB47020 | |
| Premium plain glass microscope slides | Fisher Scientific | 12-544-1 | |
| VWR micro cover glass, rectangular, no. 1 | VWR | 48404-456 | |
| Fisher Scientific Isotemp 1006S Recirculating Chiller/Heater | Fisher Scientific | temperature control | |
| Objective Cooling Collar | Bioptechs | 150303 | temperature control |
| KMI53 Biological Micrometer Measuring Stage | Semprex | KMI53 | |
| High Performance DPSS Laser 532 nm 50 mW | Edmund optics | NT66-968 | Cy3 excitation |
| CUBE Fiber Pigtailed 640 nm, 30 mW, Fiber, FC/APC Connector | Coherent | 1139604 | Cy5 excitation |
| 650 nm BrightLine Dichroic Beamsplitter | Semrock | FF650-Di01-25x36 | splitting dichroic |
| LaserMUX Beam Combiner, reflects 514.5, 532, & 543.5 nm lasers, 25 mm | Semrock | LM01-552-25 | combining dichroic |
| Brightline Fluorescence Filter 593/40 | Semrock | FF01-593/40-25 | Cy3 emission filter |
| 635 nm EdgeBasic LWP longpass Filter, 25 mm | Semrock | BLP01-635R-25 | Cy5 emission filter |
| EMCCD iXon+ | Andor Technology | DU-897E-CS0-#BV | |
| IX51 inverted microscope frame | Olympus | ||
| Objective UApo N 100X/1.49 Oil TIRF | Olympus | ||
| Immersion oil type-F for fluorescence microscopy | Olympus | IMMOIL-F30CC | |
| 2 mm Diameter 45° Rod Lens Aluminum Coated | Edmund optics | 54-092 | miniature mirror |
| 1/4" Travel Single-Axis Translation Stage | Thorlabs | MS-1 | translation of miniature mirror |
| Ø1" Achromatic Doublet, ARC: 400-700 nm, f=200 mm | Thorlabs | AC254-200-A | focusing lens |
| Adjustable Mechanical Slit | Thorlabs | VA100 | |
| Dielectric Mirror | Thorlabs | BB1-E02 | |
| Ø1" Achromatic Doublet, f = 100 mm | Thorlabs | AC254-100-A | relay lens |
| Lens Mount for Ø1" Optics | Thorlabs | LMR1 | |
| Dichroic Filter Mount | Thorlabs | FFM1 | |
| Fixed Cage Cube Platform | Thorlabs | B3C | |
| Kinematic Mount for Ø1" Optics | Thorlabs | KM100 | |
| N-BK7 Plano-Convex Lens, Ø1", f = 40 mm | Thorlabs | LA1422-A | collimating lens |
| N-BK7 Plano-Convex Lense, Ø6.0 mm, f = 15 mm | Thorlabs | LA1222-A | telescope lens |
| N-BK7 Plano-Convex Lense, Ø6.0 mm, f = 150 mm | Thorlabs | LA1433-A | telescope lens |
References
- Garcia, H. G., et al. Biological consequences of tightly bent DNA: The other life of a macromolecular celebrity. Biopolymers. 85, 115-130 (2007).
- Wiggins, P. A., et al. High flexibility of DNA on short length scales probed by atomic force microscopy. Nature Nanotechnology. 1, (2006).
- Lionberger, T. A., et al. Cooperative kinking at distant sites in mechanically stressed DNA. Nucleic Acids Research. 41, 6785-6792 (2011).
- Shore, D., et al. DNA flexibility studied by covalent closure of short fragments into circles. Proc Natl Acad Sci U S A. 78, 4833-4837 (1981).
- Geggier, S., Vologodskii, A. Sequence dependence of DNA bending rigidity. Proc Nat Acad Sci U S A. 107, 15421-15426 (1992).
- Smith, S. B., et al. Direct mechanical measurements of the elasticity of single DNA molecules by using magnetic beads. Science. 258, 1122-1126 (1992).
- Peters, J. P., Maher, L. J. DNA curvature and flexibility in vitro and in vivo. Quarterly Reviews of Biophysics. 43, 23-63 (2010).
- Cloutier, T. E., Widom, J. Spontaneous sharp bending of double-stranded DNA. Molecular Cell. 14, 355-362 (2004).
- Du, Q., et al. Cyclization of short DNA fragments and bending fluctuations of the double helix. Proc Natl Acad Sci U S A. 102, 5397-5402 (2005).
- Yuan, C., et al. T4 DNA ligase is more than an effective trap of cyclized dsDNA. Nucl. Acids Res. 35, 5294-5302 (2007).
- Manzo, C., et al. The effect of nonspecific binding of lambda repressor on DNA looping dynamics. Biophysical Journal. 103, 1753-1761 (2012).
- Le, T. T., Kim, H. D. Measuring shape-dependent looping probability of DNA. Biophys. J. 104, 2068-2076 (2013).
- Vafabakhsh, R., Ha, T. Extreme bendability of DNA less than 100 base pairs long revealed by single-molecule cyclization. Science. 337, 1097-1101 (2012).
- Friedman, L., et al. Viewing dynamic assembly of molecular complexes by multi-wavelength single-molecule fluorescence. Biophysical Journal. 91, 1023-1031 (2006).
- Kaplan, N., et al. The DNA-encoded nucleosome organization of a eukaryotic genome. Nature. 458, 362-366 (2009).
- Koo, H. S., Crothers, D. M. Calibration of DNA curvature and a unified description of sequence-directed bending. Proc Nat Acad Sci U S A. 85, 1763-1767 (1988).
- Prosseda, G., et al. A temperature-induced narrow DNA curvature range sustains the maximum activity of a bacterial promoter in vitro. Biochemistry. 49, 2778-2785 (2010).
- Rasnik, I., et al. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3, 891-893 (2006).
- Cordes, T., et al. On the mechanism of Trolox as antiblinking and antibleaching reagent. J. Am. Chem. Soc. 131, 5018-5019 (2009).
- Aitken, C. E., et al. An oxygen scavenging system for improvement of dye stability in single-molecule fluorescence experiments. Biophys J. 94, 1826-1835 (2008).
- Taylor, W. H., Hagerman, P. J. Application of the method of phage T4 DNA ligase-catalyzed ring-closure to the study of DNA structure: II. NaCl-dependence of DNA flexibility and helical repeat. Journal of Molecular Biology. 212, 363-376 (1990).
- Bolshoy, A., et al. Curved DNA without A-A: experimental estimation of all 16 DNA wedge angles. Proc Natl Acad Sci U S A. 88, 2312-2316 (1991).
- Gibson, D. G. Synthesis of DNA fragments in yeast by one-step assembly of overlapping oligonucleotides. Nucl. Acids Res. 37, 6984-6990 (2009).
- Vologodskii, A., et al. Bending of short DNA helices. Artif DNA PNA XNA. 4, (2013).
- Hoover, D. M., Lubkowski, J. DNAWorks: an automated method for designing oligonucleotides for PCR-based gene synthesis. Nucl. Acids Res. 30, (2002).
- Waters, J. T., Kim, H. D. Equilibrium Statistics of a Surface-Pinned Semiflexible Polymer. Macromolecules. 46, 6659-6666 (2013).
- Mills, J. B., et al. Electrophoretic evidence that single-stranded regions of 1 or more nucleotides dramatically increase the flexibility of DNA. Biochemistry. 33, 1797-1803 (1994).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved