Method Article
الكمي قداس الطيفية من التنميط Proteomes خلايا السرطان المستمدة من السائل والأورام الصلبة
In This Article
Summary
In-depth analyses of cancer cell proteomes facilitate identification of novel drug targets and diagnostic biomarkers. We describe an experimental workflow for quantitative analysis of (phospho-)proteomes in cancer cell subpopulations derived from liquid and solid tumors. This is achieved by combining cellular enrichment strategies with quantitative Super-SILAC-based mass spectrometry.
Abstract
في عمق تحليل proteomes الخلايا السرطانية وهناك حاجة لتوضيح pathomechanisms أنكجنيك، وكذلك لتحديد أهداف المخدرات المحتملة والمؤشرات الحيوية التشخيصية. ومع ذلك، أساليب لتوصيف بروتيوميك الكمي للأورام المستمدة من المريض وخاصة في القطعان الخلوية تفتقر إلى حد كبير. نحن هنا وصف تجريبي مجموعة المتابعة الذي يسمح التحليل الكمي للproteomes المجموعات السكانية الفرعية الخلايا السرطانية المشتقة من الأورام إما سائلة أو صلبة. ويتحقق ذلك من خلال الجمع بين استراتيجيات تخصيب الخلوية مع الكمي قياس الطيف الكتلي مقرها سوبر SILAC يليه تحليل البيانات بيوينفورمتيك. لإثراء مجموعات فرعية الخلوية محددة، وimmunophenotyped الأورام السائلة أول مرة من قبل التدفق الخلوي تليها FACS الفرز. لالأورام الصلبة، ويستخدم الليزر التقاط تسليخ مجهري لتنقية مجموعات سكانية فرعية الخلوية محددة. في الخطوة الثانية، يتم استخراج البروتينات من خلايا النقاء والجمع في وقت لاحق مع وجود ورم محددة،SILAC المسمى-ارتفاع في مستوى تمكن البروتين الكمي. يخضع الناتجة خليط من البروتين إما الكهربائي للهلام أو تصفية (فلترة) بمساعدة تحضير العينة (FASP)، يليه الهضم زيتية. وأخيرا، يتم تحليل الببتيدات زيتية باستخدام-رباعي orbitrap مطياف الكتلة الهجين، وتتم معالجة البيانات التي تم الحصول عليها مع مجموعات البرامج بيوينفورمتيك بما في ذلك MaxQuant. من خلال سير العمل المعروضة هنا، يصل إلى 8،000 البروتينات يمكن تحديدها كميا وفي عينات المستمدة من المريض، ويمكن مقارنة مما أدى لمحات البروتين التعبير بين المرضى لتحديد التوقيعات البروتين التشخيص أو الأهداف المحتملة المخدرات.
Introduction
وقد برزت البروتيوميات القائم على مطياف الكتلة والآن الانضباط تستخدم على نطاق واسع في بيولوجيا الخلية والبحوث الطبية الحيوية متعدية. جعلت التطورات التقنية في مجال من الممكن لدراسة العمليات الخلوية المعقدة في خطوط الخلايا والنماذج الحيوانية، كما يمكن التعرف على آلاف البروتينات في واحدة جماعية التجربة الطيفي 1،2. وقد تم إحراز تقدم مماثل لتحليل العديد من التعديلات ما بعد النقل مثل الفسفرة أو ubiquitination، على الرغم من أن هذا يتطلب عادة سير العمل مفصل لتخصيب اليورانيوم وتحليل البيانات لكل نوع من التعديل 2،3. وعلاوة على ذلك، وإشراك استراتيجيات وضع العلامات الكيميائية والتمثيل الغذائي، بما في ذلك SILAC، تمكن الكمي النسبي دقيق من البروتينات وPTMs، مما يجعل هذه الطريقة جاذبية خاصة لاكتشاف العمليات الخلوية الأساسية، والمؤشرات الحيوية التشخيصية والأهداف المحتملة المخدرات في سرطان البشري 4.
ومع ذلك،العديد من التحديات لا بد من التغلب عليها فيما يتعلق تحليل البروتين من السرطانات البشرية الابتدائية 5. أولا وقبل كل شيء، عينات سرطانية بشرية غالبا ما تظهر درجة عالية من التجانس الخلوية التي ويرجع ذلك إلى وجود مختلف أنواع الخلايا التي تنتمي إلى المكروية الورم، بما في ذلك الخلايا المناعية والخلايا الليفية. ثانيا، تطور نسيلي يؤدي إلى التنوع الجيني داخل الأورام نفسها، مما أدى إلى وجود عدة مجموعات سكانية فرعية الخلوية مع خصائص وظيفية متميزة. وفقا لمفهوم الحالي لعدد قليل من الخلايا الجذعية السرطانية كونها القوى الدافعة وراء تطور مرض السرطان والتقدم، تحليل البروتين من هذه القطعان الخلوية (وظيفيا ذات الصلة للغاية) ومن المتوقع أن تكون ذات أهمية كبيرة لفهم أفضل لآليات أنكجنيك ذات الصلة لتطبيق السريرية 6. ثالثا، غالبا ما يتطلب كمية البروتين ملامح التعبير عن مجموعات كبيرة من العينات لتحديد BIOMAR السريرية قويةاستعادة الطاقة الحركية. هذا لا يمكن أن يتحقق عن طريق وضع العلامات الكيميائية مثل iTRAQ 7، في حين استراتيجيات وضع العلامات الأيضية - التي تعتمد، كما يفعلون، على انتشار الخلوي 4 - غير قابلة للتطبيق بالمثل. رابعا، معظم عينات الورم الصلبة المتوفرة هي الثابتة الفورمالين، مما يعقد الشامل التحليل الطيفي بروتيوم بسبب تشكيل crosslinks البروتين 8. وأخيرا، فإن معظم سير العمل البروتينات الموجودة تتطلب كميات كبيرة من تجهيز العينات والحصول على البيانات، مما يجعل تحليل أرقام عينة ذات الصلة للبحوث السريرية الصعب، والدعوة لسير العمل الجديد نماذج 9،10.
لمعالجة هذه العقبات التي وضعت الإعداد التجريبية التي تجمع بين إما خلية تدفق cytometric فرز 11 أو الليزر التقاط تسليخ مجهري 12،13 لتخصيب الخليوي مع استراتيجية سوبر SILAC 14 إلى إدخال المعيار الداخلي العالمي للتحليل الطيفي الشامل الشامل. باستخدام الطريقة الموصوفة هنا، فمن الممكن لتحديد ما يصل إلى 8،000 البروتينات في واحدة عينات الورم الإنسان المستمدة من السرطانات إما سائلة أو صلبة.
Protocol
يجب الموافقة على جميع التجارب على الأنسجة أو الدم العينات البشرية من قبل لجنة الأخلاق وأجرى وفقا لأية مبادئ توجيهية معينة في التصويت الأخلاق.
1. الخلوية التخصيب
- الأورام السائلة / مضان تنشيط الخلايا الفرز.
- عزل الخلايا وحيدات النوى من نخاع العظم أو عينة من الدم عن طريق إجراء كرات الدم الحمراء تحلل باستخدام كلوريد الأمونيوم أو Ficoll الكثافة التدرج الطرد المركزي.
- لكرات الدم الحمراء تحلل، والجمع بين 1 مل من العينة مع 4 مل من محلول كلوريد الأمونيوم. احتضان الحل على الجليد لمدة من 5 - 10 دقيقة. إضافة 40 مل من الفوسفات مخزنة المالحة (PBS) + 2٪ مصل العجل الجنين (FCS) وأجهزة الطرد المركزي لمدة 5 دقائق في 400 x ج و 4 ° C.
- لFicoll التدرج الطرد المركزي، وطبقة 10 مل من العينة على 15 مل من Ficoll-Hypaque لتشكيل 2 طبقات متميزة (الحرص على عدم تعكير صفو طبقات). الطرد المركزي في 400 x ج لمدة 30 دقيقة في RT (15-25 درجة مئوية) بعناية وحصاد وحيدات النوىالخلايا التي جمع في الطور البيني.
- تدور باستمرار خلايا وأخذها تصل في برنامج تلفزيوني + 2٪ FCS. الطرد المركزي في 400 x ج لمدة 5 دقائق وتناول في 1 مل PBS + 2٪ FCS. اتخاذ قسامة واحد كما المراقبة السلبية وقسامة واحدة لكل صبغة الفلورسنت المستخدمة في وصمة عار النهائية.
- احتضان مع الأجسام المضادة المسمى مضان مفيدة لعزل السكان خلية اللوكيميا في تخفيف وفقا لتعليمات الشركة الصانعة على الجليد لمدة 30 دقيقة. أيضا وصمة عار على مأخوذة تستخدم لتعويض مع كل الأجسام المضادة بشكل فردي. يغسل مرتين مع برنامج تلفزيوني + 2٪ FCS.
ملاحظة: الأجسام المضادة المستخدمة كانت الماوس المضادة للبشرية ضد CD117-PE (استنساخ 95C3)، CD34-FITC (استنساخ 8G12) وCD33-PE (استنساخ P67.6). - تصفية الخلايا من خلال 35 ميكرومتر مصفاة الخلية، وذلك باستخدام أنابيب مثالي مع مصفاة خلية متكاملة في الحد الأقصى.
- إضافة صمة عار بقاء الخلية (على سبيل المثال، 7-AAD). خلايا النوع باستخدام فارز الخلية المناسبة 11 (الشكل 2). جمع الخلايا في تكاليف الدعم غير المباشر اوفه في التعديل Dulbecco والمتوسطة (IMDM) التي تحتوي على 10٪ FCS.
- عزل الخلايا وحيدات النوى من نخاع العظم أو عينة من الدم عن طريق إجراء كرات الدم الحمراء تحلل باستخدام كلوريد الأمونيوم أو Ficoll الكثافة التدرج الطرد المركزي.
- الأورام الصلبة / ليزر التقاط تسليخ مجهري.
- لوصف التجارب، استخدمت عينات FFPE من عينة سرطان الرئة. لتم إصلاح هذا النسيج سرطان الرئة الغرض فورا في 4٪ مخزنة الفورمالين بعد استئصال الجراحي وقطع من حوالي 3 × 2 × 1 سم حيث جزءا لا يتجزأ من البارافين لمزيد من التحليل.
- قطع أجزاء من 5-10 ميكرون سمك من جزءا لا يتجزأ من البارافين (FFPE) عينة الثابتة الفورمالين مع مشراح. أقسام جبل على الشرائح غشاء المغطاة فيلم وجافة عند 37 درجة مئوية لمدة 1 ساعة. Deparaffinize وترطيب الأقسام التي شنت من قبل حضانة المتعاقبة في الزيلين، والإيثانول المطلق، 70٪، والمياه، ولكل لمدة 1 دقيقة.
- وصمة عار على أقسام مع الهيماتوكسيلين لمدة 20 ثانية ثم يشطف بماء الصنبور. جمع السكان خلية من الفائدة عن طريق استخدام نظام تسليخ مجهري الليزر التقاط (انظر أيضا 12).
- الأورام السائلة.
- الطرد المركزي تعليق خلية من الخطوة 1.1.5 في 400 x ج، 4 درجة مئوية لمدة 4 دقائق وتجاهل طاف. غسل مرتين مع 500 ميكرولتر من برنامج تلفزيوني الباردة والطرد المركزي لمدة 5 دقائق في 400 x ج و 4 ° C
- إضافة 40 ميكرولتر تحلل عازلة في 10 6 خلايا واحتضان لمدة 15 دقيقة على الجليد (10 5 خلايا (حوالي 10 ميكروغرام البروتين الكلي) يجب أن يكون عدد الخلايا الحد الأدنى). الطرد المركزي المحللة في 14،000 x ج، 4 درجة مئوية لمدة 10 دقيقة ونقل طاف (مسح المحللة الخلوي) إلى أنبوب رد فعل جديد. تجاهل بيليه.
- الأورام الصلبة.
- إضافة 60 ميكرولتر من العازلة تحلل الأنسجة إلى أنسجة microdissected واحتضان لمدة 15 دقيقة على الجليد، وجمع السائل بواسطة الطرد المركزي القصير ونقل تعليق لأنبوب رد فعل جديد. يصوتن المحللة على الجليد لمدة 3 دقائق.
- إضافة 15 ميكرولتر من 20٪ دوديسيل كبريتات الصوديوم (SDS) إلى التوصل إلى SDS شارك النهائيncentration من 4٪. احتضان الأنسجة microdissected في 99 ° C في كتلة التدفئة لمدة 1 ساعة وتحريكها في 600 دورة في الدقيقة. الطرد المركزي المحللة في 16،000 x ج، 18 درجة مئوية لمدة 10 دقيقة ونقل طاف لأنبوب جديد.
3. إنشاء SILAC سبايك في الكمي قياسي (سوبر SILAC قياسي)
ملاحظة: يتكون هذا المعيار الكمي من خليط من البروتين المسمى SILAC المستمدة 4-6 خلايا الخطوط التي تتناسب مع نوع الورم من الفائدة. لتحقيق أقصى قدر من التداخل بين بروتيوم إشارة المسمى SILAC وبروتيوم المستمدة من الورم، ويحتاج إلى تحليل المكون الرئيسي التي يتعين القيام بها قبل اختيار خطوط الخلايا للمعيار الكمي 14.
- تحليل المكون الرئيسي (PCA).
- لتحديد أنماط التعبير البروتين من خطوط الخلايا، وزراعة حوالي عشرة خطوط مختلفة من الخلايا غير مناسب سائل الإعلام ثقافة الخلية. ليز الخلايا كما هو موضحفي الخطوة 2.1. إعداد لست] الخلوية لقياس الطيف الكتلي كما هو موضح في الخطوة 6.1.
- تحليل نمط تعبير البروتين لكل خط الخلية على قرار عال، يقترن اللوني السائل مطياف الكتلة (nanoLC-MS / MS).
- تحليل البيانات الخام الناتجة باستخدام الأدوات MaxQuant مجانا وإجراء تحليل لمدير مكون باستخدام برنامج المرتبطة مثل فرساوس 16،17.
- حدد 4-6 خطوط الخلايا التي تظهر أكبر تنوع بين ملامح البروتين التعبير عنها واستخدامها لتوليد سوبر SILAC المعايير ارتفاعا في.
- SILAC وضع العلامات والاختيار التسمية.
- زراعة خطوط الخلية المحددة لا يقل عن خمس دورات خلية في خلية المناسب SILAC مستنبت، والذي أرجينين ويسين وصفت مع نظائر مستقرة من الكربون والنيتروجين (SILAC المتوسطة) (4).
- ليز الخلايا كما هو موضح في الخطوة 3.1 و إعداد لست] الخلوية لقياس الطيف الكتلي كما هو موضح في الخطوة 6.1.قياس كفاءة إدراج العلامات SILAC التي كتبها nanoLC-MS / MS. تحليل البيانات الناتجة MS الخام مع MaxQuant وتحديد كفاءة SILAC وضع العلامات. ويتحقق ذلك عن طريق عد الأرقام من الببتيدات التي تم تحديدها في هم المسمى (الثقيلة) وأشكال الوطنية لديها من (الضوء)، واحتساب نسبة (الثقيلة) / (ثقيل + الضوء). يجب أن يتجاوز كفاءة وصفها 98٪.
- مزيج من proteomes SILAC والتحقق من الصحة.
- زراعة وتوسيع خطوط الخلية المحددة وفقا لتعليمات بتصنيع في المتوسط SILAC المناسب. ليز الخلايا كما هو موضح في الخطوة 2.1 للأورام السائلة أو كما هو موضح في الخطوة 3.2 للأورام الصلبة وتحديد تركيز البروتين لكل المحللة الخلوية.
- خلط كميات البروتين متساوي المولية كل سطر الخلية ويقسم الخليط في قسامة. الأداة الإضافية تجميد مأخوذة وتخزينها في -80 درجة مئوية حتى قياس. لتجربة واحدة تحتاج 20-50 ميكروغرام من سوبر SILAC المعيار. احرص على إعداد ستانوينبغي تجنب دارد تزيد عن تغيير معيار ضمن سلسلة من التجارب.
4. قياس تركيز البروتين وسبايك في
- الأورام السائلة.
- باستخدام بروتين الكميات فحص تحديد تركيزات البروتين من لست] الخلوية منها ومستوى سوبر SILAC.
- خلط كميات متساوية من مسح المحللة الخلوي ومستوى سوبر SILAC وبعد ذلك إضافة ليثيوم دوديسيل كبريتات (LDS) عازلة (25٪ من حجم العينة) والحد من وكيل (10٪ من حجم العينة).
- تسخين المحلول الناتج في كتلة التدفئة في 72 درجة مئوية لمدة 10 دقيقة. اختياريا، تخزين البروتينات التشويه والتحريف الناتجة في -80 ° C.
- الأورام الصلبة.
- للبروتين قياس تركيز على قارئ لوحة، مزيج معيار ألبومين المصل البقري (BSA) التخفيف سلسلة الحل، والمحللة والمناسب معيار سوبر SILAC مع متوفرة تجاريا البروتينssay في لوحة 96-جيدا، ويهز لمدة 1 دقيقة، احتضان لمدة الوقت المشار إليه وقياس الامتصاصية كما هو مبين من قبل الشركة المصنعة.
ملاحظة: تركيز عال من SDS وdithiothreitol (DTT) في المحللة هي مشكلة بالنسبة لمعظم المقايسات المتاحة لتقرير تركيز البروتين. - خلط كميات متساوية من المحللة أوضح ومستوى سوبر SILAC مع 200 ميكرولتر من اليوريا في وحدة تصفية وأجهزة الطرد المركزي في 14،000 x ج لمدة 30 دقيقة في 20 ° C. لا تستخدم أكثر من 50 ميكرولتر من المحللة أوضح ومستوى سوبر SILAC. تجنب درجات الحرارة أقل من 15 درجة مئوية، بحيث اليوريا لا تتبلور بها.
- للبروتين قياس تركيز على قارئ لوحة، مزيج معيار ألبومين المصل البقري (BSA) التخفيف سلسلة الحل، والمحللة والمناسب معيار سوبر SILAC مع متوفرة تجاريا البروتينssay في لوحة 96-جيدا، ويهز لمدة 1 دقيقة، احتضان لمدة الوقت المشار إليه وقياس الامتصاصية كما هو مبين من قبل الشركة المصنعة.
5. فصل العينة والبروتين دايجست
- الأورام السائلة.
- منفصل 30-100 ميكروغرام البروتين الكلي في حارة على 4-12٪ التدرج جل SDS-PAGE. البروتينات وصمة عار مع Coomassie الأزرق O / N. إزالة الزائدة Coomassie وصمة عار من قبل اثنين من يغسل بالماء لاحقة.
- قطع كل حارة من هلام وتقسيمهإلى 23 شرائح متساوية الحجم بغض النظر عن نمط من هلام تلطيخ. معالجة شرائح هلام على حدة، كل في في 0.6 مل البولي بروبلين القارورة.
- تغسل شرائح هلام مع الماء والميثانول / الماء (50:50، ت / ت)، والحد مع 10 ملي DTT التي يحتضنها لمدة 30 دقيقة في 56 ° C. يؤلكل شرائح هلام مع 55 ملي iodoacetamide (IAA) التي تفرخ في 60 دقيقة في RT في الظلام.
- بين خطوات معالجة عينة، وغسل شرائح مع الأسيتونتريل لمدة 15 دقيقة وجافة في SpeedVac لإزالة المذيب الزائدة وتحسين امتصاص حل كاشف.
- أداء البروتيني الانقسام التي كتبها المضادة للجفاف شرائح هلام المجففة مع الحد الأدنى من الحل التربسين الخنازير (12.5 نانوغرام / ميكرولتر في 0.025 M بيكربونات الأمونيوم المائية) لمدة 16 ساعة على 37 درجة مئوية.
- إضافة الماء 10 ميكرولتر لشريحة جل واحتضان لمدة 15 دقيقة عند 37 ° C. إضافة 80 ميكرولتر الأسيتونتريل واحتضان لمدة 15 دقيقة عند 37 ° C. أجهزة الطرد المركزي في 15،800 x ج، لمدة 1 دقيقة. جمع طاف وتخزينها في منفصلة 0.6 ملأنبوب.
- إضافة 65 ميكرولتر من 5٪ حمض الفورميك الحل، دوامة واحتضان لمدة 15 دقيقة عند 37 ° C. إضافة 65 ميكرولتر الأسيتونتريل واحتضان لمدة 15 دقيقة عند 37 ° C. أجهزة الطرد المركزي في 15،800 x ج لمدة 1 دقيقة. جمع طاف وإضافته إلى طاف من الخطوة السابقة. تتبخر طاف جنبا إلى جنب للجفاف في المكثف فراغ.
- الأورام الصلبة.
- لإزالة SDS من الأنسجة المحللة استخدام بروتوكول FASP التالية، كما وصفت بأنها في اشارة 15.
- بعد الطرد المركزي الأول هو موضح في الخطوة 5.2.3 إضافة 200 ميكرولتر مزيد من 8 M اليوريا على مرشح، ومزيد من أجهزة الطرد المركزي في 14،000 x ج لمدة 20 دقيقة في 20 ° C. تجاهل الترشيح التدفق من خلال.
- إضافة 100 ميكرولتر IAA وخلط في thermomixer في 600 دورة في الدقيقة لمدة 1 دقيقة. احتضان مرشح لمدة 20 دقيقة عند 20 درجة مئوية في الظلام. أجهزة الطرد المركزي لمرشح في 14،000 x ج لمدة 10 دقيقة في 20 ° C.
- إضافة 100 ميكرولتر من اليوريا إلى تصفية وCENtrifuge في 14،000 x ج، لمدة 15 دقيقة في 20 ° C. كرر هذه الخطوة مرة أخرى.
- إضافة 100 ميكرولتر من NH 4 HCO 3 إلى التصفية والطرد المركزي في 14،000 x ج لمدة 10 دقيقة في 20 ° C. كرر هذه الخطوة مرتين.
- إضافة 40 ميكرولتر NH 4 HCO 3 + 1 ميكرولتر (= 0.4 ميكروغرام) التربسين وخلط في thermomixer عند 20 درجة مئوية لمدة 600 دورة في الدقيقة، 1 دقيقة. احتضان مرشح O / N في غرفة رطبة عند 37 درجة مئوية. نقل مرشح لأنابيب جمع جديدة.
- أجهزة الطرد المركزي لمرشح في 14،000 x ج لمدة 10 دقيقة في 20 ° C. إضافة 50 ميكرولتر من NH 4 HCO 3 وأجهزة الطرد المركزي مرشح في 14،000 ز لمدة 10 دقيقة عند 20 درجة مئوية. تخزين الببتيدات الناتجة في -20 درجة مئوية حتى قياس الطيفي كتلة.
- لقياس تركيز الببتيد، الاستغناء 50 ميكرولتر من الناتج التدفق من خلال وسلسلة من التخفيفات المناسبة من التربتوفان أنيق في لوحة 96-جيدا. قياس مضان التربتوفان. تحويل تركيز الناتجة منالتربتوفان إلى تركيز الببتيد، و0.1 ميكروغرام من التربتوفان يتوافق مع 9 ميكروغرام البروتين.
6. تحليل السائل اللوني والكتلة الطيفية
- تنحل الببتيدات في 30 ميكرولتر العازلة تحميل لمدة 5 دقائق في حمام صوتنة. تدور باستمرار في أجهزة الطرد المركزي في 15،800 x ج لمدة 1 دقيقة، وماصة حل واضح في قارورة MS الاوتوماتيكى.
- حقن 5 ميكرولتر من العينة في تحليل باستخدام الاوتوماتيكى للنظام nanoLC-MS / MS. التركيز والببتيدات تحلية عبر الإنترنت على الطور المعكوس C18 ما قبل العمود (0.15 ملم × 20 ملم ID مع 5 ميكرون حجم المسام المواد C18) شنت إما في الإعداد العمود تنفيس أو precolumn تبديل الإعداد.
- الببتيدات منفصلة على مرحلة عكس C18 microcolumn (0.075 ملم × 200 ملم ID الذاتي معبأة مع 3 ميكرون أو أصغر المسام المواد حجم C18 في عمود nanospray حزمة الذاتية مثل PicoFrit، وذلك باستخدام التدرج 90 دقيقة من 5> 35٪ مقابل الأسيتونتريل . حمض الفورميك مائي 0.1٪ إلى 300 NL /دقيقة. نقل شاطف في هجين رباعي / مطياف الكتلة orbitrap عبر مصدر nanospray أيون.
- تحليل الببتيدات باستخدام Top15 البيانات تعتمد طريقة الشراء (MS م / ض نطاق 350 - 1600، القرار الهدف 70.000 FWHM، الهدف AGC 1 × 10 6، ماكس وقت ملء 60 ميللي ثانية MS / MS بدء كتلة 100، القرار الهدف 17.500 FWHM، AGC الهدف 2 × 10 5، الحد الأقصى للمرة ملء 60 ميللي ثانية MS / MS عتبة 3 × 10 4، وتشمل الدول تهمة 2 - 5، تطبيع اصطدام الطاقة NCE 25٪، ودينامية استبعاد 15 ثانية).
7. تحليل البيانات
- لتحليل البيانات استخدام متاحة بحرية MaxQuant 16 البرمجيات. ووصف بروتوكول مفصلة لتحليل البيانات بيوينفورمتيك في 16،17. للتحليل، والجمع بين ملفات البيانات الخام من جميع شرائح من حارة SDS-PAGE في تجربة واحدة (17).
النتائج
التنميط البروتين الأورام السائلة والصلبة من المرضى هو نهج واعد لاكتشاف المؤشرات الحيوية التشخيصية والتنبؤية جديدة. ومع ذلك، فإن الإجراء إعداد العينات والتحليل الطيفي الشامل وتحديا، نظرا لتعقيد العينات والحاجة إلى دقة القياس الكمي البروتين في مجموعات كبيرة من العينات. إجراء التجارب المذكورة أعلاه يبدأ مع عزل الخلايا من الفائدة، إما عن طريق مضان تنشيط الخلايا الفرز أو عن طريق الليزر التقاط تسليخ مجهري.
لهذا الغرض، هي ملطخة الخلايا من نخاع العظام شفاطات المستمدة من المريض أو عينات من الدم مع الأجسام المضادة المسمى مضان ضد علامات سطح محددة من الفائدة قبل الفرز على أساس FACS وتحلل الخلية.
لإثراء مجموعات فرعية الخلوية من أقسام الأنسجة، وهذه أول مرة يكون لتركيبها على الشرائح المناسبة للسماح ليزر التقاط تسليخ مجهري. لهذا الغرض جبل رانه أقسام الأنسجة على شرائح غشاء المناسبة واستخدام الليزر التقاط microdissector وفقا لتعليمات الشركة الصانعة. اختيار أماكن وخلايا الفائدة يتطلب المعرفة المناسبة حول histomorphology من الأنسجة السليمة والأورام. ثم يتم نقل الخلايا المستخرجة إلى أنبوب جمع المناسب. يجب أن يتم تنفيذ التجارب الأولية من أجل تحديد كمية الأنسجة اللازمة لاستخراج كميات كافية من البروتين (الحد الأدنى البروتين الكلي 10 ميكروغرام) لكل أنسجة جديدة من الفائدة. يتم التعامل مع كل عينة microdissected مع 60 ميكرولتر من العازلة تحلل الأنسجة. للتحلل كفاءة الخلايا من عينات الأنسجة يجب أن sonicated لمدة 3 دقائق وبعد إضافة 15 ميكرولتر من عينات SDS يتم تحضين في thermomixer في 99 درجة مئوية لمدة 1 ساعة لإزالة crosslinks البروتين الناجم عن الفورمالين. سوف الطرد المركزي أخيرا تسهيل جمع المحللة الخلوي مسح.
من كل داء من أنادفع الفوائد (السائل والأورام الصلبة) لمناسبة سوبر SILAC المعيار الكمي لابد من إنشاء 14. معيار المناسب يجب أن تمثل أكثر من 90٪ من البروتينات التي أعرب عنها في عينات من الفائدة. لإعداد معيار القياس الكمي، خطوط الخلايا المرتبطة ب نوع سرطان الفائدة ينبغي أولا تحليل بواسطة مطياف الكتلة لتحديد ملامح البروتين التعبير، وينبغي إجراء تحليل المكون الرئيسي في وقت لاحق. 4-6 خطوط مختلفة من الخلايا مع أنماط التعبير البروتين التفريقي يجب اختيار وSILAC المسمى مع أرجينين "الثقيل" ويسين. يجب فحص كفاءة وصفها من قبل nanoLC-MS / MS ويجب أن تكون أكبر من 98٪. بعد ذلك، ينبغي هي lysed خطوط الخلايا بنفس الطريقة كما العينة المستمدة من المريض منها، وبعد ذلك كميات البروتين متساوي المولية من كل عينة وSILAC-ارتفاع في مستوى ينبغي أن تكون مختلطة. خطوة حاسمة لدقيقة الكمي البروتين من العينات السريرية سالفائدة و هي خليط الدقيق لكميات البروتين متساوي المولية من العينات المستمدة من المريض وSILAC-ارتفاع في مستوى الكمي. لتحديد تركيز البروتين من لست] المستمدة من الخلايا فرزها، يمكن استخدام مختلف المقايسات البروتين الكمي. للست] الخلوية من الخلايا المشتقة من الأنسجة هناك حاجة إلى الفحص يمكن أن تتعامل مع تركيزات عالية من SDS وDTT في المحللة. تركيزات البروتين من العينات المستمدة من المريض وSILAC-ارتفاع في مستوى ينبغي قياس كل مرة قبل تركيبة مع العينات السريرية المعنية من أجل ضمان الخليط الصحيح، وهو أمر حاسم في اتخاذ حتى مئات من العينات للمقارنة.
بعد خليط من كميات متساوية من ارتفاع في عينات قياسية والمحللة، تم الحصول عليها من تختلط مع LDS الأورام السائلة، تسخينها في thermomixer عند 72 درجة مئوية لمدة 10 دقيقة وبعد ذلك تعرض ل1D-PAGE وفي جل الهضم للفصل البروتينات مع التربسين. عينات تم الحصول عليها منيتم الافراج عن الأنسجة من SDS ويتفاعل مع التربسين باستخدام نهج FASP كما حددها Wisniewski وآخرون 15
الببتيدات زيتية تم الحصول عليها يمكن قياسها كميا عن طريق قياس مضان التربتوفان، وهي ذات أهمية خاصة للعينات الأنسجة كما كمية من الببتيدات التي صدرت من مرشح يختلف ما بين 15٪ و 75٪ مقارنة مع كميات البروتين تحميلها في البداية على التصفية. لهذا الغرض نقيس مضان من التربتوفان. مقارنة مع سلسلة التخفيف التربتوفان مناسبة تسمح لتقدير حجم الببتيدات، و1.1 ميكروغرام من التربتوفان يتوافق مع ما يقرب من 100 ميكروغرام من الببتيد. إذا لزم الأمر، وعينات المستمدة خاصة من معالجة FASP يمكن قبل تنقيته إما تجارية أو محلية الصنع نصائح المرحلة محملة معكوسة (RP-C18) مادة مراحل C18 قبل تحميل على النظام nanoLC / MS / MS 18.
يتم تنفيذ تحليل الكتلة الطيفي على ارتفاع، قرار، ذات حساسية عالية نظام مطياف الكتلة. وباختصار، فإن المحلاة عينات الببتيد وpreconcentrated على precolumn RP-C18، وفصلها على العمود التحليلي RP-C18 إلى جانب مباشرة إلى مطياف الكتلة. لتحقيق عمق كاف من التحليل، ونحن توظيف إما مزيج من SDS-PAGE البروتين prefractionation مع 40 دقيقة التدرجات RP-C18 (للأورام السائلة) أو حقن واحدة مع طويلة 2 - 3 في ساعة التدرجات RP-C18 (للأورام الصلبة التي تتم معالجتها بواسطة FASP ). يتم الحصول MS الأطياف بدرجة وضوح 70،000 FWHM أو أفضل، للسماح الكمي الدقيق للأزواج SILAC التي كتبها التكامل لمحات الذروة الكروماتوغرافي. لتحديد البروتين، يتم استخدام طريقة الشراء التي تعتمد على البيانات Top15 لتوليد عدد كبير من الببتيد MS / MS الأطياف لالببتيد وتحديد البروتين.
من البيانات الخام الناتجة عن ذلك، وتتحقق تحديد البروتين وتقدير من قبل قاعدة بيانات البحث مع برنامج MaxQuant ضد UniProt Knowledgebasبروتيوم كاملة تسلسل قاعدة بيانات البريد الإنسان 17. في مجال البرمجيات MaxQuant (الإصدار الحالي 1.5.0.25) يتم تحديد الببتيدات من المكتسبة MS / MS الأطياف التي كتبها الببتيد شظية مطابقة ضد أطياف مستمدة في سيليكون من قاعدة البيانات تسلسل البروتين. وفي الوقت نفسه، يتم استخراج السلائف أيون لمحات النظائر في جميع أنحاء مرات الاحتفاظ الكروماتوغرافي بهم، وتستخدم المناطق الذروة متكاملة من أجل الكمي النسبي للضوء: أزواج الببتيد الثقيلة الناتجة عن وضع العلامات SILAC. ثم يتم تعيين هويات الببتيد وكثافة نسبية على خصائص البروتين المقابلة. ثم يتم استخدام البرمجيات فرساوس (الإصدار الحالي 1.5.0.15) لإجراء مزيد من التقييم الإحصائي المصب من نتائج المعالجة MaxQuant، بما في ذلك عينة إلى عينة المقارنات، PCA والتجميع الهرمي.
باستخدام وصف الإعداد التجريبية التي حددناها وكميا يصل إلى 8،000 البروتينات من اقل من 30 ميكروغرام من البروتين الكليالمستمدة من الأورام السائلة.
ويمكن تحديد ما يصل إلى 2،500 البروتينات من عينات الأورام الصلبة وكميا في نهج بروتيوميك بندقية مع التدرج LC فقط 2 ساعة، والسماح للتحليل مئات العينات السريرية في وقت قصير نسبيا.
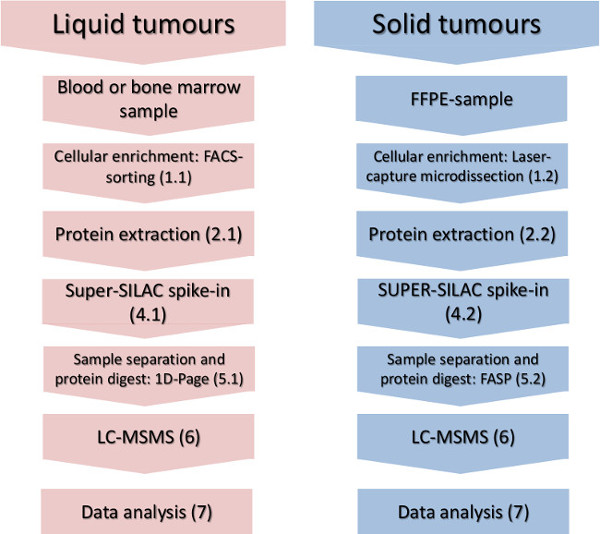
الشكل 1. سير العمل التجريبي. الخطوات الرئيسية لتخصيب الخلوية فرعية، والبروتين العزلة، وسلب في المعيار الكمي والتحليل الطيفي كتلة تظهر للأورام السائلة والصلبة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
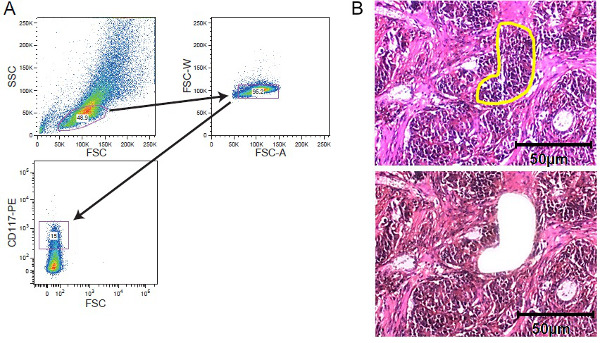
الشكل 2. strategi تخصيب الخلويوفاق. FACS الفرز وLCM. (A) استراتيجية النابضة المثالية التي تصور النابضة على السكان خلية ابيضاض الدم ملطخة CD117 التي حصل عليها فارز الخلية. (B) ملقط ليزر من نسيج الورم الصلبة. وقد شنت 10 ميكرون سمك على المغطاة فيلم الشرائح الغشاء قبل تلطيخ - أقسام الأنسجة من 5. وقد تم اختيار منطقة مصالح يدويا لملقط ليزر. المعروضة هي أقسام قبل تسليخ مجهري مع المنطقة من اهتمام ملحوظ الصفراء وبعد تسليخ مجهري. يتم تضمين شريط حجم 50 ميكرون في الشكل. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
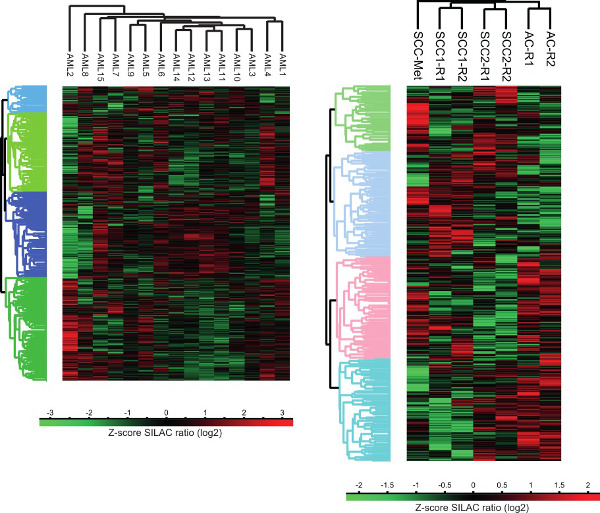
الشكل 3. تحليل الكتلة proteomes سرطان خلايا الإنسان. التحليل العنقودي بدون إشراف من العلاقات العامةتم إجراء ملامح التعبير otein الأورام السائلة والصلبة باستخدام منصة الحسابية رأس الغول. AC - غدية، SCC - سرطان الخلايا الحرشفية، SCC-MET - الحرشفية الانبثاث سرطان الخلايا من سرطان الرأس والرقبة، R - تكرار التقني.
Discussion
وهناك حاجة التنميط الطيفي الشامل من proteomes سرطان الخلايا المشتقة من المريض لاكتشاف المؤشرات الحيوية التنبؤية / التشخيص الجديدة، وكذلك لإعطاء فهم أفضل للبيولوجيا الخلايا السرطانية، والتي قد تؤدي بدورها إلى تحديد أهداف أدوية جديدة محتملة. ومع ذلك، فإن مثل هذه التحليلات الطيفي الشامل تشكل تحديا للغاية، ولا سيما بسبب مختلف القضايا قبل التحليلية يجب أن تحل، إذا واحد هو الحصول على نتائج قوية وذات الصلة من الناحية البيولوجية.
سير العمل التجريبي وصفها هنا يسمح لتوصيف بروتيوميك الكمي للproteomes المستمدة من القطعان الخلوية على حد سواء الأورام السائلة والصلبة. هناك حاجة لتخصيب الأولي من الخلايا السرطانية من قبل أي أساس FACS خلايا-sortingor تسليخ مجهري لتجنب التلوث بواسطة خلايا الورم المكروية. وعلاوة على ذلك، تسمح هذه التقنيات واحدة لعزل مجموعات سكانية فرعية الخلوية في المصالح. دراسات الخلايا البيولوجية الأخيرة لها شيطانstrated أن بعض المجموعات السكانية الفرعية الخلوية لها خصائص بدء الورم وبالتالي فهي ذات أهمية كبيرة لسرطان المرضية 19،20. كما أصبح قياس الطيف الكتلي أكثر حساسية في السنوات الأخيرة، والتحليلات البروتين الكمية مجدية لكميات صغيرة من البروتين التي يمكن استخلاصها من بضعة آلاف من الخلايا، مما يجعل من الممكن للتركيز على السكان الخلية ذات الصلة وظيفيا.
مجموعة المتابعة المقدمة هنا يمكن استخدامها لتحديد والتحقق من صحة المؤشرات الحيوية التشخيصية الجديدة في عينات FFPE. وبالتالي، فمن عود لBEA أداة مفيدة لتحسين التشخيص السريري، وحتى الآن لا يزال هناك نقص في المؤشرات الحيوية الجزيئية في عدد كاف والجودة لكثير من أنواع السرطان. أمثلة هامة من تشخيصات تفريقية الصعبة، التي المؤشرات الحيوية غير موجودة، هي التمييز بين سرطان الرئة الأولية من الانبثاث في الرئة، وسرطان خلايا الأقنية الصفراوية داخل البنكرياس وغدية البنكرياس، وكذلك تختلفentiation من ورم ليفي عصبي حميدة من الأورام العصبية الطرفية غمد الخبيثة للغاية. وعلاوة على ذلك، نحن وغيرنا قد أظهرت أن توضيح كمية من التوقيعات البروتين يمكن أن تكون مفيدة في دراسة بيولوجيا الخلايا السرطانية بشكل عام، وللكشف عن المؤشرات الحيوية التنبؤية للاستجابة العلاجية في علاج مرضى السرطان 21.
اثنين من السلبيات الحالية للالطريقة المعروضة هنا هي شرط اليدوي للواسعة تجهيز العينات والطلب على nanoLC-MS / MS اكتساب الوقت. في حين أن الأول يمكن معالجتها عن طريق تحريك إعداد نموذج لمثل تنسيقات 96-جيدا واستخدام المعالجة الروبوتية، وهذا الأخير سوف يتطلب تغييرا في استراتيجية الاستحواذ الجماعية الطيفي. مرة واحدة وقد تم تحديد مجموعات فرعية من البروتينات المستهدفة التي يمكن أن تترافق مع مثل تصنيف الورم، ونحن نتصور تصميم أساليب مطياف الكتلة الهادفة والتي تقدم قراءات الكمية لهذه المجموعات الفرعية مع جهد فصل تقلص إلى حد كبير، ووبالتالي مع انخفاض في المقابل اكتساب الوقت. إذا كان اكتساب الوقت المطلوب ويمكن خفض من 24 المطلوبة - 36 ساعة (أورام السائلة) أو 3 ساعة (الأورام الصلبة) لسبيل المثال، 1 ساعة باستخدام استهدفت قياس الطيف الكتلي والفصل بسيط أحادي البعد من الببتيدات، ثم ينتج عنها من مكاسب في الإنتاجية يمكن استخدامها لزيادة كبيرة في أعداد مكررات البيولوجية والتقنية فحصها، مع تحسينات في المقابلة على أهمية النتائج الكمي. وقد تم بالفعل أثبت النهج الطيفي الجماعية المستهدفة ليكون أداة مناسبة للتحقق من السرطان المرتبط بالبروتين العلامات البيولوجية-22 مرشحا، وتم تطويرها لنقطة حيث أنها تظهر الوعد للمصادقة أو حتى كأداة محتملة للاستخدام السريري الروتيني 23 ، 24.
Disclosures
الكتاب ليس لديهم تضارب في المصالح أو غيرها من القضايا في الكشف عنها.
Acknowledgements
The authors thank Uwe Plessmann, Monika Raabe und Silvia Münch for technical support.
Materials
| Name | Company | Catalog Number | Comments |
| 660 nm Kit | Thermo scientific | 22662 | |
| Cell culture medium depleted of arginine and lysine | Thermo Scientific | 88421 | |
| Coomassie Brilliant Blue R-250 staining solution | Bio Rad | 161-0436 | |
| Dialyzed fetal calf serum (FCS) | PAA | A15-107 | |
| Diffuser caps for microdissection | MMI | 50202 | |
| FACS-sorter | BD | FACSAria III | |
| Ionic Detergent Compatibility Reagent | Thermo scientific | 22663 | |
| Laser-capture microdissector | MMI | cell cut plus | |
| LDS buffer | Life Technologies | NP0009 | |
| Membrane slides for microdissection | MMI | 50103 | |
| Microcon YM-30 | Millipore | MRCF0R030 | |
| NuPAGE 4-12% Bis-Tris Mini Gels | Life Technologies | NP0335PK2 | |
| Picofrit Self-Pack Columns | New Objective | PF360-75-15-N-5 | Mass Spectrometry Column/Emitter |
| Reducing agent | Life Technologies | NP0007 | |
| Reprosil-Pur LC/MS/MS Column stationary phase | Dr. Maisch | 120 C18-AQ, 3 µm | |
| Reprosil-Pur LC/MS/MS Precolumn stationary phase | Dr. Maisch | 120 C18-AQ, 5 µm | |
| SILAC-labeled arginine | Eurisotop | CLM-2265-H-0.1 | |
| SILAC-labeled lysine | Eurisotop | DLM-2640-0.25 | |
| Trypsin, NB Sequencing Grade | Serva | 3728301 | for in-gel digests |
| Trypsin, Sequencing Grade | Promega | V5111 | for in-solution digests |
| Buffer and solutions | |||
| Cell lysis buffer: 150 mM NaCl, 50 mM Tris/HCl pH 7.8, 5 mM NaF, 0.5% NP40, 0.1% laurylmaltoside, Roche complete protease inhibitor, 1 mM Na3VO4 | |||
| Tissue lysis buffer: 100 mM Tris/HCl pH 7.8, 0.1 M DTT | |||
| Urea: 8 M urea in 0.1 M Tris-HCl, pH 8.5 | for FASP-protocoll | ||
| IAA: 0.05 M iodoacetamide, 8 M urea, 0.1 M Tris-HCl, pH 8.5 | for FASP-protocoll | ||
| 0.05 M NH4HCO3 | |||
| 10 mM dithiothreitol (DTT) in 0.1 M ammonium bicarbonate | for in-gel digest | ||
| 55 mM iodoacetamide (IAA) in 0.1 mM ammonium bicarbonate | for in-gel digest | ||
| 5% aqueous formic acid. |
References
- Walther, T. C., Mann, M. Mass spectrometry-based proteomics in cell biology. J Cell Biol. 190 (4), 491-500 (2010).
- Lenz, C., Urlaub, H. Separation methodology to improve proteome coverage depth. Expert Rev Proteomics. 11 (4), 409-414 (2014).
- Olsen, J. V., Mann, M. Status of large-scale analysis of post-translational modifications by mass spectrometry. Mol Cell Proteomics. 12 (12), 3444-3452 (2013).
- Ong, S. E., et al. Stable isotope labeling by amino acids in cell culture, SILAC, as a simple and accurate approach to expression proteomics. Mol Cell Proteomics. 1 (5), 376-386 (2002).
- Jimenez, C. R., Verheul, H. M. Mass spectrometry-based proteomics: from cancer biology to protein biomarkers, drug targets, and clinical applications. Am Soc Clin Oncol Educ Book. , e504-e510 (2014).
- Tang, D. G. Understanding cancer stem cell heterogeneity and plasticity. Cell Res. 22 (3), 457-472 (2012).
- Evans, C., et al. An insight into iTRAQ: where do we stand now. Anal Bioanal Chem. 404 (4), 1011-1027 (2012).
- Ostasiewicz, P., Zielinska, D. F., Mann, M., Wisniewski, J. R. Proteome, phosphoproteome, and N-glycoproteome are quantitatively preserved in formalin-fixed paraffin-embedded tissue and analyzable by high-resolution mass spectrometry. J Proteome Res. 9 (7), 3688-3700 (2010).
- Malmström, J., Picotti, P., Aebersold, R. Perspectives of targeted mass spectrometry for protein biomarker verification. Curr Opin Chem Biol. 13 (5-6), 518-525 (2009).
- Gillet, L. C., et al. Targeted data extraction of the MS/MS spectra generated by data-independent acquisition: a new concept for consistent and accurate proteome analysis. Mol Cell Proteomics. 11 (6), (2012).
- Basu, S., Campbell, H. M., Dittel, B. N., Ray, A. Purification of specific cell population by fluorescence activated cell sorting (FACS). J Vis Exp. 41, (2010).
- Edwards, R. A. Laser capture microdissection of mammalian tissue. J Vis Exp. 8, 309 (2007).
- Liu, N. Q., et al. Proteomics pipeline for biomarker discovery of laser capture microdissected breast cancer tissue. J Mammary Gland Biol Neoplasia. 17 (2), 155-164 (2012).
- Geiger, T., et al. Use of stable isotope labeling by amino acids in cell culture as a spike-in standard in quantitative proteomics. Nat Protoc. 6 (2), 147-157 (2011).
- Wisniewski, J. R. Proteomic sample preparation from formalin fixed and paraffin embedded tissue. J Vis Exp. (79), (2013).
- Cox, J., Mann, M. MaxQuant enables high peptide identification rates, individualized p.p.b.-range mass accuracies and proteome-wide protein quantification. Nat Biotechnol. 26 (12), 1367-1372 (2008).
- Cox, J., et al. A practical guide to the MaxQuant computational platform for SILAC-based quantitative proteomics. Nat Protoc. 4 (5), 698-705 (2009).
- Rappsilber, J., Mann, M., Ishihama, Y. Protocol for micro-purification, enrichment, pre-fractionation and storage of peptides for proteomics using StageTips. Nat Protoc. 2 (8), 1896-1906 (2007).
- Sarvi, S., et al. CD133+ cancer stem-like cells in small cell lung cancer are highly tumorigenic and chemoresistant but sensitive to a novel neuropeptide antagonist. Cancer Res. 74 (5), 1554-1565 (2014).
- Shlush, L. I., et al. Identification of pre-leukaemic haematopoietic stem cells in acute leukaemia. Nature. 506 (7488), 328-333 (2014).
- Schaab, C., et al. Global phosphoproteome analysis of human bone marrow reveals predictive phosphorylation markers for the treatment of acute myeloid leukemia with quizartinib. Leukemia. 28 (3), 716-719 (2014).
- Hüttenhain, R., et al. Reproducible quantification of cancer-associated proteins in body fluids using targeted proteomics. Sci Transl Med. 4 (142), 142ra94 (2012).
- Burgess, M. W., et al. Simplified and efficient quantification of low-abundance proteins at very high multiplex via targeted mass spectrometry. Mol Cell Proteomics. 13 (4), 1137-1149 (2014).
- Boja, E. S., et al. Analytical Validation Considerations of Multiplex Mass Spectrometry-based Proteomic Platforms for Measuring Protein Biomarkers. J Proteome Res. , (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved