Method Article
Mass כמותי spectrometric פרופיל של Proteomes סרטן התאים נגזרים מנוזלים וגידולים מוצקים
In This Article
Summary
In-depth analyses of cancer cell proteomes facilitate identification of novel drug targets and diagnostic biomarkers. We describe an experimental workflow for quantitative analysis of (phospho-)proteomes in cancer cell subpopulations derived from liquid and solid tumors. This is achieved by combining cellular enrichment strategies with quantitative Super-SILAC-based mass spectrometry.
Abstract
בניתוחים מעמיקים של proteomes תא הסרטני יש צורך להבהיר pathomechanisms שעור, כמו גם לזהות מטרות פוטנציאליות לתרופה, וסמנים דיאגנוסטיים. עם זאת, שיטות לאפיון proteomic כמותי של גידולים המופק מחולה ובתת-האוכלוסיות הסלולריות שלהם בפרט במידה רבה חסרות. כאן אנו מתארים ניסיוני הגדרה המאפשרת ניתוח כמותי של proteomes של תת-אוכלוסיות של תאי הסרטן נובעות משני גידולים נוזליים או מוצקים. זו מושגת על ידי שילוב של אסטרטגיות העשרה סלולריות עם ספקטרומטר מסה ואחריו ניתוח נתונים bioinformatic מבוסס Super-SILAC כמותיים. כדי להעשיר את תת סלולריים ספציפיים, גידולים נוזליים immunophenotyped ראשון על ידי זרימת cytometry אחרי FACS-מיון; לגידולים מוצקים, microdissection לייזר ללכוד משמש לטיהור תת-אוכלוסיות סלולריות ספציפיות. בשלב שני, חלבונים המופקים מהתאים המטוהרים ושילוב לאחר מכן עם גידול ספציפי,SILAC שכותרת סטנדרטי המאפשרת כימות חלבון ספייק-ב. תערובת חלבונים וכתוצאה מכך היא נתון או ג'ל אלקטרופורזה או לדוגמא סינון בעזרת הכנה (FASP) ואחריו עיכול tryptic. לבסוף, פפטידים tryptic מנותחים באמצעות ספקטרומטר מסת quadrupole-orbitrap היברידי, והנתונים המתקבלים מעובדים עם חבילות תוכנת bioinformatic כולל MaxQuant. באמצעות זרימת העבודה שהוצגה כאן, עד 8,000 חלבונים ניתן לזהות ולכמת בדגימות שמקורם בחולה, וניתן להשוות את פרופילי ביטוי חלבון וכתוצאה מכך בקרב חולים לזהות חתימות proteomic לאבחון או למטרות תרופה פוטנציאליות.
Introduction
פרוטאומיקה מבוססת ספקטרומטריית מסה התפתחה וכיום היא משמעת בשימוש נרחב בביולוגיה של תא ומחקר ביו-רפואי translational. התקדמות טכנית בתחום הפכה אותו ניתן ללמוד תהליכים תאיים מורכבים בשורות תאים ומודלים של בעלי חיים, כאלף חלבונים יכולים להיות מזוהות בניסוי ספקטרומטריה יחיד 1,2. התקדמות דומה נעשתה לניתוח רבים שינויי posttranslational כגון זרחון או ubiquitination, אם כי זה בדרך כלל דורש זרימות עבודה העידו להעשרה וניתוח נתונים עבור כל סוג של 2,3 שינוי. יתר על כן, מעורבותם של אסטרטגיות כימיות ומטבולית תיוג, כוללים SILAC, מאפשרת כימות היחסית מדויקת של חלבונים וPTMs, מה שהופך שיטה זו אטרקטיבית במיוחד לגילוי תהליכים בסיסיים סלולריים, סמנים דיאגנוסטיים ויעדים אפשריים לתרופה בסרטן בבני אדם 4.
עם זאת,כמה אתגרים יש להתגבר בכל קשור לניתוח proteomic של הסרטן אנושי ראשוני 5. קודם כל, דגימות סרטן בבני אדם לעתים קרובות להראות רמה גבוהה של ההטרוגניות סלולרית שנובעת מנוכחותם של סוגי תאים שונים השייכים למייקרו-הסביבה של הגידול, כולל תאים וfibroblasts חיסוניים. שנית, אבולוציה משובט מובילה למגוון גנטי בתוך הגידולים עצמם, וכתוצאה מכך קיומם של מספר תת-אוכלוסיות סלולריות עם תכונות פונקציונליות שונות. על פי התפיסה הנוכחית של כמה תאי גזע סרטני שהכוחות המניעים מאחורי התפתחות והתקדמות הסרטן, ניתוח proteomic של תת-אוכלוסיות (תפקודי רלוונטיות מאוד) כגון סלולריות צפוי להיות בעלת חשיבות גדולה להבנה טובה יותר של מנגנונים שעור רלוונטית ליישום קליני 6. שלישית, פרופילי ביטוי חלבון הכמותי של קבוצות גדולות של דגימות נדרשים לעתים לזיהוי biomar הקליני חזקKERS; זה לא יכול להיות מושלם על ידי תיוג כימי כגון 7 iTRAQ, ואילו אסטרטגיות תיוג מטבולית - הסתמכות, כפי שהם עושים, בהתרבות תאים 4 - הן גם ישימה. רביעית, רוב דגימות גידולים מוצקות הזמינות הן פורמלין-קבוע, אשר מסבך ניתוח proteome ספקטרומטריה עקב היווצרות של חלבון crosslinks 8. לבסוף, רוב תהליכי העבודה פרוטאומיקה הקיימת דורשים כמויות משמעותיות של עיבוד מדגם ורכישת נתונים, עיבוד הניתוח של מספרים לדוגמה רלוונטיים למחקר קליני קשה, וקוראות לעבודה חדשה פרדיגמות 9,10.
כדי לטפל במכשולים הללו פיתחנו התקנה ניסיונית המשלבת גם תא זרימת cytometric מיון 11 או לייזר ללכוד microdissection 12,13 להעשרה סלולרית עם אסטרטגית Super-SILAC 14 להציג תקן פנימי עולמי לניתוח ספקטרומטריה מקיף. על ידי שימוש בשיטה שתוארה כאן, אפשר לכמת עד 8,000 חלבונים בדגימות גידולים אנושיים אחת הנגזרות משני סוגי הסרטן נוזליים או מוצק.
Protocol
כל הניסויים בדגימות רקמה או דם אדם חייבים להיות מאושרים על ידי ועדת אתיקה ומתנהלים על-פי כל הנחיות שניתנו בהצבעת האתיקה.
1. סלולרית העשרה
- גידולים נוזליים / מיון תא הקרינה המופעל.
- בודד תאי mononuclear ממח עצם או דגימת דם על ידי ביצוע תמוגה כדורית אדומה באמצעות אמוניום כלוריד או על ידי צנטריפוגה צפיפות שיפוע Ficoll.
- לתמוגה כדורית אדומה, לשלב 1 מיליליטר של מדגם עם 4 מיליליטר של תמיסת אמוניום כלוריד. דגירה הפתרון על קרח למשך 5 - 10 דקות. הוסף 40 מיליליטר של בופר פוספט (PBS) + 2% עוברי עגל בסרום (FCS) וצנטריפוגות במשך 5 דקות ב 400 XG ו -4 מעלות צלזיוס.
- לצנטריפוגה Ficoll שיפוע, שכבה 10 מיליליטר של מדגם על 15 מיליליטר של Ficoll-Hypaque כדי ליצור 2 שכבות נפרדות (להיזהר שלא להפריע את השכבות). צנטריפוגה ב 400 XG למשך 30 דקות ב RT (15 - 25 מעלות צלזיוס) בזהירות ולאסוף את mononuclearתאים שאוספים בשלבי הביניים.
- ספין למטה התאים ולקחת אותם בPBS 2% FCS +. צנטריפוגה ב 400 XG במשך 5 דקות ולקחת את ב 1 מיליליטר PBS + 2% FCS. קח aliquot אחד כביקורת שלילית וaliquot אחד לכל צבע פלואורסצנטי המשמש בכתם הסופי.
- דגירה עם נוגדנים שכותרתו הקרינה שימושיים לבודד את אוכלוסיית תאי leukemic בדילול לפי הוראות יצרן על קרח למשך 30 דקות. גם להכתים את aliquots משמש לפיצוי עם כל נוגדן בנפרד. לשטוף פעמיים עם PBS + 2% FCS.
הערה: הנוגדנים המשמשים היו עכבר אנטי אנושי נגד CD117-PE (Clone 95C3), CD34-FITC (Clone 8G12) וCD33-PE (Clone P67.6). - תאי סינון דרך מסננת תא 35 מיקרומטר, צינורות באמצעות אידיאלי עם מסננת תא משולב בכובע.
- להוסיף כתם כדאיות תא (לדוגמא, 7-AAD). תאים מיין באמצעות סדרן תא מתאים 11 (איור 2). איסוף תאים בIsc בינוני (IMDM) השתנה Dulbecco של האובה המכיל 10% FCS.
- בודד תאי mononuclear ממח עצם או דגימת דם על ידי ביצוע תמוגה כדורית אדומה באמצעות אמוניום כלוריד או על ידי צנטריפוגה צפיפות שיפוע Ficoll.
- גידולים מוצקים / microdissection לייזר ללכוד.
- לניסויים שתוארו, דגימות FFPE מדגימת סרטן הריאות היו בשימוש. לרקמת סרטן ריאות מטרה זו נקבעה באופן מיידי ב 4% פורמלין שנאגרו לאחר כריתה וחתיכות של כ 3 x 2 x 1 סנטימטר כירורגית שבו משובץ בפרפין לניתוח נוסף.
- לחתוך קטעים של 5 - 10 עובי מיקרומטר מהמדגם קבוע פורמלין המוטבע פרפין (FFPE) עם microtome. חלקי הר בשקופיות קרום מכוסה סרט ויבש ב 37 מעלות צלזיוס במשך שעה 1. Deparaffinize ורעננותם הסעיפים רכובים על ידי דגירה רצופה בקסילן, אתנול מוחלט, 70% ומים, כל דקות 1.
- להכתים את החלקים עם hematoxylin במשך 20 שניות ולאחר מכן לשטוף במים ברז. לאסוף את אוכלוסיית התא של עניין באמצעות מערכת microdissection לייזר ללכוד (ראו גם 12).
- גידולים נוזליים.
- צנטריפוגה ההשעיה התא מהצעד 1.1.5 ב 400 XG, 4 מעלות צלזיוס למשך 4 דקות וזורקים supernatant. לשטוף פעמיים עם 500 μl של PBS הקר וצנטריפוגה במשך 5 דקות ב 400 XG ו -4 מעלות צלזיוס
- הוסף חוצץ תמוגה 40 μl לכל 10 6 תאי דגירה במשך 15 דקות על קרח (10 5 תאים (כ. 10 מיקרוגרם חלבון כולל) צריך להיות מספר התא המינימאלי). צנטריפוגה lysate 14,000 XG, 4 מעלות צלזיוס למשך 10 דקות ולהעביר את supernatant (lysate הסלולרי פינה) לצינור תגובה חדש. זורק את הכדור.
- גידולים מוצקים.
- הוסף 60 μl של חיץ תמוגה הרקמה לרקמת microdissected ודגירה במשך 15 דקות על קרח, לאסוף את הנוזל על ידי צנטריפוגה הקצרה ולהעביר את ההשעיה לצינור תגובה חדשה. Sonicate lysate על קרח במשך 3 דקות.
- הוסף 15 μl של 20% סולפט dodecyl נתרן (SDS) לתגיע שיתוף SDS סופיncentration של 4%. דגירה רקמות microdissected ב -99 ° C בבלוק חימום עבור שעה 1 ונסער ב 600 סל"ד. צנטריפוגה lysate ב16,000 XG, 18 מעלות צלזיוס למשך 10 דקות ולהעביר את supernatant לצינור חדש.
3. הקמת SILAC ספייק-בכימות רגילה (Super-SILAC רגיל)
הערה: סטנדרטי הכימות מורכב מתערובת של חלבון שכותרתו SILAC נגזרת 4-6 קווי תאים שמתאימים לסוג הגידול של עניין. כדי להשיג את החפיפה המקסימלי בין proteome התייחסות כותרת SILAC וproteome-נגזר הגידול, ניתוח מרכיבים ראשי צריכה להתבצע לפני שורות תאים נבחרות לסטנדרטית 14 כימות.
- ניתוח עיקרי רכיב (PCA).
- כדי לקבוע את דפוסי ביטוי חלבון של שורות תאים, לטפח כעשר שורות תאים שונות בתקשורת ותרבות התא המתאימה. Lyse התאים כפי שמתוארבשלב 2.1. הכן lysates הסלולרי לספקטרומטר מסה כמתואר בשלב 6.1.
- לנתח את דפוס ביטוי חלבון של כל שורת תא ברזולוציה גבוהה, ספקטרומטר מצמידים כרומטוגרפיה הנוזלי ההמוני (NanoLC-MS / MS).
- לנתח את הנתונים גולמיים וכתוצאה מכך השימוש בכלי MaxQuant חופשי ולבצע ניתוח עיקרי רכיבים באמצעות התוכנה נלווית כגון פרסאוס 16,17.
- בחר 4-6 שורות תאים המציגות את המגוון הגדול ביותר בין פרופילי חלבון-הביטוי שלהם ולהשתמש בם כדי ליצור את תקן ספייק-בסופר-SILAC.
- SILAC תיוג וסימון תווית.
- לטפח את שורות תאים שנבחרו לפחות חמישה מחזורי תא בתרבית תאים בינוניים SILAC מתאימה, שבו ארגינין וליזין מסומנים עם איזוטופים יציבים של פחמן וחנקן (בינוני SILAC) 4.
- Lyse התאים כמתואר בשלב 3.1 ולהכין lysates הסלולרי לספקטרומטר מסה כמתואר בשלב 6.1.מדוד את יעילות שילוב של תיוג SILAC ידי NanoLC-MS / MS. לנתח את נתוני MS גלם וכתוצאה מכך עם MaxQuant ולקבוע את היעילות של SILAC תיוג. זו מושגת על ידי ספירת המספרים של פפטידים שזוהו שבכותרת (הכבדה) וצורותיהם אנדוגני (אור), וחישוב היחס (כבד) / (+ אור כבד). יעילות תיוג יעלה על 98%.
- שילוב של proteomes SILAC ואימות.
- לטפח ולהרחיב את שורות תאים שנבחרו על פי הוראות מייצרת במדיום SILAC המתאים. Lyse התאים כמתואר בשלב 2.1 לגידולי נוזל או כמתואר בשלב 3.2 לגידולים מוצקים ולקבוע את ריכוז חלבון עבור כל lysate הסלולרי.
- לערבב כמויות חלבון equimolar של כל שורת תא ולחלק את התערובת לתוך aliquot. Snap-להקפיא את aliquots ולאחסן ב -80 ° C עד מדידה. בניסוי אחד שאתה צריך 20-50 מיקרוגרם של תקן Super-SILAC. דואג להכין את סטןיש להימנע dard בעודף כשינוי הסטנדרטי בתוך סדרה של ניסויים.
4. מדידת ריכוז החלבון וספייק-ב
- גידולים נוזליים.
- באמצעות assay quantitation חלבון לקבוע את ריכוז החלבון של lysates הסלולרי בהתאמה וסטנדרטית Super-SILAC.
- לערבב כמויות שווה של lysate הסלולרי נוקה וסטנדרטי Super-SILAC ולאחר מכן להוסיף למאגר ליתיום סולפט dodecyl (LDS) (25% מנפח הדגימה) וסוכן צמצום (10% מנפח הדגימה).
- מחממים את הפתרון שהתקבל בבלוק חימום על 72 מעלות צלזיוס למשך 10 דקות. לחלופין, לאחסן חלבונים מפוגלים וכתוצאה מכך ב -80 ° C.
- גידולים מוצקים.
- למדידת ריכוז חלבון על קורא צלחת, לערבב אלבומין בסרום השור סטנדרטי (BSA) סדרת דילול פתרון, lysate וסטנדרטי Super-SILAC המתאים עם חלבון זמין מסחריssay בצלחת 96-היטב, ולנער דקות 1, דגירה של זמן המצוין ולמדוד הספיגה כפי שצוין על ידי היצרן.
הערה: הריכוז הגבוה של SDS וdithiothreitol (DTT) בlysate הוא בעיה עבור רוב מבחני הזמינים לקביעת ריכוז חלבון. - לערבב כמויות שווה של lysate הבהיר וסטנדרטי Super-SILAC עם 200 μl של אוריאה ביחידת המסנן וצנטריפוגות ב 14,000 XG למשך 30 דקות ב -20 מעלות צלזיוס. אל תשתמש יותר מ -50 μl של lysate הבהיר וסטנדרטי Super-SILAC. הימנע מטמפרטורות מתחת ל -15 מעלות צלזיוס, כך האוריאה שאינה מתגבשת.
- למדידת ריכוז חלבון על קורא צלחת, לערבב אלבומין בסרום השור סטנדרטי (BSA) סדרת דילול פתרון, lysate וסטנדרטי Super-SILAC המתאים עם חלבון זמין מסחריssay בצלחת 96-היטב, ולנער דקות 1, דגירה של זמן המצוין ולמדוד הספיגה כפי שצוין על ידי היצרן.
5. הפרדה לדוגמא וחלבון Digest
- גידולים נוזליים.
- חלבון 100 מיקרוגרם כולל לכל נתיב על 4 - - נפרד 30 12% ג'ל SDS-PAGE שיפוע. חלבוני כתם עם Coomassie הכחול O / N. להסיר את כתם Coomassie עודף על ידי שתי שטיפות לאחר מכן עם מים.
- חותך כל נתיב מן הג'ל ולחלק אותול -23 פרוסות שווה בגודלם ללא קשר לתבנית של מכתים ג'ל. לעבד את פרוסות ג'ל בנפרד, כל אחד ב0.6 מיליליטר בקבוקון פוליפרופילן.
- לשטוף את פרוסות ג'ל עם מים ומתנול / מים (50:50, v / v), להפחית עם 10 מ"מ DTT ידי דוגרים למשך 30 דקות ב 56 מעלות צלזיוס. Alkylate פרוסות ג'ל עם 55 מ"מ iodoacetamide (רש"ת) על ידי דוגרים על 60 דקות ב RT בחושך.
- בין צעדי טיפול במדגם, לשטוף פרוסות עם אצטוניטריל במשך 15 דקות ויבשים בSpeedVac להסיר ממס עודף ולשפר את הספיגה של פתרון מגיב.
- בצע מחשוף פרוטאז ידי rehydrating פרוסות ג'ל מיובשים עם הכמות המינימלית של פתרון טריפסין חזירי (12.5 ng / μl ב0.025 אמוניום ביקרבונט המימי M) במשך 16 שעות על 37 מעלות צלזיוס.
- מוסיף מים 10 μl לפרוסת ג'ל דגירה במשך 15 דקות על 37 מעלות צלזיוס. להוסיף 80 אצטוניטריל μl ו דגירה במשך 15 דקות על 37 מעלות צלזיוס. צנטריפוגה ב15,800 XG, 1 דקות. איסוף supernatant וחנות ב0.6 מיליליטר נפרדצינור.
- להוסיף 65 μl של 5% חומצה פורמית פתרון, מערבולת דגירה במשך 15 דקות על 37 מעלות צלזיוס. להוסיף 65 אצטוניטריל μl ו דגירה במשך 15 דקות על 37 מעלות צלזיוס. צנטריפוגה ב15,800 XG דקות 1. לאסוף את supernatant ולהוסיף אותו לsupernatant מהשלב הקודם. להתאדות supernatant המשולב ליובש ברכז ואקום.
- גידולים מוצקים.
- כדי להסיר SDS מlysate הרקמה משתמש בפרוטוקול FASP הבא, גם כפי שתואר בהתייחסות 15.
- לאחר צנטריפוגה הראשונה מתוארת בשלב 5.2.3 להוסיף 200 μl נוסף של 8 M אוריאה במסנן, ו צנטריפוגות נוספת על 14,000 XG במשך 20 דקות ב -20 מעלות צלזיוס. מחק את תסנין הזרימה דרך.
- הוספת 100 רשות העתיקות μl ולערבב בthermomixer ב 600 סל"ד דקות 1. דגירה המסנן עבור 20 דקות ב 20 מעלות צלזיוס בחושך. צנטריפוגה המסנן 14,000 XG במשך 10 דקות ב -20 מעלות צלזיוס.
- הוספה של אוריאה 100 μl למסנן וCENtrifuge 14,000 XG, במשך 15 דקות בטמפרטורה של 20 מעלות צלזיוס. חזור על פעולה זו עוד פעם אחת.
- הוספה של 4 NH HCO 3 100 μl למסנן וצנטריפוגות ב 14,000 XG במשך 10 דקות ב -20 מעלות צלזיוס. חזור על פעולה זו פעמיים.
- הוסף 40 μl NH 4 μl HCO 3 + 1 טריפסין (= 0.4 מיקרוגרם) ומערבבים בthermomixer ב 20 מעלות צלזיוס במשך 600 סל"ד, 1 דקות. דגירה O המסנן / N בתא רטוב על 37 מעלות צלזיוס. העבר את המסנן לצינורות אוסף חדשים.
- צנטריפוגה המסנן 14,000 XG במשך 10 דקות ב -20 מעלות צלזיוס. הוסף 50 μl של 4 NH HCO 3 ו צנטריפוגות המסנן 14,000 גרם במשך 10 דקות ב -20 מעלות צלזיוס. אחסן את פפטידים וכתוצאה מכך ב -20 ° C עד מדידת ספקטרומטריה.
- למדידת ריכוז הפפטיד, לוותר 50 μl של זרימה דרך וכתוצאה מכך וסדרה של דילולים המתאימים של טריפטופן המסודר לתוך צלחת 96-היטב. למדוד הקרינה טריפטופן. להמיר את הריכוז של התוצאהטריפטופן לריכוז הפפטיד, כ0.1 מיקרוגרם של טריפטופן תואם 9 מיקרוגרם חלבון.
ניתוח 6. Liquid Chromatography וההמוני spectrometric
- Redissolve פפטידים במאגר טעינה 30 μl במשך 5 דקות באמבט sonication. ספין למטה בצנטריפוגות ב 15,800 XG דקות 1 ו פיפטה הפתרון ברור לבקבוקון autosampler MS.
- הזרק 5 μl של מדגם לניתוח באמצעות autosampler של מערכת NanoLC-MS / MS. להתרכז ופפטידים desalt מקוון בשלב הפוך C18 מראש עמודה (ID x 20 מ"מ 0.15 מ"מ עם חומר C18 גודל נקבובית 5 מיקרומטר) רכוב באו התקנת עמודה פרקה או התקנת precolumn מיתוג.
- פפטידים נפרדים על microcolumn C18 שלב הפוך (0.075 מ"מ x 200 מ"מ ID עצמי עמוס בחומר C18 גודל 3 מיקרומטר או קטנים יותר נקבובית בעמודת nanospray חבילה עצמית כגון PicoFrit, באמצעות שיפוע 90 דקות של אצטוניטריל 5> 35% לעומת . 0.1% חומצה פורמית מימית ב 300 NL /דקות. העברת eluent לquadrupole ההיברידי / ספקטרומטר מסת orbitrap באמצעות מקור יון nanospray.
- לנתח פפטידים באמצעות שיטת Top15 נתונים תלויה רכישה (מ 'טווח z / MS 350 -. 1600, יעד רזולוציה 70.000 FWHM, יעד AGC 1 x 10 6, זמן מילוי מקסימום 60 msec MS / MS להתחיל מסת 100, יעד הרזולוציה 17.500 FWHM, AGC יעד 2 x 10 5, 60 msec זמן מילוי מקסימום MS MS סף / 3 x 10 4, כולל מדינות גובות 2 -. 5, 25% המנורמלים התנגשות האנרגיה NCE, שניות הדרת 15 דינמיות).
ניתוח 7. נתונים
- לניתוח נתונים להשתמש בתוכנת MaxQuant 16 זמינה באופן חופשי. פרוטוקול מפורט לניתוח נתונים bioinformatic מתואר ב16,17. לניתוח, לשלב קבצי נתונים גולמיים מכל הפרוסות מנתיב SDS-PAGE לניסוי יחיד 17.
תוצאות
פרופיל proteomic של גידולים נוזליים ומוצקים מחולים הוא גישה מבטיחה לגילוי של סמנים לאבחון וניבוי חדשים. עם זאת, הליך הכנת מדגם וניתוח ספקטרומטריה מאתגרים, בשל המורכבות של דגימות ואת הצורך בכימות מדויק של חלבון בקבוצות גדולות של דגימות. ההליך ניסיוני שתואר לעיל מתחיל בבידוד של תאים של עניין, בין אם על ידי מיון תא הקרינה המופעל או על ידי microdissection לייזר ללכוד.
לצורך כך, תאים מaspirates-נגזר מטופל מח עצם או דגימות דם מגואלות נוגדנים שכותרתו הקרינה נגד סמנים פני הגדרה של עניין לפני מיון מבוסס FACS ותמוגה תא.
כדי להעשיר את תת סלולריים מסעיפי רקמות, אלה שיש לי ראשון שרכובים על שקופיות מתאימות כדי לאפשר לmicrodissection לייזר ללכוד. לצורך כך הר tהוא סעיפי רקמות על שקופיות קרום מתאימות ולהשתמש בליזר ללכוד microdissector לפי הוראות יצרן. בחירת האזורים ותאים של עניין דורשת ידע מתאים על histomorphology של רקמה בריאה וגידולים. לאחר מכן התאים שחולצו הועברו לצינור איסוף מתאים. יש לבצע ניסויים ראשוניים על מנת להגדיר את כמות הרקמה הכרחית להפקת כמויות מספיקות של חלבון (חלבון הכולל של 10 מיקרוגרם מינימום) לכל רקמות חדשות של עניין. כל דגימת microdissected מטופל עם 60 μl של חיץ תמוגה הרקמה. לתמוגה היעילה, תאים מדגימות רקמה צריכים להיות sonicated במשך 3 דקות ולאחר התוספת של 15 μl דגימות SDS מודגרת בthermomixer ב -99 מעלות צלזיוס במשך שעה 1 כדי להסיר crosslinks חלבון הנוצר על-פורמלין. צנטריפוגה לבסוף תקל על האוסף של lysate הסלולרי פינה.
לכל מחלה שליnterest (נוזל וגידולים מוצקים) יש סטנדרטי כימות Super-SILAC מתאים ליוקמו 14. סטנדרטי מתאים צריכים לייצג יותר מ -90% מהחלבונים המתבטאים בדגימות של עניין. להכנת סטנדרטית כימות, שורות תאים הקשורים לסוג הסרטן של עניין צריכים קודם להיות מנותחות על ידי ספקטרומטריית מסה כדי לקבוע פרופילי ביטוי החלבון שלהם וניתוח מרכיבים עיקרי לאחר מכן יש לבצע. יש לבחור 6 שורות תאים שונות עם דפוסי ביטוי חלבון ההפרש וSILAC שכותרתו עם ארגינין "כבד" וליזין - 4. יעילות תיוג צריכה להיבדק על ידי NanoLC-MS / MS וצריכה להיות גדול מ 98%. לאחר מכן, יש lysed שורות תאים באותו אופן כמו לדוגמא בהתאמה נגזר מטופל ו, לאחר מכן, כמויות חלבון equimolar של כל דגימה והסטנדרטית ספייק-בSILAC צריכים להיות מעורבות. צעד קריטי לכימות מדויק של חלבון דגימות קליניות oעניין f הוא התערובת מדויקת של כמויות חלבון equimolar של דגימות שמקורם בחולה וסטנדרטית כימות ספייק-בSILAC. כדי לקבוע את ריכוז החלבון של lysates שמקורם בתאים ממוינים, ניתן להשתמש במבחני כימות חלבון שונים. לlysates הסלולרי מתאים שמקורם ברקמה יש צורך assay שיכול להתמודד עם ריכוזים גבוהים של SDS וDTT בlysate. ריכוז חלבון של דגימות שמקורם בחולה וסטנדרטית ספייק-בSILAC יש למדוד בכל פעם לפני שילוב עם הדגימות קליניות המתאימות כדי להבטיח נכונה תערובת, שהוא חיוני בהפיכת אפילו מאות דגימות דומות.
לאחר שהתערובת של כמויות שווה של עיכול ספייק-בדגימות סטנדרטית וlysate, המתקבלות מגידולים נוזליים מעורבבים עם LDS, מחוממים בthermomixer על 72 מעלות צלזיוס למשך 10 דקות ולאחר מכן נחשפו ל1D-עמוד ובג'ל של מופרד חלבונים עם טריפסין. דגימות שהתקבלו מרקמה משתחררת מSDS ומתעכלת עם טריפסין על ידי שימוש בגישת FASP כפי שנקבע על ידי וישנייבסקי et al. 15
פפטידים tryptic שהושגו ניתן לכמת על ידי מדידת הקרינה טריפטופן, שהוא בעל עניין מיוחד עבור דגימות רקמה כסכום של פפטידים שוחררו מהמסנן שונה בין 15% לבין 75% בהשוואה לכמויות החלבון בתחילה הועמסו על המסנן. לשם כך אנו מודדים את הקרינה של טריפטופן. השוואה עם סדרת דילול טריפטופן מתאימה מאפשרת כימות של פפטידים, כ1.1 מיקרוגרם של טריפטופן מתאים לכ 100 מיקרוגרם של פפטיד. במידת צורך, דגימות נגזרות בעיקר מעיבוד FASP ניתן מראש מטוהרות משני טיפים שלב מסחריים או תוצרת בית עמוס בחומר הפוך שלב C18 (RP-C18) לפני העמסתי על מערכת NanoLC / MS / MS 18.
ניתוח המוני spectrometric מבוצע על גבוה-resolution, מערכת ספקטרומטר מסת רגישות גבוהה. בקיצור, דגימות פפטיד הם desalted וpreconcentrated על precolumn RP-C18, והפרידו על עמודה אנליטיים RP-C18 בשילוב ישירות לספקטרומטר המסה. כדי להשיג עומק מספק של ניתוח, אנו מעסיקים או שילוב של prefractionation חלבון SDS-PAGE עם מילויים 40 דקות RP-C18 (לגידולים נוזליים) או זריקות יחידים עם 2 ארוך - הדרגתיים RP-C18 3 שעות (לגידולים מוצקים מעובדים על ידי FASP ). MS ספקטרום נרכש ברזולוציה של 70,000 FWHM או טוב יותר, כדי לאפשר לכימות מדויק של זוגות SILAC על ידי שילוב של פרופילי שיא chromatographic. לזיהוי חלבון, שיטת רכישת נתונים תלויים Top15 משמשת להפקה מספר רב של פפטיד MS / MS ספקטרום לפפטיד וזיהוי חלבונים.
מהנתונים הגולמיים וכתוצאה מכך, זיהוי חלבונים וכימות מושגות על ידי מסד נתונים עם תוכנת חיפוש MaxQuant נגד Knowledgebas UniProtמסד נתוני דואר אדם Proteome השלם רצף 17. בתוכנת MaxQuant (גרסה הנוכחית 1.5.0.25) פפטידים מזוהים מMS / MS הספקטרום שנרכש על ידי פפטיד בר-התאמה נגד ספקטרום נגזר בסיליקון ומבסיס נתוני רצף חלבון. במקביל, מבשר יון פרופילי איזוטופי מופק סביב הפעמים שמירת chromatographic, ואזורי השיא המשולבים שלהם משמשים לכימות יחסי של האור: זוגות פפטיד כבדים שנוצרו על ידי תיוג SILAC. זהויות פפטיד ועוצמות יחסי לאחר מכן הוקצו לנכסי החלבון המקביל. תוכנת פרסאוס (גרסה הנוכחית 1.5.0.15) לאחר מכן נעשה שימוש כדי לבצע הערכה נוספת במורד הזרם סטטיסטית של תוצאות עיבוד MaxQuant, כוללים השוואות מדגם למדגם, PCA וקיבוץ היררכי.
שימוש בהגדרת הניסוי מתואר זיהינו ולכמת עד 8,000 חלבונים מקטנים כמו 30 מיקרוגרם של חלבון הכוללשמקורם בגידולים נוזליים.
עד 2,500 חלבונים מדגימות מוצק-גידול יכולים להיות מזוהים ולכמת בגישת proteomic רובה עם שיפוע LC של רק 2 שעות, המאפשרים הניתוח של מאות דגימות קליניות בזמן קצר יחסית.
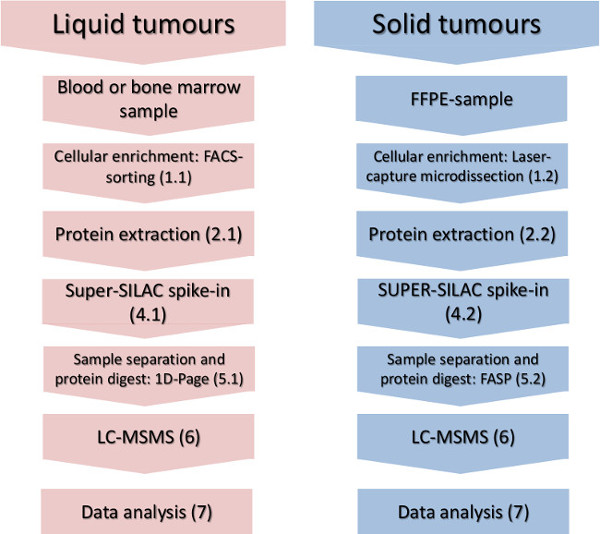
איור 1. זרימת עבודה ניסויית. השלבים העיקריים של העשרה סלולרית-משנה, בידוד חלבון, ספייק-בתקן כימות והניתוח המוני spectrometric מוצגים לגידולים נוזליים ומוצקים. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
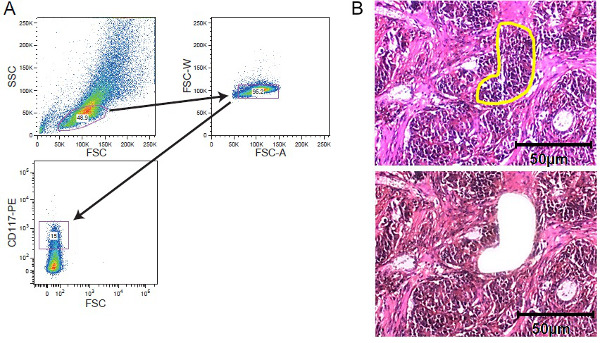
2. אסטרטגיה העשרה סלולרית איורes. מיון FACS וLCM. (א) אסטרטגית gating מופת המתארת gating על אוכלוסיית תאי leukemic המוכתם CD117 נרכשה על ידי סדרן תא. microdissection ללכוד לייזר (B) של רקמת גידול מוצקה. סעיפי רקמות של 5 - 10 עובי מיקרומטר היו רכובים על שקופיות קרום מכוסה סרט לפני הצביעה. האזור של אינטרסים שנבחר באופן ידני לmicrodissection ללכוד לייזר. מוצגים קטעים לפני microdissection עם האזור של עניין מסומן צהוב ולאחר microdissection. סרגל קנה מידה של 50 מיקרומטר כלול בדמות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
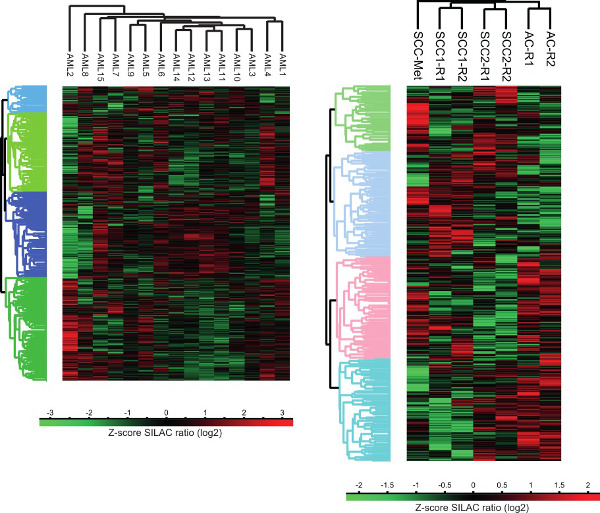
ניתוח איור 3. אשכול proteomes סרטן תאים האנושי. ניתוח אשכולות ללא פיקוח והשגחה של יחסי ציבורפרופילי ביטוי otein של גידולים נוזליים ומוצקים בוצעו באמצעות הפלטפורמה חישובית פרסאוס. AC - אדנוקרצינומה, SCC - קרצינומה של תאי קשקש, SCC-Met - גרורות קרצינומה של תאי קשקש מסרטן הראש והצוואר, R - לשכפל טכני.
Discussion
פרופיל ספקטרומטריה של proteomes סרטן תאים שמקורם בחולה נדרש לגילוי של סמנים חזוי / אבחון חדשים, כמו גם לתת הבנה טובה יותר של ביולוגיה של סרטן תאים, אשר עשוי בתורו להוביל לזיהוי של מטרות פוטנציאליות לתרופה חדשות. עם זאת, ניתוחי ספקטרומטריה כאלה הם מאתגרים מאוד, במיוחד בגלל בעיות מראש אנליטיות שונות צריכים להיפתר, אם אחד הוא להשיג תוצאות חזקות ורלוונטיות מבחינה ביולוגית.
העבודה הניסויית המתוארת כאן מאפשרת אפיון כמותי של proteomic proteomes נגזר מאוכלוסיות סלולריות של שני גידולים נוזליים ומוצקים. יש צורך בהעשרה הראשונית של תאים סרטניים או על ידי microdissection התא-sortingor מבוסס FACS, כדי למנוע זיהום על ידי תאים של מייקרו-הסביבה של הגידול. יתר על כן, טכניקות אלו מאפשרות אחד לבודד אוכלוסיות סלולריות של עניין. מחקרי תא-ביולוגי אחרונים יש לי שדstrated שיש לי תת-אוכלוסיות סלולריות מסוימות נכסי ייזום-גידול ולכן הם רלוונטיים ביותר להיווצרות מחל סרטן 19,20. כספקטרומטריית מסה הפכה רגישה יותר בשנים האחרונות, ניתוחים כמותיים proteomic הם ריאלי עבור הכמויות הקטנות של חלבון שניתן להפיק מכמה אלף תאים, מה שמאפשרים להתמקד באוכלוסיות תאים רלוונטיות מבחינה תפקודית.
הסט-אפ שהוצג כאן יכול לשמש כדי לזהות ולאמת את סמנים דיאגנוסטיים רומן בדגימות FFPE. לפיכך, הוא מבטיח BEA כלי שימושי לשיפור אבחון קליני, כעד כה עדיין יש חוסר של סמנים ביולוגיים מולקולריים במספר ובאיכות נאותים לסוגים רבים של סרטן. דוגמאות חשובות של אבחנה מבדלת קשה, שלסמנים ביולוגיים חסרות, הן האפליה בין סרטן הריאות ראשוני מגרורות בריאות, קרצינומה cholangiocellular intrapancreatic ואדנוקרצינומה של לבלב, כמו גם שונותentiation של neurofibroma השפיר מגידולי עצבים היקפיים נדן הממאירים ביותר. יתר על כן, אנו ואחרים הראו כי הבהרת כמותי של חתימות proteomic יכולה להיות שימושית בלימוד ביולוגיה של תא הסרטן באופן כללי, ולחושפים סמנים ביולוגיים חזוי של תגובה לטיפול בחולי סרטן 21.
שני חסרונות הנוכחיים של השיטה שהוצגה כאן הם הדרישה לעיבוד מדגם ידני נרחב והביקוש בזמן רכישת NanoLC-MS / MS. בעוד ניתן לטפל לשעבר על ידי הזזת הכנת מדגם לדוגמה, פורמטים 96-היטב ובאמצעות עיבוד רובוטית, האחרון ידרוש שינוי באסטרטגיית רכישות ספקטרומטריה. ברגע תת קבוצות של חלבוני היעד זוהו שיכולה להיות קשורות לדוגמה, סיווג גידול, אנו חוזים את העיצוב של שיטות ספקטרומטריית מסה ממוקדות המספקות קריאות כמותי לתת אלה במאמץ הפרדה מופחת במידה ניכרת, ולכן עם זמן רכישה מופחתת בהתאם. אם זמן הרכישה הנדרש הנדרש יכול להיות מופחת 24-36 שעות (גידולים נוזליים) או 3 שעות (גידולים מוצקים) לדוגמה, שעה 1 באמצעות ספקטרומטר מסה ממוקדת והפרדה חד-ממדית פשוטה של פפטידים, אז רווח וכתוצאה מכך התפוקה יכול לשמש כדי להגדיל באופן משמעותי את מספרם של משכפל ביולוגי וטכני שנבדק, עם מקביל שיפורים במשמעות של תוצאות כימות. ממוקדת גישות ספקטרומטריה כבר הוכיחו להיות כלי מתאים לאימות של סמן ביולוגי-מועמדי חלבון סרטן הקשורים 22, ופותחו לנקודה שבה הם מראים הבטחה לאימות או אפילו ככלי פוטנציאלי לשימוש קליני שיגרתי 23 , 24.
Disclosures
אי לנו ניגוד עניינים או נושאים אחרים לחשוף.
Acknowledgements
The authors thank Uwe Plessmann, Monika Raabe und Silvia Münch for technical support.
Materials
| Name | Company | Catalog Number | Comments |
| 660 nm Kit | Thermo scientific | 22662 | |
| Cell culture medium depleted of arginine and lysine | Thermo Scientific | 88421 | |
| Coomassie Brilliant Blue R-250 staining solution | Bio Rad | 161-0436 | |
| Dialyzed fetal calf serum (FCS) | PAA | A15-107 | |
| Diffuser caps for microdissection | MMI | 50202 | |
| FACS-sorter | BD | FACSAria III | |
| Ionic Detergent Compatibility Reagent | Thermo scientific | 22663 | |
| Laser-capture microdissector | MMI | cell cut plus | |
| LDS buffer | Life Technologies | NP0009 | |
| Membrane slides for microdissection | MMI | 50103 | |
| Microcon YM-30 | Millipore | MRCF0R030 | |
| NuPAGE 4-12% Bis-Tris Mini Gels | Life Technologies | NP0335PK2 | |
| Picofrit Self-Pack Columns | New Objective | PF360-75-15-N-5 | Mass Spectrometry Column/Emitter |
| Reducing agent | Life Technologies | NP0007 | |
| Reprosil-Pur LC/MS/MS Column stationary phase | Dr. Maisch | 120 C18-AQ, 3 µm | |
| Reprosil-Pur LC/MS/MS Precolumn stationary phase | Dr. Maisch | 120 C18-AQ, 5 µm | |
| SILAC-labeled arginine | Eurisotop | CLM-2265-H-0.1 | |
| SILAC-labeled lysine | Eurisotop | DLM-2640-0.25 | |
| Trypsin, NB Sequencing Grade | Serva | 3728301 | for in-gel digests |
| Trypsin, Sequencing Grade | Promega | V5111 | for in-solution digests |
| Buffer and solutions | |||
| Cell lysis buffer: 150 mM NaCl, 50 mM Tris/HCl pH 7.8, 5 mM NaF, 0.5% NP40, 0.1% laurylmaltoside, Roche complete protease inhibitor, 1 mM Na3VO4 | |||
| Tissue lysis buffer: 100 mM Tris/HCl pH 7.8, 0.1 M DTT | |||
| Urea: 8 M urea in 0.1 M Tris-HCl, pH 8.5 | for FASP-protocoll | ||
| IAA: 0.05 M iodoacetamide, 8 M urea, 0.1 M Tris-HCl, pH 8.5 | for FASP-protocoll | ||
| 0.05 M NH4HCO3 | |||
| 10 mM dithiothreitol (DTT) in 0.1 M ammonium bicarbonate | for in-gel digest | ||
| 55 mM iodoacetamide (IAA) in 0.1 mM ammonium bicarbonate | for in-gel digest | ||
| 5% aqueous formic acid. |
References
- Walther, T. C., Mann, M. Mass spectrometry-based proteomics in cell biology. J Cell Biol. 190 (4), 491-500 (2010).
- Lenz, C., Urlaub, H. Separation methodology to improve proteome coverage depth. Expert Rev Proteomics. 11 (4), 409-414 (2014).
- Olsen, J. V., Mann, M. Status of large-scale analysis of post-translational modifications by mass spectrometry. Mol Cell Proteomics. 12 (12), 3444-3452 (2013).
- Ong, S. E., et al. Stable isotope labeling by amino acids in cell culture, SILAC, as a simple and accurate approach to expression proteomics. Mol Cell Proteomics. 1 (5), 376-386 (2002).
- Jimenez, C. R., Verheul, H. M. Mass spectrometry-based proteomics: from cancer biology to protein biomarkers, drug targets, and clinical applications. Am Soc Clin Oncol Educ Book. , e504-e510 (2014).
- Tang, D. G. Understanding cancer stem cell heterogeneity and plasticity. Cell Res. 22 (3), 457-472 (2012).
- Evans, C., et al. An insight into iTRAQ: where do we stand now. Anal Bioanal Chem. 404 (4), 1011-1027 (2012).
- Ostasiewicz, P., Zielinska, D. F., Mann, M., Wisniewski, J. R. Proteome, phosphoproteome, and N-glycoproteome are quantitatively preserved in formalin-fixed paraffin-embedded tissue and analyzable by high-resolution mass spectrometry. J Proteome Res. 9 (7), 3688-3700 (2010).
- Malmström, J., Picotti, P., Aebersold, R. Perspectives of targeted mass spectrometry for protein biomarker verification. Curr Opin Chem Biol. 13 (5-6), 518-525 (2009).
- Gillet, L. C., et al. Targeted data extraction of the MS/MS spectra generated by data-independent acquisition: a new concept for consistent and accurate proteome analysis. Mol Cell Proteomics. 11 (6), (2012).
- Basu, S., Campbell, H. M., Dittel, B. N., Ray, A. Purification of specific cell population by fluorescence activated cell sorting (FACS). J Vis Exp. 41, (2010).
- Edwards, R. A. Laser capture microdissection of mammalian tissue. J Vis Exp. 8, 309 (2007).
- Liu, N. Q., et al. Proteomics pipeline for biomarker discovery of laser capture microdissected breast cancer tissue. J Mammary Gland Biol Neoplasia. 17 (2), 155-164 (2012).
- Geiger, T., et al. Use of stable isotope labeling by amino acids in cell culture as a spike-in standard in quantitative proteomics. Nat Protoc. 6 (2), 147-157 (2011).
- Wisniewski, J. R. Proteomic sample preparation from formalin fixed and paraffin embedded tissue. J Vis Exp. (79), (2013).
- Cox, J., Mann, M. MaxQuant enables high peptide identification rates, individualized p.p.b.-range mass accuracies and proteome-wide protein quantification. Nat Biotechnol. 26 (12), 1367-1372 (2008).
- Cox, J., et al. A practical guide to the MaxQuant computational platform for SILAC-based quantitative proteomics. Nat Protoc. 4 (5), 698-705 (2009).
- Rappsilber, J., Mann, M., Ishihama, Y. Protocol for micro-purification, enrichment, pre-fractionation and storage of peptides for proteomics using StageTips. Nat Protoc. 2 (8), 1896-1906 (2007).
- Sarvi, S., et al. CD133+ cancer stem-like cells in small cell lung cancer are highly tumorigenic and chemoresistant but sensitive to a novel neuropeptide antagonist. Cancer Res. 74 (5), 1554-1565 (2014).
- Shlush, L. I., et al. Identification of pre-leukaemic haematopoietic stem cells in acute leukaemia. Nature. 506 (7488), 328-333 (2014).
- Schaab, C., et al. Global phosphoproteome analysis of human bone marrow reveals predictive phosphorylation markers for the treatment of acute myeloid leukemia with quizartinib. Leukemia. 28 (3), 716-719 (2014).
- Hüttenhain, R., et al. Reproducible quantification of cancer-associated proteins in body fluids using targeted proteomics. Sci Transl Med. 4 (142), 142ra94 (2012).
- Burgess, M. W., et al. Simplified and efficient quantification of low-abundance proteins at very high multiplex via targeted mass spectrometry. Mol Cell Proteomics. 13 (4), 1137-1149 (2014).
- Boja, E. S., et al. Analytical Validation Considerations of Multiplex Mass Spectrometry-based Proteomic Platforms for Measuring Protein Biomarkers. J Proteome Res. , (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved