Method Article
액체 및 고체 종양 유래의 암세포 프로테옴 정량적 질량 분석 프로파일
요약
In-depth analyses of cancer cell proteomes facilitate identification of novel drug targets and diagnostic biomarkers. We describe an experimental workflow for quantitative analysis of (phospho-)proteomes in cancer cell subpopulations derived from liquid and solid tumors. This is achieved by combining cellular enrichment strategies with quantitative Super-SILAC-based mass spectrometry.
초록
심층 암세포 프로테옴 분석은 종양 pathomechanisms 해명뿐만 아니라 잠재적 인 약물 표적 및 진단 바이오 마커를 식별하는 데 필요하다. 그러나, 환자 유래의 종양, 특히 자신의 세포 개체군에서 정량 프로테오믹스 특성화하기위한 방법은 크게 부족하다. 여기에서 우리는 액체 또는 고체 종양 중 하나에서 파생 된 암 세포 개체군의 프로테옴의 정량 분석을 허용하는 실험 장치에 대해 설명합니다. 이는 생물 정보학적인 데이터 분석 하였다 정량적 슈퍼 SILAC 계 질량 분석법으로 세포 농축 전략을 조합함으로써 달성된다. FACS - 정렬 한 다음 세포 계측법 특정 세포 하위 집합을 풍부하게하기 위해, 액체 종양은 제 1 유동에 의해 immunophenotyped된다 고형 종양에 대해, 레이저 캡처 미세 절제는 특정 세포 개체군을 정화하는 데 사용됩니다. 제 2 단계에서, 정제 된 단백질이 세포로부터 추출되고이어서 암 특이 적 결합,단백질 정량을 가능하게 스파이크 표준을 SILAC 표지. 생성 된 단백질 혼합물을 겔 전기 영동 또는 트립신 분해를 돕는 뒤에 필터 시료 준비 (FASP) 중 실시된다. 마지막으로, 트립신 펩티드 하이브리드 orbitrap 극자 질량 분광계를 이용하여 분석하고, 얻어진 데이터는 MaxQuant 포함한 생물 정보학 소프트웨어 군으로 처리된다. 8,000 단백질까지, 여기에 제시된 방법의 흐름에 의해 식별 될 수 있고, 환자 유래의 시료의 정량하고, 얻어진 단백질 발현 프로파일 진단 단백체 서명 또는 잠재적 약물 표적을 식별하는 환자 중 비교 될 수있다.
서문
질량 분석 기반 단백질 체학 (proteomics)가 등장했다 및 세포 생물학 및 병진 생물 의학 연구에 널리 사용되는 분야는 지금이다. 단백질 수천 번의 질량 분석 실험 1,2-에서 식별 될 수있는 기술 분야에서의 진보는 세포주 및 동물 모델에서 복잡한 세포 과정을 연구하는 것이 가능했다. 이것은 일반적으로 변성 2,3- 유형별 농축 및 데이터 분석을 위해 주문 된 워크 플로우가 필요하지만 유사하게 진행, 예컨대 인산화 또는 유비퀴틴 많은 번역 후 변형의 분석을했다. 또한, SILAC를 포함하여 화학 및 신진 대사 라벨링 전략의 참여는 인간의 암 4의 기본 세포 과정, 진단 바이오 마커 및 잠재적 인 약물 표적의 발견이 방법은 특히 매력적인 만드는 단백질과 PTMS의 정확한 상대 정량화 할 수 있습니다.
그러나,여러 과제 일차 인간 암 (5)의 프로테옴 해석에 관해서 극복되어야한다. 첫째, 인간의 암 샘플은 종종 면역 세포와 섬유 아세포를 포함한 종양 미세 환경에 속하는 다양한 유형의 세포의 존재로 인해 세포 이질성 고도를 나타낸다. 둘째, 클론 진화는 별개의 기능적 특성과 여러 세포 개체군의 존재의 결과로, 자신 종양 내에서 유전 적 다양성에 연결됩니다. 암 발생 및 진행, 예컨대 (기능적 관련성) 세포 개체군의 프로테옴 분석 뒤에 구동력 인 몇 암 줄기 세포의 현재의 개념에 따르면, 임상 적 적용에 대한 중요한 발암 기전의 더 나은 이해를 위해 매우 중요 할 것으로 예상된다 6. 셋째, 많은 양의 샘플 세트들의 정량적 단백질 발현 프로파일은 종종 강력한 임상 BIOMAR의 식별에 필요한KERS; 의존 그들이 같은 세포 증식 4에서, - - 마찬가지로 대상 외 대사 표지 전략이 동안, 예컨대 7 iTRAQ 화학적 라벨링함으로써 달성 될 수 없다. 넷째, 가장 가능한 고형 종양 샘플은 포르말린 고정 의한 가교 단백질 (8)의 형성에 질량 분석 프로테옴 해석을 복잡하게한다. 마지막으로, 대부분의 기존 프로테오믹스 흐름이 곤란 임상 연구에 대한 중요한 시료 번호의 렌더링 분석 시료 처리 및 데이터 수집의 상당한 양을 요구하고, 새로운 워크 플로우를 요구하면 9,10 패러다임.
이러한 장애를 해결하기 위해 우리는 포괄적 인 질량 분석에 대한 글로벌 내부 표준을 소개하는 슈퍼 SILAC (14) 전략과 세포 농축을 위해 11 레이저 캡처 미세 절제 12, 13 정렬 중 하나 유세포 셀을 결합하는 실험 장치를 개발. 여기에 기술 된 방법을 사용함으로써, 액체 또는 고체의 암 중 하나로부터 유도 된 인간 종양 샘플에서 8000까지 단백질 정량화 할 수있다.
프로토콜
인체 조직 또는 혈액 샘플에 모든 실험은 윤리 투표에 나와있는 지침에 따라 윤리위원회의 승인을 수행해야합니다.
1. 휴대 심화
- 액체 종양 / 형광 활성화 된 셀 정렬.
- 염화 암모늄을 사용하여 적혈구를 용해 또는 피콜 수행하여 밀도 구배 원심 분리하여 골수 또는 혈액 샘플로부터 단핵 세포를 분리.
- 적혈구 용해를 들어, 염화 암모늄 수용액 4 ㎖로 1 ㎖의 시료를 결합한다. 10 분 - 5 얼음에 솔루션을 품어. 400 XG에 5 분, 4 ° C의 인산염 완충 식염수 (PBS) + 2 % 소 태아 혈청 (FCS)와 원심 분리기 40 ML을 추가합니다.
- 피콜 구배 원심 분리, 층이 별개의 층을 형성하는 피콜-Hypaque 15 ml의에 샘플 10ml를 들어 (레이어를 방해하지 않도록주의). 실온에서 30 분 동안 400 XG에 원심 분리기 -주의 (15 ~ 25 ° C의)와 단핵 수확계면에서 수집 세포.
- 세포를 스핀 다운 및 PBS + 2 % FCS에서 그들을 차지합니다. 5 분 400 XG에 원심 분리기 1 ml의 PBS + 2 % FCS에서 차지합니다. 음성 대조군으로 한 나누어지는 최종 얼룩에 사용 된 각 형광 염료에 대한 하나 나누어보세요.
- 30 분 동안 얼음에 제조업체의 지시에 따라 희석 백혈병 세포 집단을 분리하는 데 유용 형광 표지 된 항체로 인큐베이션. 또한 개별적 항체 보상에 사용 분취 얼룩. PBS + 2 % FCS로 두 번 씻으십시오.
참고 : 사용 된 항체는 CD117-PE (복제 95C3), CD34-FITC (클론 8G12) 및 CD33-PE (복제 P67.6)에 대한 마우스 항 - 인간이었다. - 35 μm의 셀 스트레이너를 통해 필터 세포는 셀 스트레이너에 이상적으로 사용하는 튜브 캡에 통합.
- (예를 들어, 7-AAD) 세포 생존 능력 얼룩을 추가합니다. 적절한 셀 소터 (11) (그림 2)를 사용하여 정렬 세포. 단락 전류의 세포를 수집 10 % FCS를 포함 비켜의 수정 된 둘 베코의 중간 (IMDM).
- 염화 암모늄을 사용하여 적혈구를 용해 또는 피콜 수행하여 밀도 구배 원심 분리하여 골수 또는 혈액 샘플로부터 단핵 세포를 분리.
- 고형 종양 / 레이저 캡처 미세 절제.
- 기재된 실험을 위해, 폐암 FFPE 시료에서 샘플을 사용 하였다. 이 목적 폐암 조직 즉시 수술 적 절제 약 3 × 2 × 1cm의 조각 후 4 % 포르말린에 고정을 위해 추가 분석을 위해 파라핀에 포함한다.
- 마이크로톰와 포르말린 고정 파라핀 (FFPE) 샘플에서 10 μm의 두께 - 5의 섹션을 잘라. 필름 피복 막 슬라이드와 1 시간 동안 37 ° C에서 건조에 마운트 섹션. Deparaffinize과 1 분 동안, 자일 렌의 연속 배양, 무수 에탄올 70 %와 물을 각각 장착 섹션을 재수.
- 20 초 동안 헤 마톡 실린으로 섹션을 얼룩 후 수돗물로 씻어냅니다. 레이저 미세 절제 캡처 시스템을 사용하여 관심있는 세포 집단을 수집 (도 12 참조).
- 액체 종양.
- 400 XG, 4 분 4 ° C에서 단계 1.1.5에서 세포 현탁액을 원심 분리기 상층 액을 버린다. 400 XG에서 5 분 동안 500 차가운 PBS의 μL 원심 분리로 두 번 세척하고 4 ° C
- 10 6 세포 당 40 μL 용해 버퍼를 추가하고 (최소 세포 수를해야 10 5 세포 (약. 10 μg의 총 단백질)) 얼음에 15 분 동안 품어. 14,000 XG, 10 분 동안 39 ° C에서 용 해물을 원심 분리 새로운 반응 튜브에 상청 (클리어 세포 용 해물)를 옮긴다. 펠렛을 폐기하십시오.
- 고형 종양.
- microdissected 조직에 조직 용해 버퍼의 60 μl를 추가하고 얼음에 15 분 동안 품어, 짧은 원심 분리하여 유체를 수집하고 새로운 반응 관에 정지를 전송합니다. 3 분 동안 얼음에 해물 초음파 처리.
- 최종 SDS 공동 도달에 20 % 황산 도데 실 나트륨 (SDS)의 15 μL를 추가4 %의 ncentration. 1 시간 동안 가열 블럭에서 99 ° C에서 microdissected 조직을 인큐베이션하고 600 rpm으로 교반. 16,000 XG, 10 분 동안 18 ° C에서 해물을 원심 분리기 새로운 튜브에 뜨는을 전송합니다.
SILAC 스파이크의 정량 표준 3. 설립 (슈퍼 SILAC 표준)
주 : 정량 표준은 4로부터 유도 SILAC 표지 된 단백질이 섞여 - 관심 종양 유형과 일치 6 세포주. SILAC 표지 된 기준 프로테옴 및 종양 유래 프로테옴 사이의 최대 오버랩을 달성하기 위하여, 주성분 분석은 세포주 정량 표준 14 선정되기 전에 수행 될 필요가있다.
- 주성분 분석 (PCA).
- 세포주의 단백질 발현 양상을 확인하기 위해, 적절한 세포 배양 배지에 약 10 가지 세포주를 배양. 로 용해 세포 기술로단계 2.1. 단계 6.1에 설명 된대로 질량 분석을위한 세포 용 해물을 준비합니다.
- 고해상도 각 세포주의 단백질 발현 패턴을 분석하고, 액체 크로마토 그래피 - 질량 분석 장치에 결합 (nanoLC-MS / MS).
- 무료 도자기 MaxQuant를 사용하여 생성 된 원시 데이터를 분석하고 페르세우스 16, 17 등의 관련 소프트웨어를 사용하여 주요 구성 요소 분석을 수행합니다.
- 자신의 단백질 발현 양상의 가장 큰 다양성을 보여주고 슈퍼 SILAC 스파이크 표준을 생성하는 데 사용할 6 세포주 - 4를 선택합니다.
- SILAC 표지 및 라벨 검사.
- 아르기닌과 리신은 탄소 및 질소 (SILAC 매체) (4)의 안정적인 동위 원소로 표지 된 적합한 SILAC 세포 배양 배지에서 적어도 다섯 세포주기에 대한 선택된 세포주를 배양.
- 로 용해 단계 6.1에 설명 된대로 3.1 단계에 설명 및 질량 분석을위한 세포 용 해물을 준비하는 세포.nanoLC-MS / MS에 의한 SILAC 라벨의 결합 효율을 측정한다. MaxQuant와 결과 원시 MS 데이터를 분석하고 SILAC 라벨링의 효율성을 결정합니다. 이것은 그들의 표지 (중량)에서 식별 된 펩티드 및 그의 내인성 폼 (광)의 개수를 카운트하고, 비율 (중량) / (+ 무거운 광)을 계산함으로써 달성된다. 라벨 효율은 98 %를 초과해야한다.
- SILAC의 프로테옴 및 검증의 조합입니다.
- 배양 및 적절한 SILAC 매체에 지침을 제조에 따라 선택 세포주를 확장합니다. 를 Lyse 고형 종양에 대해 단계 3.2에 기재된 각 세포 용 해물에 대한 단백질 농도를 결정 액상 종양 2.1 과정 또는 세포.
- 각 세포주의 동일한 몰 양의 단백질을 분취 량으로 혼합하고, 혼합물을 나눈다. 측정 할 때까지 -80 ° C에서 분주 저장을 스냅 동결. 슈퍼 SILAC 표준의 50 μg의 - 한 실험의 경우는 20이 필요합니다. 스탠를 준비하는주의일련의 실험에서 표준 변경 등 초과 준 피해야한다.
단백질 농도와 스파이크에서 4. 측정
- 액체 종양.
- 단백질 정량 분석법을 이용하면, 각 세포 용 해물과 슈퍼 SILAC 표준의 단백질 농도를 결정한다.
- 클리어 세포 용 해물과 슈퍼 SILAC 표준 동량 혼합하고이어서 도데 실 황산 리튬 (LDS) 완충액 (샘플 량의 25 %) 및 환원제 (샘플 량의 10 %)을 추가한다.
- 10 분 동안 72 ℃에서 가열 블록에서 생성 된 용액을 가열한다. 선택적으로, -80 ° C에서의 결과 변성 단백질을 저장합니다.
- 고형 종양.
- 플레이트 판독기에 단백질 농도 측정을 위해, (BSA) 희석액 시리즈, 파쇄물 및 시판 단백질과 적절한 슈퍼 SILAC 표준 표준 소 혈청 알부민을 섞어96 웰 플레이트에 ssay, 1 분 동안 흔들어 지정된 시간 동안 배양 및 제조 업체에 의해 지시 된 바와 같이 흡광도를 측정한다.
참고 : 해물의 높은 SDS의 농도와 디티 오 트레이 톨 (DTT)는 단백질 농도 결정에 가장 사용할 수 분석에 대한 문제입니다. - 명확히 해물 및 20 ° C에서 30 분 동안 14,000 XG에 필터 부 및 원심 분리기 우레아 200 μL와 슈퍼 SILAC 표준의 동일한 양을 혼합한다. 50 개 이상의 명확히 해물 μL와 슈퍼 SILAC 표준을 사용하지 마십시오. 그 요소가 결정화되지 않도록, 15 ° C 이하의 온도를 피하십시오.
- 플레이트 판독기에 단백질 농도 측정을 위해, (BSA) 희석액 시리즈, 파쇄물 및 시판 단백질과 적절한 슈퍼 SILAC 표준 표준 소 혈청 알부민을 섞어96 웰 플레이트에 ssay, 1 분 동안 흔들어 지정된 시간 동안 배양 및 제조 업체에 의해 지시 된 바와 같이 흡광도를 측정한다.
5. 샘플 분리 및 단백질 다이제스트
- 액체 종양.
- 12 % 그라데이션 SDS-PAGE 젤 - 별도의 30 - 4 레인 당 100 μg의 총 단백질. 코마시 블루 O / N으로 얼룩 단백질. 물이 이후의 세척에 의해 초과 쿠마 얼룩을 제거합니다.
- 겔에서 각 레인을 차단하고 분할에 관계없이 젤 염색 패턴의 23 동일한 크기의 조각으로. 0.6 ml의 폴리 프로필렌 바이알에서, 개별적으로 각각의 젤 슬라이스를 처리한다.
- 물과 메탄올 / 물 (50:50, V는 / V), 56 ° C에서 30 분 동안 배양하여 10 mM의 DTT로 줄이기로 겔 조각을 씻으십시오. 어둠 속에서 실온에서 60 분에서 배양하여 요오도 아세트 아미드 55 mM의 (IAA)와 겔 조각을 킬레이트.
- 시료 처리 단계들 사이, 과량의 용매를 제거하고, 시약 용액의 흡수를 향상시키기를 Speedvac에서 15 분 동안 건조 아세토 니트릴로 슬라이스를 세척 하였다.
- 37 ° C에서 16 시간 동안 (0.025 M 수성 중탄산 암모늄 12.5 NG / μL) 돼지 트립신 용액 최소량으로 건조 겔 슬라이스를 재수 프로테아제에 의해 절단을 수행한다.
- 젤 조각에 10 μl의 물을 추가하고 37 ° C에서 15 분 동안 품어. 80 μL 아세토 니트릴을 추가하고 37 ° C에서 15 분 동안 품어. 1 분 동안 15,800 XG에 원심 분리기. 별도의 0.6 ㎖에 뜨는 및 저장소를 수집튜브.
- 5 % 포름산 용액, 소용돌이의 65 μl를 추가하고 37 ° C에서 15 분 동안 품어. 65 μL 아세토 니트릴을 추가하고 37 ° C에서 15 분 동안 품어. 1 분 동안 15,800 XG에 원심 분리기. 상층 액을 수집하고 이전 단계의 상층 액에 추가합니다. 진공 농축기에서 건조에 결합 된 상층 액을 증발.
- 고형 종양.
- 조직 파쇄물 SDS를 제거하기 위해도 기준 15으로 설명 된 다음 FASP 프로토콜을 사용합니다.
- 단계 5.2.3에서 설명한 제 원심 분리 후 20 ° C에서 20 분 동안 14,000 XG에서 필터 8 M 우레아를 추가로 200 μL, 또한 원심 분리기를 추가한다. 흐름을 통해 여과 액을 버린다.
- 100 μL IAA를 추가하고 1 분 동안 600 rpm에서 써모에 섞는다. 어둠 속에서 20 ° C에서 20 분 동안 필터를 품어. 20 ° C에서 10 분 동안 14,000 XG에 필터를 원심 분리기.
- 필터 및 CEN에 요소의 100 μl를 추가20 ℃에서 15 분 동안 14,000 XG에 trifuge. 이 단계를 한 번 더 반복합니다.
- 20 ° C에서 10 분 동안 14,000 XG에서 필터와 원심 분리기에 NH 4 HCO 3의 100 μl를 추가합니다. 두 번이 단계를 반복합니다.
- 40 μL NH 4 HCO 3 + 1 μL (= 0.4 μg의) 트립신을 추가하고 600 rpm으로 1 분 동안 20 ° C에서 써모 믹스. 37 ℃에서 습윤 챔버에서 필터 O / N 부화. 새 컬렉션 튜브 필터를 전송합니다.
- 20 ° C에서 10 분 동안 14,000 XG에 필터를 원심 분리기. 20 ° C에서 10 분 동안 14,000g에서 NH 4 HCO 3, 원심 분리기 50 μL 필터를 추가합니다. 질량 분광 측정 할 때까지 -20 ° C에서 생성 된 펩티드를 저장합니다.
- 펩티드 농도 측정을 위해 96 웰 플레이트에 얻어진 관류 깔끔한 트립토판의 적절한 희석액의 시리즈 중 50 μL 분주. 트립토판 형광을 측정합니다. 의 결과 농도 변환트립토판 0.1 μg의 같은 펩타이드 농도 트립토판, 9 μg의 단백질에 해당합니다.
6. 액체 크로마토 그래피 및 질량 분석
- 초음파 욕조에서 5 분 동안 30 μL 로딩 버퍼의 펩티드를 재용. 1 분 동안 15,800 XG에서 원심 분리기에 스핀 다운과 MS 오토 샘플러 유리 병에 맑은 용액을 피펫.
- nanoLC-MS / MS 시스템의 자동 시료 주입기를 사용하여 분석 당 샘플의 5 μl를 주입한다. C18 사전 칼럼 (5 μm의 기공 크기 C18 재료로 0.15 mm의 ID X 20mm)이 배출 한 열 설정이나 프리 컬럼 전환 설정에 설치할 역상에 온라인으로 집중과 탈염 펩티드.
- 역상 C18의 마이크로 칼럼에서 분리 된 펩티드 (0.075 mm ID X 200mm 자체 충전 5> 35 % 아세토 니트릴의 90 분 구배 대를 사용하여, 예컨대 PicoFrit 같은 자기 팩의 nanospray 열에 3 ㎛ 이하의 기공 크기 C18 재료 300에서 NL., 0.1 % 수성 포름산 /분. 의 nanospray 이온 소스를 통해 혼성 사중 극 / orbitrap 질량 분광계로 전송 용리액.
- Top15 데이터에 의존 취득 법 (MS의 M / Z 범위 (350) 사용 펩티드 분석 -. 1600, 해상도 대상 70.000 FWHM, AGC 대상 1 × 6, 최대 충전 시간이 60 밀리 초 MS / MS 질량 100 시작, 해상도 대상 17.500 FWHM, AGC ., MS / MS 임계 값 3 × 10 4 2 × 10 (5), 최대 충전 시간이 60 밀리 초를 대상으로 충전 상태 2 등 - 5, 표준화 충돌 에너지 NCE 25 %, 동적 제외 15 초).
7. 데이터 분석
- 데이터 분석을 위해 무료로 사용할 수 MaxQuant 16 소프트웨어를 사용합니다. 생물 정보학적인 분석에 대한 데이터 (16, 17)은 상세한 프로토콜 설명한다. 분석을 위해, 17 번의 실험으로 SDS-PAGE 차선에서 모든 슬라이스 원시 데이터 파일을 결합한다.
결과
환자의 액체 및 고체 종양의 프로테옴 프로파일 링은 새로운 진단 및 예측 바이오 마커의 발견을위한 유망한 접근법이다. 그러나, 샘플 제조 절차 및 질량 분석은 샘플의 복잡성과 샘플의 큰 집합의 정확한 단백질 정량에 대한 필요성으로 인해, 도전이다. 위에서 설명한 실험 절차는 형광 활성화 셀 정렬 또는 레이저 캡처 미세 절제에 의해 하나, 관심의 세포의 분리와 함께 시작합니다.
이를 위해 환자 유래 골수 흡인 또는 혈액 샘플에서 세포를 FACS 기반의 정렬 및 세포 용해 전에 관심의 정의 표면 마커에 대한 형광 표지 항체로 염색된다.
조직 섹션에서 세포의 부분 집합을 풍부하게하려면 다음 먼저 레이저 캡처 미세 절제 수 있도록 적절한 슬라이드에 장착해야합니다. 이를 위해 t 마운트그는 적절한 막 슬라이드에 조직 절편과는 제조업체의 지침에 레이저 캡처 microdissector 따라 사용합니다. 지역과 관심의 셀을 선택하면 건강하고 종양 조직의 histomorphology에 대한 적절한 지식이 필요합니다. 추출 된 세포는 적절한 수집 튜브로 전송됩니다. 초기 실험은 관심있는 모든 새로운 조직에 대한 충분한 양의 단백질 (최소 10 μg의 총 단백질)의 추출에 필요한 조직의 양을 정의하기 위해 수행되어야한다. 각 시료 microdissected 조직 용해 완충액 60 μL로 처리된다. 효율적인 용해를 들어 조직 샘플로부터의 세포를 포르말린 - 유도 된 가교 결합 된 단백질을 제거하기 위해 1 시간 동안 99 ° C에서 써모 인큐베이션 3 분 동안 샘플을 SDS 15 μL를 첨가 한 후 초음파 처리되어야한다. 원심 분리 마침내 지워 세포 용 해물의 수집을 용이하게합니다.
나는 모든 질병에 대한nterest (액체 및 고체 종양)에 적합한 슈퍼 SILAC 정량 표준이있다 (14)를 설립한다. 적절한 표준은 관심 샘플에서 발현 된 단백질의 90 % 이상을 나타낼 것이다. 정량 표준의 준비를위한 관심의 암 유형에 관련된 세포주 제 그들의 단백질 발현 프로필을 결정하기 위해 질량 분석기로 분석한다이어서 주성분 분석이 수행되어야한다. 4 - 차동 단백질 발현 패턴을 가진 6 개의 세포주를 선택하고 "무거운"아르기닌과 라이신과 SILAC은 표지되어야한다. 라벨 효율은 nanoLC-MS / MS에 의해 확인되어야하고, 98 %보다 커야합니다. 이후, 세포주이어서, 각 샘플 및 SILAC 스파이크 표준 몰량의 단백질 양이 혼합되어야 각 환자 유래의 시료와 같은 동일한 방식으로 용해되어야한다. 오 임상 샘플의 정확한 단백질 정량 중요한 단계F의 관심은 환자 유래 샘플 및 SILAC 스파이크의 정량 표준의 몰 단백질 양의 정확한 혼합물이다. 정렬 세포 유래의 용 해물의 단백질 농도를 결정하기 위해, 다양한 단백질의 정량 분석이 사용될 수있다. 조직 유래 세포에서 세포 용 해물에 대한 분석은 해물 SDS와 DTT의 높은 농도를 해결할 수있는이 필요하다. 환자 유래의 시료와 SILAC 스파이크 된 표준 단백질 농도에도 필적 수백 개의 샘플 제작에 중요 올바른 혼합물을 보장하기 위해 각각의 임상 샘플 전에 조합마다 측정되어야한다.
분리의 1D-PAGE로 10 분 동안 72 ° C에서 써모 LDS 가열과 혼합 액체 종양으로부터 수득하고이어서 실시하고, 표준 샘플과 파쇄물에서 스파이크 및 겔에서 소화 등량 혼합물의 후 트립신 단백질. 샘플에서 얻은조직 위스 니 스키 등에 의해 제정 된대로 FASP 방식을 사용하여 SDS에서 해방하고 트립신 분해된다. 15
수득 된 트립신 펩티드는 필터로부터 방출 펩티드의 양이 초기 필터 상에 로딩 된 단백질 량에 비해 15 %와 75 % 사이의 차이로 조직 샘플에 대한 특별한 관심의 트립토판 형광을 측정함으로써 정량화 될 수있다. 이를 위해 우리는 트립토판의 형광을 측정한다. 트립토판의 1.1 μg의 약 100 μg의 펩타이드에 해당 같은 적절한 트립토판 희석 시리즈와 비교, 펩티드의 정량 수 있습니다. 필요한 경우 FASP 처리에서 특히 유래 시료 nanoLC / MS / MS 시스템 (18) 상에로드하기 전에 역상-C18 (RP-C18) 물질로 충전 상업적 또는 집에서 만든 스테이지 팁 하나에 미리 정제 할 수있다.
대량 분광 분석은 높은 수행됩니다지키미, 고감도 질량 분석 시스템입니다. 즉, 펩티드 샘플은 탈염 및 RP-C18의 프리 컬럼에 통과시켜 농축하고, 질량 분석 장치에 직접 결합 RP-C18 분석 컬럼상에서 분리. FASP에 의해 처리 고형 종양에 대해 (3 시간 RP-C18 구배 - 분석의 충분한 깊이를 달성하기 위해, 우리는 긴 2 40 분 RP-C18의 (액체 종양) 그라디언트 또는 단일 주사와 SDS-PAGE 단백질 예비 분별의 조합 중 하나를 사용 ). MS 스펙트럼은 피크의 크로마토 그래피 프로필을 통합하여 SILAC 쌍의 정확한 정량을 허용하도록, 70,000 이상 FWHM의 해상도에서 획득된다. 식별을위한 단백질, Top15 데이터 의존 취득 방법은 펩티드 및 단백질 식별 펩티드 MS / MS 스펙트럼의 다수를 생성하는데 사용된다.
결과 원시 데이터에서, 단백질 식별 및 정량화 UniProt Knowledgebas에 대한 MaxQuant 소프트웨어와 데이터베이스 검색에 의해 달성된다즉 완전한 인간 프로테옴 서열 데이터베이스 (17). MaxQuant 소프트웨어 (현재 버전 1.5.0.25)에서 펩타이드는 단백질 서열 데이터베이스에서 실리에서 파생 된 스펙트럼에 펩티드 단편 일치에 의해 획득 한 MS / MS 스펙트럼에서 식별됩니다. 동시에, 동위 프로필 이온 전구체는 크로마토 그래피 체류 시간 주위를 추출하고, 그 통합 된 피크 면적은 광의 상대적인 정량을 위해 사용된다 : SILAC 라벨링에 의해 생성 된 펩티드 무거운 쌍. 펩타이드 정체성과 상대 강도는 다음 해당 단백질의 특성에 할당됩니다. 페르세우스 소프트웨어 (현재 버젼 1.5.0.15) 그런 샘플 간 비교, PCA 및 계층 적 클러스터링을 포함 MaxQuant 처리 결과 하류 통계적 평가를 수행하는데 사용된다.
실험 장치는 우리가 식별 한 설명과 같은 작은 총 단백질의 μg의 30에서 8,000 단백질까지 정량 사용액체 종양에서 유래.
고체 종양 샘플에서 최대 2,500 단백질 식별 및 비교적 짧은 시간에 임상 수백 개의 샘플의 분석을 허용하는, 단지 2 시간의 LC 구배 산탄 프로테오믹스 방법으로 정량화 될 수있다.
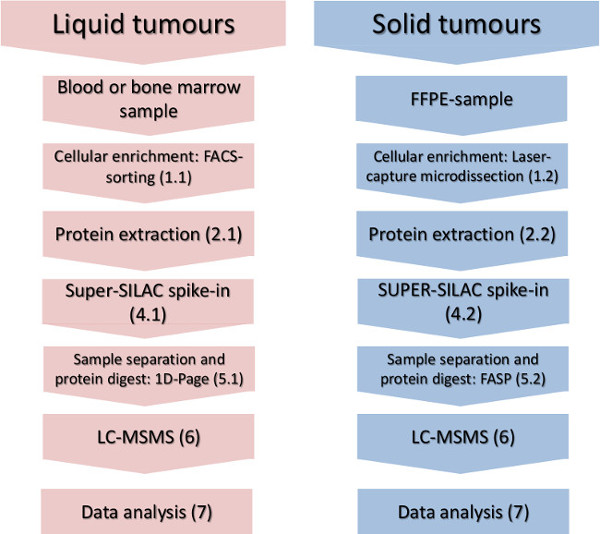
그림 1. 실험 워크 플로우. 셀룰러 일부 농축, 단백질 분리의 주요 단계는, 스파이크에 액체 및 고체 종양 표시된 정량 표준 및 질량 분광 분석을. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
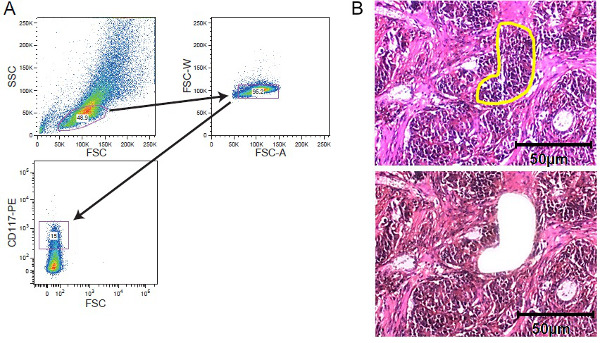
그림 2. 세포 농축 strategi에스. FACS 정렬 및 LCM. (A) 실시 게이팅 전략은 셀 소터에 의해 취득 CD117 염색 백혈병 세포 집단 상에 게이팅 묘사. 고형 종양 조직의 (B) 레이저 캡처 미세 절제. (5)의 조직 절편 - 10 μm의 두께는 염색 전의 필름 피복 막 슬라이드 상에 장착 하였다. 관심 지역은 레이저 캡처 미세 절제에 대해 수동으로 선택되었다. 관심 영역과 미세 절제 노란색과 미세 절제 후 표시하기 전에 섹션있는 바와 같다. 50 ㎛의 스케일 바는 그림에 포함되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
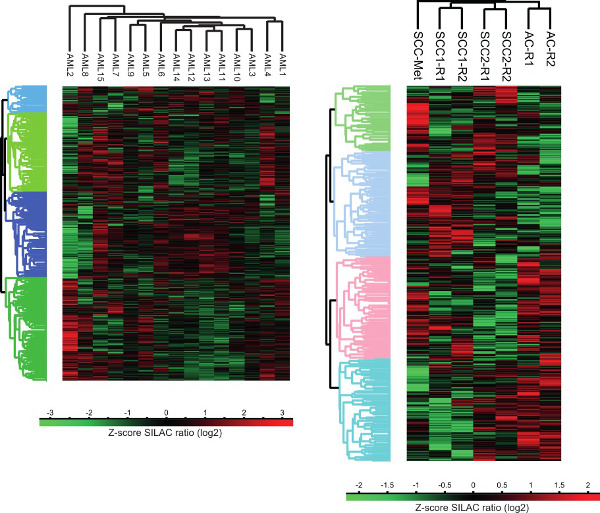
인간의 암 세포 프로테옴 그림 3. 클러스터 분석. 홍보의 자율 군집 분석액체 및 고체 종양 otein 발현 프로파일 페르세우스 연산 플랫폼을 이용하여 수행 하였다. AC - 선암, SCC - 편평 세포 암, SCC-메트로 - 기술 복제 - 머리와 목 암, R에서 편평 세포 암 전이.
토론
환자 유래의 암 세포 프로테옴의 질량 분석 프로파일은 새로운 진단 / 예측 바이오 마커 발견에 필요할뿐만 아니라 암세포 생물학의 더 나은 이해를 제공 할 수도 새로운 잠재적 인 약물 타겟들의 식별에 차례 리드. 다양한 사전 분석 문제 하나가 견고하고 생물학적으로 중요한 결과를 얻을 경우, 해결되어야 할 필요가 있기 때문에, 이러한 질량 분광 분석은 특히, 매우 도전적이다.
여기에 설명 된 실험적인 작업 흐름은 액체 및 고체 종양 모두의 세포 개체군에서 파생 된 프로테옴의 정량 프로테오믹스 특성화 수 있습니다. 어느 FACS 기반 셀 sortingor의 미세 절제함으로써 종양 세포의 농축은 초기 종양 미세 환경의 세포에 의한 오염을 방지하기 위해 필요하다. 또한, 이들 기술은 하나의 세포가 관심 개체군을 분리 할 수있다. 최근 세포 생물학적 연구는 악마가특정 세포 개체군이 종양을 시작하는 특성을 가지고있어 암 발병 (19, 20)에 대한 관련성이 높은 것을 strated. 질량 분석은 최근 몇 년 동안 더 민감하게되면서, 양적 프로테옴 분석은, 몇 천 세포로부터 유도 될 수있다 단백질의 소량을위한 실현 가능한 것이 가능 기능적으로 관련 세포 집단에 초점을 할 수있다.
여기에 제시된 셋업은 FFPE 시료에서 신규 진단 바이오 마커를 식별하고 검증하는 데 사용될 수있다. 따라서, 여전히 많은 유형의 암 및 적절한 수의 품질 분자 바이오 마커의 부족으로 현재까지 임상 진단의 개선을위한 유용한 도구 BEA 약속. 바이오 마커가 부족하는 어려운 차동 진단의 중요한 예는 폐에 전이, intrapancreatic cholangiocellular 암 및 췌장 선암에서 원발성 폐암 사이의 차별이다,뿐만 아니라 다른고도의 악성 말초 신경 칼집 종양에서 양성 신경 섬유종의 entiation. 또한, 우리는 다른 사람의 서명 단백질체 정량 해명은 일반적으로 암 세포 생물학 연구 및 암 환자에서 치료 적 응답 (21)의 예측을위한 바이오 마커를 드러내는 유용 할 수 있음을 보여 주었다.
여기에 제시된 방법의 단점은 두 개의 전류 광범위한 설명서 시료 처리에 대한 요구 및 nanoLC-MS / MS 획득 시간에 대한 요구이다. 전자는 예를 들어, 96 웰 형식으로 시료 전처리를 이동 로봇 및 프로세싱을 사용하여 해결 될 수 있지만, 후자는 질량 분석 인수 전략의 변경을 요구할 것이다. 표적 단백질의 서브 세트는 예를 들면, 종양의 분류와 연관 될 수있는 식별되고 나면, 우리는 매우 감소 분리 노력이 서브 세트에 대한 판독 값을 제공하는 정량 대상 질량 분석 방법의 설계를 직시 한따라서 대응하여 획득 시간 감소와. (24)로부터 감소 될 수있다 요구되는 필요한 수집 시간 경우 - 36 시간 (액체 종양) 또는 3 시간 (고형 종양)을 예 :하기 1 시간 후 질량 분석 및 펩티드의 단순한 일차원 분리, 처리량 얻어진 이득을 타겟팅 사용 하 정량 결과의 유의성 개선 대응하는, 생물학적 검사 기술 복제물 유의 숫자를 증가하는데 사용될 수있다. 타겟 질량 분석 방법은 이미 암 관련 단백질 바이오 마커 - 후보 (22)의 검증을위한 적절한 도구로 입증되었다, 그들은 검증 또는 심지어 루틴 임상 23 전위 도구로 약속 표시 점 개발되어왔다 24.
공개
저자는 공개 할 관심이나 다른 문제의 충돌이 없습니다.
감사의 말
The authors thank Uwe Plessmann, Monika Raabe und Silvia Münch for technical support.
자료
| Name | Company | Catalog Number | Comments |
| 660 nm Kit | Thermo scientific | 22662 | |
| Cell culture medium depleted of arginine and lysine | Thermo Scientific | 88421 | |
| Coomassie Brilliant Blue R-250 staining solution | Bio Rad | 161-0436 | |
| Dialyzed fetal calf serum (FCS) | PAA | A15-107 | |
| Diffuser caps for microdissection | MMI | 50202 | |
| FACS-sorter | BD | FACSAria III | |
| Ionic Detergent Compatibility Reagent | Thermo scientific | 22663 | |
| Laser-capture microdissector | MMI | cell cut plus | |
| LDS buffer | Life Technologies | NP0009 | |
| Membrane slides for microdissection | MMI | 50103 | |
| Microcon YM-30 | Millipore | MRCF0R030 | |
| NuPAGE 4-12% Bis-Tris Mini Gels | Life Technologies | NP0335PK2 | |
| Picofrit Self-Pack Columns | New Objective | PF360-75-15-N-5 | Mass Spectrometry Column/Emitter |
| Reducing agent | Life Technologies | NP0007 | |
| Reprosil-Pur LC/MS/MS Column stationary phase | Dr. Maisch | 120 C18-AQ, 3 µm | |
| Reprosil-Pur LC/MS/MS Precolumn stationary phase | Dr. Maisch | 120 C18-AQ, 5 µm | |
| SILAC-labeled arginine | Eurisotop | CLM-2265-H-0.1 | |
| SILAC-labeled lysine | Eurisotop | DLM-2640-0.25 | |
| Trypsin, NB Sequencing Grade | Serva | 3728301 | for in-gel digests |
| Trypsin, Sequencing Grade | Promega | V5111 | for in-solution digests |
| Buffer and solutions | |||
| Cell lysis buffer: 150 mM NaCl, 50 mM Tris/HCl pH 7.8, 5 mM NaF, 0.5% NP40, 0.1% laurylmaltoside, Roche complete protease inhibitor, 1 mM Na3VO4 | |||
| Tissue lysis buffer: 100 mM Tris/HCl pH 7.8, 0.1 M DTT | |||
| Urea: 8 M urea in 0.1 M Tris-HCl, pH 8.5 | for FASP-protocoll | ||
| IAA: 0.05 M iodoacetamide, 8 M urea, 0.1 M Tris-HCl, pH 8.5 | for FASP-protocoll | ||
| 0.05 M NH4HCO3 | |||
| 10 mM dithiothreitol (DTT) in 0.1 M ammonium bicarbonate | for in-gel digest | ||
| 55 mM iodoacetamide (IAA) in 0.1 mM ammonium bicarbonate | for in-gel digest | ||
| 5% aqueous formic acid. |
참고문헌
- Walther, T. C., Mann, M. Mass spectrometry-based proteomics in cell biology. J Cell Biol. 190 (4), 491-500 (2010).
- Lenz, C., Urlaub, H. Separation methodology to improve proteome coverage depth. Expert Rev Proteomics. 11 (4), 409-414 (2014).
- Olsen, J. V., Mann, M. Status of large-scale analysis of post-translational modifications by mass spectrometry. Mol Cell Proteomics. 12 (12), 3444-3452 (2013).
- Ong, S. E., et al. Stable isotope labeling by amino acids in cell culture, SILAC, as a simple and accurate approach to expression proteomics. Mol Cell Proteomics. 1 (5), 376-386 (2002).
- Jimenez, C. R., Verheul, H. M. Mass spectrometry-based proteomics: from cancer biology to protein biomarkers, drug targets, and clinical applications. Am Soc Clin Oncol Educ Book. , e504-e510 (2014).
- Tang, D. G. Understanding cancer stem cell heterogeneity and plasticity. Cell Res. 22 (3), 457-472 (2012).
- Evans, C., et al. An insight into iTRAQ: where do we stand now. Anal Bioanal Chem. 404 (4), 1011-1027 (2012).
- Ostasiewicz, P., Zielinska, D. F., Mann, M., Wisniewski, J. R. Proteome, phosphoproteome, and N-glycoproteome are quantitatively preserved in formalin-fixed paraffin-embedded tissue and analyzable by high-resolution mass spectrometry. J Proteome Res. 9 (7), 3688-3700 (2010).
- Malmström, J., Picotti, P., Aebersold, R. Perspectives of targeted mass spectrometry for protein biomarker verification. Curr Opin Chem Biol. 13 (5-6), 518-525 (2009).
- Gillet, L. C., et al. Targeted data extraction of the MS/MS spectra generated by data-independent acquisition: a new concept for consistent and accurate proteome analysis. Mol Cell Proteomics. 11 (6), (2012).
- Basu, S., Campbell, H. M., Dittel, B. N., Ray, A. Purification of specific cell population by fluorescence activated cell sorting (FACS). J Vis Exp. 41, (2010).
- Edwards, R. A. Laser capture microdissection of mammalian tissue. J Vis Exp. 8, 309 (2007).
- Liu, N. Q., et al. Proteomics pipeline for biomarker discovery of laser capture microdissected breast cancer tissue. J Mammary Gland Biol Neoplasia. 17 (2), 155-164 (2012).
- Geiger, T., et al. Use of stable isotope labeling by amino acids in cell culture as a spike-in standard in quantitative proteomics. Nat Protoc. 6 (2), 147-157 (2011).
- Wisniewski, J. R. Proteomic sample preparation from formalin fixed and paraffin embedded tissue. J Vis Exp. (79), (2013).
- Cox, J., Mann, M. MaxQuant enables high peptide identification rates, individualized p.p.b.-range mass accuracies and proteome-wide protein quantification. Nat Biotechnol. 26 (12), 1367-1372 (2008).
- Cox, J., et al. A practical guide to the MaxQuant computational platform for SILAC-based quantitative proteomics. Nat Protoc. 4 (5), 698-705 (2009).
- Rappsilber, J., Mann, M., Ishihama, Y. Protocol for micro-purification, enrichment, pre-fractionation and storage of peptides for proteomics using StageTips. Nat Protoc. 2 (8), 1896-1906 (2007).
- Sarvi, S., et al. CD133+ cancer stem-like cells in small cell lung cancer are highly tumorigenic and chemoresistant but sensitive to a novel neuropeptide antagonist. Cancer Res. 74 (5), 1554-1565 (2014).
- Shlush, L. I., et al. Identification of pre-leukaemic haematopoietic stem cells in acute leukaemia. Nature. 506 (7488), 328-333 (2014).
- Schaab, C., et al. Global phosphoproteome analysis of human bone marrow reveals predictive phosphorylation markers for the treatment of acute myeloid leukemia with quizartinib. Leukemia. 28 (3), 716-719 (2014).
- Hüttenhain, R., et al. Reproducible quantification of cancer-associated proteins in body fluids using targeted proteomics. Sci Transl Med. 4 (142), 142ra94 (2012).
- Burgess, M. W., et al. Simplified and efficient quantification of low-abundance proteins at very high multiplex via targeted mass spectrometry. Mol Cell Proteomics. 13 (4), 1137-1149 (2014).
- Boja, E. S., et al. Analytical Validation Considerations of Multiplex Mass Spectrometry-based Proteomic Platforms for Measuring Protein Biomarkers. J Proteome Res. , (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유