Method Article
对源自液体和固体肿瘤癌症细胞定量蛋白质组质谱剖析
摘要
In-depth analyses of cancer cell proteomes facilitate identification of novel drug targets and diagnostic biomarkers. We describe an experimental workflow for quantitative analysis of (phospho-)proteomes in cancer cell subpopulations derived from liquid and solid tumors. This is achieved by combining cellular enrichment strategies with quantitative Super-SILAC-based mass spectrometry.
摘要
深入的癌细胞蛋白质组分析,需要阐明致癌病理机制,以及以确定潜在的药物靶标和诊断生物标志物。然而,对于患者来源的肿瘤,特别是它们的细胞亚群的定量蛋白质组表征方法在很大程度上缺乏。在这里,我们描述了一个实验装置,其允许从液体或固体肿瘤衍生的癌细胞亚群蛋白质组的定量分析。这是通过结合细胞富集策略,定量超级SILAC基于质谱其次是生物信息学数据分析来实现的。为了丰富特异性细胞亚群,液体肿瘤首先由流动immunophenotyped术之后FACS排序;对于实体瘤,激光捕获显微切割是用于纯化特定的细胞亚群。在第二步骤中,蛋白质是从纯化的细胞中提取并随后用肿瘤特异性结合,SILAC标记穗的标准,使蛋白质定量。所得的蛋白质混合物进行要么凝胶电泳或过滤计算机辅助样品制备 (FASP),随后加入胰蛋白酶消化。最后,胰蛋白酶肽是使用混合四极的Orbitrap质谱仪进行分析,所获得的数据与生物信息学软件套件包括MaxQuant处理。通过这里提出,高达8000蛋白质工作流的装置可以识别并定量患者来源的样品中,将得到的蛋白质表达谱可以在患者之中,以确定诊断蛋白质组学签名或潜在的药物靶标进行比较。
引言
质谱为基础的蛋白质组学已经出现,现在是一个广泛使用的学科细胞生物学和转化医学研究。在该领域的技术进步已使得能够研究细胞系和动物模型中的复杂的细胞过程,如成千上万的蛋白质可以在单一质谱实验1,2来识别。类似的进展已为许多翻译后修饰,如磷酸化或泛素化的分析,尽管这通常需要定制工作流程富集和数据分析对于每种类型的变形例2,3的。此外,化学和代谢标记战略,包括SILAC,参与使蛋白和翻译后修饰的准确的相对定量,使得这种方法对于基本的细胞过程,诊断生物标志物和潜在的药物靶标在人类癌症4的发现特别有吸引力。
然而,若干挑战必须对于初级人类癌症5的蛋白质组分析来克服。首先,人类癌症的样品常常表现出细胞异质性程度高是由于属于肿瘤微环境,包括免疫细胞和成纤维细胞的各种细胞类型的存在。其次,克隆演变导致遗传多样性内肿瘤本身,导致几个细胞亚群具有不同功能特性的存在。据一些癌症干细胞是癌症背后的发展过程中,这样的(功能上高度相关)细胞亚群的蛋白质组学分析的驱动力的电流概念有望成为非常重要的相关临床应用更好地了解致癌机制6。第三,经常需要对强有力的临床BIOMAR鉴定大组样品定量蛋白质表达谱KERS;这不能用化学标记,如的iTRAQ 7来完成,而代谢标记策略-靠,因为他们这样做,对细胞增殖4 -也同样适用。第四,大多数可用的固体肿瘤样品是福尔马林固定的,这是由于蛋白质交联8的形成质谱蛋白质组学分析复杂化。最后,大多数现有蛋白质组学工作流程需要显著量样品处理和数据采集,呈现相关的临床研究困难样本数的分析,并要求新的工作流范式9,10。
为了解决这些障碍,我们开发了一个实验装置,要么流式细胞细胞分选相结合11或激光捕获显微切割12,13与一个超级SILAC 14战略引进了综合质谱分析一个全球性的内部标准的蜂窝富集。通过使用这里所描述的方法,能够定量至多8000的蛋白质从液体或固体癌衍生的单一的人肿瘤样品中。
研究方案
对人体组织或血液样本,所有实验必须由道德委员会根据道德票给予的指导方针的批准和执行。
1.细胞富集
- 液肿瘤/荧光激活细胞分选。
- 通过使用氯化铵进行红细胞裂解或通过Ficoll密度梯度离心分离自骨髓或血液样品的单核细胞。
- 为红细胞裂解,将1 ml样品的用4毫升氯化铵溶液。冰上孵育该溶液为5 - 10分钟。加40毫升磷酸盐缓冲盐水(PBS)+ 2%胎牛血清(FCS)和离心机5分钟,在400×g离心并4℃。
- 对于聚蔗糖梯度离心层10毫升上15毫升聚蔗糖 - 泛影葡胺的样本,形成2个不同的层(要小心,不要打扰层)。离心机在400 XG 30分钟在室温(15 - 25°C)细心和收获的单核细胞收集在相间。
- 降速细胞,把它们在PBS + 2%FCS。离心机在400×g离心5分钟,并占用于1ml PBS + 2%FCS中。取1等份作为阴性对照和一个等份用于在最终污渍中使用的每个荧光染料。
- 孵育荧光标记抗体有用根据制造商的在冰上30分钟的指令来隔离白血病细胞群中稀释。也染色用于与每个单独的抗体赔偿等分。与PBS + 2%FCS洗两次澡。
注:所用的抗体是抗CD117-PE(克隆95C3),CD34-FITC(克隆8G12)和CD33-PE(克隆P67.6)的小鼠抗人。 - 通过35微米的细胞过滤过滤单元,最理想的是采用管与细胞滤网集成在帽。
- 添加细胞活力染色( 例如,7-AAD)。使用适当的细胞分选仪11( 图2)分类的细胞。收集细胞电流Isc OVE氏改良的Dulbecco氏培养基(IMDM)含有10%FCS。
- 通过使用氯化铵进行红细胞裂解或通过Ficoll密度梯度离心分离自骨髓或血液样品的单核细胞。
- 实体瘤/激光捕获显微切割。
- 对于所描述的实验中,从肺癌标本FFPE样品。用于此目的的肺癌组织进行外科手术切除和大约3×2×1厘米的片后,立即固定在4%缓冲的福尔马林中,其中包埋在石蜡中用于进一步分析。
- 从福尔马林固定的石蜡包埋(FFPE)用切片机样品10微米厚 - 切的5个部分。摩部分上膜覆盖膜的幻灯片和干燥,在37℃1小时。 Deparaffinize和再水化的安装部分通过连续培养中的二甲苯,无水乙醇,70%和水,每次1分钟。
- 染色与苏木的章节,持续20秒,然后用自来水冲洗。使用激光捕获显微切割系统收集感兴趣的细胞群(也见12)。
- 液体肿瘤。
- 离心从步骤1.1.5细胞悬浮液在400×g离心,4℃进行4分钟,并弃去上清液。用500μl冷的PBS并离心5分钟,在400×g离心洗两次,并4℃下
- 添加每10 6个细胞40微升裂解缓冲液并培育在冰上15分钟(10 5个细胞(大约10微克总蛋白)应该是最低的细胞数量)。离心裂解物以14000×g离心,4℃,10分钟,将上清液(清零蜂窝裂解物)转移到一个新的反应管中。弃沉淀。
- 实体肿瘤。
- 添加60微升组织裂解缓冲液对显微组织,并培育在冰上15分钟后,收集由短暂离心流体和悬浮液转移到一个新的反应管中。超声处理在冰上裂解液3分钟。
- 添加15微升20%的十二烷基硫酸钠(SDS),提供一个达成最终的SDS共ncentration的4%。孵育在99℃的显微组织中的加热块1小时,并搅拌在600rpm。离心裂解物在16000×g离心,18℃,10分钟,并且将上清液转移到一个新试管中。
3.建立一个SILAC穗的定量标准(超级SILAC标准)
注:量化标准由来自4衍生的SILAC标记蛋白混合物的 - 6细胞匹配感兴趣的肿瘤类型的行。为了实现SILAC标记参考蛋白质和肿瘤来源的蛋白质组之间的最大程度的重叠,主成分分析之前需要的细胞系被选择用于量化标准14被执行。
- 主成分分析(PCA)。
- 为了确定细胞系中的蛋白表达模式,培育合适的细胞培养基约十个不同的细胞系。裂解的细胞所描述在步骤2.1。按照步骤6.1中所述准备细胞裂解物质谱。
- 上的高分辨率分析每个细胞系的蛋白质表达模式,液相色谱偶联质谱(nanoLC-MS / MS)。
- 使用免费的洁具MaxQuant分析得到的原始数据,并利用相关软件,如英仙座16,17进行主成分分析。
- 选择4 - 这表明他们的蛋白质表达谱之间的最大差异,并利用它们来产生超级SILAC穗标准6芯线。
- SILAC标记和标签检查。
- 培养所选择的细胞系为至少5细胞周期在适当的SILAC细胞培养基,其中精氨酸和赖氨酸都标有碳和氮(SILAC介质)4的稳定同位素。
- 作为裂解按照步骤6.1中所述步骤3.1中所述,准备细胞裂解物质谱细胞。测量SILAC标记的通过nanoLC-MS / MS的引入效率。分析与MaxQuant所得原始MS数据,并确定SILAC标记的效率。这是通过计数在其标记为(重)鉴定的肽和它们的内源形式的(光)的数量,并计算比率(重)/(重+光)来实现。标记效率应超过98%。
- 结合SILAC蛋白质组和验证。
- 培育并根据制造商在适当的SILAC介质中的指令扩展选定的细胞系。裂解如步骤2.1中所述液体肿瘤或如在步骤3.2中所述实体瘤和确定每个细胞裂解物的蛋白质浓度的细胞。
- 混合各细胞系的等摩尔量的蛋白质和划分成混合物等分试样。卡扣冻结的等份并储存在-80℃直到测定。对于一个实验,你需要20 - 的超级SILAC标准的50微克。小心准备斯坦应避免准过量作为内的一系列实验改变标准。
4.测量蛋白质浓度和穗的
- 液体肿瘤。
- 使用蛋白定量测定确定相应蜂窝裂解物和超SILAC标准的蛋白浓度。
- 混合清零蜂窝裂解物和超SILAC标准等量并随后添加十二烷基硫酸锂(LDS)缓冲液(样品体积的25%)和还原剂(样品体积的10%)。
- 加热中的加热块将所得溶液在72℃下进行10分钟。可选,存储所产生的变性蛋白在-80℃。
- 实体肿瘤。
- 用于在板读数器蛋白浓度测定,混合标准牛血清白蛋白(BSA)稀释溶液系列,溶胞产物和合适的超级SILAC标准用市售的蛋白质的SSAY在96孔板中,并振摇1分钟,孵育指定的时间,并测量吸光度由生产所指示的。
注意:高浓度的SDS和二硫苏糖醇(DTT)中的溶胞产物是用于蛋白质浓度测定。多数可以检测的问题。 - 混合澄清裂解物,并在20℃下的超SILAC标准用200μl尿素在滤波器单元和离心机以14000×g离心30分钟,等量。不要使用超过50微升澄清裂解物,并在超级SILAC标准。避免温度低于15℃时,使尿素不结晶出来。
- 用于在板读数器蛋白浓度测定,混合标准牛血清白蛋白(BSA)稀释溶液系列,溶胞产物和合适的超级SILAC标准用市售的蛋白质的SSAY在96孔板中,并振摇1分钟,孵育指定的时间,并测量吸光度由生产所指示的。
5.样品分离和蛋白质精华
- 液体肿瘤。
- 分离30 - 每车道100微克的总蛋白上的4 - 12%梯度SDS-PAGE凝胶。染色的蛋白质与考马斯亮蓝O / N。由两个连续洗涤水去除多余的考马斯亮蓝染色。
- 从凝胶中切每条泳道和把它成不论凝胶染色的图案23个大小相等的片。分别处理凝胶切片,每一个在0.6毫升聚丙烯小瓶中。
- 用水和甲醇/水(50:50,V / V),通过在56℃温育30分钟减少用10mM DTT的洗涤凝胶切片。在60分钟的暗孵化室温烷基化凝胶片,用55毫米碘乙酰胺(IAA)。
- 样品处理步骤之间,洗涤切片,用乙腈15分钟,并干燥在 SpeedVac中以除去过量的溶剂和提高的试剂溶液的摄取。
- 通过在37℃下再水化干燥的凝胶片,用猪胰蛋白酶溶液(12.5毫微克/微升的0.025M的碳酸氢铵水溶液)的最小量为16小时进行蛋白酶切割。
- 加10微升水凝胶切片孵育15分钟,在37℃。添加80μl的乙腈,并培育15分钟,在37℃。离心机以15800×g离心,1分钟。收集上清并储存在一个单独的0.6毫升管。
- 加入65微升的5%的甲酸溶液,涡旋并温育15分钟,在37℃。添加65微升乙腈孵育15分钟,在37℃。离心15800 XG 1分钟。收集上清液,并将其从以前的步骤添加到上清液。蒸发该合并的上清液至干,在真空浓缩。
- 实体肿瘤。
- 从组织裂解除去SDS使用下面FASP协议,也被描述为在参考15。
- 在步骤5.2.3中描述的第一次离心后在20℃下添加另外的200微升8M尿素在过滤器上,并进一步离心以14000×g离心20分钟。丢弃流过滤液。
- 添加100微升IAA和混合在一恒温以600rpm持续1分钟。在黑暗中孵育滤波器20分钟在20℃。离心过滤器以14000×g离心,在20℃10分钟。
- 加入100微升的尿素到过滤器和岑trifuge在14000×g离心,15分钟,在20℃。重复此步骤一次。
- 加入100微升的NH 4 HCO 3的过滤器和离心机在14,000rpm离心10分钟,在20℃。重复此步骤两次。
- 添加40微升的NH 4 HCO 3 + 1微升(= 0.4微克)胰蛋白酶并混合在恒温在20℃下以600rpm,1分钟。孵育滤波器O / N在湿润室中于37℃。传输过滤器新的收集管。
- 离心过滤器以14000×g离心,在20℃10分钟。添加50微升的NH 4 HCO 3和离心机的过滤器在14,000rpm离心10分钟,在20℃。存储所得到的肽在-20℃直到质谱测量。
- 肽浓度测量,分配50μl的所得流通等一系列整齐色氨酸适当稀释成96孔板。测量色氨酸荧光。转换所产生的浓度色氨酸中的肽浓度,如0.1色氨酸微克相当于9微克蛋白质。
6.液相色谱和质谱分析
- 再溶解的肽中的30μl上样缓冲液进行5分钟的超声处理浴中。在离心机降速在15800×g离心1分钟,并吸取澄清的溶液到MS自动进样瓶中。
- 注射5μl的每次分析样品的使用nanoLC-MS / MS系统的自动进样器。在C18预柱(0.15 mm内径×20毫米,5微米孔径C18材料)安装在任何一个通风列设置或预柱开关设置反相集中精力,淡化肽在线。
- 在反相C18微单独的肽(0.075毫米内径×200毫米自行填充有3微米或更小的孔尺寸的C18材料以自包纳流柱如PicoFrit,用5> 35%乙腈的90分钟梯度VS 0.1%甲酸水溶液以300标升/分钟。转移到洗脱通过纳米喷雾离子源的混合四极杆/轨道阱质谱仪。
- 分析使用TOP15数据依赖采集方法(MS m / z范围350肽- 1600,目标分辨率70.000 FWHM,AGC目标1×10 6,最大填充时间60毫秒MS / MS开始大量100,分辨率标17.500 FWHM,AGC针对2×10 5个,最大填充时间60毫秒的MS / MS阈3×10 4个,包括充电状态的2 - 5中,归一化碰撞能量NCE 25%,动态排阻15秒)。
7.数据分析
- 数据分析使用免费提供的MaxQuant 16软件。为生物信息学数据分析的详细协议16,17描述。为了便于分析,结合从一个SDS-PAGE车道所有片原始数据文件到一个单一的实验17。
结果
液体和固体肿瘤的患者蛋白质组分析是一种很有前途的方法为新的诊断和预测生物标志物的发现。然而,该样品制备过程和质谱分析是具有挑战性的,由于样品的复杂性,并需要精确蛋白质定量在大组样品。以上所述的实验程序开始,所关注的细胞的分离,或者通过荧光激活细胞分选或通过激光捕获显微切割。
为了这个目的,从患者来源的骨髓抽吸物或血液样品细胞用针对感兴趣之前基于FACS的排序和细胞裂解限定的表面标记物的荧光标记抗体。
充实从组织切片的细胞亚群,这些先有要安装在适当的滑动,以允许激光捕获显微切割。为此目的装入吨他适当的膜载玻片的组织切片,并使用激光捕获microdissector根据制造商的说明。选择地区和感兴趣的细胞大约需要健康组织和肿瘤组织的组织形态学相应的知识。然后将提取的细胞被转移到一个适当的收集管。最初的实验中应当以限定所需的提取足够量的蛋白质(最小10微克总蛋白)对于每个感兴趣的新的组织的组织的量来进行。每个显微样品溶液用60微升组织裂解缓冲液。为有效的裂解,从组织样品的细胞必须被超声处理3分钟,并加入15微升的SDS样品后孵育在恒温在99℃1小时,除去福尔马林诱导的蛋白质交联。离心将最终有助于清除细胞裂解物的集合。
对于我每一种疾病nterest(液体和固体肿瘤)的合适超SILAC定量标准必须建立14。适当的标准应该代表超过90%的表示感兴趣的样品中的蛋白质。用于制剂的定量标准,与所关注的癌症类型的细胞系应当首先通过质谱法进行分析,以确定它们的蛋白质表达谱,并随后主成分分析应该执行。 4 - 6个不同的细胞系差异蛋白表达模式应选择和SILAC标记与"重"精氨酸和赖氨酸。标记效率应由nanoLC-MS / MS进行检查,并应大于98%。之后,细胞系应当裂解以同样的方式作为各患者来源的样品,且随后,每个样品和SILAC尖峰在标准的等摩尔蛋白量应混合。对临床标本Ø准确蛋白定量的一个关键一步˚F兴趣是源自患者的样品和SILAC尖峰在定量标准的等摩尔蛋白量的精确混合物。为了确定从分选的细胞衍生的裂解物的蛋白质浓度,各种蛋白质定量测定法都可以使用。为从组织来源的细胞的细胞裂解物的测定是必要的,可与在裂解液的高浓度的SDS和DTT的处理。源自患者的样品和SILAC尖峰在标准的蛋白浓度应在每次测量前,组合与相应的临床样品中,以确保正确的混合物,它是在使甚至数百个样品可比的关键。
的分离的尖峰在从液体肿瘤的LDS混合,在恒温下加热得到的在72℃下进行10分钟,并随后进行到1D-PAGE标准和裂解物,将样品与凝胶内消化的等量的混合物后蛋白质与胰蛋白酶。从获得的样本组织通过使用FASP方法通过的Wisniewski 等人确立摆脱SDS和用胰蛋白酶消化。15
得到的胰蛋白酶肽可以通过测量色氨酸荧光,这对于组织样品特别感兴趣,因为从过滤释放肽的量相比,最初装载到过滤器中的蛋白质的量的15%和75%之间的不同来量化。为了这个目的,我们测量色氨酸的荧光。用合适的色氨酸稀释系列的比较允许对肽的定量,如1.1色氨酸微克大约相当于肽100微克。如果需要的话,特别是从FASP处理衍生的样品可以在装载到nanoLC / MS / MS系统18之前,反相-C18(RP-C 18)的材料填充商用或自制阶段提示预纯化。
在一个高执行质谱仪分析- 分辨率,高灵敏度的质谱系统。总之,肽样品脱盐,预浓缩上的RP-C 18柱前,并分离上直接耦合到质谱仪的RP-C 18分析柱。以实现分析的足够的深度,我们采用的SDS-PAGE蛋白质预分馏或者与40分钟RP-C 18梯度(用于液体肿瘤)或单次注射长2的组合 - 3小时RP-C 18梯度(用于通过FASP处理实体肿瘤)。 MS谱是在70,000 FWHM或更高的分辨率收购,允许SILAC对准确定量通过集成的色谱峰轮廓。用于蛋白质鉴定,一个TOP15数据依赖采集方法用于产生大量的肽的MS / MS谱的肽和蛋白质的鉴定。
从得到的原始数据,蛋白质鉴定和定量是通过数据库针对的UniProt Knowledgebas MaxQuant软件实现搜索Ë人类蛋白质组全序列数据库17。在MaxQuant软件(当前版本1.5.0.25)肽是从所获取的MS / MS谱图确定肽片段匹配对光谱从蛋白质序列数据库来自在硅片 。与此同时,前体离子的同位素分布,提取围绕它们的色谱保留时间,以及它们的积分的峰面积用于光的相对定量:通过SILAC标记产生沉重的肽对。肽的身份和相对强度然后被分配到相应的蛋白质的特性。修斯软件(当前版本1.5.0.15)然后被用于执行的MaxQuant处理结果更下游的统计评估,包括样品到样品的比较,PCA和层次聚类。
使用的实验装置描述我们已经确定并定量达8000蛋白质从少至总蛋白的30微克源自液体肿瘤。
高达2500蛋白质从固 - 肿瘤样品可以识别并定量结合的仅2小时的LC梯度猎枪蛋白组学方法,允许在相对较短的时间数百临床样品的分析。
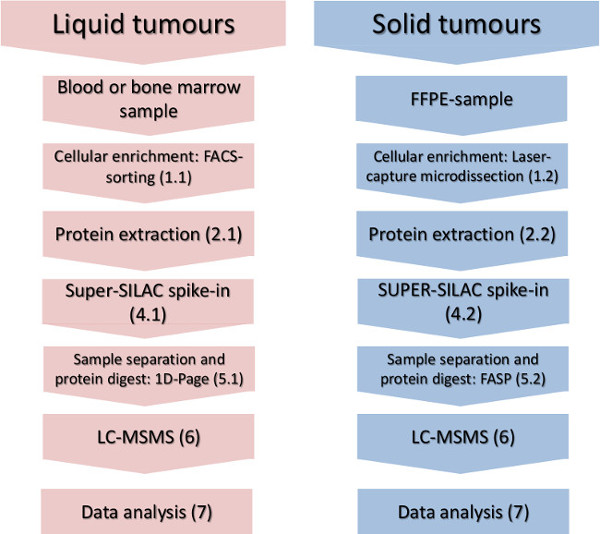
图1.实验的工作流程。细胞子集浓缩,蛋白质分离的主要步骤,秒杀式的量化标准和质谱仪分析显示液体和固体肿瘤。 请点击此处查看该图的放大版本。
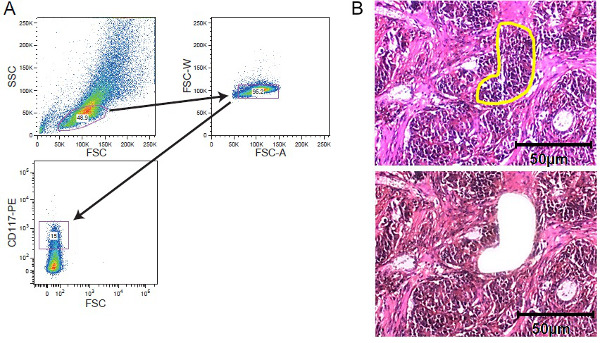
图2.细胞富集战略性ES,FACS排序和LCM。 (A)典型的门控策略,描绘了门控由一个细胞分选仪获得了CD117染白血病细胞群。固体肿瘤组织(B)激光捕获显微切割。 5组织切片 - 10微米的厚度被安装在染色前膜覆盖膜的幻灯片。利益的地区是手动选择激光捕获显微切割。显示的是部分之前显微切割与感兴趣的区域标记为黄色和显微切割后。 50微米比例尺包括在数字。 请点击此处查看该图的放大版本。
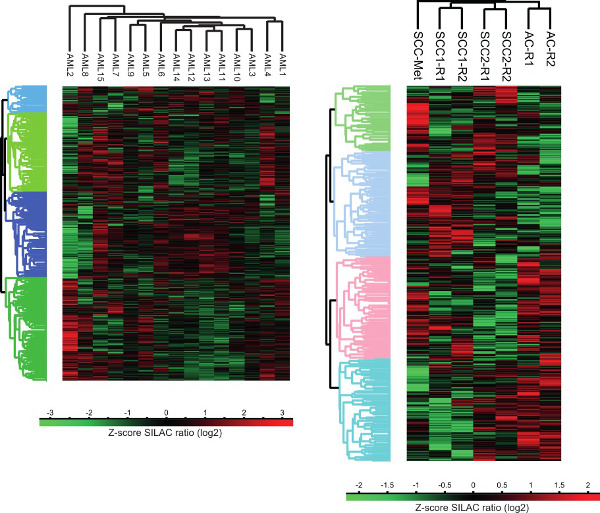
人类肿瘤细胞蛋白质组图3.聚类分析。PR的无监督聚类分析液体和固体肿瘤otein表达谱是使用计算平台修斯执行。 AC - 腺癌,鳞状细胞癌 - 鳞状细胞癌,SCC-Met的 - 技术的复制 - 从头部和颈部癌症,R鳞状细胞癌转移。
讨论
的患者来源的癌症细胞的蛋白质组质谱分析已需要新的诊断/预测的生物标记物的发现以及以得到更好的理解癌症细胞生物学的,这可能又导致的新的潜在的药物靶点的鉴定。然而,这样的质谱分析是极具挑战性的,特别是因为不同的预分析的问题必须解决,如果一个是获得坚固的生物学相关的结果。
此处所述的实验工作流允许从液体和固体肿瘤的细胞亚群衍生蛋白质组的定量蛋白质组表征。肿瘤细胞通过任一基于FACS的细胞sortingor显微切割的初始富集是需要避免污染由肿瘤微环境的细胞。此外,这些技术允许一个隔离感兴趣的细胞亚群。最近的细胞生物学研究有妖strated某些蜂窝亚群具有肿瘤起始特性,因而用于癌症发病19,20高度相关。作为质谱变得更加敏感,近年来,定量蛋白质组学分析是对于可以从几千细胞衍生的少量蛋白是可行的,从而有可能集中于功能性相关的细胞群。
该组向上这里介绍可用于识别和确认新的诊断生物标记FFPE样品中。因此,它有望BEA有用的工具,用于临床诊断的改进,至今仍有缺乏足够数量和质量的分子标志物的许多癌症类型。的困难的鉴别诊断,为此,生物标志物缺乏重要的例子,是从转移在肺,胰内胆管细胞癌和胰腺癌原发性肺癌之间的鉴别,以及不同entiation从高度恶性外周神经鞘瘤良性的神经纤维瘤。此外,我们和其他人已经表明,蛋白质组签名定量澄清可以在研究癌症细胞生物学在一般情况下,并揭示在癌症患者21的治疗响应的预测性生物标志物是有用的。
这里介绍的方法的两个电流的缺点是要求大量的人工检测体处理和nanoLC-MS / MS的采集时间的需求。而前者可通过移动样品制备向如 96孔格式,并使用机器人处理加以处理,后者需要在质谱采集策略的改变。一旦靶蛋白的亚群的已确定可与例如肿瘤分类相关联,我们设想提供定量的读数为这些子集带大大减少分离努力靶向质谱方法的设计,并且因此具有相应减少采集时间。如果需要的话,可以从24减少所需的采集时间- 36小时(液体肿瘤)或3小时(实体瘤),以例如,1小时采用针对性的质谱和肽的一个简单的一维分离,然后将所得的增益中的吞吐量可用于提高检测生物和技术重复显著号,并提供相应的改进定量结果的意义。靶向质谱方法已经被证明是一个合适的工具的与癌症相关的蛋白生物标志物候选22的验证,并已发展到它们显示出许进行验证或甚至作为用于常规临床应用23的潜在工具的一个点24。
披露声明
作者有没有利益冲突或其他问题不便透露。
致谢
The authors thank Uwe Plessmann, Monika Raabe und Silvia Münch for technical support.
材料
| Name | Company | Catalog Number | Comments |
| 660 nm Kit | Thermo scientific | 22662 | |
| Cell culture medium depleted of arginine and lysine | Thermo Scientific | 88421 | |
| Coomassie Brilliant Blue R-250 staining solution | Bio Rad | 161-0436 | |
| Dialyzed fetal calf serum (FCS) | PAA | A15-107 | |
| Diffuser caps for microdissection | MMI | 50202 | |
| FACS-sorter | BD | FACSAria III | |
| Ionic Detergent Compatibility Reagent | Thermo scientific | 22663 | |
| Laser-capture microdissector | MMI | cell cut plus | |
| LDS buffer | Life Technologies | NP0009 | |
| Membrane slides for microdissection | MMI | 50103 | |
| Microcon YM-30 | Millipore | MRCF0R030 | |
| NuPAGE 4-12% Bis-Tris Mini Gels | Life Technologies | NP0335PK2 | |
| Picofrit Self-Pack Columns | New Objective | PF360-75-15-N-5 | Mass Spectrometry Column/Emitter |
| Reducing agent | Life Technologies | NP0007 | |
| Reprosil-Pur LC/MS/MS Column stationary phase | Dr. Maisch | 120 C18-AQ, 3 µm | |
| Reprosil-Pur LC/MS/MS Precolumn stationary phase | Dr. Maisch | 120 C18-AQ, 5 µm | |
| SILAC-labeled arginine | Eurisotop | CLM-2265-H-0.1 | |
| SILAC-labeled lysine | Eurisotop | DLM-2640-0.25 | |
| Trypsin, NB Sequencing Grade | Serva | 3728301 | for in-gel digests |
| Trypsin, Sequencing Grade | Promega | V5111 | for in-solution digests |
| Buffer and solutions | |||
| Cell lysis buffer: 150 mM NaCl, 50 mM Tris/HCl pH 7.8, 5 mM NaF, 0.5% NP40, 0.1% laurylmaltoside, Roche complete protease inhibitor, 1 mM Na3VO4 | |||
| Tissue lysis buffer: 100 mM Tris/HCl pH 7.8, 0.1 M DTT | |||
| Urea: 8 M urea in 0.1 M Tris-HCl, pH 8.5 | for FASP-protocoll | ||
| IAA: 0.05 M iodoacetamide, 8 M urea, 0.1 M Tris-HCl, pH 8.5 | for FASP-protocoll | ||
| 0.05 M NH4HCO3 | |||
| 10 mM dithiothreitol (DTT) in 0.1 M ammonium bicarbonate | for in-gel digest | ||
| 55 mM iodoacetamide (IAA) in 0.1 mM ammonium bicarbonate | for in-gel digest | ||
| 5% aqueous formic acid. |
参考文献
- Walther, T. C., Mann, M. Mass spectrometry-based proteomics in cell biology. J Cell Biol. 190 (4), 491-500 (2010).
- Lenz, C., Urlaub, H. Separation methodology to improve proteome coverage depth. Expert Rev Proteomics. 11 (4), 409-414 (2014).
- Olsen, J. V., Mann, M. Status of large-scale analysis of post-translational modifications by mass spectrometry. Mol Cell Proteomics. 12 (12), 3444-3452 (2013).
- Ong, S. E., et al. Stable isotope labeling by amino acids in cell culture, SILAC, as a simple and accurate approach to expression proteomics. Mol Cell Proteomics. 1 (5), 376-386 (2002).
- Jimenez, C. R., Verheul, H. M. Mass spectrometry-based proteomics: from cancer biology to protein biomarkers, drug targets, and clinical applications. Am Soc Clin Oncol Educ Book. , e504-e510 (2014).
- Tang, D. G. Understanding cancer stem cell heterogeneity and plasticity. Cell Res. 22 (3), 457-472 (2012).
- Evans, C., et al. An insight into iTRAQ: where do we stand now. Anal Bioanal Chem. 404 (4), 1011-1027 (2012).
- Ostasiewicz, P., Zielinska, D. F., Mann, M., Wisniewski, J. R. Proteome, phosphoproteome, and N-glycoproteome are quantitatively preserved in formalin-fixed paraffin-embedded tissue and analyzable by high-resolution mass spectrometry. J Proteome Res. 9 (7), 3688-3700 (2010).
- Malmström, J., Picotti, P., Aebersold, R. Perspectives of targeted mass spectrometry for protein biomarker verification. Curr Opin Chem Biol. 13 (5-6), 518-525 (2009).
- Gillet, L. C., et al. Targeted data extraction of the MS/MS spectra generated by data-independent acquisition: a new concept for consistent and accurate proteome analysis. Mol Cell Proteomics. 11 (6), (2012).
- Basu, S., Campbell, H. M., Dittel, B. N., Ray, A. Purification of specific cell population by fluorescence activated cell sorting (FACS). J Vis Exp. 41, (2010).
- Edwards, R. A. Laser capture microdissection of mammalian tissue. J Vis Exp. 8, 309 (2007).
- Liu, N. Q., et al. Proteomics pipeline for biomarker discovery of laser capture microdissected breast cancer tissue. J Mammary Gland Biol Neoplasia. 17 (2), 155-164 (2012).
- Geiger, T., et al. Use of stable isotope labeling by amino acids in cell culture as a spike-in standard in quantitative proteomics. Nat Protoc. 6 (2), 147-157 (2011).
- Wisniewski, J. R. Proteomic sample preparation from formalin fixed and paraffin embedded tissue. J Vis Exp. (79), (2013).
- Cox, J., Mann, M. MaxQuant enables high peptide identification rates, individualized p.p.b.-range mass accuracies and proteome-wide protein quantification. Nat Biotechnol. 26 (12), 1367-1372 (2008).
- Cox, J., et al. A practical guide to the MaxQuant computational platform for SILAC-based quantitative proteomics. Nat Protoc. 4 (5), 698-705 (2009).
- Rappsilber, J., Mann, M., Ishihama, Y. Protocol for micro-purification, enrichment, pre-fractionation and storage of peptides for proteomics using StageTips. Nat Protoc. 2 (8), 1896-1906 (2007).
- Sarvi, S., et al. CD133+ cancer stem-like cells in small cell lung cancer are highly tumorigenic and chemoresistant but sensitive to a novel neuropeptide antagonist. Cancer Res. 74 (5), 1554-1565 (2014).
- Shlush, L. I., et al. Identification of pre-leukaemic haematopoietic stem cells in acute leukaemia. Nature. 506 (7488), 328-333 (2014).
- Schaab, C., et al. Global phosphoproteome analysis of human bone marrow reveals predictive phosphorylation markers for the treatment of acute myeloid leukemia with quizartinib. Leukemia. 28 (3), 716-719 (2014).
- Hüttenhain, R., et al. Reproducible quantification of cancer-associated proteins in body fluids using targeted proteomics. Sci Transl Med. 4 (142), 142ra94 (2012).
- Burgess, M. W., et al. Simplified and efficient quantification of low-abundance proteins at very high multiplex via targeted mass spectrometry. Mol Cell Proteomics. 13 (4), 1137-1149 (2014).
- Boja, E. S., et al. Analytical Validation Considerations of Multiplex Mass Spectrometry-based Proteomic Platforms for Measuring Protein Biomarkers. J Proteome Res. , (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。