A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
توليف بولي (
In This Article
Summary
We present a protocol to synthesize Janus microhydrogels composed entirely of the same base material, poly(N-isopropylacrylamide) (PNIPAAm), with a clearly compartmentalized structure base on the phase separation of a supersaturated NIPAAm monomer solution. The synthesized Janus microhydrogels show unique properties such as anisotropic thermo-responsiveness and organophilic/hydrophilic loading capability.
Abstract
Janus microparticles are compartmentalized particles with differing molecular structures and/or functionality on each of their two sides. Because of this unique property, Janus microparticles have been recognized as a new class of materials, thereby attracting a great deal of attention from various research fields. The versatility of these microparticles has been exemplified through their uses as building blocks for self-assembly, electrically responsive actuators, emulsifiers for painting and cosmetics, and carriers for drug delivery. This study introduces a detailed protocol that explicitly describes a synthetic method for designing novel Janus microhydrogels composed of a single base material, poly(N-isopropylacrylamide) (PNIPAAm). Janus microdroplets are firstly generated via a hydrodynamic focusing microfluidic device (HFMD) based on the separation of a supersaturated aqueous NIPAAm monomer solution and subsequently polymerized through exposure to UV irradiation. The resulting Janus microhydrogels were found to be entirely composed of the same base material, featured an easily identifiable compartmentalized morphology, and exhibited anisotropic thermo-responsiveness and organophilic/hydrophilic loading capability. We believe that the proposed method introduces a novel hydrogel platform with the potential for advanced synthesis of multi-functional Janus microhydrogels.
Introduction
Hydrogels are a network of hydrophilic polymer chains.1 An increasing amount of research in the field of hydrogels has promoted significant advances and revealed their similarity to biological tissues; the properties of hydrogels allow the uptake of large amounts of water while maintaining their structure. Environmentally responsive hydrogels have also been studied extensively because of their ability to swell or shrink reversibly in response to external stimuli.2 Several triggers, including temperature,3-5 pH,6,7 light,8,9 electric fields,10,11 and specific molecules, such as glucose,12,13 have been suggested to control the geometric shape of hydrogels. Among the many environmentally responsive hydrogels currently available, poly(N-isopropylacrylamide) (PNIPAAm), a well-known thermo-responsive hydrogel, exhibits volume shrinkage above a low critical solution temperature (LCST) of 32 °C.14 A recent study by Sasaki et al.15 reported the intriguing liquid-liquid phase separation of supersaturated NIPAAm, which is the monomer of PNIPAAm. According to this report, supersaturated NIPAAm was dissolved with a 10-fold molar excess of H2O, and soon after, the solution separated into two liquid phases when allows to stand at a temperature above 25 °C; by contrast, dilute NIPAAm was dissolved homogeneously under the same conditions.
Microparticles made of environmentally responsive hydrogels are fascinating candidates for application in drug delivery,16,17 catalysis,18 sensing,19,20 and photonics.21 Traditional synthetic methods including emulsion polymerization, are used to produce hydrogel microparticles with polydispersity.22,23 However, certain applications require microparticles with a narrow size distribution, for example, to stabilize the pharmacokinetics of drug delivery.24 Irregularly shaped or polydisperse embolic microparticles aggregate proximally into clusters, leading to chronic inflammatory responses in embolic particles for cancer therapeutic treatment.25,26
The microfluidic approach is at the forefront of research as a means of fabricating micro-sized particles with narrow size distributions and complex shapes.27-31 The advantages of fabricating microparticles in the microfluidic device are predicated by the small characteristic length of the microfluidic device, which results in a low Reynolds number. In contrast to traditional bulk emulsification where drops are formed in parallel, microdroplets produced in microfluidic devices are generated in series and subsequently polymerized into microparticles upon exposure to UV irradiation. The fundamental principle of droplet formation using a microfluidic device is balance between the interfacial tension and the shear force of the sheath fluid acting on the core fluid.
Despite the obvious advantages of microfluidic fabrication of droplets/particles, Janus droplets/particles consisting of the same base material are rarely reported because the internal morphology of these droplets/particles is generally disturbed by the diffusion and perturbation of the core fluids. To circumvent this intrinsic limitation, two groups recently reported the preparation of the Janus microparticles by employing heat-induced phase separation of colloidal nanoparticles and UV-directed phase separation.32,33
To this end, we report a microfluidic approach to synthesize Janus microhydrogels entirely composed of a single base material and obtain a product with clearly compartmentalized morphology. Our approach is based on the primary concept of liquid-liquid phase separation of supersaturated NIPAAm monomer. The resulting Janus microhydrogels were found to possess unique properties including anisotropic thermo-responsiveness and organophilic/hydrophilic loading capability.
Protocol
1. تصنيع القالب الرئيسي للهيدرودينامي التركيز جهاز ميكروفلويديك (الحمى الثلاثية) من خلال الطباعة التصويرية
- تصميم الضوئية الرئيسية لمرض الحمى الثلاثية (الشكل 1A) باستخدام تصميم (CAD) والبرمجيات بمساعدة الحاسوب وفقا لبروتوكول الشركة المصنعة.
- شطف رقاقة 4 "السيليكون مع الأسيتون، ايزوبروبيل (IPA)، والماء منزوع الأيونات (DI) لإزالة الغبار العضوي وغير العضوي من الرقاقة.
- تنظيف رقاقة السيليكون مع O 2 البلازما في 100 واط من الطاقة لمدة 5 دقائق لزيادة قوة الترابط بين رقاقة وSU-8.
- تدور معطف 4 مل من مقاومة للضوء سلبي، SU-8 2150، على الرقاقة عند 3000 دورة في الدقيقة لمدة 30 ثانية لتحقيق سمك 150 ميكرون (B1 في الشكل 1B).
- ضع SU-8 المغلفة رقاقة على موقد لمدة 5 دقائق عند 65 درجة مئوية، ضبط درجة الحرارة إلى 95 درجة مئوية، ثم ترك الرقاقة على موقد لمدة 30 دقيقة لخبز لينة.
- ضع التصميم الضوئية الرئيسية على رقاقة وفضح لضوء الأشعة فوق البنفسجية (260 ميغا جول سم -2، 26 ثانية لمدة 10 ميغاواط سم -2) في اليجنر قناع (B2 في الشكل 1B).
- أداء بعد التعرض الخبز على موقد (65 درجة مئوية لمدة 5 دقائق ثم 95 درجة مئوية لمدة 12 دقيقة).
- تطوير رقاقة عن طريق الغمر في حمام المطور SU-8 لمدة 10 دقيقة، ومن ثم نقلها إلى مطور جديد لمدة 5 ثوان للحصول على سطح نظيف.
- شطف الرقاقة لمدة 20 ثانية بالماء DI وتجف لمدة 10 ثانية مع الغاز N 2 (B3 في الشكل 1B). استخدام رقاقة ملفقة بمثابة القالب الرئيسي للثنائي ميثيل بولي سيلوكسان (PDMS) صب في القسم 2.
2. تلفيق من مرض الحمى الثلاثية من خلال PDMS الصب
- استخدام الرقاقة نمط الحصول عليها في القسم (1)، القالب الرئيسي للPDMS الصب.
- خلط PDMS قبل البوليمر وكيل علاج متجانس في نسبة وزن 10: 1؛ على سبيل المثال، استخدم 1 غرام من وكيل علاج لمدة 10 غراما من PDMS قبل polymإيه.
- صب PDMS قبل البوليمر في القالب الرئيسي وديغا لمدة 1 ساعة في فراغ الغرفة (B4 في الشكل 1B).
- وضع القالب الرئيسي مع PDMS قبل البوليمر في الفرن على 65 درجة مئوية لمدة 3 ساعات.
- قطع PDMS الشفاء في حجم شريحة واحدة باستخدام مشرط حاد. تقشر بعناية النسخة المتماثلة PDMS شفي من القالب الرئيسي باليد.
- كرر الخطوات من 2،2-2،5 للحصول على PDMS متماثلة متطابقة.
- لكمة مدخل ومخرج الثقوب في واحدة من النسخ المتماثلة باستخدام ثقب الناخس التي يبلغ قطرها أصغر قليلا من القطر الخارجي للأنابيب التوصيل.
- تطبيق العلاج البلازما الجوية لمنطقة الترابط من كل نسخة متماثلة باستخدام المفاوض كورونا 34
تحذير: استخدام المفاوض كورونا في منطقة ذات تهوية جيدة لتجنب تراكم طبقة الأوزون. - قطرة 5 ميكرولتر من الميثانول على المناطق المعالجة البلازما الجوية. ناعما محاذاة اثنين متطابقة PDMS النماذج المقلده، لافتعال الحمى الثلاثية manipu اليد lation، وتحقق المواءمة عبر المجهر (B5 في الشكل 1B).
ملاحظة: المعالجة البلازما النسخ المتماثلة PDMS الهواء هي لزجة وصعبة للتلاعب إلى حد ما. وبالتالي، يتم إضافة 5 ميكرولتر من الميثانول إلى السطح المعالجة البلازما الجوية لتكون بمثابة مواد التشحيم. - وضع مرض الحمى الثلاثية في فرن مجموعة إلى 65 درجة مئوية خلال الليل لتعزيز الروابط بين اثنين PDMS النسخ المتماثلة (B6 في الشكل 1B). السندات اثنين متطابقة PDMS النماذج المقلده، لتزيد من ارتفاع متناهية من مرض الحمى الثلاثية وتجنب انسداد microdroplets في قناة ميكروفلويديك خلال العملية.
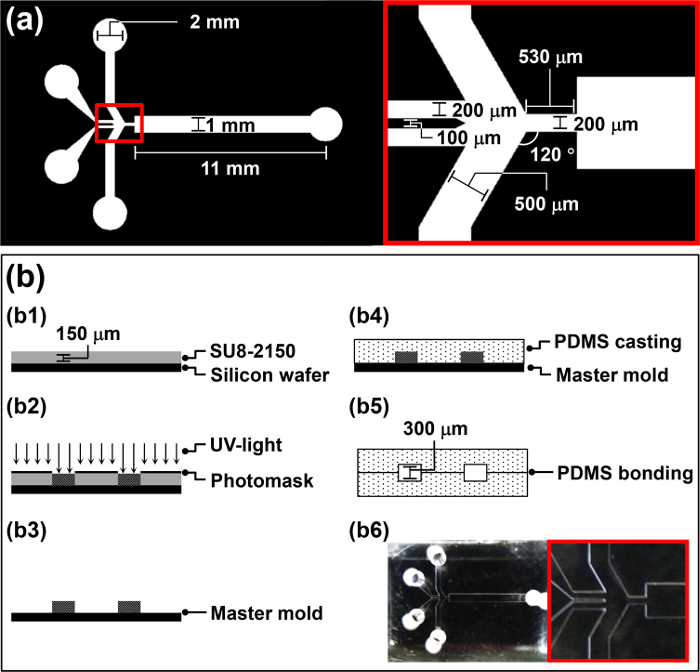
الشكل 1: نظرة عامة على الإجراءات مرض الحمى الثلاثية التصنيع (أ) المعلمات تصميم الضوئية الرئيسية لمرض الحمى الثلاثية. (ب) رسم توضيحي لإجراء تلفيق لمرض الحمى الثلاثية.ftp_upload / 52813 / 52813fig1large.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
3. إعداد NIPAAm الغنية (N الغنية) وNIPAAm الفقراء (N-الفقراء) مراحل من فصل المرحلة من الفوق NIPAAm
- حل مونومر NIPAAm في الماء DI في فصيل عبد الواحد / ث نسبة 1: 1 باستخدام خلاط دوامة. على سبيل المثال، حل 10 غرام من NIPAAm في 10 مل من الماء DI (الصورة الأولى من الشكل 2A).
ملاحظة: بمجرد حل مونومر NIPAAm بالكامل في درجة حرارة الغرفة، والحل يبدو عكر (الصورة الثانية من الشكل 2A). هذه الظاهرة هي جديلة أول حدث أن فصل المرحلة التي يسببها ذوبان مونومر NIPAAm التشبع بنجاح. - السماح للحل مونومر للراحة في وضع عمودي في درجة حرارة الغرفة لمدة 15 دقيقة على الأقل. المرحلة الأولى هي مرحلة N-الغنية، ومرحلة أكثر كثافة أسفل هي مرحلة N-الفقيرة (الصورة الثالثة من الشكل 2A). كثافة من المراحل ه N-الأغنياء والفقراء N هي 0.93 ± 0.01 و 0.99 ± 0.01 جم سم -3 على التوالي. 15
- عندما تصبح واجهة الفصل بين المرحلتين واضحة، واستخراج بعناية 2 مل من محلول مركب بسيط من المراحل N-الغنية والفقيرة N-دون إزعاج هذه الواجهة باستخدام ماصة.
- إضافة 4 ملغ من N، N '-methylenebisacrylamide (MBAAm) باعتباره crosslinker و 4 ملغ من 4- (2-hydroxyethoxy) فينيل (2-هيدروكسي-2-ن) كيتون باعتباره photoinitiator لاستخراج N-الأغنياء وN -poor حلول مونومر لإعداد السوائل الأساسية 1 و 2 للتركيز crosslinker منخفضة (2 ملغ مل -1) عينة (B1 و B2 في الشكل 2B).
- كرر الخطوة السابقة 3.3 وإضافة 80 ملغ من MBAAm و 4 ملغ من 4- (2-hydroxyethoxy) فينيل (2-هيدروكسي-2-ن) كيتون في كل من استخراج الحل N-غني وفقير N-مونومر لإعداد السوائل الأساسية 1 و 2 للتركيز عال crosslinker (40 ملغ مل -1) عينة (B3 و B4 في الشكللدى عودتهم 2B).
- حل 10٪ بالوزن السطحي النفط في الزيوت المعدنية لتحضير السائل غمد (B5 في الشكل 2B).
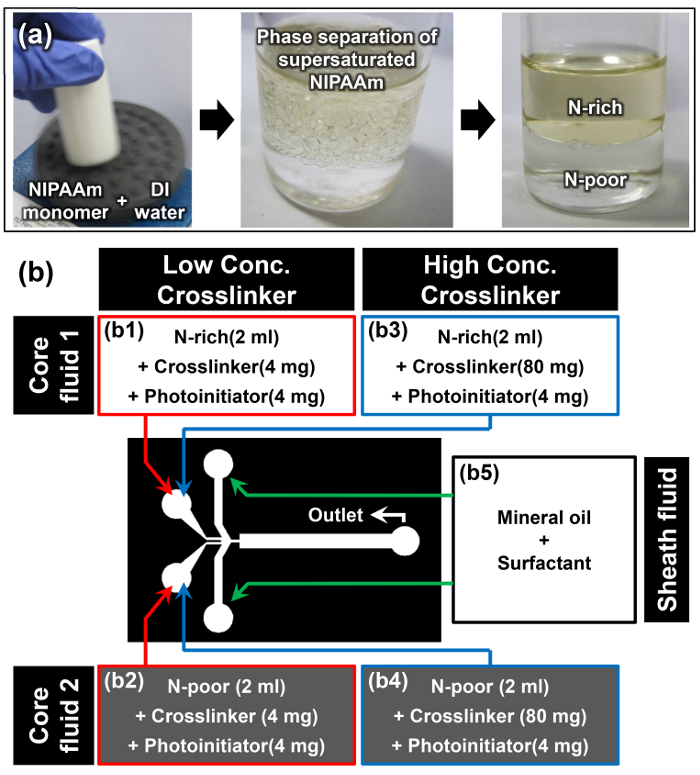
الشكل 2: إعداد مواد لليانوس Microhydrogel التجميعي (أ) إعداد حلول مونومر N-الغنية وN-الفقيرة من خلال فصل مرحلة NIPAAm الفوق. (ب) تفاصيل عن المواد والإعداد التجريبية المستخدمة في البروتوكول. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
4. توليف يانوس Microhydrogels باستخدام الحمى الثلاثية
- تحميل 2 مل من السوائل الأساسية 1 و 2 (B1، B2 B3 أو B4 في اللوحة 2B) والسائل غمد (B5 في الشكل 2B) إلى ثلاثة منفصلة 3 مل الحقن.
- جبل الحقن في مضخات المحاقن وربط كل حقنة لمدخل السوائل المناسب للمرض الحمى الثلاثية باستخدام أنابيب (الشكل (ب). استخدام أنابيب لتوصيل منفذ السوائل من مرض الحمى الثلاثية إلى خزان التجميع.
- تعيين مضخات حقنة ويبث السوائل الأساسية 1 و 2 و السائل غمد في معدلات تدفق من 2، 2، و 10 ميكرولتر دقيقة -1، على التوالي.
- (اختياري) اللحن معدل تدفق السوائل الأساسية 1 و 2 لضبط نسب حجم النسبية لكل جانب من microdroplet يانوس.
- وضع مصدر ضوء الأشعة فوق البنفسجية عموديا حوالي 1 سم بعيدا عن خزان جمع. التبديل على مصدر ضوء الأشعة فوق البنفسجية ومراقبة بصريا الإنتاج المستمر من microhydrogels يانوس.
تحذير: استخدام الأشعة فوق البنفسجية واقية نظارات واقية عند رصد إنتاج microhydrogel. - جمع microhydrogels يانوس ملفقة في أنبوب مخروطي الشكل وغسلها باستخدام IPA. ثم، الطرد المركزي أنبوب مخروطي (780 غ لمدة 5 دقائق) لتسويةmicrohydrogels.
- كرر الخطوة 4.6 عدة مرات لإزالة الزيوت المعدنية المحيطة microhydrogels يانوس تماما.
- كرر الخطوة 4.6 ولكن استخدام المياه DI مع السطحي للمياه من 0.005٪ (ت / ت) بدلا من IPA لإزالة بقايا IPA حول microhydrogels يانوس.
- تخزين غسلها تماما microhydrogels يانوس في 10 مل قارورة تحتوي على الماء DI.
5. تحليل متباين الخواص الحرارية استجابة يانوس Microhydrogels
- استخدام ماصة لوضع microhydrogels يانوس توليفها من القسم 4 في 24 لوحة جيدا. السماح للmicrohydrogels ليستقر لمدة 15 ثانية حتى يتم تشكيل أحادي الطبقة على السطح السفلي من البئر.
- الحصول على صورة microhydrogel يانوس في 24 درجة مئوية باستخدام المجهر الضوئي تستقيم مع عدسة موضوعية 5X.
- تعيين وحدة الحرارية تحت لوحة جيدا والتحكم في الجهد من هذه الوحدة إلى زيادة درجة حرارة محلول يحتوي على يانوس الصغيرةالهلاميات المائية إلى 32 درجة مئوية.
- الحصول على صورة microhydrogel يانوس في 32 درجة مئوية مرة أخرى باستخدام المجهر الضوئي تستقيم مع عدسة موضوعية 5X.
- كرر الخطوات من 5،2-5،4 24 مرات، مع الحرص على اختيار microhydrogel يانوس مختلفة للتحليل الإحصائي.
- من 25 صور مختلفة microhydrogels يانوس في 24 و 32 درجة مئوية، وقياس نصف قطر أجزاء PN-الغنية والفقيرة PN-من microhydrogels يانوس باستخدام برمجيات تحليل الصور وفقا لتعليمات الشركة الصانعة.
النتائج
ويعرض الشكل 3A تخطيطي من الإعداد التجريبية المستخدمة لتجميع microhydrogels يانوس عبر الحمى الثلاثية. تم حقن المراحل N-الغنية والفقيرة على وجه التحديد N-في الحمى الثلاثية بأنها السوائل الأساسية 1 و 2 و ثم اندمجوا وانقسموا الى microdroplets يانوس في فت?...
Discussion
وتستخدم اثنين من المواد الأساسية إمتزاج عموما لتجميع microhydrogels يانوس. حتى وقت قريب، كانت نادرا ما ذكرت microhydrogels يانوس مكونة من نفس المواد الأساسية وفعل microhydrogels يانوس ذكرت لا يكون التشكل الداخلي واضح بسبب الاضطرابات التي يسببها امتزاج المواد المكون. 35، 36 في هذا ال...
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
This work was supported by the National Research Foundation of Korea (NRF) grant funded by the Korea Government (MSIP (Nos. 2014R1A2A1A01006527 and 2011-0030075).
Materials
| Name | Company | Catalog Number | Comments |
| Silicon wafer | LG Siltron | 4", Test grade | Wafer for master mold fabrication |
| Acetone | Samchun Pure Chemical | A0097 | Cleaning silicon wafer |
| Isopropyl alcohol (IPA) | Daejung Chemicals & Metals | 5035-4404 | Cleaning silicon wafer |
| Water purification system | Merck Millipore | EMD Millipore RIOs Essential 5 | Prepering deionized water |
| O2 plasma machine | Femto Science | VITA-A | Cleaning silicon wafer |
| SU-8 2150 negative photoresist | MicroChem | Y111077 0500L1GL | Photoresist for master mold fabrication |
| Hot plate | Misung Scientific | HP330D, HP150D | Baking SU-8 |
| SU-8 developer | Microchem | Y020100 4000L1PE | Developing SU-8 |
| Mask aligner system for photolithograpy | Shinu Mst Co. | CA-6M | Photolithography |
| Sylgard 184 silicone elastomer kit | Dow Corning | 1064891 | PDMS casting |
| Laboratory Corona Treater | Electro-technic Products Inc. | Model BD-20AC | PDMS air plasma treatment |
| N-isopropylacrylamide (NIPAAm) | Sigma-Aldrich | 415324-50G | Monomer |
| N,N'-methylenebisacrylamide (MBAAm) | Sigma-Aldrich | 146072-100G | Crosslinker of NIPAAm |
| 4-(2-hydroxyethoxy)phenyl-(2-hydroxy-2-propyl)ketone, Irgacure 2959 | BASF | 55047962 | Photoinitiator of NIPAAm |
| ABIL EM 90 | Evonik Industries | 201109 | Sufactant for oil |
| Vortex mixer | Scientific Industries Inc. | Vortex-Genie 2 | Mixing |
| Tygon tubing | Saint-Gobain | I.D. 1/32", O.D. 3/32", Wall 1/32" | Connecting tube between syringes and HFMD |
| UV light source | Hamamatsu | Spot light source LC8 | Polymerization from NIPAAm to PNIPAAm |
| Syringes, NORM-JECT (3ml) | Henke-Sass Wolf GmbH | 22767 | Loading of materials |
| Syringe pump | KD Scientific | KDS model 200 | Perfusion of materials |
| Tegitol Type NP-10 | Sigma-Aldrich | NP10-500ML | Surfactant for water |
| Oil red O | Sigma-Aldrich | O0625-25G | Dye for N-rich phase |
| Oil Blue N | Sigma-Aldrich | 391557-5G | Dye for N-rich phase |
| Yellow food dye | Edentown F&B | NA | Dye for N-poor phase |
| Green food dye | Edentown F&B | NA | Dye for N-poor phase |
| Power supply | Agilent | E3649A | Power soruce for thermoelectric moduel |
| Thermoelectric module | Peltier | FALC1-12710T125 | Temparature control |
| Centrifuge machine | Labogene | 1248R | Settling down microhydrogels |
| 24-well plate | SPL Life Sciences | 32024 | Reservoir for observation |
| Optical microscope | Nikon | ECLIPSE 80i | Optical observation |
| Image analysis software | IMT i-Solution Inc. | iSolutions DT | Measurement of radius |
References
- Hoffman, A. S. Hydrogels for biomedical applications. Adv. Drug Delivery Rev. 54 (1), 3-12 (2002).
- Qiu, Y., Park, K. Environment-sensitive hydrogels for drug delivery. Adv. Drug Delivery Rev. 53 (3), 321-339 (2001).
- Hirokawa, Y., Tanaka, T. Volume phase transition in a nonionic gel. J. Chem. Phys. 81 (12), 6379-6380 (1984).
- Bae, Y. H., Okano, T., Hsu, R., Kim, S. W. Thermo-sensitive polymers as on-off switches for drug release. Macromol. Rapid Commun. 8 (10), 481-485 (1987).
- Yoshida, R., et al. Comb-type grafted hydrogels with rapid deswelling response to temperature changes. Nature. 374 (6519), 240-242 (1995).
- Tanaka, T. Collapse of gels and the critical endpoint. Phys. Rev. Lett. 40 (12), 820-823 (1978).
- Tanaka, T., et al. Phase transitions in ionic gels. Phys. Rev. Lett. 45 (20), 1636-1639 (1980).
- Zhao, Y. L., Stoddart, J. F. Azobenzene-based light-responsive hydrogel system. Langmuir. 25 (15), 8442-8446 (2009).
- Alvarez-Lorenzo, C., Bromberg, L., Concheiro, A. Light-sensitive intelligent drug delivery systems. Photochem. Photobiol. 85 (4), 848-860 (2009).
- Tanaka, T., Nishio, I., Sun, S. T., Ueno-Nishio, S. Collapse of gels in an electric field. Science. 218 (4571), 467-469 (1982).
- Kwon, I. C., Bae, Y. H., Kim, S. W. Electrically credible polymer gel for controlled release of drugs. Nature. 354 (6351), 291-293 (1991).
- Obaidat, A. A., Park, K. Characterization of protein release through glucose-sensitive hydrogel membranes. Biomaterials. 18 (11), 801-806 (1997).
- Kataoka, K., Miyazaki, H., Bunya, M., Okano, T., Sakurai, Y. Totally synthetic polymer gels responding to external glucose concentration: their preparation and application to on-off regulation of insulin release. J. Am. Chem. Soc. 120 (48), 12694-12695 (1998).
- Heskins, M., Guillet, J. E. Solution properties of poly(N-isopropylacrylamide). J. Macromol. Sci. Part A Pure Appl. Chem. 2 (8), 1441-1455 (1968).
- Sasaki, S., Okabe, S., Miyahara, Y. Thermodynamic properties of N-isopropylacrylamide in water: solubility transition, phase separation of supersaturated solution, and glass formation. J. Phys. Chem. B. 114 (46), 14995-15002 (2010).
- Bromberg, L., Alakhov, V. Effects of polyether-modified poly(acrylic acid) microgels on doxorubicin transport in human intestinal epithelial Caco-2 cell layers. J. Controlled Release. 88 (1), 11-22 (2003).
- Coughlan, D. C., Quilty, F. P., Corrigan, O. I. Effect of drug physicochemical properties on swelling/deswelling kinetics and pulsatile drug release from thermoresponsive poly(N-isopropylacrylamide) hydrogels. J. Controll. Release. 98 (1), 97-114 (2004).
- Bergbreiter, D. E., Case, B. L., Liu, Y. S., Caraway, J. W. Poly(N-isopropylacrylamide) soluble polymer supports in catalysis and synthesis. Macromolecules. 31 (18), 6053-6062 (1998).
- Lapeyre, V., Gosse, I., Chevreux, S., Ravaine, V. Monodispersed glucose-responsive microgels operating at physiological salinity. Biomacromolecules. 7 (12), 3356-3363 (2006).
- Hoare, T., Pelton, R. Engineering glucose swelling responses in poly(N-isopropylacrylamide)-based microgels. Macromolecules. 40 (3), 670-678 (2007).
- Xu, S., Zhang, J., Paquet, C., Lin, Y., Kumacheva, E. From hybrid microgels to photonic crystals. Adv. Funct. Mater. 13 (6), 468-472 (2003).
- Clarke, J., Vincent, B. Stability of non-aqueous microgel dispersions in the presence of free polymer. J. Chem. Soc., Faraday Trans. 1. 77 (8), 1831-1843 (1981).
- Mears, S. J., Deng, Y., Cosgrove, T., Pelton, R. Structure of sodium dodecyl sulfate bound to a poly (NIPAM) microgel particle. Langmuir. 13 (7), 1901-1906 (1997).
- Shah, R. K., Kim, J. W., Agresti, J. J., Weitz, D. A., Chu, L. Y. Fabrication of monodisperse thermosensitive microgels and gel capsules in microfluidic devices. Soft Matter. 4 (12), 2303-2309 (2008).
- Jack, C. R., Forbes, G., Dewanjee, M. K., Brown, M. L., Earnest, F. Polyvinyl alcohol sponge for embolotherapy: particle size and morphology. Am. J. Neuroradiol. 6 (4), 595-597 (1985).
- Derdeyn, C. P., Moran, C. J., Cross, D. T., Dietrich, H. H., Dacey, R. G. Polyvinyl alcohol particle size and suspension characteristics. Am. J. Neuroradiol. 16 (6), 1335-1343 (1995).
- Han, K., et al. Effect of flow rates on generation of monodisperse clay-poly(N-isopropylacrylamide) embolic microspheres using hydrodynamic focusing microfluidic device. Jpn. J. Appl. Phys. 50 (6), 06-12 (2011).
- Seo, K. D., Doh, J., Kim, D. S. One-step microfluidic synthesis of Janus microhydrogels with anisotropic thermo-responsive behavior and organophilic/hydrophilic loading capability. Langmuir. 29 (49), 15137-15141 (2013).
- Seo, K. D., Kim, D. S. Microfluidic synthesis of thermo-responsive poly(N-isopropylacrylamide)-poly(ethylene glycol) diacrylate microhydrogels as chemo-embolic microspheres. J. Micromech. Microeng. 24 (8), 085001 (2014).
- Seo, K. D., Kwak, B. K., Kim, D. S., Sánchez, S. Microfluidic-assisted fabrication of flexible and location traceable organo-motor. IEEE Trans. Nanobiosci. 14 (3), 298-304 (2015).
- Seo, K. D., Kim, D. S., Sánchez, S. Fabrication and application of complex-shaped microparticles via microfluidics. Lab Chip. , (2015).
- Shah, R. K., Kim, J. W., Weitz, D. A. Janus supraparticles by induced phase separation of nanoparticles in droplets. Adv. Mater. 21 (19), 1949-1953 (2009).
- Lone, S., et al. Microfluidic synthesis of Janus particles by UV-directed phase separation. Chem. Commun. 47 (9), 2634-2636 (2011).
- Hauber, K., Drier, T., Beebe, D. PDMS bonding by means of a portable, low-cost corona system. Lab chip. 6 (12), 1548-1549 (2006).
- Nisisako, T., Torii, T., Takahashi, T., Takizawa, Y. Synthesis of monodisperse bicolored Janus particles with electrical anisotropy using a microfluidic co-flow system. Adv. Mater. 18 (9), 1152-1156 (2006).
- Seiffert, S., Romanowsky, M. B., Weitz, D. A. Janus microgels produced from functional precursor polymers. Langmuir. 26 (18), 14842-14847 (2010).
- Peppas, N. A., Hilt, J. Z., Khademhosseini, A., Langer, R. Hydrogels in biology and medicine: from molecular principles to bionanotechnology. Adv. Mater. 18 (11), 1345-1360 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved