Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Synthese von Poly (
In diesem Artikel
Zusammenfassung
We present a protocol to synthesize Janus microhydrogels composed entirely of the same base material, poly(N-isopropylacrylamide) (PNIPAAm), with a clearly compartmentalized structure base on the phase separation of a supersaturated NIPAAm monomer solution. The synthesized Janus microhydrogels show unique properties such as anisotropic thermo-responsiveness and organophilic/hydrophilic loading capability.
Zusammenfassung
Janus microparticles are compartmentalized particles with differing molecular structures and/or functionality on each of their two sides. Because of this unique property, Janus microparticles have been recognized as a new class of materials, thereby attracting a great deal of attention from various research fields. The versatility of these microparticles has been exemplified through their uses as building blocks for self-assembly, electrically responsive actuators, emulsifiers for painting and cosmetics, and carriers for drug delivery. This study introduces a detailed protocol that explicitly describes a synthetic method for designing novel Janus microhydrogels composed of a single base material, poly(N-isopropylacrylamide) (PNIPAAm). Janus microdroplets are firstly generated via a hydrodynamic focusing microfluidic device (HFMD) based on the separation of a supersaturated aqueous NIPAAm monomer solution and subsequently polymerized through exposure to UV irradiation. The resulting Janus microhydrogels were found to be entirely composed of the same base material, featured an easily identifiable compartmentalized morphology, and exhibited anisotropic thermo-responsiveness and organophilic/hydrophilic loading capability. We believe that the proposed method introduces a novel hydrogel platform with the potential for advanced synthesis of multi-functional Janus microhydrogels.
Einleitung
Hydrogels are a network of hydrophilic polymer chains.1 An increasing amount of research in the field of hydrogels has promoted significant advances and revealed their similarity to biological tissues; the properties of hydrogels allow the uptake of large amounts of water while maintaining their structure. Environmentally responsive hydrogels have also been studied extensively because of their ability to swell or shrink reversibly in response to external stimuli.2 Several triggers, including temperature,3-5 pH,6,7 light,8,9 electric fields,10,11 and specific molecules, such as glucose,12,13 have been suggested to control the geometric shape of hydrogels. Among the many environmentally responsive hydrogels currently available, poly(N-isopropylacrylamide) (PNIPAAm), a well-known thermo-responsive hydrogel, exhibits volume shrinkage above a low critical solution temperature (LCST) of 32 °C.14 A recent study by Sasaki et al.15 reported the intriguing liquid-liquid phase separation of supersaturated NIPAAm, which is the monomer of PNIPAAm. According to this report, supersaturated NIPAAm was dissolved with a 10-fold molar excess of H2O, and soon after, the solution separated into two liquid phases when allows to stand at a temperature above 25 °C; by contrast, dilute NIPAAm was dissolved homogeneously under the same conditions.
Microparticles made of environmentally responsive hydrogels are fascinating candidates for application in drug delivery,16,17 catalysis,18 sensing,19,20 and photonics.21 Traditional synthetic methods including emulsion polymerization, are used to produce hydrogel microparticles with polydispersity.22,23 However, certain applications require microparticles with a narrow size distribution, for example, to stabilize the pharmacokinetics of drug delivery.24 Irregularly shaped or polydisperse embolic microparticles aggregate proximally into clusters, leading to chronic inflammatory responses in embolic particles for cancer therapeutic treatment.25,26
The microfluidic approach is at the forefront of research as a means of fabricating micro-sized particles with narrow size distributions and complex shapes.27-31 The advantages of fabricating microparticles in the microfluidic device are predicated by the small characteristic length of the microfluidic device, which results in a low Reynolds number. In contrast to traditional bulk emulsification where drops are formed in parallel, microdroplets produced in microfluidic devices are generated in series and subsequently polymerized into microparticles upon exposure to UV irradiation. The fundamental principle of droplet formation using a microfluidic device is balance between the interfacial tension and the shear force of the sheath fluid acting on the core fluid.
Despite the obvious advantages of microfluidic fabrication of droplets/particles, Janus droplets/particles consisting of the same base material are rarely reported because the internal morphology of these droplets/particles is generally disturbed by the diffusion and perturbation of the core fluids. To circumvent this intrinsic limitation, two groups recently reported the preparation of the Janus microparticles by employing heat-induced phase separation of colloidal nanoparticles and UV-directed phase separation.32,33
To this end, we report a microfluidic approach to synthesize Janus microhydrogels entirely composed of a single base material and obtain a product with clearly compartmentalized morphology. Our approach is based on the primary concept of liquid-liquid phase separation of supersaturated NIPAAm monomer. The resulting Janus microhydrogels were found to possess unique properties including anisotropic thermo-responsiveness and organophilic/hydrophilic loading capability.
Protokoll
1. Die Herstellung einer Masterform für die hydrodynamische Fokussierung Mikrofluidik-Gerät (HFMD) durch Lithografie
- Entwerfen Sie eine Photomaske für die HFMD (Abbildung 1a) unter Verwendung von computergestützten Konstruktion (CAD) Software gemäß dem Protokoll des Herstellers.
- Spülen eine 4 'Siliciumwafer mit Aceton, Isopropylalkohol (IPA) und deionisiertes (DI) Wasser zu organischem und anorganischem Staub von dem Wafer zu entfernen.
- Reinigen der Siliciumscheibe mit O 2 -Plasma bei 100 W Leistung für 5 min , um die Bindungsfestigkeit zwischen dem Wafer und SU-8 zu erhöhen.
- Spin-coat 4 ml des negativen Photoresist, SU-8 2150, auf den Wafer bei 3000 Upm für 30 sec mit einer Dicke von 150 um (b1 in Figur 1b) zu erreichen.
- Legen Sie die SU-8 beschichtete Wafer auf einer Heizplatte für 5 min bei 65 ° C, die Temperatur auf 95 ° C, und dann lassen Sie den Wafer auf der Heizplatte 30 min zu weich backen.
- Setze dasentworfen Photomaske über dem Wafer und setzen mit UV - Licht (260 mJ cm -2, 26 sec für 10 mW cm -2) in einem Mask Aligner (b2 in Abbildung 1b).
- Führen der Nachbelichtung auf einer Heizplatte Backen (65 ° C für 5 min und dann 95 ° C für 12 min).
- Entwickeln Sie die Wafer durch Eintauchen in ein SU-8-Entwicklerbades für 10 min und dann übertragen sie in frischen Entwickler für 5 Sekunden um eine saubere Oberfläche zu erhalten.
- Spülen Sie den Wafer für 20 Sekunden mit DI - Wasser und trocknen Sie sie 10 Sekunden lang mit N 2 -Gas (b3 in Abbildung 1b). Verwenden Sie die hergestellte Wafer als Masterform für Polydimethylsiloxan (PDMS) Gießen in Abschnitt 2.
2. Die Herstellung des HFMD durch PDMS Casting
- Verwenden Sie die strukturierten Wafer in Abschnitt 1 als Master-Form erhalten für PDMS Guss.
- Mischen Sie die PDMS Vorpolymer und ein Härtungsmittel homogen in einem Gewichtsverhältnis von 10: 1; beispielsweise verwendet werden 1 g Härter 10 g PDMS vorge Polymer.
- Gießen Sie die PDMS - Pre-Polymer in die Urform und entgast es für 1 Stunde in einer Vakuumkammer (b4 in Abbildung 1b).
- Platzieren Sie die Mutterform mit der PDMS Vorpolymer in einem Ofen bei 65 ° C für 3 Stunden.
- Schneiden Sie die gehärtete PDMS in der Größe eines einzelnen Chips ein scharfes Skalpell. das gehärtete PDMS Replik aus der Urform mit der Hand vorsichtig abziehen.
- Wiederholen Sie die Schritte 2.2 bis 2.5 eine identische PDMS Replik zu erhalten.
- Stanzen Einlass- und Auslasslöcher in eine der Repliken einen Locher mit einem etwas kleineren Durchmesser als der Außendurchmesser der Verbindungsrohrleitung verwendet wird.
- Bewerben Luft Plasmabehandlung auf die Klebefläche jedes Replikat eine Corona Anlage verwendet wird . 34
Achtung: Verwenden Sie die Corona Anlage in einem Bereich mit guter Belüftung Ozon Ablagerungen zu verhindern. - Drop-5 ul Methanol auf die Luft-Plasma-behandelten Flächen. Fein ausgerichtet zwei identische PDMS Repliken der HFMD von Hand Manipu- herzustellen nung und Ausrichtung prüfen über ein Mikroskop (b5 in Abbildung 1b).
Hinweis: Die Luft-Plasma-behandelten PDMS Repliken ziemlich klebrig und schwer zu manipulieren. So wurden 5 ul Methanol wird an die Luft plasmabehandelte Oberfläche hinzugefügt als Schmiermittel fungiert. - Legen Sie die HFMD in einem Ofen auf 65 ° C über Nacht um die Bindung zwischen zwei PDMS Repliken (b6 in Abbildung 1b) zu stärken. Bond zwei identische PDMS Repliken, die Höhe des Mikrokanals des HFMD zu erhöhen und in dem mikrofluidischen Kanal während des Betriebs ein Verstopfen von Mikrotröpfchen zu vermeiden.
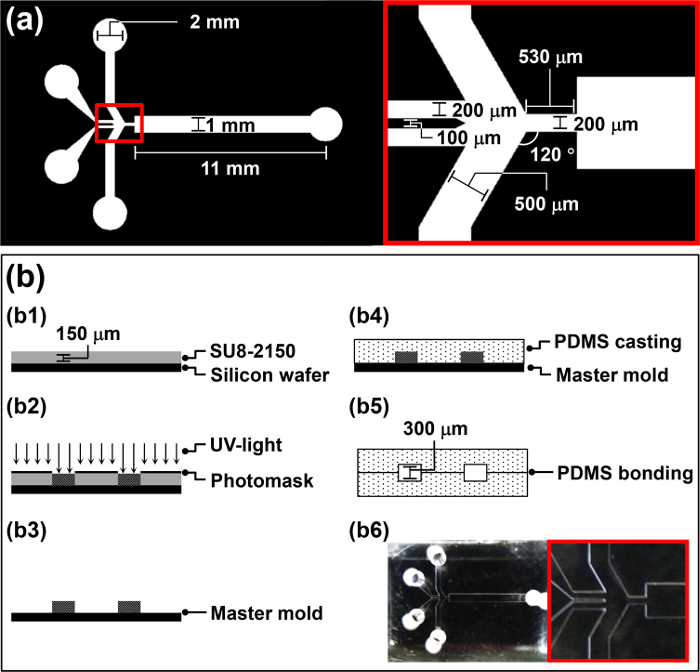
Abbildung 1: Überblick über die HFMD Herstellungsverfahren (a) Design - Parameter der Photomaske für die HFMD.. (B) Abbildung des Herstellungsverfahrens für die HFMD.ftp_upload / 52813 / 52813fig1large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
3. Herstellung von NIPAAm reichen (N-reich) und NIPAAm-armen (N-arm) Phasen durch Phasentrennung von Supersaturated NIPAAm
- Auflösen NIPAAm Monomer in entionisiertem Wasser bei aw / w-Verhältnis von 1: 1 unter Verwendung eines Vortex-Mischers; beispielsweise 10 g von NIPAAm in 10 ml DI - Wasser (erstes Bild von Figur 2a) aufzulösen.
Hinweis: Wenn der NIPAAm Monomer vollständig bei Raumtemperatur gelöst, die Lösung trüb erscheint (zweites Bild von Figur 2a). Dieses Phänomen ist der erste Hinweis, dass die Löslichkeit induzierte Phasentrennung des übersättigten NIPAAm Monomer erfolgreich stattgefunden hat. - Erlauben die Monomerlösung in einer vertikalen Position bei Raumtemperatur für mindestens 15 min ruhen. Die obere Phase ist die N-reiche Phase und die dichtere untere Phase ist die N-armen Phase (drittes Bild von Abbildung 2a). Die Dichten von the N-reiche und N-armen Phasen sind 0,93 ± 0,01 und 0,99 ± 0,01 g cm -3. 15
- Wenn die Schnittstelle der beiden Phasen trennt klar wird, extrahiert man vorsichtig 2 ml Monomerlösung aus den N-reichen und N-armen Phasen ohne diese Schnittstelle zu stören, indem mit Hilfe einer Pipette.
- Hinzufügen 4 mg N, N 'Methylenbisacrylamid (MBAAm) als Vernetzer und 4 mg 4- (2-hydroxyethoxy) phenyl- (2-hydroxy-2-propyl) keton als Photoinitiator zu dem extrahierten N-reiche und N -arme Monomerlösungen zur Herstellung von Kernflüssigkeiten 1 und 2 für die niedrige Vernetzerkonzentration (2 mg ml -1) Probe (b1 und b2 in Abbildung 2b).
- Wiederholen vorherigen Schritt 3.3 und fügen 80 mg MBAAm und 4 mg 4- (2-hydroxyethoxy) phenyl- (2-hydroxy-2-propyl) keton in jede der extrahierten N-reiche und arme N-Monomerlösung Kernflüssigkeiten herzustellen 1 und 2 für die hohe Vernetzerkonzentration (40 mg ml -1) Probe (b3 und b4 in Figure 2b).
- Man löst 10 Gew% des Tensids in Öl Mineralöl die Hüllflüssigkeit (b5 in 2b) herzustellen.
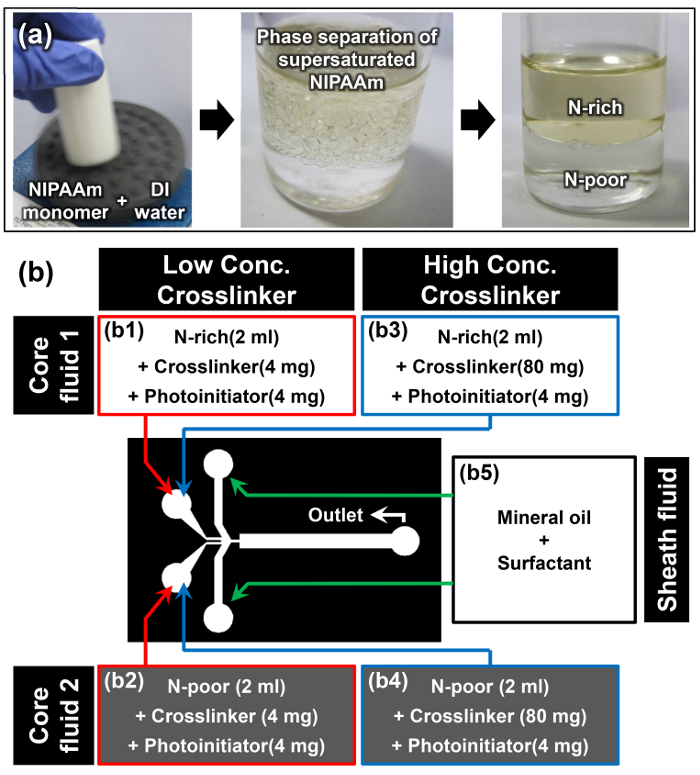
Fig . 2: Materialvorbereitung für Janus Microhydrogel Synthesis (a) Herstellung von N-reiche und N-armen Monomerlösungen durch Phasentrennung von übersättigten NIPAAm. (B) Einzelheiten zu den Materialien und Versuchsaufbau im Protokoll verwendet. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
4. Synthese von Janus Microhydrogels die HFMD Verwendung
- Last 2 ml Kernflüssigkeiten 1 und 2 (b1, b2 oder b3, b4 in Bild 2b) und der Hüllflüssigkeit (b5 in 2b) in drei separate 3 ml Spritzen.
- Montieren Sie die Spritzen in die Spritzenpumpen und schließen jede Spritze mit dem entsprechenden Fluideinlass des HFMD mit Schlauch (Abbildung (b). Schlauch Verwenden Sie den Fluidauslass der HFMD zu einem Sammelbehälter zu verbinden.
- Stellen Sie die Spritzenpumpen und infundieren Kernflüssigkeiten 1 und 2 und Hüllfluid mit Strömungsgeschwindigkeiten von 2, 2, und 10 & mgr; l min -1.
- (Optional) Tune die Strömungsgeschwindigkeit des Kern Fluide 1 und 2 die relativen Volumenverhältnisse von jeder Seite des Janus Mikrotröpfchenpropofol einzustellen.
- Positionieren Sie die UV-Lichtquelle senkrecht etwa 1 cm entfernt von der Sammelreservoir. Einschalten der UV-Lichtquelle und optisch überwachen die kontinuierliche Herstellung von Janus microhydrogels.
Achtung: Verwenden Sie UV - Schutzbrille , wenn microhydrogel Produktion zu überwachen. - Sammeln Sie die hergestellt Janus microhydrogels in eine konische Röhre und waschen Sie sie IPA verwenden. Zentrifuge dann das konische Röhrchen (780 g für 5 min) zu regeln diemicrohydrogels.
- Wiederholen Sie Schritt 4.6 mehrmals das Mineralöl rund um die Janus microhydrogels vollständig zu entfernen.
- Wiederholen Sie Schritt 4.6 aber die Verwendung DI Wasser mit einem Wasser-Tensid von 0,005% (v / v) anstelle von IPA die übrig gebliebenen IPA um die Janus microhydrogels zu entfernen.
- Lagern Sie vollständig gewaschen Janus microhydrogels in einem 10 ml-Fläschchen mit VE-Wasser.
5. Analyse der anisotropen Thermo-Ansprechempfindlichkeit von Janus Microhydrogels
- Verwenden Sie eine Pipette Janus microhydrogels aus Abschnitt 4 in einer 24-Well-Platte synthetisiert zu platzieren. Lassen Sie die microhydrogels für 15 Sekunden absetzen, bis eine Monoschicht an der Bodenfläche der Vertiefung gebildet ist.
- Erhalten Sie ein Bild des Janus microhydrogel bei 24 ° C ein aufrechtes Lichtmikroskop mit einem 5fach Objektivlinse verwendet wird.
- Stellen Sie ein thermoelektrisches Modul unter der Well-Platte und steuern die Spannung dieses Moduls die Temperatur der Lösung, die Janus Mikro zu erhöhenHydrogele auf 32 ° C.
- Erhalten Sie ein Bild des Janus microhydrogel bei 32 ° C nochmals um ein aufrechtes Lichtmikroskop mit einem 5fach Objektivlinse verwendet wird.
- Wiederholen Sie die Schritte 5,2-5,4 24-mal, wobei darauf geachtet, eine andere Janus microhydrogel für die statistische Analyse zu wählen.
- Von den 25 Bildern verschiedener Janus microhydrogels bei 24 und 32 ° C, messen Sie den Radius der PN-rich und PN-armen Teile der Janus microhydrogels Bildanalyse-Software gemäß den Anweisungen des Herstellers.
Ergebnisse
Figur 3a zeigt eine schematische Darstellung des Versuchsaufbaus verwendet Janus microhydrogels über die HFMD zu synthetisieren. Die N-reiche und N-arme Phasen wurden präzise in die HFMD als Kernflüssigkeiten eingespritzt 1 und 2 und dann zusammengefügt und zerlegt in Janus Mikrotröpfchen an der Öffnung durch die Mantelflüssigkeit Mineralöl wegen der kapillaren Instabilität Rayleigh. Folglich besteht Janus Mikrotröpfchen von N-reiche und N-arme Phasen ...
Diskussion
Zwei nicht mischbare Basismaterialien werden in der Regel verwendet, um die Janus microhydrogels zu synthetisieren. Bis vor kurzem bestehend Janus microhydrogels aus dem gleichen Grundmaterial wurden selten beobachtet , und die berichteten Janus microhydrogels keine klare interne Morphologie aufgrund der Störung durch die Mischbarkeit der Komponenten - Materialien verursacht. 35, 36 In diesem Protokoll zeigen wir ein Verfahren Janus microhydrogels bestehen vollständig aus dem einzigen Grundmaterial, PNIPAAm...
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
This work was supported by the National Research Foundation of Korea (NRF) grant funded by the Korea Government (MSIP (Nos. 2014R1A2A1A01006527 and 2011-0030075).
Materialien
| Name | Company | Catalog Number | Comments |
| Silicon wafer | LG Siltron | 4", Test grade | Wafer for master mold fabrication |
| Acetone | Samchun Pure Chemical | A0097 | Cleaning silicon wafer |
| Isopropyl alcohol (IPA) | Daejung Chemicals & Metals | 5035-4404 | Cleaning silicon wafer |
| Water purification system | Merck Millipore | EMD Millipore RIOs Essential 5 | Prepering deionized water |
| O2 plasma machine | Femto Science | VITA-A | Cleaning silicon wafer |
| SU-8 2150 negative photoresist | MicroChem | Y111077 0500L1GL | Photoresist for master mold fabrication |
| Hot plate | Misung Scientific | HP330D, HP150D | Baking SU-8 |
| SU-8 developer | Microchem | Y020100 4000L1PE | Developing SU-8 |
| Mask aligner system for photolithograpy | Shinu Mst Co. | CA-6M | Photolithography |
| Sylgard 184 silicone elastomer kit | Dow Corning | 1064891 | PDMS casting |
| Laboratory Corona Treater | Electro-technic Products Inc. | Model BD-20AC | PDMS air plasma treatment |
| N-isopropylacrylamide (NIPAAm) | Sigma-Aldrich | 415324-50G | Monomer |
| N,N'-methylenebisacrylamide (MBAAm) | Sigma-Aldrich | 146072-100G | Crosslinker of NIPAAm |
| 4-(2-hydroxyethoxy)phenyl-(2-hydroxy-2-propyl)ketone, Irgacure 2959 | BASF | 55047962 | Photoinitiator of NIPAAm |
| ABIL EM 90 | Evonik Industries | 201109 | Sufactant for oil |
| Vortex mixer | Scientific Industries Inc. | Vortex-Genie 2 | Mixing |
| Tygon tubing | Saint-Gobain | I.D. 1/32", O.D. 3/32", Wall 1/32" | Connecting tube between syringes and HFMD |
| UV light source | Hamamatsu | Spot light source LC8 | Polymerization from NIPAAm to PNIPAAm |
| Syringes, NORM-JECT (3ml) | Henke-Sass Wolf GmbH | 22767 | Loading of materials |
| Syringe pump | KD Scientific | KDS model 200 | Perfusion of materials |
| Tegitol Type NP-10 | Sigma-Aldrich | NP10-500ML | Surfactant for water |
| Oil red O | Sigma-Aldrich | O0625-25G | Dye for N-rich phase |
| Oil Blue N | Sigma-Aldrich | 391557-5G | Dye for N-rich phase |
| Yellow food dye | Edentown F&B | NA | Dye for N-poor phase |
| Green food dye | Edentown F&B | NA | Dye for N-poor phase |
| Power supply | Agilent | E3649A | Power soruce for thermoelectric moduel |
| Thermoelectric module | Peltier | FALC1-12710T125 | Temparature control |
| Centrifuge machine | Labogene | 1248R | Settling down microhydrogels |
| 24-well plate | SPL Life Sciences | 32024 | Reservoir for observation |
| Optical microscope | Nikon | ECLIPSE 80i | Optical observation |
| Image analysis software | IMT i-Solution Inc. | iSolutions DT | Measurement of radius |
Referenzen
- Hoffman, A. S. Hydrogels for biomedical applications. Adv. Drug Delivery Rev. 54 (1), 3-12 (2002).
- Qiu, Y., Park, K. Environment-sensitive hydrogels for drug delivery. Adv. Drug Delivery Rev. 53 (3), 321-339 (2001).
- Hirokawa, Y., Tanaka, T. Volume phase transition in a nonionic gel. J. Chem. Phys. 81 (12), 6379-6380 (1984).
- Bae, Y. H., Okano, T., Hsu, R., Kim, S. W. Thermo-sensitive polymers as on-off switches for drug release. Macromol. Rapid Commun. 8 (10), 481-485 (1987).
- Yoshida, R., et al. Comb-type grafted hydrogels with rapid deswelling response to temperature changes. Nature. 374 (6519), 240-242 (1995).
- Tanaka, T. Collapse of gels and the critical endpoint. Phys. Rev. Lett. 40 (12), 820-823 (1978).
- Tanaka, T., et al. Phase transitions in ionic gels. Phys. Rev. Lett. 45 (20), 1636-1639 (1980).
- Zhao, Y. L., Stoddart, J. F. Azobenzene-based light-responsive hydrogel system. Langmuir. 25 (15), 8442-8446 (2009).
- Alvarez-Lorenzo, C., Bromberg, L., Concheiro, A. Light-sensitive intelligent drug delivery systems. Photochem. Photobiol. 85 (4), 848-860 (2009).
- Tanaka, T., Nishio, I., Sun, S. T., Ueno-Nishio, S. Collapse of gels in an electric field. Science. 218 (4571), 467-469 (1982).
- Kwon, I. C., Bae, Y. H., Kim, S. W. Electrically credible polymer gel for controlled release of drugs. Nature. 354 (6351), 291-293 (1991).
- Obaidat, A. A., Park, K. Characterization of protein release through glucose-sensitive hydrogel membranes. Biomaterials. 18 (11), 801-806 (1997).
- Kataoka, K., Miyazaki, H., Bunya, M., Okano, T., Sakurai, Y. Totally synthetic polymer gels responding to external glucose concentration: their preparation and application to on-off regulation of insulin release. J. Am. Chem. Soc. 120 (48), 12694-12695 (1998).
- Heskins, M., Guillet, J. E. Solution properties of poly(N-isopropylacrylamide). J. Macromol. Sci. Part A Pure Appl. Chem. 2 (8), 1441-1455 (1968).
- Sasaki, S., Okabe, S., Miyahara, Y. Thermodynamic properties of N-isopropylacrylamide in water: solubility transition, phase separation of supersaturated solution, and glass formation. J. Phys. Chem. B. 114 (46), 14995-15002 (2010).
- Bromberg, L., Alakhov, V. Effects of polyether-modified poly(acrylic acid) microgels on doxorubicin transport in human intestinal epithelial Caco-2 cell layers. J. Controlled Release. 88 (1), 11-22 (2003).
- Coughlan, D. C., Quilty, F. P., Corrigan, O. I. Effect of drug physicochemical properties on swelling/deswelling kinetics and pulsatile drug release from thermoresponsive poly(N-isopropylacrylamide) hydrogels. J. Controll. Release. 98 (1), 97-114 (2004).
- Bergbreiter, D. E., Case, B. L., Liu, Y. S., Caraway, J. W. Poly(N-isopropylacrylamide) soluble polymer supports in catalysis and synthesis. Macromolecules. 31 (18), 6053-6062 (1998).
- Lapeyre, V., Gosse, I., Chevreux, S., Ravaine, V. Monodispersed glucose-responsive microgels operating at physiological salinity. Biomacromolecules. 7 (12), 3356-3363 (2006).
- Hoare, T., Pelton, R. Engineering glucose swelling responses in poly(N-isopropylacrylamide)-based microgels. Macromolecules. 40 (3), 670-678 (2007).
- Xu, S., Zhang, J., Paquet, C., Lin, Y., Kumacheva, E. From hybrid microgels to photonic crystals. Adv. Funct. Mater. 13 (6), 468-472 (2003).
- Clarke, J., Vincent, B. Stability of non-aqueous microgel dispersions in the presence of free polymer. J. Chem. Soc., Faraday Trans. 1. 77 (8), 1831-1843 (1981).
- Mears, S. J., Deng, Y., Cosgrove, T., Pelton, R. Structure of sodium dodecyl sulfate bound to a poly (NIPAM) microgel particle. Langmuir. 13 (7), 1901-1906 (1997).
- Shah, R. K., Kim, J. W., Agresti, J. J., Weitz, D. A., Chu, L. Y. Fabrication of monodisperse thermosensitive microgels and gel capsules in microfluidic devices. Soft Matter. 4 (12), 2303-2309 (2008).
- Jack, C. R., Forbes, G., Dewanjee, M. K., Brown, M. L., Earnest, F. Polyvinyl alcohol sponge for embolotherapy: particle size and morphology. Am. J. Neuroradiol. 6 (4), 595-597 (1985).
- Derdeyn, C. P., Moran, C. J., Cross, D. T., Dietrich, H. H., Dacey, R. G. Polyvinyl alcohol particle size and suspension characteristics. Am. J. Neuroradiol. 16 (6), 1335-1343 (1995).
- Han, K., et al. Effect of flow rates on generation of monodisperse clay-poly(N-isopropylacrylamide) embolic microspheres using hydrodynamic focusing microfluidic device. Jpn. J. Appl. Phys. 50 (6), 06-12 (2011).
- Seo, K. D., Doh, J., Kim, D. S. One-step microfluidic synthesis of Janus microhydrogels with anisotropic thermo-responsive behavior and organophilic/hydrophilic loading capability. Langmuir. 29 (49), 15137-15141 (2013).
- Seo, K. D., Kim, D. S. Microfluidic synthesis of thermo-responsive poly(N-isopropylacrylamide)-poly(ethylene glycol) diacrylate microhydrogels as chemo-embolic microspheres. J. Micromech. Microeng. 24 (8), 085001 (2014).
- Seo, K. D., Kwak, B. K., Kim, D. S., Sánchez, S. Microfluidic-assisted fabrication of flexible and location traceable organo-motor. IEEE Trans. Nanobiosci. 14 (3), 298-304 (2015).
- Seo, K. D., Kim, D. S., Sánchez, S. Fabrication and application of complex-shaped microparticles via microfluidics. Lab Chip. , (2015).
- Shah, R. K., Kim, J. W., Weitz, D. A. Janus supraparticles by induced phase separation of nanoparticles in droplets. Adv. Mater. 21 (19), 1949-1953 (2009).
- Lone, S., et al. Microfluidic synthesis of Janus particles by UV-directed phase separation. Chem. Commun. 47 (9), 2634-2636 (2011).
- Hauber, K., Drier, T., Beebe, D. PDMS bonding by means of a portable, low-cost corona system. Lab chip. 6 (12), 1548-1549 (2006).
- Nisisako, T., Torii, T., Takahashi, T., Takizawa, Y. Synthesis of monodisperse bicolored Janus particles with electrical anisotropy using a microfluidic co-flow system. Adv. Mater. 18 (9), 1152-1156 (2006).
- Seiffert, S., Romanowsky, M. B., Weitz, D. A. Janus microgels produced from functional precursor polymers. Langmuir. 26 (18), 14842-14847 (2010).
- Peppas, N. A., Hilt, J. Z., Khademhosseini, A., Langer, R. Hydrogels in biology and medicine: from molecular principles to bionanotechnology. Adv. Mater. 18 (11), 1345-1360 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten