Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Síntesis de Poli (
En este artículo
Resumen
We present a protocol to synthesize Janus microhydrogels composed entirely of the same base material, poly(N-isopropylacrylamide) (PNIPAAm), with a clearly compartmentalized structure base on the phase separation of a supersaturated NIPAAm monomer solution. The synthesized Janus microhydrogels show unique properties such as anisotropic thermo-responsiveness and organophilic/hydrophilic loading capability.
Resumen
Janus microparticles are compartmentalized particles with differing molecular structures and/or functionality on each of their two sides. Because of this unique property, Janus microparticles have been recognized as a new class of materials, thereby attracting a great deal of attention from various research fields. The versatility of these microparticles has been exemplified through their uses as building blocks for self-assembly, electrically responsive actuators, emulsifiers for painting and cosmetics, and carriers for drug delivery. This study introduces a detailed protocol that explicitly describes a synthetic method for designing novel Janus microhydrogels composed of a single base material, poly(N-isopropylacrylamide) (PNIPAAm). Janus microdroplets are firstly generated via a hydrodynamic focusing microfluidic device (HFMD) based on the separation of a supersaturated aqueous NIPAAm monomer solution and subsequently polymerized through exposure to UV irradiation. The resulting Janus microhydrogels were found to be entirely composed of the same base material, featured an easily identifiable compartmentalized morphology, and exhibited anisotropic thermo-responsiveness and organophilic/hydrophilic loading capability. We believe that the proposed method introduces a novel hydrogel platform with the potential for advanced synthesis of multi-functional Janus microhydrogels.
Introducción
Hydrogels are a network of hydrophilic polymer chains.1 An increasing amount of research in the field of hydrogels has promoted significant advances and revealed their similarity to biological tissues; the properties of hydrogels allow the uptake of large amounts of water while maintaining their structure. Environmentally responsive hydrogels have also been studied extensively because of their ability to swell or shrink reversibly in response to external stimuli.2 Several triggers, including temperature,3-5 pH,6,7 light,8,9 electric fields,10,11 and specific molecules, such as glucose,12,13 have been suggested to control the geometric shape of hydrogels. Among the many environmentally responsive hydrogels currently available, poly(N-isopropylacrylamide) (PNIPAAm), a well-known thermo-responsive hydrogel, exhibits volume shrinkage above a low critical solution temperature (LCST) of 32 °C.14 A recent study by Sasaki et al.15 reported the intriguing liquid-liquid phase separation of supersaturated NIPAAm, which is the monomer of PNIPAAm. According to this report, supersaturated NIPAAm was dissolved with a 10-fold molar excess of H2O, and soon after, the solution separated into two liquid phases when allows to stand at a temperature above 25 °C; by contrast, dilute NIPAAm was dissolved homogeneously under the same conditions.
Microparticles made of environmentally responsive hydrogels are fascinating candidates for application in drug delivery,16,17 catalysis,18 sensing,19,20 and photonics.21 Traditional synthetic methods including emulsion polymerization, are used to produce hydrogel microparticles with polydispersity.22,23 However, certain applications require microparticles with a narrow size distribution, for example, to stabilize the pharmacokinetics of drug delivery.24 Irregularly shaped or polydisperse embolic microparticles aggregate proximally into clusters, leading to chronic inflammatory responses in embolic particles for cancer therapeutic treatment.25,26
The microfluidic approach is at the forefront of research as a means of fabricating micro-sized particles with narrow size distributions and complex shapes.27-31 The advantages of fabricating microparticles in the microfluidic device are predicated by the small characteristic length of the microfluidic device, which results in a low Reynolds number. In contrast to traditional bulk emulsification where drops are formed in parallel, microdroplets produced in microfluidic devices are generated in series and subsequently polymerized into microparticles upon exposure to UV irradiation. The fundamental principle of droplet formation using a microfluidic device is balance between the interfacial tension and the shear force of the sheath fluid acting on the core fluid.
Despite the obvious advantages of microfluidic fabrication of droplets/particles, Janus droplets/particles consisting of the same base material are rarely reported because the internal morphology of these droplets/particles is generally disturbed by the diffusion and perturbation of the core fluids. To circumvent this intrinsic limitation, two groups recently reported the preparation of the Janus microparticles by employing heat-induced phase separation of colloidal nanoparticles and UV-directed phase separation.32,33
To this end, we report a microfluidic approach to synthesize Janus microhydrogels entirely composed of a single base material and obtain a product with clearly compartmentalized morphology. Our approach is based on the primary concept of liquid-liquid phase separation of supersaturated NIPAAm monomer. The resulting Janus microhydrogels were found to possess unique properties including anisotropic thermo-responsiveness and organophilic/hydrophilic loading capability.
Protocolo
1. La fabricación de un molde maestro para el enfoque hidrodinámico dispositivo de microfluidos (MPB) a través de fotolitografía
- Diseñar una fotomáscara para la MPB (Figura 1a) usando el software de diseño (CAD) asistidas por ordenador de acuerdo con el protocolo del fabricante.
- Enjuagar una oblea de 4 'de silicio con acetona, alcohol isopropílico (IPA), y agua desionizada (DI) para eliminar el polvo orgánicos e inorgánicos de la oblea.
- Limpiar la oblea de silicio con plasma de O2 a 100 W de potencia durante 5 min para aumentar la resistencia de la unión entre la oblea y SU-8.
- Spin-capa 4 ml de la resina fotosensible negativa, SU-8 2150, sobre la oblea a 3000 rpm durante 30 segundos para lograr un espesor de 150 micras (b1 en la Figura 1b).
- Coloque el disco recubierto SU-8 sobre una placa caliente durante 5 minutos a 65 ° C, ajustar la temperatura a 95 ° C, y luego salir de la oblea en la placa caliente durante 30 minutos para hornear suave.
- Colocar elfoto máscara diseñada sobre la oblea y exponer a la luz UV (260 mJ cm -2, 26 seg para 10 mW cm-2) en un alineador de máscara (b2 en la Figura 1b).
- Realizar la cocción posterior a la exposición sobre una placa caliente (65 ° C durante 5 minutos y luego 95 ° C durante 12 min).
- Desarrollar la oblea por inmersión en un baño de revelado SU-8 durante 10 minutos, y luego transferirlo a revelador nuevo durante 5 segundos para obtener una superficie limpia.
- Enjuagar la oblea durante 20 segundos con agua DI y se seca durante 10 s con N 2 gas (b3 en la Figura 1b). Utilice la oblea fabricada como un molde maestro para la fundición de polidimetilsiloxano (PDMS) en la sección 2.
2. La fabricación de la MPB a través de fundición PDMS
- Utilice la oblea modelada obtenida en la sección 1 como el molde maestro de PDMS de fundición.
- Mezclar el PDMS pre-polímero y un agente de curado de manera homogénea en una relación en peso de 10: 1; por ejemplo, utilizar 1 g de agente de curado para 10 g de PDMS pre-Polymer.
- Verter el PDMS pre-polímero en el molde maestro y desgasificar durante 1 h en una cámara de vacío (b4 en la Figura 1b).
- Colocar el molde maestro con el PDMS pre-polímero en un horno a 65 ° C durante 3 hr.
- Cortar los PDMS curados en el tamaño de un solo chip usando un bisturí afilado. Despega cuidadosamente la réplica de PDMS curado del molde maestro con la mano.
- Repita los pasos 2.2 a 2.5 para obtener una réplica idéntica PDMS.
- Perforar de entrada y salida agujeros en una de las réplicas utilizando una perforadora con un diámetro ligeramente menor que el diámetro exterior del tubo de conexión.
- Aplicar el tratamiento con plasma de aire a la zona de unión de cada réplica utilizando un tratador corona. 34
Precaución: Utilice el tratador corona en un área con buena ventilación para evitar la acumulación de ozono. - Caída de 5 l de metanol en las áreas tratadas con plasma de aire. Finamente alinear dos PDMS réplicas idénticas para fabricar la HFMD por parte manipu mento, y compruebe la alineación a través de un microscopio (b5 en la Figura 1b).
Nota: Las réplicas de PDMS tratadas con plasma de aire son bastante pegajoso y difícil de manipular. Por lo tanto, 5 l de metanol se añade a la superficie tratada con plasma de aire para funcionar como un lubricante. - Coloque la HFMD en un horno a 65ºC durante la noche ° C para fortalecer el vínculo entre dos réplicas de PDMS (b6 en la Figura 1b). Bond dos PDMS réplicas idénticas para aumentar la altura del microcanal de la HFMD y evitar la obstrucción de las microgotitas en el canal microfluídico durante la operación.
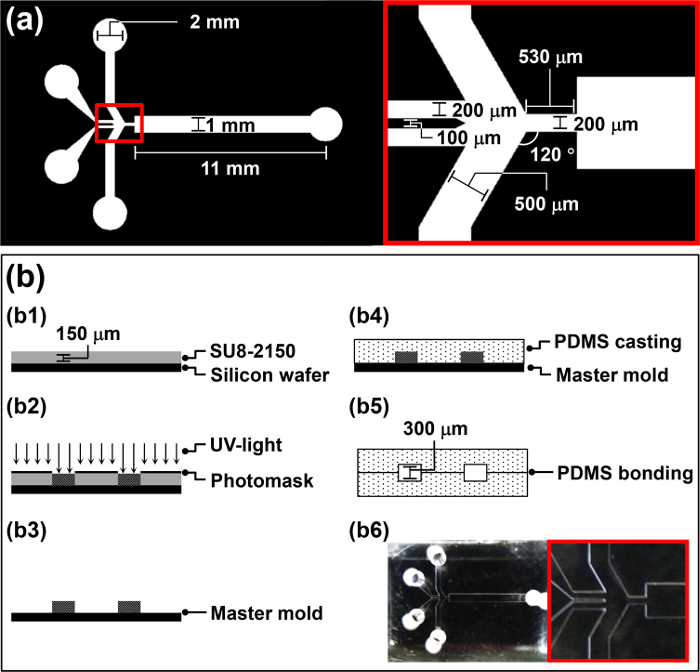
Figura 1: Resumen del proceso de fabricación MPB (a) Los parámetros de diseño de la máscara fotográfica para la HFMD.. (B) Ilustración del procedimiento de fabricación de la MPB.ftp_upload / 52813 / 52813fig1large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
3. Preparación de NIPAAm ricos (rico en N) y NIPAAm pobres (N-pobres) Fases de separación de fases de Supersaturada NIPAAm
- Disolver monómero NIPAAm en agua DI en relación w / w de 1: 1 utilizando un mezclador de vórtice; por ejemplo, disolver 10 g de NIPAAm en 10 ml de agua DI (primera imagen de la Figura 2a).
Nota: Una vez que el monómero NIPAAm se haya disuelto completamente a temperatura ambiente, la solución aparece turbia (segunda imagen de la Figura 2a). Este fenómeno es la primera señal se ha producido con éxito que la separación de fases de solubilidad inducida del monómero NIPAAm sobresaturada. - Deje que la solución de monómero para descansar en una posición vertical a temperatura ambiente durante al menos 15 minutos. La fase superior es la fase rico en N, y la fase densa inferior es la N-pobres fase (tercera imagen de la figura 2a). Las densidades de THfases e rico en N y N-pobres son 0,93 ± 0,01 y 0,99 ± 0,01 g cm-3, respectivamente. 15
- Cuando la interfaz de la separación de las dos fases se hace evidente, extraer cuidadosamente 2 ml del solución de monómero a partir de las fases N-ricos y N-pobres sin molestar a esta interfaz mediante el uso de una pipeta.
- Añadir 4 mg de N, N '-methylenebisacrylamide (MBAAm) como un agente de reticulación y 4 mg de 4- fenil- (2-hidroxietoxi) (2-hidroxi-2-propil) cetona como un fotoiniciador a la extraída rico en N y N -poor soluciones de monómero para preparar fluidos básicos 1 y 2 para la baja concentración de agente de entrecruzamiento (2 mg ml -1) muestra (B1 y B2 en la Figura 2b).
- Repita anterior Paso 3.3 y añadir 80 mg de MBAAm y 4 mg de 4- fenil- (2-hidroxietoxi) (2-hidroxi-2-propil) cetona en cada uno de solución de monómero rico en N y N-pobre extraído para preparar fluidos básicos 1 y 2 para la alta concentración de agente de reticulación (40 mg ml -1) muestra (b3 y b4 en la figuraUre 2b).
- Disolver 10% en peso de tensioactivo de aceite en aceite mineral para preparar el fluido de revestimiento (b5 en la Figura 2b).
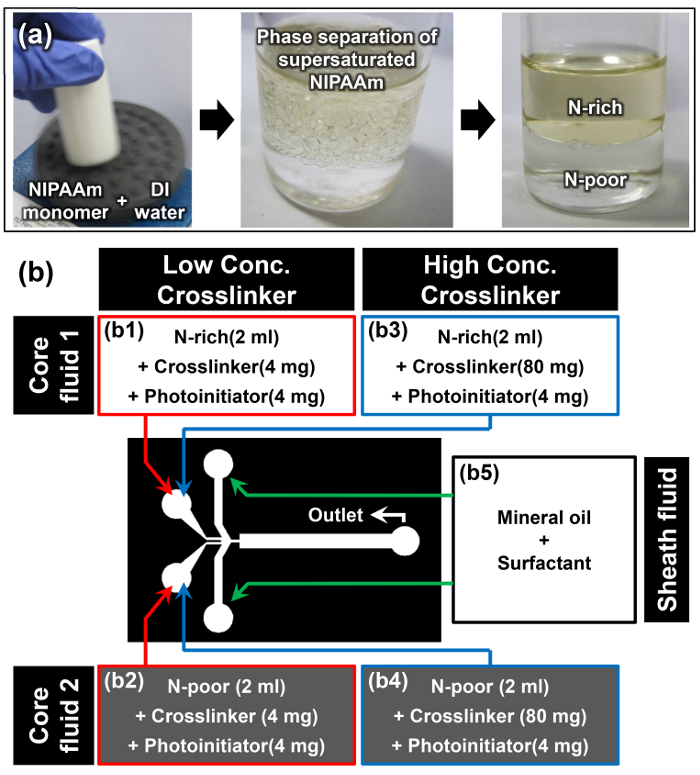
Figura 2:. Preparación de materiales para Janus Microhydrogel Síntesis (a) Preparación de soluciones de N-ricos y pobres N-monómero a través de la separación de fases de NIPAAm sobresaturada. (B) Los detalles de los materiales y la configuración experimental utilizada en el protocolo. Haga clic aquí para ver una versión más grande de esta figura.
4. Síntesis de Janus Microhydrogels Uso de la MPB
- Carga de 2 ml de los fluidos del núcleo 1 y 2 (b1, b3 b2 o, b4 en Fi gura 2b) y el fluido de revestimiento (B5 en la figura 2b) en tres separadas 3 ml jeringas.
- Montar las jeringas en las bombas de jeringa y conectar cada jeringa para la entrada de fluido apropiada de la HFMD utilizando tubería (Figura (b). Usa tuberías para conectar la salida de fluido de la HFMD a un depósito de recogida.
- Establecer las bombas de jeringa e inyectar fluidos básicos 1 y 2 y fluido de revestimiento a velocidades de flujo de 2, 2, y 10 min l -1, respectivamente.
- (Opcional) Tune la velocidad de flujo de fluidos del núcleo 1 y 2 para ajustar las relaciones de volumen relativo de cada lado de la microgota Janus.
- Coloque la fuente de luz UV perpendicularmente alrededor de 1 cm de distancia del depósito de recogida. Conectar la fuente de luz UV y controlar visualmente la producción continua de microhydrogels Janus.
Precaución: El uso de protección UV-gafas, al supervisar la producción microhydrogel. - Recoge los microhydrogels Janus fabricados en un tubo cónico y lavarlos usando IPA. A continuación, se centrifuga el tubo cónico (780 g durante 5 minutos) para resolver lamicrohydrogels.
- Repita el paso 4.6 varias veces para eliminar el aceite mineral que rodea a los microhydrogels Janus por completo.
- Repita el paso 4.6, pero el uso del agua DI con un agente tensioactivo en agua de 0,005% (v / v) en lugar de IPA para quitar el sobrante alrededor de las IPA microhydrogels Janus.
- Almacenar microhydrogels Janus completamente lavados en una que contiene agua DI vial de 10 ml.
5. Análisis de la Termo-anisotrópico capacidad de respuesta de Janus Microhydrogels
- Utilizar una pipeta para colocar microhydrogels Janus sintetizados a partir de la sección 4 en una placa de 24 pocillos. Permitir que los microhydrogels se asienten durante 15 segundos hasta que una monocapa se forma en la superficie inferior del pozo.
- Obtener una imagen de la microhydrogel Janus a 24 ° C utilizando un microscopio óptico en posición vertical con una lente de objetivo 5X.
- Establecer un módulo termoeléctrico debajo de la placa y así controlar el voltaje de este módulo para aumentar la temperatura de la solución que contiene Janus microhidrogeles a 32 ° C.
- Obtener una imagen de la microhydrogel Janus a 32 ° C, una vez más mediante el uso de un microscopio óptico en posición vertical con una lente de objetivo 5X.
- Repita los pasos 5.2-5.4 24 veces, teniendo cuidado de elegir un microhydrogel Janus diferente para el análisis estadístico.
- De las 25 imágenes de diferentes microhydrogels Janus en 24 y 32 ° C, medir el radio de las partes PN-ricos y PN-pobres de las microhydrogels Janus utilizando software de análisis de imagen de acuerdo con las instrucciones del fabricante.
Resultados
La Figura 3a presenta un esquema de la configuración experimental utilizada para sintetizar microhydrogels Janus a través de la HFMD. Las fases N-ricos y N-pobres fueron inyectados con precisión en la HFMD como fluidos de núcleo 1 y 2 y luego se fusionaron y divide en microgotas Janus en el orificio por el fluido de revestimiento de aceite mineral debido a la inestabilidad capilar Rayleigh. En consecuencia, microgotas Janus compuestas de fases N-ricos y N-po...
Discusión
Dos materiales de base inmiscibles se utilizan generalmente para sintetizar los microhydrogels Janus. Hasta hace poco, microhydrogels Janus que consisten en el mismo material de base rara vez se informa y los microhydrogels Janus reportados no tienen una morfología interna clara debido a la perturbación causada por la miscibilidad de los materiales que lo componen. 35, 36 En este protocolo, se demuestra un método para sintetizar microhydrogels Janus compuesto en su totalidad de material de una sola base, P...
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
This work was supported by the National Research Foundation of Korea (NRF) grant funded by the Korea Government (MSIP (Nos. 2014R1A2A1A01006527 and 2011-0030075).
Materiales
| Name | Company | Catalog Number | Comments |
| Silicon wafer | LG Siltron | 4", Test grade | Wafer for master mold fabrication |
| Acetone | Samchun Pure Chemical | A0097 | Cleaning silicon wafer |
| Isopropyl alcohol (IPA) | Daejung Chemicals & Metals | 5035-4404 | Cleaning silicon wafer |
| Water purification system | Merck Millipore | EMD Millipore RIOs Essential 5 | Prepering deionized water |
| O2 plasma machine | Femto Science | VITA-A | Cleaning silicon wafer |
| SU-8 2150 negative photoresist | MicroChem | Y111077 0500L1GL | Photoresist for master mold fabrication |
| Hot plate | Misung Scientific | HP330D, HP150D | Baking SU-8 |
| SU-8 developer | Microchem | Y020100 4000L1PE | Developing SU-8 |
| Mask aligner system for photolithograpy | Shinu Mst Co. | CA-6M | Photolithography |
| Sylgard 184 silicone elastomer kit | Dow Corning | 1064891 | PDMS casting |
| Laboratory Corona Treater | Electro-technic Products Inc. | Model BD-20AC | PDMS air plasma treatment |
| N-isopropylacrylamide (NIPAAm) | Sigma-Aldrich | 415324-50G | Monomer |
| N,N'-methylenebisacrylamide (MBAAm) | Sigma-Aldrich | 146072-100G | Crosslinker of NIPAAm |
| 4-(2-hydroxyethoxy)phenyl-(2-hydroxy-2-propyl)ketone, Irgacure 2959 | BASF | 55047962 | Photoinitiator of NIPAAm |
| ABIL EM 90 | Evonik Industries | 201109 | Sufactant for oil |
| Vortex mixer | Scientific Industries Inc. | Vortex-Genie 2 | Mixing |
| Tygon tubing | Saint-Gobain | I.D. 1/32", O.D. 3/32", Wall 1/32" | Connecting tube between syringes and HFMD |
| UV light source | Hamamatsu | Spot light source LC8 | Polymerization from NIPAAm to PNIPAAm |
| Syringes, NORM-JECT (3ml) | Henke-Sass Wolf GmbH | 22767 | Loading of materials |
| Syringe pump | KD Scientific | KDS model 200 | Perfusion of materials |
| Tegitol Type NP-10 | Sigma-Aldrich | NP10-500ML | Surfactant for water |
| Oil red O | Sigma-Aldrich | O0625-25G | Dye for N-rich phase |
| Oil Blue N | Sigma-Aldrich | 391557-5G | Dye for N-rich phase |
| Yellow food dye | Edentown F&B | NA | Dye for N-poor phase |
| Green food dye | Edentown F&B | NA | Dye for N-poor phase |
| Power supply | Agilent | E3649A | Power soruce for thermoelectric moduel |
| Thermoelectric module | Peltier | FALC1-12710T125 | Temparature control |
| Centrifuge machine | Labogene | 1248R | Settling down microhydrogels |
| 24-well plate | SPL Life Sciences | 32024 | Reservoir for observation |
| Optical microscope | Nikon | ECLIPSE 80i | Optical observation |
| Image analysis software | IMT i-Solution Inc. | iSolutions DT | Measurement of radius |
Referencias
- Hoffman, A. S. Hydrogels for biomedical applications. Adv. Drug Delivery Rev. 54 (1), 3-12 (2002).
- Qiu, Y., Park, K. Environment-sensitive hydrogels for drug delivery. Adv. Drug Delivery Rev. 53 (3), 321-339 (2001).
- Hirokawa, Y., Tanaka, T. Volume phase transition in a nonionic gel. J. Chem. Phys. 81 (12), 6379-6380 (1984).
- Bae, Y. H., Okano, T., Hsu, R., Kim, S. W. Thermo-sensitive polymers as on-off switches for drug release. Macromol. Rapid Commun. 8 (10), 481-485 (1987).
- Yoshida, R., et al. Comb-type grafted hydrogels with rapid deswelling response to temperature changes. Nature. 374 (6519), 240-242 (1995).
- Tanaka, T. Collapse of gels and the critical endpoint. Phys. Rev. Lett. 40 (12), 820-823 (1978).
- Tanaka, T., et al. Phase transitions in ionic gels. Phys. Rev. Lett. 45 (20), 1636-1639 (1980).
- Zhao, Y. L., Stoddart, J. F. Azobenzene-based light-responsive hydrogel system. Langmuir. 25 (15), 8442-8446 (2009).
- Alvarez-Lorenzo, C., Bromberg, L., Concheiro, A. Light-sensitive intelligent drug delivery systems. Photochem. Photobiol. 85 (4), 848-860 (2009).
- Tanaka, T., Nishio, I., Sun, S. T., Ueno-Nishio, S. Collapse of gels in an electric field. Science. 218 (4571), 467-469 (1982).
- Kwon, I. C., Bae, Y. H., Kim, S. W. Electrically credible polymer gel for controlled release of drugs. Nature. 354 (6351), 291-293 (1991).
- Obaidat, A. A., Park, K. Characterization of protein release through glucose-sensitive hydrogel membranes. Biomaterials. 18 (11), 801-806 (1997).
- Kataoka, K., Miyazaki, H., Bunya, M., Okano, T., Sakurai, Y. Totally synthetic polymer gels responding to external glucose concentration: their preparation and application to on-off regulation of insulin release. J. Am. Chem. Soc. 120 (48), 12694-12695 (1998).
- Heskins, M., Guillet, J. E. Solution properties of poly(N-isopropylacrylamide). J. Macromol. Sci. Part A Pure Appl. Chem. 2 (8), 1441-1455 (1968).
- Sasaki, S., Okabe, S., Miyahara, Y. Thermodynamic properties of N-isopropylacrylamide in water: solubility transition, phase separation of supersaturated solution, and glass formation. J. Phys. Chem. B. 114 (46), 14995-15002 (2010).
- Bromberg, L., Alakhov, V. Effects of polyether-modified poly(acrylic acid) microgels on doxorubicin transport in human intestinal epithelial Caco-2 cell layers. J. Controlled Release. 88 (1), 11-22 (2003).
- Coughlan, D. C., Quilty, F. P., Corrigan, O. I. Effect of drug physicochemical properties on swelling/deswelling kinetics and pulsatile drug release from thermoresponsive poly(N-isopropylacrylamide) hydrogels. J. Controll. Release. 98 (1), 97-114 (2004).
- Bergbreiter, D. E., Case, B. L., Liu, Y. S., Caraway, J. W. Poly(N-isopropylacrylamide) soluble polymer supports in catalysis and synthesis. Macromolecules. 31 (18), 6053-6062 (1998).
- Lapeyre, V., Gosse, I., Chevreux, S., Ravaine, V. Monodispersed glucose-responsive microgels operating at physiological salinity. Biomacromolecules. 7 (12), 3356-3363 (2006).
- Hoare, T., Pelton, R. Engineering glucose swelling responses in poly(N-isopropylacrylamide)-based microgels. Macromolecules. 40 (3), 670-678 (2007).
- Xu, S., Zhang, J., Paquet, C., Lin, Y., Kumacheva, E. From hybrid microgels to photonic crystals. Adv. Funct. Mater. 13 (6), 468-472 (2003).
- Clarke, J., Vincent, B. Stability of non-aqueous microgel dispersions in the presence of free polymer. J. Chem. Soc., Faraday Trans. 1. 77 (8), 1831-1843 (1981).
- Mears, S. J., Deng, Y., Cosgrove, T., Pelton, R. Structure of sodium dodecyl sulfate bound to a poly (NIPAM) microgel particle. Langmuir. 13 (7), 1901-1906 (1997).
- Shah, R. K., Kim, J. W., Agresti, J. J., Weitz, D. A., Chu, L. Y. Fabrication of monodisperse thermosensitive microgels and gel capsules in microfluidic devices. Soft Matter. 4 (12), 2303-2309 (2008).
- Jack, C. R., Forbes, G., Dewanjee, M. K., Brown, M. L., Earnest, F. Polyvinyl alcohol sponge for embolotherapy: particle size and morphology. Am. J. Neuroradiol. 6 (4), 595-597 (1985).
- Derdeyn, C. P., Moran, C. J., Cross, D. T., Dietrich, H. H., Dacey, R. G. Polyvinyl alcohol particle size and suspension characteristics. Am. J. Neuroradiol. 16 (6), 1335-1343 (1995).
- Han, K., et al. Effect of flow rates on generation of monodisperse clay-poly(N-isopropylacrylamide) embolic microspheres using hydrodynamic focusing microfluidic device. Jpn. J. Appl. Phys. 50 (6), 06-12 (2011).
- Seo, K. D., Doh, J., Kim, D. S. One-step microfluidic synthesis of Janus microhydrogels with anisotropic thermo-responsive behavior and organophilic/hydrophilic loading capability. Langmuir. 29 (49), 15137-15141 (2013).
- Seo, K. D., Kim, D. S. Microfluidic synthesis of thermo-responsive poly(N-isopropylacrylamide)-poly(ethylene glycol) diacrylate microhydrogels as chemo-embolic microspheres. J. Micromech. Microeng. 24 (8), 085001 (2014).
- Seo, K. D., Kwak, B. K., Kim, D. S., Sánchez, S. Microfluidic-assisted fabrication of flexible and location traceable organo-motor. IEEE Trans. Nanobiosci. 14 (3), 298-304 (2015).
- Seo, K. D., Kim, D. S., Sánchez, S. Fabrication and application of complex-shaped microparticles via microfluidics. Lab Chip. , (2015).
- Shah, R. K., Kim, J. W., Weitz, D. A. Janus supraparticles by induced phase separation of nanoparticles in droplets. Adv. Mater. 21 (19), 1949-1953 (2009).
- Lone, S., et al. Microfluidic synthesis of Janus particles by UV-directed phase separation. Chem. Commun. 47 (9), 2634-2636 (2011).
- Hauber, K., Drier, T., Beebe, D. PDMS bonding by means of a portable, low-cost corona system. Lab chip. 6 (12), 1548-1549 (2006).
- Nisisako, T., Torii, T., Takahashi, T., Takizawa, Y. Synthesis of monodisperse bicolored Janus particles with electrical anisotropy using a microfluidic co-flow system. Adv. Mater. 18 (9), 1152-1156 (2006).
- Seiffert, S., Romanowsky, M. B., Weitz, D. A. Janus microgels produced from functional precursor polymers. Langmuir. 26 (18), 14842-14847 (2010).
- Peppas, N. A., Hilt, J. Z., Khademhosseini, A., Langer, R. Hydrogels in biology and medicine: from molecular principles to bionanotechnology. Adv. Mater. 18 (11), 1345-1360 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados