A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
סינתזה של פולי (
In This Article
Summary
We present a protocol to synthesize Janus microhydrogels composed entirely of the same base material, poly(N-isopropylacrylamide) (PNIPAAm), with a clearly compartmentalized structure base on the phase separation of a supersaturated NIPAAm monomer solution. The synthesized Janus microhydrogels show unique properties such as anisotropic thermo-responsiveness and organophilic/hydrophilic loading capability.
Abstract
Janus microparticles are compartmentalized particles with differing molecular structures and/or functionality on each of their two sides. Because of this unique property, Janus microparticles have been recognized as a new class of materials, thereby attracting a great deal of attention from various research fields. The versatility of these microparticles has been exemplified through their uses as building blocks for self-assembly, electrically responsive actuators, emulsifiers for painting and cosmetics, and carriers for drug delivery. This study introduces a detailed protocol that explicitly describes a synthetic method for designing novel Janus microhydrogels composed of a single base material, poly(N-isopropylacrylamide) (PNIPAAm). Janus microdroplets are firstly generated via a hydrodynamic focusing microfluidic device (HFMD) based on the separation of a supersaturated aqueous NIPAAm monomer solution and subsequently polymerized through exposure to UV irradiation. The resulting Janus microhydrogels were found to be entirely composed of the same base material, featured an easily identifiable compartmentalized morphology, and exhibited anisotropic thermo-responsiveness and organophilic/hydrophilic loading capability. We believe that the proposed method introduces a novel hydrogel platform with the potential for advanced synthesis of multi-functional Janus microhydrogels.
Introduction
Hydrogels are a network of hydrophilic polymer chains.1 An increasing amount of research in the field of hydrogels has promoted significant advances and revealed their similarity to biological tissues; the properties of hydrogels allow the uptake of large amounts of water while maintaining their structure. Environmentally responsive hydrogels have also been studied extensively because of their ability to swell or shrink reversibly in response to external stimuli.2 Several triggers, including temperature,3-5 pH,6,7 light,8,9 electric fields,10,11 and specific molecules, such as glucose,12,13 have been suggested to control the geometric shape of hydrogels. Among the many environmentally responsive hydrogels currently available, poly(N-isopropylacrylamide) (PNIPAAm), a well-known thermo-responsive hydrogel, exhibits volume shrinkage above a low critical solution temperature (LCST) of 32 °C.14 A recent study by Sasaki et al.15 reported the intriguing liquid-liquid phase separation of supersaturated NIPAAm, which is the monomer of PNIPAAm. According to this report, supersaturated NIPAAm was dissolved with a 10-fold molar excess of H2O, and soon after, the solution separated into two liquid phases when allows to stand at a temperature above 25 °C; by contrast, dilute NIPAAm was dissolved homogeneously under the same conditions.
Microparticles made of environmentally responsive hydrogels are fascinating candidates for application in drug delivery,16,17 catalysis,18 sensing,19,20 and photonics.21 Traditional synthetic methods including emulsion polymerization, are used to produce hydrogel microparticles with polydispersity.22,23 However, certain applications require microparticles with a narrow size distribution, for example, to stabilize the pharmacokinetics of drug delivery.24 Irregularly shaped or polydisperse embolic microparticles aggregate proximally into clusters, leading to chronic inflammatory responses in embolic particles for cancer therapeutic treatment.25,26
The microfluidic approach is at the forefront of research as a means of fabricating micro-sized particles with narrow size distributions and complex shapes.27-31 The advantages of fabricating microparticles in the microfluidic device are predicated by the small characteristic length of the microfluidic device, which results in a low Reynolds number. In contrast to traditional bulk emulsification where drops are formed in parallel, microdroplets produced in microfluidic devices are generated in series and subsequently polymerized into microparticles upon exposure to UV irradiation. The fundamental principle of droplet formation using a microfluidic device is balance between the interfacial tension and the shear force of the sheath fluid acting on the core fluid.
Despite the obvious advantages of microfluidic fabrication of droplets/particles, Janus droplets/particles consisting of the same base material are rarely reported because the internal morphology of these droplets/particles is generally disturbed by the diffusion and perturbation of the core fluids. To circumvent this intrinsic limitation, two groups recently reported the preparation of the Janus microparticles by employing heat-induced phase separation of colloidal nanoparticles and UV-directed phase separation.32,33
To this end, we report a microfluidic approach to synthesize Janus microhydrogels entirely composed of a single base material and obtain a product with clearly compartmentalized morphology. Our approach is based on the primary concept of liquid-liquid phase separation of supersaturated NIPAAm monomer. The resulting Janus microhydrogels were found to possess unique properties including anisotropic thermo-responsiveness and organophilic/hydrophilic loading capability.
Protocol
ייצור 1. של עובש אב המכשיר microfluidic התמקדות הידרודינמית (HFMD) באמצעות ליתוגרפיה
- עיצוב photomask עבור HFMD (איור 1 א) באמצעות תוכנת מחשב בסיוע עיצוב (CAD) על פי פרוטוקול של היצרן.
- לשטוף פרוסות סיליקון 4 'עם אצטון, אלכוהול איזופרופיל (IPA), ו ללא יונים (DI) במים כדי להסיר אבק אורגניים ואי-אורגניים מן רקיק.
- נקו את פרוסות סיליקון עם פלזמה O 2 ב 100 וואט במשך 5 דקות כדי להגביר את כוח מליטה בין רקיק SU-8.
- ספין-מעיל 4 מ"ל של photoresist שלילית, SU-8 2150, על גבי פרוסות סיליקון בסל"ד 3000 למשך 30 שניות כדי להשיג עובי של 150 מיקרומטר (ב 1 באיור 1b).
- מניח את הפרוסות מצופות SU-8 על פלטה חמה למשך 5 דקות ב 65 מעלות צלזיוס, להגדיר את הטמפרטורה עד 95 מעלות צלזיוס, ולאחר מכן לעזוב את הרקיק על הפלטה החמה למשך 30 דקות כדי לאפות רך.
- מניחים אתתוכנן photomask על פרוסות סיליקון ולחשוף לאור UV (260 mJ -2 ס"מ, 26 שניות -2 10 mW ס"מ) aligner המסכה (B2 באיור 1b).
- בצע שלאחר חשיפה לאפות על פלטה חמה (65 מעלות צלזיוס למשך 5 דקות ולאחר מכן 95 מעלות צלזיוס במשך 12 דקות).
- פיתוח הרקיק ידי טבילה באמבט מפתח SU-8 למשך 10 דקות, ולאחר מכן להעביר אותו לתוך מפתח טרי במשך 5 שניות כדי לקבל משטח נקי.
- שוטפים את פרוסות סיליקון עבור 20 שניות עם מים די ולייבשו במשך 10 שניות עם גז N 2 (ב 3 באיור 1b). השתמש רקיק מפוברק כמו עובש אב polydimethylsiloxane (PDMS) הליהוק בסעיף 2.
ייצור 2. HFMD דרך יציקת PDMS
- השתמש רקיק בדוגמת המתקבל בסעיף 1 כמו עובש אמן ליציקת PDMS.
- מערבבים את מראש פולימר PDMS ואת סוכן ריפוי הומוגנית לפי יחס משקל של 10: 1; למשל, להשתמש 1 גרם של סוכן ריפוי עבור 10 גרם של-polym מראש PDMSאה.
- יוצקים את PDMS מראש פולימר לתוך התבנית מאסטר ודגה זה עבור שעה 1 בתא ואקום (B4 באיור 1b).
- מניחים את התבנית הורים עם הקדם-פולימר PDMS לתוך בתנור על 65 מעלות צלזיוס במשך 3 שעות.
- חותכים את PDMS נרפא לתוך בגודל של שבב יחיד באמצעות אזמל חד. בזהירות לקלף את העתק PDMS נרפא מהתבנית המאסטר ביד.
- חזור על שלבי 2.2 עד 2.5 עד לקבל העתק PDMS זהה.
- פונץ כניסה ויציאה חורה לאחת ההעתקים באמצעות-אגרופן חור בקוטר מעט קטן יותר מאשר הקוטר החיצוני של צינורות חיבור.
- החל טיפול פלזמה אוויר לאזור מליטה של כל העתק באמצעות treater קורונה. 34
זהירות: השתמש treater קורונה באזור עם אוורור טוב כדי למנוע הצטברות אוזון. - ירידה של 5 μl של מתנול על אזורי הפלזמה שטופלה האוויר. דק ליישר שני העתקים PDMS זהה לפברק את HFMD ביד manipu אוכלוסייה, ולבדוק יישור באמצעות מיקרוסקופ (B5 באיור 1b).
הערה: העתקי PDMS הפלזמה שטופלה האוויר הם די דביקים וקשים לתמרן. לפיכך, 5 μl של מתנול מתווסף אל פני שטח הפלזמה שטופלה האוויר לתפקד כחומר סיכה. - מניחים את HFMD בתנור שחומם ל -65 מעלות למשך הלילה C כדי לחזק את הקשר בין שני העתקים PDMS (B6 באיור 1b). בונד שני העתקי PDMS זהים להגדיל את הגובה של microchannel של HFMD ולהימנע סתימת microdroplets בערוץ microfluidic במהלך מבצע.
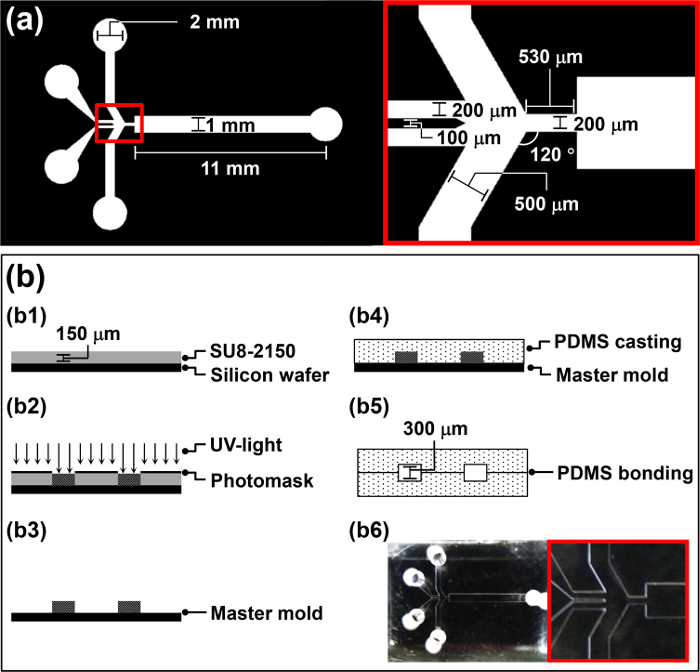
איור 1: סקירה כללית של הליך ייצור HFMD (א) פרמטרים עיצוב של photomask עבור HFMD.. (ב) איור של הליך הייצור עבור HFMD."Target =" ftp_upload / 52,813 / 52813fig1large.jpg _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
3. הכנת NIPAAm העשירית (N-עשיר) ו NIPAAm-עלוב (N-עניים) שלבים על ידי הפרדת פאזות של רווית NIPAAm
- ממיסים מונומר NIPAAm במים DI ב יחס aw / w של 1: 1 בעזרת מערבל מערבולת; למשל, לפזר 10 גרם של NIPAAm ב 10 מ"ל מים DI (התמונה הראשונה של איור 2 א).
הערה: לאחר מונומר NIPAAm נמס לגמרי בטמפרטורת חדר, הפתרון נראה עכורה (תמונה שנייה של איור 2 א). תופעה זו היא הסימן הראשון כי הפרדת פאזות מושרה המסיסה של מונומר NIPAAm הרוויה התרחשה בהצלחה. - אפשר פתרון מונומר לנוח במצב אנכי בטמפרטורת החדר למשך 15 דקות לפחות. השלב העליון הוא השלב N-העשיר, ואת השלב התחתון הצפוף הוא השלב N-העלוב (תמונה שלישית של איור 2 א). הצפיפויות של הדואר N-עשירים N-עניים שלבים הם 0.93 ± 0.01 ו 0.99 ± 0.01 גרם ס"מ -3, בהתאמה. 15
- כאשר ממשק הפרדת שני השלבים מתבהר, לחלץ בזהירות 2 מיליליטר של תמיסת מונומר משלבי N-העשירים N-עניים מבלי להפריע ממשק זה באמצעות פיפטה.
- הוסף 4 מ"ג של N, -methylenebisacrylamide 'N (MBAAm) בתור crosslinker ו -4 מ"ג של 4- (2-hydroxyethoxy) phenyl- (2-הידרוקסי-2-propyl) קטון בתור photoinitiator אל N-עשיר חילוץ N -poor פתרונות מונומר להכין נוזלים הליבה 1 ו -2 לצורך ריכוז crosslinker נמוך (2 מ"ג מ"ל -1) מדגם (B1 ו- B2 באיור 2b).
- חזור על הצעד קודם 3.3 ולהוסיף 80 מ"ג של MBAAm ו -4 מ"ג של 4- (2-hydroxyethoxy) phenyl- (2-הידרוקסי-2-propyl) קיטון לתוך כל אחד פתרון מונומר חילוץ N-עשיר N-העני להכין נוזלי ליבה 1 ו -2 עבור ריכוז גבוה crosslinker (40 מ"ג מ"ל -1) מדגם (B3 ו- B4 באיוריור 2b).
- ממיסים 10% WT של פעילי שטח שמן לתוך שמן מינרלי להכין את נוזל נדן (B5 ב איור 2b).
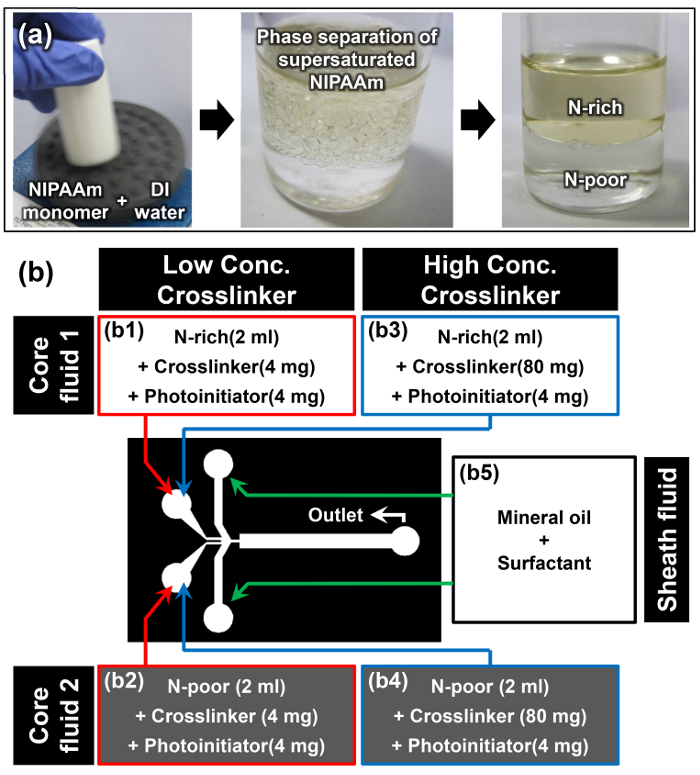
איור 2:. הכנת חומר עבור יאנוס Microhydrogel סינתזה (א) הכנת N-עשירים N-עניים פתרונות מונומר באמצעות הפרדת פאזות של NIPAAm רוויה. (ב) פירוט החומרים ההתקנה הניסוי נעשה שימוש בפרוטוקול. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
סינתזה 4. של יאנוס Microhydrogels שימוש HFMD
- טען 2 מ"ל של נוזלים הליבה 1 ו -2 (B1, B2 או B3, B4 בתרשים 2b) ואת נוזל נדן (B5 באיור 2b) לשלוש 3 מ"ל מזרקים נפרד.
- הר מזרקים לתוך משאבות מזרק ולהתחבר מזרק אחד אל כניסת הנוזל המתאים של HFMD באמצעות צינורות (איור (ב). השתמש צינורות לחיבור לשקע נוזל של HFMD למאגר אוסף.
- הגדר את משאבות מזרק להשרות נוזלי ליבת 1 ו -2 ו נוזל נדן ברמות ספיקה של 2, 2, ו -10 μl דקות -1, בהתאמה.
- Tune (אופציונלי) את קצב הזרימה של נוזלים הליבה 1 ו -2 כדי לכוונן את יחסי הנפח היחסי של כל צד של microdroplet יאנוס.
- מקם את מקור אור UV בניצב על 1 סנטימטר מן המאגר האוסף. הפעילו את מקור האור האולטרה סגול ויזואלית לפקח על ייצור רציף של microhydrogels יאנוס.
אזהרה: השימוש UV מגן-משקפים כאשר ניטור ייצור microhydrogel. - אסוף את microhydrogels תאנוס מפוברק לתוך צינור חרוטים ולשטוף אותם באמצעות IPA. לאחר מכן, צנטריפוגות צינור חרוטי (780 גרם במשך 5 דק ') כדי ליישב אתmicrohydrogels.
- חזור על שלב 4.6 כמה פעמים כדי להסיר את שמן מינרלי סביב יאנוס microhydrogels לחלוטין.
- חזור על שלב מים DI 4.6 אך השימוש עם פעילי שטח המים של 0.005% (v / v) במקום IPA להסיר את IPA שאריות ברחבי microhydrogels יאנוס.
- אחסן לחלוטין שטף יאנוס microhydrogels בתוך מים די 10 מ"ל בקבוקון המכיל.
ניתוח 5.-היענות Thermo אניזוטרופי של יאנוס Microhydrogels
- השתמש פיפטה למקם יאנוס microhydrogels מסונתז מסעיף 4 לתוך צלחת 24 גם. אפשר microhydrogels להסתפק 15 שניות עד בשכבה נוצר על פני השטח התחתון של הבאר.
- להשיג תמונה של microhydrogel יאנוס ב 24 ° C באמצעות מיקרוסקופ אופטי זקוף עם עדשה אובייקטיבית 5X.
- הגדר מודול ותרמית תחת הצלחת היטב ולשלוט מתח של מודול זה כדי להגדיל את הטמפרטורה של תמיסה המכילה מיקרו יאנוסהידרוג ל -32 מעלות צלזיוס.
- להשיג תמונה של microhydrogel יאנוס על 32 מעלות צלזיוס פעם נוספת באמצעות מיקרוסקופ אופטי זקוף עם עדשה אובייקטיבית 5X.
- חזור על שלבי 5.2-5.4 24 פעמים, מקפידים לבחור microhydrogel תאנוס שונה לניתוח סטטיסטי.
- מתוך 25 התמונות של microhydrogels השונה תאנוס ב 24 ו 32 מעלות צלזיוס, למדוד את רדיוס PN-עשיר PN-עניים החלקים microhydrogels יאנוס באמצעות תוכנת ניתוח תמונה על פי הוראות היצרן.
תוצאות
איור 3 א מציג סכמטי של הגדרת הניסוי בשימוש לסנתז יאנוס microhydrogels דרך HFMD. N-עשיר שלב N-עניים הוזרקו בדיוק לתוך HFMD כמו נוזלי ליבת 1 ו -2 ולאחר מכן התמזג התפרק microdroplets יאנוס על הפתח ידי נוזל הנדן של שמן מינרלים בגלל חוסר יציבות נימי ריילי. כתוצאה ...
Discussion
שני חומרי הבסיס immiscible משמשים בדרך כלל כדי לסנתז את microhydrogels יאנוס. עד לאחרונה, תאנוס microhydrogels המורכב מאותו חומר הבסיס לעתים רחוקות דווח ואת microhydrogels יאנוס הדיווח לא היה מורפולוגיה פנימית ברורה עקב ההפרעה הנגרמת על ידי miscibility של מחומרים המרכיבים. 35, 36 בפרוטוקול זה, ?...
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
This work was supported by the National Research Foundation of Korea (NRF) grant funded by the Korea Government (MSIP (Nos. 2014R1A2A1A01006527 and 2011-0030075).
Materials
| Name | Company | Catalog Number | Comments |
| Silicon wafer | LG Siltron | 4", Test grade | Wafer for master mold fabrication |
| Acetone | Samchun Pure Chemical | A0097 | Cleaning silicon wafer |
| Isopropyl alcohol (IPA) | Daejung Chemicals & Metals | 5035-4404 | Cleaning silicon wafer |
| Water purification system | Merck Millipore | EMD Millipore RIOs Essential 5 | Prepering deionized water |
| O2 plasma machine | Femto Science | VITA-A | Cleaning silicon wafer |
| SU-8 2150 negative photoresist | MicroChem | Y111077 0500L1GL | Photoresist for master mold fabrication |
| Hot plate | Misung Scientific | HP330D, HP150D | Baking SU-8 |
| SU-8 developer | Microchem | Y020100 4000L1PE | Developing SU-8 |
| Mask aligner system for photolithograpy | Shinu Mst Co. | CA-6M | Photolithography |
| Sylgard 184 silicone elastomer kit | Dow Corning | 1064891 | PDMS casting |
| Laboratory Corona Treater | Electro-technic Products Inc. | Model BD-20AC | PDMS air plasma treatment |
| N-isopropylacrylamide (NIPAAm) | Sigma-Aldrich | 415324-50G | Monomer |
| N,N'-methylenebisacrylamide (MBAAm) | Sigma-Aldrich | 146072-100G | Crosslinker of NIPAAm |
| 4-(2-hydroxyethoxy)phenyl-(2-hydroxy-2-propyl)ketone, Irgacure 2959 | BASF | 55047962 | Photoinitiator of NIPAAm |
| ABIL EM 90 | Evonik Industries | 201109 | Sufactant for oil |
| Vortex mixer | Scientific Industries Inc. | Vortex-Genie 2 | Mixing |
| Tygon tubing | Saint-Gobain | I.D. 1/32", O.D. 3/32", Wall 1/32" | Connecting tube between syringes and HFMD |
| UV light source | Hamamatsu | Spot light source LC8 | Polymerization from NIPAAm to PNIPAAm |
| Syringes, NORM-JECT (3ml) | Henke-Sass Wolf GmbH | 22767 | Loading of materials |
| Syringe pump | KD Scientific | KDS model 200 | Perfusion of materials |
| Tegitol Type NP-10 | Sigma-Aldrich | NP10-500ML | Surfactant for water |
| Oil red O | Sigma-Aldrich | O0625-25G | Dye for N-rich phase |
| Oil Blue N | Sigma-Aldrich | 391557-5G | Dye for N-rich phase |
| Yellow food dye | Edentown F&B | NA | Dye for N-poor phase |
| Green food dye | Edentown F&B | NA | Dye for N-poor phase |
| Power supply | Agilent | E3649A | Power soruce for thermoelectric moduel |
| Thermoelectric module | Peltier | FALC1-12710T125 | Temparature control |
| Centrifuge machine | Labogene | 1248R | Settling down microhydrogels |
| 24-well plate | SPL Life Sciences | 32024 | Reservoir for observation |
| Optical microscope | Nikon | ECLIPSE 80i | Optical observation |
| Image analysis software | IMT i-Solution Inc. | iSolutions DT | Measurement of radius |
References
- Hoffman, A. S. Hydrogels for biomedical applications. Adv. Drug Delivery Rev. 54 (1), 3-12 (2002).
- Qiu, Y., Park, K. Environment-sensitive hydrogels for drug delivery. Adv. Drug Delivery Rev. 53 (3), 321-339 (2001).
- Hirokawa, Y., Tanaka, T. Volume phase transition in a nonionic gel. J. Chem. Phys. 81 (12), 6379-6380 (1984).
- Bae, Y. H., Okano, T., Hsu, R., Kim, S. W. Thermo-sensitive polymers as on-off switches for drug release. Macromol. Rapid Commun. 8 (10), 481-485 (1987).
- Yoshida, R., et al. Comb-type grafted hydrogels with rapid deswelling response to temperature changes. Nature. 374 (6519), 240-242 (1995).
- Tanaka, T. Collapse of gels and the critical endpoint. Phys. Rev. Lett. 40 (12), 820-823 (1978).
- Tanaka, T., et al. Phase transitions in ionic gels. Phys. Rev. Lett. 45 (20), 1636-1639 (1980).
- Zhao, Y. L., Stoddart, J. F. Azobenzene-based light-responsive hydrogel system. Langmuir. 25 (15), 8442-8446 (2009).
- Alvarez-Lorenzo, C., Bromberg, L., Concheiro, A. Light-sensitive intelligent drug delivery systems. Photochem. Photobiol. 85 (4), 848-860 (2009).
- Tanaka, T., Nishio, I., Sun, S. T., Ueno-Nishio, S. Collapse of gels in an electric field. Science. 218 (4571), 467-469 (1982).
- Kwon, I. C., Bae, Y. H., Kim, S. W. Electrically credible polymer gel for controlled release of drugs. Nature. 354 (6351), 291-293 (1991).
- Obaidat, A. A., Park, K. Characterization of protein release through glucose-sensitive hydrogel membranes. Biomaterials. 18 (11), 801-806 (1997).
- Kataoka, K., Miyazaki, H., Bunya, M., Okano, T., Sakurai, Y. Totally synthetic polymer gels responding to external glucose concentration: their preparation and application to on-off regulation of insulin release. J. Am. Chem. Soc. 120 (48), 12694-12695 (1998).
- Heskins, M., Guillet, J. E. Solution properties of poly(N-isopropylacrylamide). J. Macromol. Sci. Part A Pure Appl. Chem. 2 (8), 1441-1455 (1968).
- Sasaki, S., Okabe, S., Miyahara, Y. Thermodynamic properties of N-isopropylacrylamide in water: solubility transition, phase separation of supersaturated solution, and glass formation. J. Phys. Chem. B. 114 (46), 14995-15002 (2010).
- Bromberg, L., Alakhov, V. Effects of polyether-modified poly(acrylic acid) microgels on doxorubicin transport in human intestinal epithelial Caco-2 cell layers. J. Controlled Release. 88 (1), 11-22 (2003).
- Coughlan, D. C., Quilty, F. P., Corrigan, O. I. Effect of drug physicochemical properties on swelling/deswelling kinetics and pulsatile drug release from thermoresponsive poly(N-isopropylacrylamide) hydrogels. J. Controll. Release. 98 (1), 97-114 (2004).
- Bergbreiter, D. E., Case, B. L., Liu, Y. S., Caraway, J. W. Poly(N-isopropylacrylamide) soluble polymer supports in catalysis and synthesis. Macromolecules. 31 (18), 6053-6062 (1998).
- Lapeyre, V., Gosse, I., Chevreux, S., Ravaine, V. Monodispersed glucose-responsive microgels operating at physiological salinity. Biomacromolecules. 7 (12), 3356-3363 (2006).
- Hoare, T., Pelton, R. Engineering glucose swelling responses in poly(N-isopropylacrylamide)-based microgels. Macromolecules. 40 (3), 670-678 (2007).
- Xu, S., Zhang, J., Paquet, C., Lin, Y., Kumacheva, E. From hybrid microgels to photonic crystals. Adv. Funct. Mater. 13 (6), 468-472 (2003).
- Clarke, J., Vincent, B. Stability of non-aqueous microgel dispersions in the presence of free polymer. J. Chem. Soc., Faraday Trans. 1. 77 (8), 1831-1843 (1981).
- Mears, S. J., Deng, Y., Cosgrove, T., Pelton, R. Structure of sodium dodecyl sulfate bound to a poly (NIPAM) microgel particle. Langmuir. 13 (7), 1901-1906 (1997).
- Shah, R. K., Kim, J. W., Agresti, J. J., Weitz, D. A., Chu, L. Y. Fabrication of monodisperse thermosensitive microgels and gel capsules in microfluidic devices. Soft Matter. 4 (12), 2303-2309 (2008).
- Jack, C. R., Forbes, G., Dewanjee, M. K., Brown, M. L., Earnest, F. Polyvinyl alcohol sponge for embolotherapy: particle size and morphology. Am. J. Neuroradiol. 6 (4), 595-597 (1985).
- Derdeyn, C. P., Moran, C. J., Cross, D. T., Dietrich, H. H., Dacey, R. G. Polyvinyl alcohol particle size and suspension characteristics. Am. J. Neuroradiol. 16 (6), 1335-1343 (1995).
- Han, K., et al. Effect of flow rates on generation of monodisperse clay-poly(N-isopropylacrylamide) embolic microspheres using hydrodynamic focusing microfluidic device. Jpn. J. Appl. Phys. 50 (6), 06-12 (2011).
- Seo, K. D., Doh, J., Kim, D. S. One-step microfluidic synthesis of Janus microhydrogels with anisotropic thermo-responsive behavior and organophilic/hydrophilic loading capability. Langmuir. 29 (49), 15137-15141 (2013).
- Seo, K. D., Kim, D. S. Microfluidic synthesis of thermo-responsive poly(N-isopropylacrylamide)-poly(ethylene glycol) diacrylate microhydrogels as chemo-embolic microspheres. J. Micromech. Microeng. 24 (8), 085001 (2014).
- Seo, K. D., Kwak, B. K., Kim, D. S., Sánchez, S. Microfluidic-assisted fabrication of flexible and location traceable organo-motor. IEEE Trans. Nanobiosci. 14 (3), 298-304 (2015).
- Seo, K. D., Kim, D. S., Sánchez, S. Fabrication and application of complex-shaped microparticles via microfluidics. Lab Chip. , (2015).
- Shah, R. K., Kim, J. W., Weitz, D. A. Janus supraparticles by induced phase separation of nanoparticles in droplets. Adv. Mater. 21 (19), 1949-1953 (2009).
- Lone, S., et al. Microfluidic synthesis of Janus particles by UV-directed phase separation. Chem. Commun. 47 (9), 2634-2636 (2011).
- Hauber, K., Drier, T., Beebe, D. PDMS bonding by means of a portable, low-cost corona system. Lab chip. 6 (12), 1548-1549 (2006).
- Nisisako, T., Torii, T., Takahashi, T., Takizawa, Y. Synthesis of monodisperse bicolored Janus particles with electrical anisotropy using a microfluidic co-flow system. Adv. Mater. 18 (9), 1152-1156 (2006).
- Seiffert, S., Romanowsky, M. B., Weitz, D. A. Janus microgels produced from functional precursor polymers. Langmuir. 26 (18), 14842-14847 (2010).
- Peppas, N. A., Hilt, J. Z., Khademhosseini, A., Langer, R. Hydrogels in biology and medicine: from molecular principles to bionanotechnology. Adv. Mater. 18 (11), 1345-1360 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved