A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Photopatterning البروتينات والخلايا في وسط مائي البيئة عن طريق تيو
In This Article
Summary
We describe a protocol for modifying cell affinity of a scaffold surface in aqueous environment. The method takes advantage of titanium dioxide photocatalysis to decompose organic film in the photo-irradiated region. We show that it can be used to create microdomains of scaffolding proteins, both ex situ and in situ.
Abstract
الملوثات العضوية كثف على السطح من ثاني أكسيد التيتانيوم (تيو 2) يمكن أن تتحلل عن طريق تحفيز ضوئي تحت الأشعة فوق البنفسجية (UV) النور. نحن هنا وصف بروتوكول رواية توظيف تحفيز ضوئي تيو 2 لتغيير محليا تقارب خلية من سطح الركيزة. لهذه التجربة، وكان رقيق تيو 2 فيلم على ساترة الزجاج المطلي تفل، وتم تعديل سطح تيو 2 في وقت لاحق مع أحادي الطبقة organosilane المستمدة من octadecyltrichlorosilane (OTS)، الذي يمنع التصاق الخلية. تم مغمورة العينة في مستنبت الخلية، وركز تم المشع ضوء الأشعة فوق البنفسجية إلى منطقة مثمنة. عندما كانت مطلية على الخلايا PC12 خط الخلية العصبية على العينة، خلايا التقيد فقط على منطقة المشع للأشعة فوق البنفسجية. وتبين لنا أيضا أن هذا التعديل السطح ويمكن أيضا أن يؤديها في الموقع، أي حتى عندما الخلايا تنمو على الركيزة. التعديل المناسب للسطح المطلوب مصفوفة ص خارج الخليةrotein الكولاجين ليكون حاضرا في المتوسط في وقت اشعة فوق البنفسجية. تقنية المعروضة هنا يمكن أن يحتمل استخدامها في الزخرفة أنواع خلايا متعددة لبناء أنظمة coculture أو التلاعب تعسفية الخلايا تحت الثقافة.
Introduction
عمليات أشباه الموصلات الطباعة الحجرية ومشتقاته - مثل 1،2 ضوئيه، شعاع الإلكترون الطباعة الحجرية 3-6، وmicrocontact طباعة 10/07 - أصبحت الآن أداة أنشئت في بيولوجيا الخلية في النمو الخلايا الحية في وضع تعريف والهندسة. يعتمد أسلوب الزخرفة على استخدام ركائز microfabricated، تتكون من جزيرة صغيرة من الخلايا طلاء متساهل في الخلفية غير متساهلة. تخدم هذه الركيزة كقالب لنمط الخلايا. وقد وفرت هذه التقنيات لنا طرق جديدة لهندسة الخلايا وظيفتها على مستوى أحادية ومتعددة الخلايا، لاستخراج الخصائص الجوهرية للخلايا، وزيادة الإنتاجية من خلية القاعدة المخدرات فحص 11.
ان درجة-الحرية في الزخرفة الخلية زيادة كبيرة إذا كان من الممكن تغيير هندسة نمط القالب في الموقع، أي في حين أن الخلايا يتم تربيتها على الصورةurface. الأساليب التقليدية لتشكيل نمط لا يمكن تطبيقها مباشرة هنا، لأنها معالجة العينات في الجو أو في فراغ. وقد اقترحت مختلف بالتالي تقنيات تعديل السطح الجديدة، والتي تقوم، على سبيل المثال، على مركبات photoreactive 12،13 أو ليزر الاجتثاث 5،14، على سبيل المثال لا الحصر. وقد تم استعراض الأساليب المقترحة لطيف من قبل روبرتوس وآخرون 15، ومؤخرا من قبل تشوي وآخرون. 16 وناكانيشي 17.
هنا في هذه المقالة، نحن تصف بروتوكول رواية في الموقع تعديل السطح، الذي يستفيد من التحلل بهوتوكاتاليتيك من الجزيئات العضوية على ثاني أكسيد التيتانيوم (تيو 2) سطح 18،19. في هذه الطريقة، يتم إدراج فيلم تيو 2 بين الركيزة الزجاج والفيلم العضوية التي واجهات الخلايا، وتتحلل الفيلم العضوية في الموقع عن طريق تشعيع محليا فوق البنفسجية (UV)ضوء على المنطقة ذات الاهتمام (λ <388 نانومتر). وتبين لنا أن البروتوكول الجديد يمكن أن تستخدم لخلق micropatterns من البروتينات المصفوفة خارج الخلية والخلايا الحية على حد سواء خارج الموقع والموقع. تيو 2 متوافق حيويا ومستقر كيميائيا، وشفافة بصريا، ملامح مما يجعلها صديقة ليعرض في تجارب لزراعة الخلايا. يوفر هذا البروتوكول بديل المواد على أساس علمي لتعديل السقالات خلية الثقافة في بيئة خلية الثقافة.
Protocol
1. إعداد تيو 2 المغلفة زجاج ساترة
- عدد لل coverslips باستخدام الناسخ الماس. هذا لا يساعد فقط على تتبع كل coverslips لكن أيضا لضمان أن الجانب الصحيح من العينة هو مواجهة. تنظيف لل coverslips، أولا تحت تشغيل ده 2 O، ثم عن طريق غمر لهم في حل سمكة البيرانا (H 2 SO 4: H 2 O 2 = 4: 1). بعد 10 دقيقة، شطف لل coverslips بدقة، 8 مرات في 2 O. ده تجفيف coverslips تحت N 2 التدفق.
- تعيين تيو 2 هدف في الترددات الراديوية (RF) النظام الاخرق. إرفاق لل coverslips على حامل عينة من المعدات الاخرق باستخدام الشريط بوليميد. وضع صاحب العينة في غرفة الاخرق. إخلاء الغرفة حتى يصل الضغط 2.0 × 10 -4 باسكال.
- إدخال الغاز عار في غرفة وضبط ضغط ترسب إلى 4.0 mTorr. مع الحفاظ على مصراع مغلقة، تزيد تدريجياقوة RF إلى 70 W.
- فتح مصراع وتفل لمدة 15 دقيقة للحصول على الفيلم مع سماكة من 120-150 نانومتر (الشكل 1: الخطوة A). معدل النمو في الفيلم يحتاج إلى أن تستمد لكل جهاز.
2. طلاء السطح مع الخلية طارد السينمائي
- Hydrophilize سطح تيو 2 عن طريق التعامل مع العينة مع O 2 البلازما، واتباع التعليمات المقدمة من قبل الشركة المصنعة للمفاعل البلازما. تعاملنا مع العينة لمدة 5 دقائق في 200 W مع O 2 تدفق 100 SCCM. تزج العينة في ده 2 O والتأكد من أن السطح فائقة المحبة للماء. يجف السطح تماما تحت N 2 التدفق.
- إعداد 1 ملم octadecyltrichlorosilane (OTS) حل عن طريق إضافة 39.6 OTS ميكرولتر إلى 100 مل التولوين. تزج العينة في حل لمدة 1 ساعة على RT. إجراء هذه الخطوة داخل N 2 كيس القفازات -تعبئة (الشكل 1: الخطوة B).
- لإزالة جزيئات physisorbed، sonicatالبريد العينة في التولوين، والأسيتون، والإيثانول، وده 2 O لمدة 5 دقائق لكل منهما، في هذا النظام. شطف العينة أربع مرات في ده الطازجة 2 O ويجف السطح تحت N 2 التدفق. يجب أن يكون السطح مسعور مع زاوية الاتصال من 100-110 درجة.
3. مثال الموضع الزخرفة السطحية
- العمل في الصفحي تدفق غطاء محرك السيارة، ووضع عدة علامات خدش مع الناسخ الماس على السطح. علامات تساعد في تتبع المناطق المجهزة وجلب المجاهر إلى التركيز أيضا. تعقيم تيو OTS المغلفة 2 عن طريق غمر العينة في الايثانول 70٪ لمدة 5 دقائق. ثم شطف العينة مرتين في تعقيم ده 2 O.
- ضع عينة في طبق 35 ملم، وإضافة 2 مل من النمو PC12 المتوسطة (انظر الخطوة 4.2). احتضان لأكثر من 3 ساعات في CO 2 حاضنة (37 ° C). ويهدف هذا الإجراء إلى السماح الالبيومينات المصل تمتص على السطح. الالبيومينات كثف تمنع امتصاص لاحقا المتواجد الآخرينخصوصيات والخلايا (الشكل 1: الخطوة C).
- في الوقت الذي تنتظر، وإعداد المجهر مضان مقلوب.
- تشغيل مصباح قوس، تضاف مكعبات فلتر الأشعة فوق البنفسجية، وتعيين عدسة موضوعية إلى 20X.
- قياس شدة الضوء I (W سم -2) باستخدام الأشعة فوق البنفسجية متر الكثافة، وحساب الزمن t التشعيع (بالثواني) لجرعة من د (في J سم -2) على النحو التالي: ر = د / I.
على سبيل المثال، لأشرق بجرعة 200 J سم -2 باستخدام مصدر ضوء 600 ميغاواط سم -2، مطلوب 333 ثانية من الإشعاع. - استخدام ميكرومتر المرحلة وإغلاق الحجاب الحاجز المجال لضبط حجم المنطقة المراد المشع، على سبيل المثال، 200 ميكرون.
- بعد الحضانة 3 ساعات، تكملة المتوسطة مع 200 ميكرولتر من 3.0 ملغ مل -1 نوع-IV الكولاجين (كو-IV؛ النهائية تركيز 300 ميكروغرام مل -1).
- نقل 35 ملم طبق على المسرح المجهر. البحث الصفر متابوت، والتركيز المجهر على سطح العينة، وأشرق ضوء الأشعة فوق البنفسجية عند تناول جرعة مقدارها 200 J سم -2 (الشكل 1: الخطوة D). مجال الأشعة فوق البنفسجية يمكن تغيير إما عن طريق ضبط افتتاح الحجاب الحاجز الميدان أو عن طريق استبدال الحجاب الحاجز الميدان مع قناع المعادن هندسة التحكيم.
- استبدال المتوسطة مع المتوسطة النمو الطازجة (بدون العقيد-IV)، ووضع العينة مرة أخرى في الحاضنة.
الثقافة 4. خلية
- يتم الثقافة الروتينية الخلايا PC12 خارجا على طبق من البلاستيك المغلفة الكولاجين.
- إلى معطف 60 ملم طبق الأنسجة الثقافة مع العقيد-IV، والرطب أولا السطح مع [ده 2 O ونضح كل ده 2 O.
- إعداد 300 ميكروغرام مل -1 العقيد-IV عن طريق تمييع الحل الأصلي (3 ملغ مل -1) 10X مع ده 2 O.
- إضافة 200 ميكرولتر من 300 ميكروغرام مل -1 العقيد-IV في 60 ملم الطبق. اسمحوا الحل تنتشر عبر السطح.
- تي الجافانه طبق في غطاء تدفق الصفحي لحوالي 1 ساعة.
- شطف السطح مرتين مع 4 مل من الفوسفات مخزنة المالحة Dulbecco و(D-PBS). في حالة عدم استخدام طبق المغلفة على الفور، وشطف الطبق مرة واحدة مع 4 مل من ده 2 O. بعد الشفط ده 2 O، تخزين الطبق في الحاضنة. ليس محاولة للحفاظ على تخزينها لأكثر من أسبوعين.
- تزرع خلايا PC12 في وسط النمو الذي يتكون من: متوسطة (الجلوكوز منخفض) تعديل النسر Dulbecco لفي المصل + 1٪ حل البنسلين الستربتومايسين + 10٪ مصل بقري جنيني + حصان 5٪. احتضان الخلايا في CO 2 حاضنة (37 ° C، 5٪ CO 2)، واستبدال نصف المتوسط كل يوم. خلايا مرور قبل أن تصل إلى نقطة التقاء.
- نضح في والمتوسطة النمو، وإضافة 2 مل من برنامج تلفزيوني + (D-PBS + 10 ملغ مل -1 ألبومين المصل البقري (BSA) + 10 ملي EDTA) prewarmed إلى 37 درجة مئوية. احتضان لمدة 5 دقائق عند 37 ° C. اضغط برفق الطبق لفصل كل مLLS.
- جمع الخلايا في أنبوب مخروطي 15 مل. شطف الطبق مع 3 مل من جديد D-PBS، prewarmed إلى 37 درجة مئوية.
- أجهزة الطرد المركزي الأنبوب في 150 × ز لمدة 4 دقائق.
- نضح طاف، وإضافة 1 مل من وسط النمو.
- للثقافة الروتينية، وتقسيم الخلايا 1: 3-1: 5.
- لوحة الخلايا على OTS / تيو 2 عينة المعدلة للأشعة فوق البنفسجية، عد كثافة الخلايا وإضافة 3.0 × 10 5 خلايا في طبق 35 ملم (الشكل 1: الخطوة E). احتضان الطبق في الحاضنة ترطيب (37 ° C، 5٪ CO 2) لمدة 1-2 أيام. كلا عامل نمو العصب السذاجة و(NGF) خلايا PC12 -differentiated يمكن أن تستخدم في التجارب الزخرفة. لNGF التمايز، يضاف 100 نانوغرام -1 مل من 7S-NGF إلى النمو المتوسط عدة أيام قبل طلاء الخلايا على العينة. يبدو NGF-التمايز لزيادة adhesibility من الخلايا PC12 ويجعل التعامل أسهل، وخاصة في في الموقع الزخرفة هxperiments.
5. في الموضع الزخرفة السطحية
- بعد 1-2 أيام من الثقافة على سطح السابقين الموقع المعدلة، تأكد من أن الخلايا تنمو ويعلق فقط على منطقة المشع للأشعة فوق البنفسجية. إعداد المجهر، كما هو موضح في الخطوة 3.4.
- نقل العينة إلى الجديد 35 ملم الأنسجة صحن الثقافة التي تحتوي على النمو المتوسطة، و 100 نانوغرام مل -1 NGF (في حالة استخدام الخلايا NGF متباينة)، و 100 ميكروغرام مل -1 العقيد-IV.
- وضع الطبق على المسرح المجهر. العثور على الموقف المناسب، وأشرق ضوء الأشعة فوق البنفسجية عند تناول جرعة مقدارها 200 J سم -2 (الشكل 1: الخطوة F، G). يشار المنطقة المتساهلة التي أنشئت حديثا مع النجمة في الشكل 1: الخطوة G.
- في محاولة لاستكمال تجهيز عينة واحدة خلال 30 دقيقة. بعد التشعيع، ونقل العينة مرة أخرى إلى وسيط وبدون العقيد-IV.
- كن حذرا للغاية عند القيام الطبق مع مكعبخلايا ltured ونقل عينة من طبق إلى طبق لمنع فصل الخلايا منقوشة.
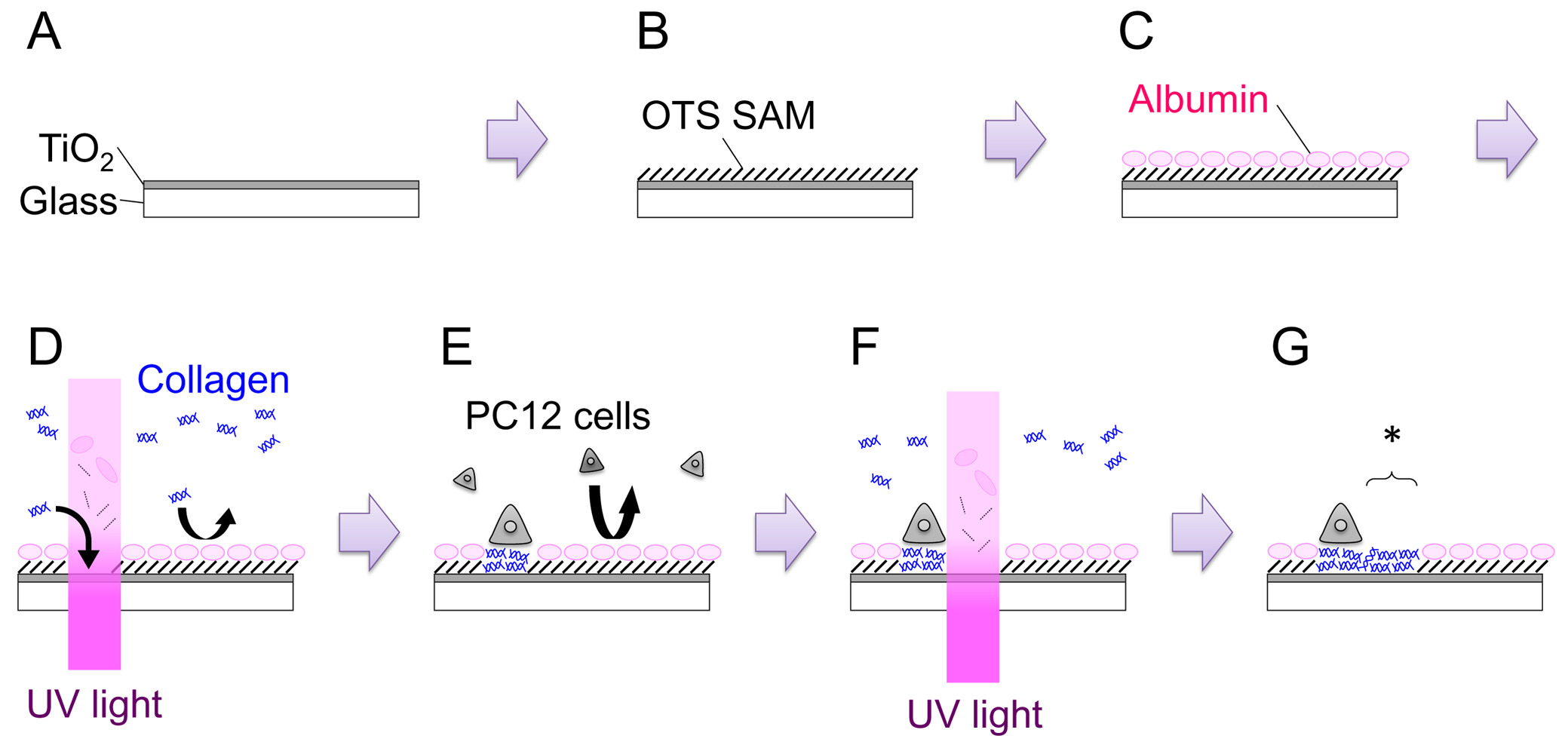
الشكل 1. توضيح تخطيطي لعملية شاملة. انظر النص لمزيد من التفاصيل. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
الشكل 2A يظهر مستعرضة المجهر الإلكتروني (SEM) صورة تيو 2 فيلم المودعة تفل. من الملاحظة، قدرت سماكة الفيلم أن ما يقرب من 150 نانومتر. ملحوظة هنا هو التسطيح للأودعت تيو 2 فيلم. كشف مزيد من التحليل بالقوة المجهر الذري (AFM) أن جذر متوسط مربع (RMS) خشونة السط?...
Discussion
في البروتوكول الحالي لدينا، تشكلت تيو 2 فيلم RF-المغنطرون الاخرق. نحن نؤيد هذا الأسلوب من ترسب لأنه يسمح لنا لإعداد بتكاثر على بهوتوكاتاليتيك تيو 2 فيلم مع خشونة نانومتر الفرعي. على الرغم من أن عمليات ترسيب بالرش مألوفة للعلماء والمهندسين المواد الإلكترون?...
Disclosures
The authors have nothing to disclose.
Acknowledgements
Authors thank Mr. Kotaro Okubo for the kind assistance with SEM imaging. This work was supported by the Japan Society for the Promotion of Science Grant-in-Aid for Basic Research (B) (20310069), Grant-in-Aid for Research Activity Start-up (25880021), and by research grants from the Kurata Memorial Hitachi Science and Technology Foundation and the Nippon Sheet Glass Foundation for Materials Science and Engineering.
Materials
| Name | Company | Catalog Number | Comments |
| Glass coverslip | Warner Instruments | CS-15R15 | 15 mm diameter, #1.5 thickness |
| Diamond scriber | Ogura Jewel Industry | D-Point Pen | |
| RF sputtering system | ANELVA | SPC350 | |
| TiO2 sputtering target | Kojundo Chemical Lab | Titanium (IV) oxide, target | Purity, 99.9% |
| Plasma reactor | Yamato | PR301 | |
| n-octadecyltrichlorosilane (OTS) | Aldrich | 104817 | |
| Toluene | Wako | 204-01866 | |
| Tissue-culture dish (35 mm) | Greiner | 627160 | |
| Tissue-culture dish (60 mm) | BD Falcon | 353002 | |
| Type-IV collagen | Nitta Gelatin | Cellmatrix Type IV | |
| D-PBS | Gibco | 14190-144 | |
| Dulbecco's modified Eagle's medium (DMEM) | Gibco | 11885-084 | |
| Fetal bovine serum | Gibco | 12483-020 | Heat-inactivate and pass through a 0.22 μm filter before use |
| Horse serum | Gibco | 26050-088 | Pass through a 0.22 μm filter before use |
| Penicillin-streptomycin (100x) | Nacalai tesque | 26253-84 | |
| 7S nerve growth factor (NGF) | Alomone Labs | N-130 | |
| Bovine serum albumin (BSA) | Sigma | A2153 | |
| EDTA | Dojindo | N001 | Stock solution in 0.5 M |
| TiO2 nanoparticle | Tayca | TKD-701 |
References
- Hughes, M. A., Brennan, P. M., Bunting, A. S., Shipston, M. J., Murray, A. F. Cell Patterning on Photolithographically Defined Parylene-C: SiO2 Substrates. J. Vis. Exp. (85), e50929 (2014).
- Kleinfeld, D., Kahler, K. H., Hockberger, P. E. Controlled Outgrowth of Dissociated Neurons on Patterned Substrates. J. Neurosci. 8, 4098-4120 (1988).
- Pensen, D., Heinz, W. F., Werbin, J. L., Hoh, J. H., Haviland, D. B. Electron Beam Patterning of Fibronectin Nanodots that Support Focal Adhesion Formation. Soft Matter. 3, 1280-1284 (2007).
- Tanii, T., et al. Application of Organosilane Monolayer Template to Quantitative Evaluation of Cancer Cell Adhesive Ability. Jpn. J. Appl. Phys. 50, 06GL01 (2011).
- Yamamoto, H., et al. In-Situ Guidance of Individual Neuronal Processes by Wet Femtosecond Laser Processing of Self-Assembled Monolayers. Appl. Phys. Lett. 99, 163701-1610 (2011).
- Yamamoto, H., et al. Differential Neurite Outgrowth is Required for Axon Specification by Cultured Hippocampal Neurons. J. Neurochem. 123, 904-910 (2012).
- Shen, K., Qi, J., Kam, L. C. Microcontact Printing of Proteins for Cell Biology. J. Vis. Exp. (22), e1065 (2008).
- Johnson, D. M., LaFranzo, N. A., Maurer, J. A. Creating Two-Dimensional Patterned Substrates for Protein and Cell Confinement. J. Vis. Exp. (55), e3164 (2011).
- Singhvi, R., et al. Engineering Cell Shape and Function. Science. 264, 696-698 (1126).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric Control of Cell Life and Death. Science. 276, 1425-1428 (1997).
- Degot, S., et al. Improved Visualization and Quantitative Analysis of Drug Effects using Micropatterned Cells. J. Vis. Exp. (46), e2514 (2010).
- Nakanishi, J., et al. Photoactivation of a Substrate for Cell Adhesion under Standard Fluorescence Microscopes. J. Am. Chem. Soc. 126, 16314-16315 (2004).
- Kim, M., et al. Addressable Micropatterning of Multiple Proteins and Cells by Microscope Projection Photolithography Based on a Protein Friendly Photoresist. Langmuir. 26, 12112-12118 (2010).
- Deka, G., Okano, K., Kao, F. -. J. Dynamic Photopatterning of Cells In Situ by Q-Switched Neodymium-Doped Yttrium Ortho-Vanadate. Laser. J. Biomed. Opt. 19, 011012 (2014).
- Robertus, J., Browne, W. R., Feringa, B. L. Dynamic Control over Cell Adhesive Properties using Molecular-Based Surface Engineering Strategies. Chem. Soc. Rev. 39, 354-378 (2010).
- Choi, I., Yeo, W. -. S. Self-Assembled Monolayers with Dynamicity Stemming from (Bio)chemical Conversions: From Construction to Application. ChemPhysChem. 14, 55-69 (2013).
- Nakanishi, J. Switchable Substrates for Analyzing and Engineering Cellular Functions. Chem. Asian J. 9, 406-417 (2014).
- Yamamoto, H., et al. In Situ Modification of Cell-Culture Scaffolds by Photocatalytic Decomposition of Organosilane Monolayers. Biofabrication. 6, 035021 (2014).
- Sekine, K., Yamamoto, H., Kono, S., Ikeda, T., Kuroda, A., Tanii, T. Surface Modification of Cell Scaffold in Aqueous Solution using TiO2 Photocatalysis and Linker Protein L2 for Patterning Primary Neurons. e-J. Surf. Sci. Nanotech. 13, 213-218 (2015).
- Arima, Y., Iwata, H. Effects of Surface Functional Groups on Protein Adsorption and Subsequent Cell Adhesion using Self-Assembled Monolayers. J. Mater. Chem. 17, 4079-4087 (2007).
- Fujishima, A., Zhang, X., Tryk, D. A. TiO2 Photocatalysis and Related Surface Phenomena. Surf. Sci. Rep. 63, 515-582 (2008).
- Sigal, G. B., Mrksich, M., Whitesides, G. M. Effect of Surface Wettability on the Adsorption of Proteins and Detergents. J. Am. Chem. Soc. 120, 3464-3473 (1998).
- Zhang, X., et al. A Transparent and Photo-Patternable Superhydrophobic Film. Chem. Commun. 2007, 4949-4951 (1039).
- Kaech, S., Banker, G. Culturing Hippocampal Neurons. Nat. Protoc. 1, 2406-2415 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved