このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
TiOを使用して水性環境中のタンパク質や細胞を光パターニング
要約
We describe a protocol for modifying cell affinity of a scaffold surface in aqueous environment. The method takes advantage of titanium dioxide photocatalysis to decompose organic film in the photo-irradiated region. We show that it can be used to create microdomains of scaffolding proteins, both ex situ and in situ.
要約
二酸化チタン(TiO 2)の表面に吸着した有機汚染物質は、紫外線(UV)光の下で光触媒により分解することができます。ここでは、局所的に、基板表面の細胞親和性を変化させるためにTiO 2の光触媒を採用した新たなプロトコルを記述します。この実験では、薄膜のTiO 2膜をスパッタコーティングしたカバーガラス上で、TiO 2の表面は、続いて、細胞接着を阻害オクタデシルトリクロロシラン(OTS)に由来するオルガノシラン単層で修飾しました。サンプルは、細胞培養培地中に浸漬し、UV光を八角形の領域に照射された焦点を合わせました。神経細胞株PC12細胞を試料上にプレーティングしたときに、細胞は、UV照射領域に接着しました。我々はさらに、細胞を基板上に成長している場合でも、この表面改質はまた、 例えば 、 その場で行うことができることを示しています。表面の適切な修飾は、細胞外マトリックスpを必要とUV照射時に培地中に存在することが、コラーゲンをrotein。ここに提示された技術は、潜在的に共培養システムを構築するか、任意の培養で細胞を操作するための複数の細胞型のパターン化に用いることができます。
概要
半導体リソグラフィプロセスおよびその誘導体- 、フォトリソグラフィ1,2、電子ビームリソグラフィ3-6、および7-10を印刷マイクロコンタクトとしては-今定義された位置と形状に生きた細胞を成長させるために、細胞生物学の確立ツールとなっています。パターニング方法は、非許容バックグラウンドでセル許容コーティングのミクロの島からなる、微細加工された基板の使用に依存しています。このような基板は、パターンセルをするためのテンプレートとして機能します。これらの技術は、私たちの細胞の本質的な特性を抽出すること、及び細胞ベースの薬物スクリーニング11のスループットを高めるために、単一および多細胞レベルでの細胞およびそれらの機能を設計するための新規な方法を提供しています。
テンプレートのパターン形状を、すなわち 、 その場で変更することができれば、細胞がS上で培養されながら、自由度のセルのパターニングでは大きく増加しますurface。これらは大気中または真空中でサンプルを処理するためのパターン形成のための従来の方法は、直接、ここでは適用できません。そのため、様々な新しい表面改質技術はちょうど少数を示すために、光反応性化合物12,13またはレーザーアブレーション5,14に、 例えば 、基になっている、提案されています。提案された方法はうまくチョイら 16と中西17によって、より最近になって。Robertusらによって 15を見直し、されています。
ここでは、この記事では、我々は、二酸化チタン上に有機分子の光触媒分解を利用していますin-situで表面修飾、(TiO 2の)表面18,19の新規のプロトコルを記述します。この方法では、TiO 2のフィルムは、ガラス基板と細胞膜の間に有機インターフェースに挿入され、有機膜が局部的に紫外線(UV)を照射することにより、その場で分解され関心領域(λ<388 nm)での光。新たなプロトコルは、細胞外マトリックスタンパク質および生細胞の両方の現場外のその場での微細パターンを作成するために使用できることを示します。 TiO 2は、細胞培養実験に導入することがフレンドリーになる特徴、そのうちの、生体適合性の化学的に安定し、光学的に透明です。このプロトコルは、細胞培養環境での細胞培養足場を修正するための材料科学ベースの代替手段を提供します。
プロトコル
TiO 2の調製は、ガラスカバースリップをコーティングを採用しました
- ナンバーダイヤモンドスクライバーを使用してカバースリップ。これは、各カバースリップを追跡するためだけでなく、サンプルの正しい側が上を向いていることを確実にするためだけではなく役立ちます。次にピラニア溶液にそれらを浸漬することにより、第一のddH 2 Oを実行して下に、カバーガラスを清掃し(H 2 SO 4:H 2 O 2 = 4:1)。 10分後、のddH 2 Oに、徹底的に8回をカバースリップをすすぎN 2気流下でカバーガラスを乾燥させます。
- 無線周波数(RF)スパッタリング装置にTiO 2のターゲットを設定します。ポリイミドテープを用いたスパッタリング装置の試料ホルダー上にカバーガラスを取り付けます。スパッタチャンバー内の試料ホルダーを配置します。圧力が2.0×10 -4 Paのに達するまで室を避難させます。
- チャンバー内にArガスを導入し、4.0トルの堆積圧力を設定します。シャッターが閉じ維持しながら、徐々に増加W. 70へのRF電力
- シャッターを開き、120〜150ナノメートル( 図1:ステップA)の厚さのフィルムを得るために15分間スパッタ。膜の成長速度は、マシンごとに導出する必要があります。
セル・撥水膜との2表面コーティング
- プラズマ反応器のメーカーが提供する説明書に従って、O 2プラズマで試料を処理することにより、TiO 2の表面を親水化。私たちは、100 SCCMのO 2流量で200 Wで5分間サンプルを処理します。 ddH 2 Oにサンプルを浸し、表面が超親水であることを確認します。 N 2気流下で完全に表面を乾燥させます。
- 100ミリリットルのトルエンに39.6μlのOTSを追加することによって、1mMのオクタデシルトリクロロシラン(OTS)溶液を調製します。室温で1時間、溶液中の試料を浸し。 N 2 -filledグローブバッグ(:ステップB 図1)の内部では、この手順を行ってください。
- 物理吸着分子を除去するために、sonicat電子トルエン、アセトン、エタノール中のサンプル、及びその順序で各5分間、のためのddH 2 Oを。新鮮なのddH 2 O中でサンプルを4回すすぎ、N 2気流下で表面を乾燥。表面は100〜110°の接触角を有する疎水性でなければなりません。
3. 現場外表面パターニング
- 層流フードでの作業、表面にダイヤモンドスクライバーで数スクラッチマークを描きます。マークが処理された領域を追跡し、また焦点に顕微鏡をもたらすのに役立ちます。 5分間70%エタノール中にサンプルを浸漬することにより被覆されたOTSのTiO 2を殺菌します 。その後、滅菌のddH 2 Oで二回サンプルをすすぎ
- 35-mmディッシュ内のサンプルを置き、PC12成長培地2mlを追加し(ステップ4.2を参照)。 CO 2インキュベーター(37℃)で3時間以上インキュベートします。この手順は、血清アルブミンの表面上に吸収させることを意図しています。吸着アルブミンは他のproteのその後の吸着を阻害しますインと細胞( 図1:ステップC)。
- 待っている間に、倒立蛍光顕微鏡を設定します。
- 、アークランプをオンにするUVフィルターキューブを挿入し、20X対物レンズを設定します。
- 光強度Iを測定する(W cm -2の)紫外線強度計を用いて、 および dの用量のために(秒)照射時間Tを算出する(Jセンチ-2)として:T = D / I。
例えば、200 J cmの線量で照射すること-2 600ミリワットのcm -2での光源を用い、照射の333秒が必要です。 - ステージマイクロメータを使用して、 例えば 、照射される領域のサイズを設定するには、200ミクロンの視野絞りを閉じます。
- 3時間のインキュベーションの後、3.0 mgのmlの200μlの-1 IV型コラーゲン(;最終濃度は300μgmlの-1 COL-IV)を含む培地を補います。
- 顕微鏡ステージに35-mmディッシュを転送します。スクラッチメートルを探しますアークは、試料表面上に顕微鏡の焦点を合わせると、200 Jセンチ-2( 図1:ステップD)の投与量でUV光を照射します。 UV照射の領域は、視野絞りの開度を調整することにより、または仲裁ジオメトリのメタルマスクを用いて視野絞りの交換のいずれかによって変更することができます。
- (COL-IVなし)新鮮な増殖培地で培地を交換し、バックインキュベーター内のサンプルを配置します。
4.細胞培養
- PC12細胞のルーチン培養物を、コラーゲンコートされたプラスチックディッシュ上で行われます。
- コートCOL-IVと60 mmの組織培養皿に、最初のddH 2 Oで表面を濡らし、すべてのddH 2 Oを吸引
- 元の溶液を希釈して300μgのmlの-1 COL-IVを準備するのddH 2 Oで(3ミリグラムml -1の)10倍
- 300μgのmlの200μlの-1 60-mmディッシュあたりCOL-IVを追加します。表面を介して広がるソリューションをしてみましょう。
- ドライトン彼は約1時間、層流フード内で皿。
- ダルベッコのリン酸緩衝生理食塩水(D-PBS)4mlで二回表面をすすぎます。すぐにコートディッシュを使用しない場合、のddH 2 Oの4ミリリットルで一回の皿をすすぎddH 2 Oを吸引した後、インキュベーターで料理を格納します。それが2週間以上保存され維持しないようにしてください。
- ダルベッコ改変イーグル培地(低グルコース)+ 10%ウシ胎児血清+ 5%ウマ血清+ 1%ペニシリン - ストレプトマイシン溶液:PC12細胞から成る増殖培地中で増殖させます。 CO 2インキュベーター中で細胞をインキュベートする(37℃、5%CO 2)、一日おきに培地の半分を交換します。継代細胞は、それらがコンフルエンスに到達する前に。
- 吸引は、増殖培地、及び追加の2 mlのPBS +(D-PBS +の10mg ml -1の牛血清アルブミン(BSA)+ 10mMのEDTA)を37℃に予熱。 37℃で5分間インキュベートします。静かに、すべてのCEを切り離すために料理をタップLLS。
- 15ミリリットルコニカルチューブ内の細胞を収集します。 37℃に予熱し、新鮮なD-PBS 3mlで料理を、洗浄します。
- 4分間150×gでチューブを遠心。
- 上清を吸引除去し、成長培地1mlを加えます。
- 1:3:ルーチン培養のため、細胞を1分割5。
- UV-修正OTS / TiO 2のサンプルの細胞をプレートに、細胞密度をカウントし、35-mmディッシュで3.0×10 5細胞 ( 図1:ステップE)を追加します。 1~2日間の加湿インキュベーター(37℃、5%CO 2)で皿をインキュベートします。両方のナイーブおよび神経成長因子(NGF)-differentiated PC12細胞は、パターニング実験に使用することができます。 NGF分化のために、7S-NGFの100 ngのmlの-1は数日間試料上に細胞をプレーティングする前に増殖培地に添加されます。 NGF分化は、PC12細胞の密着性を高めるように見える、特にその場でパターニング e。で、扱いやすくなりますxperiments。
5. その場表面パターニング
- 現場外改変された表面上での培養の1〜2日後、細胞を取り付け、紫外線照射された領域のみに成長していることを確認します。ステップ3.4で説明したように、顕微鏡を設定します。
- 成長培地を含む新しい35-mm組織培養皿にサンプルを転送し、100 ngのmlの-1 NGF(NGF分化細胞を用いた場合)、および100μgmlの-1 COL-IV。
- 顕微鏡ステージ上の皿を置きます。適切な位置を見つけ、200のJ cm -2の( 図1:工程F、G)の線量のUV光を照射します。新しく作成された許容領域は、 図1のアスタリスクで示されます。ステップG.
- 30分以内に単一のサンプルの処理を完了してみてください。照射後、COL-IVなしにバック中にサンプルを転送します。
- Cuと料理を運ぶ時は十分に注意してくださいltured細胞や皿からサンプルを転送するには、パターン化された細胞の着脱防止するために皿に。
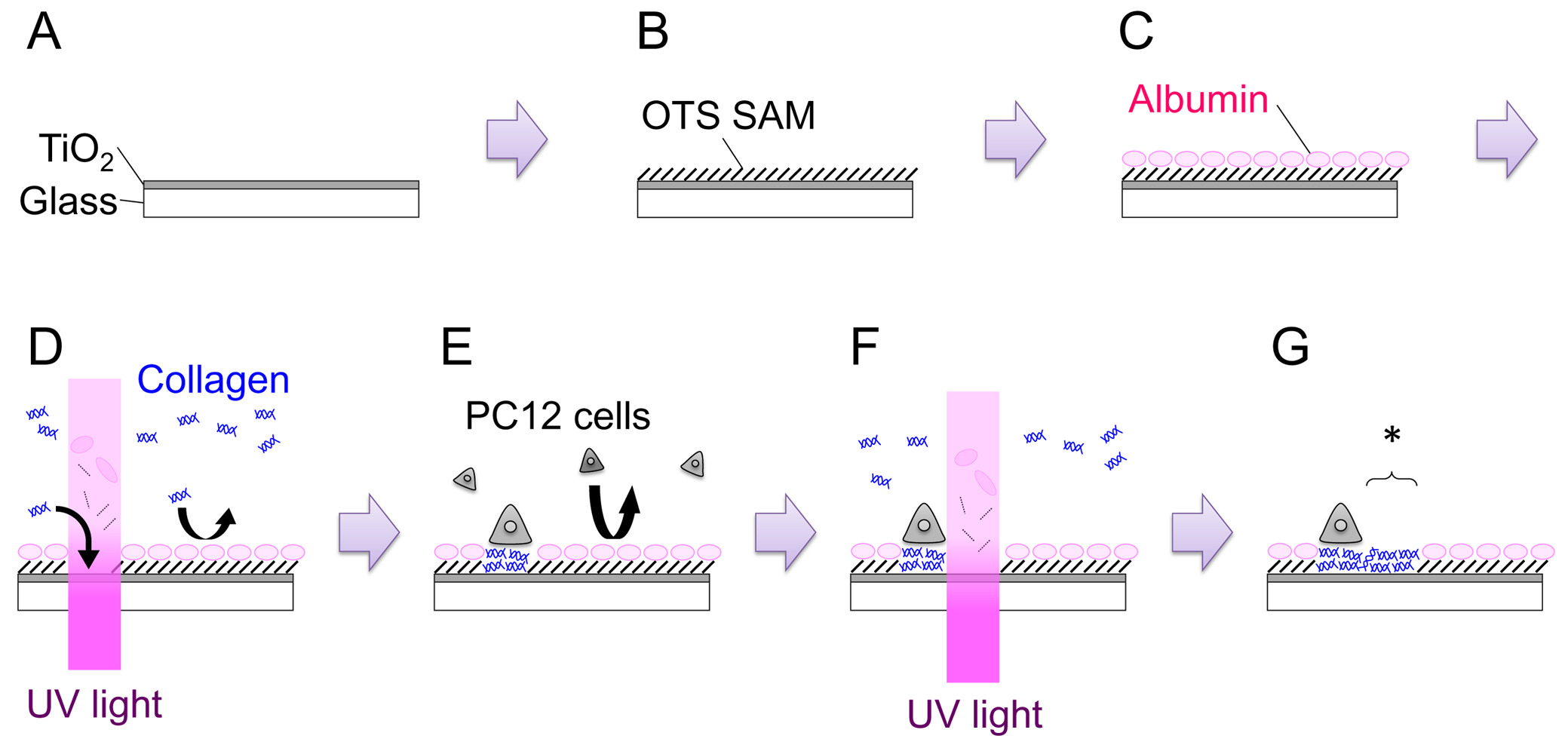
全体的なプロセスの1模式図を図。詳細は本文を参照してください。 この図の拡大版をご覧になるにはこちらをクリックしてください。
結果
図2Aは、スパッタ堆積のTiO 2膜の断面の走査型電子顕微鏡(SEM)像を示します。観察から、フィルムの厚さは150nm程度であると推定されました。ここで顕著な堆積のTiO 2膜の平坦性があります。原子間力顕微鏡(AFM)によるさらなる分析は、表面の二乗平均平方根(RMS)粗さは0.2nmで( 図2B)であることが明らかになりました。
ディスカッション
我々の現在のプロトコルでは、TiO 2の膜は、RFマグネトロンスパッタ法により形成しました。それは、私たちは再現性のサブnmの粗さと光触媒の TiO 2膜を作製することができますので、我々は、堆積のこの方法を好みます。スパッタ成膜プロセスは材料科学者や電子技術者によく知られているが、それは生物学者に非常にアクセスできないことがあります。その場合には、スピ...
開示事項
The authors have nothing to disclose.
謝辞
Authors thank Mr. Kotaro Okubo for the kind assistance with SEM imaging. This work was supported by the Japan Society for the Promotion of Science Grant-in-Aid for Basic Research (B) (20310069), Grant-in-Aid for Research Activity Start-up (25880021), and by research grants from the Kurata Memorial Hitachi Science and Technology Foundation and the Nippon Sheet Glass Foundation for Materials Science and Engineering.
資料
| Name | Company | Catalog Number | Comments |
| Glass coverslip | Warner Instruments | CS-15R15 | 15 mm diameter, #1.5 thickness |
| Diamond scriber | Ogura Jewel Industry | D-Point Pen | |
| RF sputtering system | ANELVA | SPC350 | |
| TiO2 sputtering target | Kojundo Chemical Lab | Titanium (IV) oxide, target | Purity, 99.9% |
| Plasma reactor | Yamato | PR301 | |
| n-octadecyltrichlorosilane (OTS) | Aldrich | 104817 | |
| Toluene | Wako | 204-01866 | |
| Tissue-culture dish (35 mm) | Greiner | 627160 | |
| Tissue-culture dish (60 mm) | BD Falcon | 353002 | |
| Type-IV collagen | Nitta Gelatin | Cellmatrix Type IV | |
| D-PBS | Gibco | 14190-144 | |
| Dulbecco's modified Eagle's medium (DMEM) | Gibco | 11885-084 | |
| Fetal bovine serum | Gibco | 12483-020 | Heat-inactivate and pass through a 0.22 μm filter before use |
| Horse serum | Gibco | 26050-088 | Pass through a 0.22 μm filter before use |
| Penicillin-streptomycin (100x) | Nacalai tesque | 26253-84 | |
| 7S nerve growth factor (NGF) | Alomone Labs | N-130 | |
| Bovine serum albumin (BSA) | Sigma | A2153 | |
| EDTA | Dojindo | N001 | Stock solution in 0.5 M |
| TiO2 nanoparticle | Tayca | TKD-701 |
参考文献
- Hughes, M. A., Brennan, P. M., Bunting, A. S., Shipston, M. J., Murray, A. F. Cell Patterning on Photolithographically Defined Parylene-C: SiO2 Substrates. J. Vis. Exp. (85), e50929 (2014).
- Kleinfeld, D., Kahler, K. H., Hockberger, P. E. Controlled Outgrowth of Dissociated Neurons on Patterned Substrates. J. Neurosci. 8, 4098-4120 (1988).
- Pensen, D., Heinz, W. F., Werbin, J. L., Hoh, J. H., Haviland, D. B. Electron Beam Patterning of Fibronectin Nanodots that Support Focal Adhesion Formation. Soft Matter. 3, 1280-1284 (2007).
- Tanii, T., et al. Application of Organosilane Monolayer Template to Quantitative Evaluation of Cancer Cell Adhesive Ability. Jpn. J. Appl. Phys. 50, 06GL01 (2011).
- Yamamoto, H., et al. In-Situ Guidance of Individual Neuronal Processes by Wet Femtosecond Laser Processing of Self-Assembled Monolayers. Appl. Phys. Lett. 99, 163701-1610 (2011).
- Yamamoto, H., et al. Differential Neurite Outgrowth is Required for Axon Specification by Cultured Hippocampal Neurons. J. Neurochem. 123, 904-910 (2012).
- Shen, K., Qi, J., Kam, L. C. Microcontact Printing of Proteins for Cell Biology. J. Vis. Exp. (22), e1065 (2008).
- Johnson, D. M., LaFranzo, N. A., Maurer, J. A. Creating Two-Dimensional Patterned Substrates for Protein and Cell Confinement. J. Vis. Exp. (55), e3164 (2011).
- Singhvi, R., et al. Engineering Cell Shape and Function. Science. 264, 696-698 (1126).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric Control of Cell Life and Death. Science. 276, 1425-1428 (1997).
- Degot, S., et al. Improved Visualization and Quantitative Analysis of Drug Effects using Micropatterned Cells. J. Vis. Exp. (46), e2514 (2010).
- Nakanishi, J., et al. Photoactivation of a Substrate for Cell Adhesion under Standard Fluorescence Microscopes. J. Am. Chem. Soc. 126, 16314-16315 (2004).
- Kim, M., et al. Addressable Micropatterning of Multiple Proteins and Cells by Microscope Projection Photolithography Based on a Protein Friendly Photoresist. Langmuir. 26, 12112-12118 (2010).
- Deka, G., Okano, K., Kao, F. -. J. Dynamic Photopatterning of Cells In Situ by Q-Switched Neodymium-Doped Yttrium Ortho-Vanadate. Laser. J. Biomed. Opt. 19, 011012 (2014).
- Robertus, J., Browne, W. R., Feringa, B. L. Dynamic Control over Cell Adhesive Properties using Molecular-Based Surface Engineering Strategies. Chem. Soc. Rev. 39, 354-378 (2010).
- Choi, I., Yeo, W. -. S. Self-Assembled Monolayers with Dynamicity Stemming from (Bio)chemical Conversions: From Construction to Application. ChemPhysChem. 14, 55-69 (2013).
- Nakanishi, J. Switchable Substrates for Analyzing and Engineering Cellular Functions. Chem. Asian J. 9, 406-417 (2014).
- Yamamoto, H., et al. In Situ Modification of Cell-Culture Scaffolds by Photocatalytic Decomposition of Organosilane Monolayers. Biofabrication. 6, 035021 (2014).
- Sekine, K., Yamamoto, H., Kono, S., Ikeda, T., Kuroda, A., Tanii, T. Surface Modification of Cell Scaffold in Aqueous Solution using TiO2 Photocatalysis and Linker Protein L2 for Patterning Primary Neurons. e-J. Surf. Sci. Nanotech. 13, 213-218 (2015).
- Arima, Y., Iwata, H. Effects of Surface Functional Groups on Protein Adsorption and Subsequent Cell Adhesion using Self-Assembled Monolayers. J. Mater. Chem. 17, 4079-4087 (2007).
- Fujishima, A., Zhang, X., Tryk, D. A. TiO2 Photocatalysis and Related Surface Phenomena. Surf. Sci. Rep. 63, 515-582 (2008).
- Sigal, G. B., Mrksich, M., Whitesides, G. M. Effect of Surface Wettability on the Adsorption of Proteins and Detergents. J. Am. Chem. Soc. 120, 3464-3473 (1998).
- Zhang, X., et al. A Transparent and Photo-Patternable Superhydrophobic Film. Chem. Commun. 2007, 4949-4951 (1039).
- Kaech, S., Banker, G. Culturing Hippocampal Neurons. Nat. Protoc. 1, 2406-2415 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved