JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
산화 티타늄을 사용하여 수성 환경에서 단백질과 세포를 포토 패터닝
요약
We describe a protocol for modifying cell affinity of a scaffold surface in aqueous environment. The method takes advantage of titanium dioxide photocatalysis to decompose organic film in the photo-irradiated region. We show that it can be used to create microdomains of scaffolding proteins, both ex situ and in situ.
초록
이산화 티타늄의 표면 (이산화 티탄)에 흡착 된 유기 오염 물질은 자외선 (UV) 광 하에서 광촉매 작용에 의해 분해 될 수있다. 여기에서 우리는 로컬 기판 표면의 세포 친 화성을 변경할 수있는 이산화 티탄 광촉매를 사용하는 새로운 프로토콜을 설명합니다. 이 실험을 위해, 얇은 이산화 티탄 막은 스퍼터 - 코팅 유리 커버 슬립이며, 이산화 티탄 표면은 후속 적으로 세포 부착을 억제 옥타 데실 트리클로로 실란 (OTS)로부터 유도 된 단일 층 오가 노 실란으로 개질 하였다. 샘플은 세포 배양 배지에 침지하고, UV 광이 각형 영역에 집중 조사 하였다. 신경 세포주 PC12 세포 샘플에서 도금 될 때, 셀은 UV 조사 된 영역에 부착. 우리는 상기 셀이 상기 기판 상에 성장하는 경우에도,이 표면 개질도 즉, 인 시츄로 수행 될 수 있음을 보여준다. 표면의 적절한 수정은 세포 외 기질 P 필요콜라겐 rotein하면 UV 조사시의 중간에 존재한다. 여기에 제시된 기술은 잠재적 하에서 배양 세포를 공 배양 시스템을 구축하거나 임의로 조작 패터닝 여러 세포 유형에 이용 될 수있다.
서문
반도체 리소그래피 공정 및 그 유도체 - 포토 리소그래피 1,2, 전자빔 리소그래피 3-6 및 7-10 인쇄 마이크로 콘택트로서 - 이제 정의 된 위치 및 형상에 살아있는 세포가 성장하는 세포 생물학에서 확립 도구가되었다. 패터닝 방법은, 비 허용 세포에서 배경 허용 코팅 마이크로 섬 이루어진 미세 가공 된 기판의 사용에 의존한다. 이러한 기판 패턴 세포에 템플릿 역할을합니다. 이러한 기술은 우리에게 세포의 고유 특성을 추출하고, 세포 기반 약물 검사 (11)의 처리량을 증가시키기 위해, 단일 및 다중 세포 수준에서 세포와 그 기능을 설계 할 수있는 새로운 방법을 제공하고 있습니다.
템플릿 패턴 형상이 즉, 현장에서 변경 될 수 있다면 세포의 배양 동안 자유도 셀 패턴에서 크게 증가 할 것urface. 그들은 분위기 또는 진공에서 샘플을 처리 이후 패턴 형성 방법은 종래의 직접 여기에 적용 할 수 없다. 따라서 여러 새로운 표면 개질 기술들은 단지 몇 가지 이름을, 광 반응성 화합물 (12, 13) 또는 레이저 어블 5,14에, 예를 들면, 기준이되는, 제안되어있다. 제안 된 방법은 잘 최 등. (16)와 나카니시 (17)에 의해 최근에. Robertus 등의 알 15을 검토하고있다.
다음은이 문서에서, 우리는 이산화 티타늄에 유기 분자의 광촉매 분해의 활용에 현장 표면 개질 (이산화 티탄) 표면 (18, 19)의 새로운 프로토콜을 설명합니다. 이 방법에서, 이산화 티탄 막은 유리 기판과 세포 인터페이스 유기 막 사이에 삽입되고, 상기 유기 막 국소 자외선 (UV)을 조사하여 그 자리에서 분해되어관심 영역 (λ <388 ㎚)에 빛. 우리는 새로운 프로토콜은 세포 외 기질 단백질과 살아있는 세포 모두 외부 계와 시츄 미세 패턴을 생성하는데 사용될 수 있음을 보여준다. 이산화 티탄은 세포 배양 실험에서 소개가 친절하게 기능이있는, 생체 적합성 화학적으로 안정하고, 광학적으로 투명하다. 이 프로토콜은 세포 배양 환경에서 세포 배양 지지체를 수정하기위한 재료 과학 기반의 대안을 제공합니다.
프로토콜
이산화 티탄 1. 준비 유리 커버 슬립을 피복 된
- 번호 다이아몬드 스크 라이버를 이용하여 커버 슬립. 이것은 각 커버 슬립 추적 할뿐만 아니라, 시료의 정확한면이 위를 향하게되도록뿐만 돕는다. 제 피라니아 용액에 침지하여이를 다음, DDH 2 O 흐르는, 커버 슬립을 청소 (H 2 SO 4 : H 2 O 2 = 4 : 1). 10 분 후, 2 DDH O.에서 철저 8 번 커버 슬립 린스 N이 흐름에 따라 커버 슬립을 건조.
- 무선 주파수 (RF) 스퍼터링 시스템에 이산화 티탄 목표를 설정합니다. 폴리이 미드 테이프를 사용하는 스퍼터링 장치의 샘플 홀더에 부착 된 커버를. 스퍼터링 챔버에 샘플 홀더를 놓습니다. 압력이 2.0 × 10에 도달 할 때까지 실을 대피 -4 아빠를.
- 챔버 내에 Ar 가스를 도입하고 4.0 mTorr로에 증착 압력을 설정합니다. 셔터 폐쇄 유지하면서 서서히 증가(70) W.에 RF 전력
- 셔터를 열고 120-150 나노 미터 (도 1 : 단계 A)의 두께의 필름을 얻기 위해 15 분 동안 스퍼터. 피막의 성장 속도는 각각의 시스템에 대해 유도 될 필요가있다.
세포 발수 필름 2. 표면 코팅
- 플라즈마 반응기의 제조에 의해 제공되는 지시에 따라, O 2 플라즈마에 의해 시료를 처리하여 이산화 티탄 표면을 친수성으로. 우리는 100 SCCM의 O 2 흐름 (W) (200)에서 5 분의 샘플을 취급합니다. DDH 2 O에서 샘플을 담그고 표면이 초 친수성인지 확인합니다. 철저 N이 흐름에 따라 표면을 건조시킵니다.
- 100 ml의 톨루엔 39.6 μL OTS를 추가하여 1 MM의 옥타 데실 트리클로로 실란 (OTS) 솔루션을 준비합니다. RT에서 1 시간 동안 용액의 시료를 담그. N 2 - 채워진 장갑 가방 (: 단계 B 그림 1) 내부에이 단계를 실시한다.
- physisorbed 분자를 제거하려면, sonicat전자 톨루엔, 아세톤, 에탄올 샘플, 그 순서대로 5 분 각각에 대한 DDH 2 O. 신선한 DDH 2 O에서 샘플 네 번 씻어 N 2의 흐름에 따라 표면을 건조. 표면 100-110 °의 접촉각과 소수성이어야한다.
3. 현지 외 표면 패터닝
- 층류 후드에서 작업, 표면에 다이아몬드 스크 라이버 여러 긁힌 자국을 그립니다. 마크 처리 된 영역을 추적하고 또한 초점 현미경을 가져에 도움이됩니다. 5 분 동안 70 % 에탄올에 침지시켜 샘플을 OTS 코팅 이산화 티탄 살균. 그런 다음 멸균 DDH 2 O 두 번 샘플을 씻어
- 35 mm의 접시에 샘플을 놓고 PC12 성장 매체 2 ㎖를 추가 (단계 4.2 참조). CO 2 배양기에서 3 시간 이상 (37 ° C)에 대해 품어. 이 절차는 혈청 알부민은 표면 상에 흡수하도록하기위한 것이다. 흡착 된 알부민은 다른 보호 자전거의 후속 흡착을 억제기능과 세포 (그림 1 : 단계 C).
- 기다리는 동안, 반전 형광 현미경을 설정합니다.
- 아크 램프를 켜고 UV 필터 큐브를 삽입하고 20 배에 대물 렌즈를 설정합니다.
- 광 강도 I (W cm -2)을 사용하여 UV 강도 측정기를 측정하고 (J의 형상 -2)에서 D의 투여 량 (초) 조사 시간 t를 계산한다 : t = D / I.
예를 들어, 200 J의 cm의 도즈 량 조사하는 -2 Mw가 600 cm -2의 광원을 사용하여 333 초간 조사가 필요하다. - 스테이지 마이크로 미터를 사용하여 영역의 크기가 예를 들면 200 μm의, 조사되도록 설정하는 필드 조리개를 닫는다.
- (; 최종 농도 300 μg의 ml의 골 -1-IV)에서 3 시간 배양 후, 3.0 mL의 밀리그램 -1-IV 형 콜라겐 200 μL와 매체를 보충.
- 현미경 단계로 35 밀리미터 접시를 전송합니다. 스크래치 M 찾기아크는, 샘플 표면에 초점 현미경, 200 J의 cm -2 (도 1 스텝 D)의 용량으로 UV 광을 조사한다. UV 조사의 영역은 필드 조리개의 개구를 조정함으로써, 또는 중재 형상의 메탈 마스크 필드 조리개를 대체함으로써 변경하거나 할 수있다.
- (골-IV)없이 새로운 성장 매체와 매체를 교체하고 다시 인큐베이터에서 샘플을 놓습니다.
4. 세포 배양
- PC12 세포의 루틴 배양 콜라겐 코팅 된 플라스틱 접시에 수행된다.
- 코트 골-IV와 60 mm의 조직 배양 접시에 먼저 DDH 2 O로 표면을 적시고 모든 DDH 2 O를 대기음
- 300 μg의 용액을 준비 -1 골-IV를 DDH 2 O (3 mg의 용액 1) 10 배 원액을 희석하여
- 300 μg의 ml의 -1 60 밀리미터 접시 당 골-IV의 200 μl를 추가합니다. 표면을 통해 확산 솔루션을 보자.
- 드라이 T그는 약 1 시간 동안 층류 후드에서 요리.
- 둘 베코 인산염 완충 식염수 (D-PBS) 4 ㎖로 두 번 표면을 씻어. 바로 코팅 된 접시를 사용하지 않을 경우, 2 DDH O. 4 ㎖로 한번 씻어 접시 DDH 2 O 흡입 한 후, 인큐베이터에서 접시를 저장합니다. 이 2 주 이상 보관 유지하지보십시오.
- PC12 세포로 구성 성장 배지에서 성장시킨다 : 둘 베코 변형 이글 배지 (저 글루코즈) + 10 % 소 태아 혈청 + 5 % 말 혈청 + 1 % 페니실린 - 스트렙토 마이신 용액. CO 2 배양기에서 세포를 품어 (37 ℃, 5 % CO 2), 그리고 매일 매체의 절반을 교체합니다. 통로 세포는 그들이 합류에 도달하기 전에.
- 흡 인물은 성장 배지 및 추가 2ml의 PBS + (D-PBS + 10 mg을 -1 ml의 소 혈청 알부민 (BSA) + 10 mM의 EDTA)을 37 ℃로 데워진. 37 ℃에서 5 분 동안 배양한다. 부드럽게 CE를 분리 접시를 누릅니다LLS.
- 15 ML 원뿔 튜브에 세포를 수집합니다. 37 ℃로 데워진 신선한 D-PBS의 3 ㎖와 접시를 씻어.
- 4 분 동안 150 × g에서 원심 분리 튜브.
- 상등액을 흡인하고, 성장 배지 1 ㎖를 추가한다.
- 1~3 : 루틴 배양, 세포 1 분할 5.
- , UV-수정 OTS / 이산화 티탄 샘플 세포를 플레이트 세포 밀도를 계산하고 35 밀리미터 접시 (그림 1 단계 : E) 3.0 × 10 5 세포를 추가합니다. 1-2일위한 가습 인큐베이터 접시 (37 ° C를, 5 % CO 2) 배양한다. 나이브 모두 신경 성장 인자 (NGF) -differentiated PC12 세포 패터닝 실험에 사용될 수있다. NGF 차별화, 7S-NGF NG 100 ml의 시료 -1에 도금 전에 세포 성장 배지 며칠에 첨가된다. NGF 분화는 PC12 세포의 점착력을 증가시키는 것, 특히 시츄 패터닝 E에서 용이하게 취급xperiments.
5. 원위치 표면 패터닝
- 전 현장 표면 개질에 문화 1 ~ 2 일 후, 세포 부착 및 자외선 조사 지역에서만 성장하고 있는지 확인합니다. 단계 3.4에 설명 된대로, 현미경을 설정합니다.
- 성장 배지를 함유하는 새로운 35-mm 조직 배양 접시에 시료를 이동시켜, (NGF-분화 된 세포를 사용하는 경우) 100 NG ml의 -1 NGF, 및 100 μg의 용액 -1 골-IV.
- 현미경의 무대에서 접시를 놓습니다. 적절한 위치를 찾아 200 J 센티미터 -2 (그림 1 단계 : F, G)의 용량으로 자외선을 조사. 새로 생성 허용 영역은 그림 1에서 별표로 표시됩니다 : 단계 G.
- 30 분 내에 단일 샘플의 처리를 완료하려고합니다. 조사 후, 골-IV없이 다시 매체에 샘플을 전송합니다.
- CU와 함께 요리를 운반 할 때는 특히 조심ltured 세포 접시에서 샘플을 전송은 패턴 화 된 세포의 분리 방지하기 위해 접시.
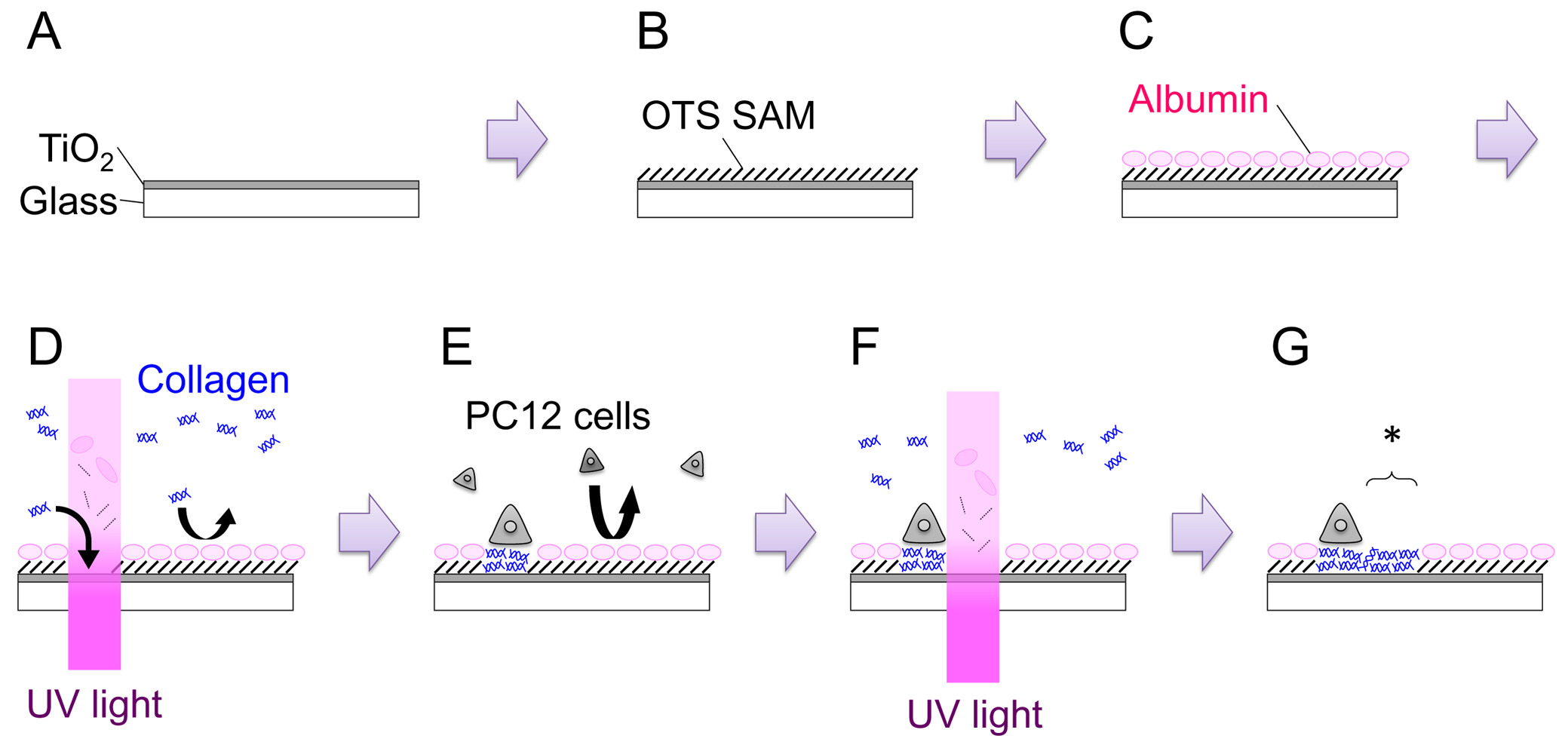
전체 프로세스의 도식 그림을 그림. 자세한 내용은 텍스트를 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
도 2a는 스퍼터 - 증착 된 이산화 티탄 필름의 단면 주사 전자 현미경 (SEM) 이미지를 나타낸다. 관찰로부터, 필름의 두께는 약 150 nm 인 것으로 추정되었다. 여기에 띄는 증착 이산화 티탄 막의 평탄성이다. 원자력 현미경 (AFM)에 의한 추가 분석은면의 제곱 평균 제곱근 (RMS) 조도는 0.2nm의 (도 2B)이한다고 밝혀졌다.
이산화 티탄?...
토론
현재의 프로토콜에서, 이산화 티탄 막을 RF 마그네트론 스퍼터링에 의해 형성 하였다. 그것은 우리가 재현 서브 나노 거칠기 광촉매 이산화 티탄 필름을 제조 할 수 있기 때문에 우리는 증착이 방법을 선호. 스퍼터 증착 공정은 재료 과학자 및 전자 엔지니어 잘 알고 있지만, 생물 학자에 매우 액세스 할 수 없습니다. 이 경우에, 스핀 코팅 이산화 티탄 필름 (23)의 ?...
공개
The authors have nothing to disclose.
감사의 말
Authors thank Mr. Kotaro Okubo for the kind assistance with SEM imaging. This work was supported by the Japan Society for the Promotion of Science Grant-in-Aid for Basic Research (B) (20310069), Grant-in-Aid for Research Activity Start-up (25880021), and by research grants from the Kurata Memorial Hitachi Science and Technology Foundation and the Nippon Sheet Glass Foundation for Materials Science and Engineering.
자료
| Name | Company | Catalog Number | Comments |
| Glass coverslip | Warner Instruments | CS-15R15 | 15 mm diameter, #1.5 thickness |
| Diamond scriber | Ogura Jewel Industry | D-Point Pen | |
| RF sputtering system | ANELVA | SPC350 | |
| TiO2 sputtering target | Kojundo Chemical Lab | Titanium (IV) oxide, target | Purity, 99.9% |
| Plasma reactor | Yamato | PR301 | |
| n-octadecyltrichlorosilane (OTS) | Aldrich | 104817 | |
| Toluene | Wako | 204-01866 | |
| Tissue-culture dish (35 mm) | Greiner | 627160 | |
| Tissue-culture dish (60 mm) | BD Falcon | 353002 | |
| Type-IV collagen | Nitta Gelatin | Cellmatrix Type IV | |
| D-PBS | Gibco | 14190-144 | |
| Dulbecco's modified Eagle's medium (DMEM) | Gibco | 11885-084 | |
| Fetal bovine serum | Gibco | 12483-020 | Heat-inactivate and pass through a 0.22 μm filter before use |
| Horse serum | Gibco | 26050-088 | Pass through a 0.22 μm filter before use |
| Penicillin-streptomycin (100x) | Nacalai tesque | 26253-84 | |
| 7S nerve growth factor (NGF) | Alomone Labs | N-130 | |
| Bovine serum albumin (BSA) | Sigma | A2153 | |
| EDTA | Dojindo | N001 | Stock solution in 0.5 M |
| TiO2 nanoparticle | Tayca | TKD-701 |
참고문헌
- Hughes, M. A., Brennan, P. M., Bunting, A. S., Shipston, M. J., Murray, A. F. Cell Patterning on Photolithographically Defined Parylene-C: SiO2 Substrates. J. Vis. Exp. (85), e50929 (2014).
- Kleinfeld, D., Kahler, K. H., Hockberger, P. E. Controlled Outgrowth of Dissociated Neurons on Patterned Substrates. J. Neurosci. 8, 4098-4120 (1988).
- Pensen, D., Heinz, W. F., Werbin, J. L., Hoh, J. H., Haviland, D. B. Electron Beam Patterning of Fibronectin Nanodots that Support Focal Adhesion Formation. Soft Matter. 3, 1280-1284 (2007).
- Tanii, T., et al. Application of Organosilane Monolayer Template to Quantitative Evaluation of Cancer Cell Adhesive Ability. Jpn. J. Appl. Phys. 50, 06GL01 (2011).
- Yamamoto, H., et al. In-Situ Guidance of Individual Neuronal Processes by Wet Femtosecond Laser Processing of Self-Assembled Monolayers. Appl. Phys. Lett. 99, 163701-1610 (2011).
- Yamamoto, H., et al. Differential Neurite Outgrowth is Required for Axon Specification by Cultured Hippocampal Neurons. J. Neurochem. 123, 904-910 (2012).
- Shen, K., Qi, J., Kam, L. C. Microcontact Printing of Proteins for Cell Biology. J. Vis. Exp. (22), e1065 (2008).
- Johnson, D. M., LaFranzo, N. A., Maurer, J. A. Creating Two-Dimensional Patterned Substrates for Protein and Cell Confinement. J. Vis. Exp. (55), e3164 (2011).
- Singhvi, R., et al. Engineering Cell Shape and Function. Science. 264, 696-698 (1126).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric Control of Cell Life and Death. Science. 276, 1425-1428 (1997).
- Degot, S., et al. Improved Visualization and Quantitative Analysis of Drug Effects using Micropatterned Cells. J. Vis. Exp. (46), e2514 (2010).
- Nakanishi, J., et al. Photoactivation of a Substrate for Cell Adhesion under Standard Fluorescence Microscopes. J. Am. Chem. Soc. 126, 16314-16315 (2004).
- Kim, M., et al. Addressable Micropatterning of Multiple Proteins and Cells by Microscope Projection Photolithography Based on a Protein Friendly Photoresist. Langmuir. 26, 12112-12118 (2010).
- Deka, G., Okano, K., Kao, F. -. J. Dynamic Photopatterning of Cells In Situ by Q-Switched Neodymium-Doped Yttrium Ortho-Vanadate. Laser. J. Biomed. Opt. 19, 011012 (2014).
- Robertus, J., Browne, W. R., Feringa, B. L. Dynamic Control over Cell Adhesive Properties using Molecular-Based Surface Engineering Strategies. Chem. Soc. Rev. 39, 354-378 (2010).
- Choi, I., Yeo, W. -. S. Self-Assembled Monolayers with Dynamicity Stemming from (Bio)chemical Conversions: From Construction to Application. ChemPhysChem. 14, 55-69 (2013).
- Nakanishi, J. Switchable Substrates for Analyzing and Engineering Cellular Functions. Chem. Asian J. 9, 406-417 (2014).
- Yamamoto, H., et al. In Situ Modification of Cell-Culture Scaffolds by Photocatalytic Decomposition of Organosilane Monolayers. Biofabrication. 6, 035021 (2014).
- Sekine, K., Yamamoto, H., Kono, S., Ikeda, T., Kuroda, A., Tanii, T. Surface Modification of Cell Scaffold in Aqueous Solution using TiO2 Photocatalysis and Linker Protein L2 for Patterning Primary Neurons. e-J. Surf. Sci. Nanotech. 13, 213-218 (2015).
- Arima, Y., Iwata, H. Effects of Surface Functional Groups on Protein Adsorption and Subsequent Cell Adhesion using Self-Assembled Monolayers. J. Mater. Chem. 17, 4079-4087 (2007).
- Fujishima, A., Zhang, X., Tryk, D. A. TiO2 Photocatalysis and Related Surface Phenomena. Surf. Sci. Rep. 63, 515-582 (2008).
- Sigal, G. B., Mrksich, M., Whitesides, G. M. Effect of Surface Wettability on the Adsorption of Proteins and Detergents. J. Am. Chem. Soc. 120, 3464-3473 (1998).
- Zhang, X., et al. A Transparent and Photo-Patternable Superhydrophobic Film. Chem. Commun. 2007, 4949-4951 (1039).
- Kaech, S., Banker, G. Culturing Hippocampal Neurons. Nat. Protoc. 1, 2406-2415 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유