Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Photopatterning белки и клетки в водной среде, используя TiO
В этой статье
Резюме
We describe a protocol for modifying cell affinity of a scaffold surface in aqueous environment. The method takes advantage of titanium dioxide photocatalysis to decompose organic film in the photo-irradiated region. We show that it can be used to create microdomains of scaffolding proteins, both ex situ and in situ.
Аннотация
Органические примеси, адсорбированные на поверхности диоксида титана (TiO 2) можно разложить на фотокатализа при ультрафиолетовом (УФ) свете. Здесь мы опишем протокол, использующую новый TiO 2 фотокатализ локально изменять сродство клеток поверхности подложки. Для этого эксперимента, тонкий TiO 2 фильм был покрытым напылением на стекло покровное, и поверхность TiO 2 были внесены изменения с кремнийорганическим монослоя, полученного из octadecyltrichlorosilane (OTS), который ингибирует клеточную адгезию. Образец погружали в среду для культивирования клеток, и целенаправленный ультрафиолетового света облучали с восьмиугольной области. Когда нейрональные клетки линии РС12 клетки высевают на образце, клетки придерживались только на области УФ-облучении. Кроме того, мы показали, что эта поверхность модификации могут быть выполнены на месте, то есть, даже когда клетки растут на подложке. Правильное модификация поверхности необходимо внеклеточного матрикса рrotein коллаген присутствовать в среде в момент УФ-облучения. Техника, представленная здесь может потенциально быть использованы в нескольких паттерна типов клеток для построения совместного культивирования системы или произвольно манипулировать клетки под культуры.
Введение
Полупроводниковые литографии процессы и ее производные, такие как - фотолитографии 1,2, электронно-лучевой литографии 3-6 и 7-10 микроконтакта печати - стали теперь установлено инструментом в клеточной биологии расти живые клетки в определенном положении и геометрии. Способ формирования рисунка зависит от использования микроизготовленном подложек, состоящий из микро-острове клеток разрешающей покрытия в непермиссивной фоне. Такой субстрат служит в качестве шаблона для модели клетки. Эти технологии при условии, нам новые способы для конструирования клеток и их функции в одно- и мульти-клеточном уровне, чтобы извлечь внутренние свойства клеток, а также увеличить пропускную способность на основе клеток скрининга лекарственных средств 11.
Степень-о-свободы в клеточной паттерна бы значительно увеличить, если геометрия модели шаблона могут быть изменены на месте, то есть, в то время как клетки культивируют на Surface. Обычные методы формирования рисунка не могут быть непосредственно применены здесь, так как они обрабатывают образцы в атмосфере или в вакууме. Поэтому различные новые методы модификации поверхности были предложены, которые основаны, например, на фотореакционноспособных соединений 12,13 или лазерной абляции 5,14, только чтобы назвать несколько. Предложенные методы были хорошо рассмотрены Robertus др. 15, а в последнее время Чой и др. 16 и 17 Nakanishi.
Здесь, в этой статье мы опишем новый протокол на месте модификации поверхности, которая принимает преимущество фотокаталитического разложения органических молекул на диоксид титана (TiO 2) поверхности 18,19. В этом методе, пленка TiO 2 вставляется между стеклянной подложкой и органическую пленку, который взаимодействует клетки, и органическая пленка разлагается на месте путем облучения локально ультрафиолетового (УФ)свет в интересующей области (λ <388 нм). Покажем, что новый протокол может быть использован для создания micropatterns белков внеклеточного матрикса и живых клеток обоих ex-situ и на месте. TiO 2 является биологически совместимым, химически стабильный, и оптически прозрачной, особенности, что делает его удобным ввести в экспериментам с культурой клеток. Этот протокол обеспечивает материалы на основе науки альтернативу для изменения клеточной культуры каркасов в среде культивирования клеток.
протокол
1. Подготовка TiO 2 -покрытие покровного стекла
- Количество покровные использованием алмазного рисок. Это помогает не только отслеживать каждый покровные но также для того, чтобы правильно сторона образца вверх. Очистите покровные, сначала под проточной DDh 2 O, а затем путем погружения их в пираний решения (H 2 SO 4: H 2 O 2 = 4: 1). Через 10 мин смойте покровные тщательно, 8 раз в DDh 2 O. Высушите покровные под N 2 потока.
- Установите TiO 2 цель в радио-частоты (РЧ) распыления системы. Прикрепите покровные на держатель образца распыления оборудования с использованием полиимидной лентой. Поместите держатель образца в камере напыления. Эвакуировать камеру, пока давление не достигнет 2,0 × 10 -4 Па.
- Представьте Ar газа в камеру и установить давление осаждения до 4,0 мТорр. Сохраняя затвор закрыт, постепенно увеличиватьВЧ-мощность 70 Вт на
- Открыть затвор, и распыление в течение 15 мин, чтобы получить пленку толщиной 120-150 нм (рис 1: Шаг A). Скорость роста пленки должна быть получена для каждой машины.
2. Поверхность покрытия с сотового нем пленку
- Гидрофилизации поверхности TiO 2 путем обработки образца с O 2 плазме после инструкциям производителя плазменного реактора. Мы рассматриваем образец в течение 5 мин при 200 Вт с O 2 потока 100 SCCM. Погрузитесь образца в DDh 2 O и убедитесь, что поверхность superhydrophilic. Высушите поверхность полностью под N 2 потока.
- Подготовьте 1 мМ octadecyltrichlorosilane решение (OTS), добавив 39,6 мкл OTS 100 мл толуола. Погружают образец в растворе в течение 1 ч при комнатной температуре. Провести этот шаг внутри N 2 с наполнением перчатками (рис 1: Шаг B).
- Для удаления молекул physisorbed, sonicatэлектронной образец в толуоле, ацетоне, этаноле и DDH 2 O в течение 5 мин каждый, в указанном порядке. Промыть образец четыре раза в свежем DDh 2 O и высушить поверхность под N 2 потока. Поверхность должна быть гидрофобной с контактным углом 100-110 °.
3. Экс-Ситу поверхности Создание массивов
- Работа в капюшоне ламинарного потока, сделать несколько царапин с алмазной Чертилка на поверхности. Знаки помочь в отслеживании обработанных областей, а также привлечения внимания микроскопы в. Стерилизацию ОТС покрытием TiO 2 путем погружения образца в 70% этаноле в течение 5 мин. Затем промыть образец в два раза в стерилизованной DDh 2 O.
- Поместите образец в 35-мм блюдо и добавить 2 мл среды роста РС12 (см Шаг 4.2). Инкубировать в течение более 3 часов в СО 2 инкубатор (37 ° C). Эта процедура предназначена, чтобы поглотить сывороточные альбумины на поверхность. Адсорбированных альбумины ингибируют последующее адсорбции другой защмодули и клетки (Рисунок 1: Шаг C).
- Ожидая, настроить перевернутой флуоресцентного микроскопа.
- Включите дуговой лампы, вставьте куб УФ-фильтр и установите объектив с 20х.
- Измерьте интенсивность света I (Вт см -2), используя измеритель УФ-интенсивность, и рассчитать время облучения т (в секундах) для дозы D (J в см -2), как: T = d / I.
Например, для облучения в дозе 200 Дж см -2 с помощью источника света 600 МВт см -2, 333 сек облучения требуется. - Используйте микрометра и закройте полевую диафрагму, чтобы установить размер области, которая будет облучаться, например, 200 мкм.
- После 3 ч инкубации дополнить среду с 200 мкл 3,0 мг мл -1 типа IV коллагена (Col-IV; конечной концентрации 300 мкг мл -1).
- Трансфер 35-мм блюдо к столику микроскопа. Найти скретч мАрканзас, сфокусировать микроскоп на поверхности образца, и облучение УФ-светом в дозе 200 Дж см -2 (рис 1: Стадия D). Площадь УФ-облучения может быть изменена либо путем регулировки отверстия полевой диафрагмы или заменой полевой диафрагмы с металлической маской арбитражного геометрии.
- Замените среду с свежей средой роста (без Col-IV), и поместить образец назад в инкубаторе.
4. Культура клеток
- Регулярное культуры клеток РС12 осуществляется на коллаген-покрытием пластиковую чашку.
- Для пальто 60-мм ткани блюдо культуры с Col-IV, прежде смачивать поверхность с DDh 2 O и аспирации все DDh 2 O.
- Подготовьте 300 мкг мл -1 Col-IV путем разбавления оригинальное решение (3 мг мл -1) 10x с DDH 2 O.
- Добавить 200 мкл 300 мкг мл -1 Col-IV на 60-мм блюдо. Пусть решение распространить через поверхность.
- Сухой тон блюдо в капюшоне ламинарного потока в течение примерно 1 часа.
- Промыть поверхность дважды 4 мл фосфатно-солевом буфере Дульбекко (D-PBS). Когда не сразу, используя блюдо, покрытое, промыть блюдо один раз 4 мл DDH 2 O. После аспирации DDh 2 O, хранить блюдо в инкубаторе. Старайтесь не держать его хранить в течение более чем двух недель.
- PC12 клетки выращивают в питательной среде, состоящей из: среда (низкий уровень глюкозы) Игла в модификации Игла + 10% фетальной бычьей сыворотки + 5% лошадиной сыворотки и 1% пенициллина-стрептомицина решение. Инкубируйте клетки в инкубаторе СО2 (37 ° С, 5% СО 2), и заменить половину среды через день. Прохождение клетки, прежде чем они достигают слияния.
- Аспирируйте ростовую среду, и добавляют 2 мл PBS + (D-PBS + 10 мг мл -1 бычий сывороточный альбумин (БСА) + 10 мМ ЭДТА), предварительно нагретую до 37 ° С. Инкубировать в течение 5 мин при 37 ° С. Аккуратно нажмите блюдо, чтобы отсоединить все сезаполняет.
- Собирают клетки в 15 мл коническую пробирку. Промыть тарелку с 3 мл свежего D-PBS, предварительно нагретой до 37 ° С.
- Центрифуга трубки на 150 х г в течение 4 мин.
- Аспирируйте супернатант и добавить 1 мл ростовой среды.
- Для повседневной культуры, разделить клеткам 1: 3 до 1: 5.
- Для пластины ячеек на УФ-модифицированный ОТС / TiO 2 образца, рассчитывать плотность клеток и добавить 3,0 × 10 5 клеток в 35-мм блюдо (рис 1: стади E). Инкубируйте блюдо в увлажненном инкубаторе (37 ° C, 5% CO 2) в течение 1-2 дней. Оба наивным и фактор роста нервов (NGF) -differentiated PC12 клетки могут быть использованы для формирования паттерна экспериментов. Для NGF дифференциации, 100 нг мл -1 7S-NGF добавляют к росту среднего за несколько дней до посева клеток на образец. NGF-дифференцировки, кажется, увеличивает adhesibility из клеток РС12 и делает управление проще, особенно в на месте узора еxperiments.
5. В месте поверхности Создание массивов
- Через 1-2 дней культуры на месте экс-модифицированной поверхности, подтверждают, что клетки есть и растет только от региона УФ-облученных. Настройка микроскопа, как описано в шаге 3.4.
- Передача образца на новый 35-мм чашки для культивирования тканей, содержащий среду для роста, 100 нг мл -1 ФРН (в случае использования NGF-дифференцированных клетках) и 100 мкг мл -1 Col-IV.
- Поместите блюдо на столике микроскопа. Найти соответствующий позиции, и облучение УФ-светом в дозе 200 Дж см -2 (рис 1: Шаг F, G). Вновь созданный разрешительный область обозначается звездочкой на рисунке 1: Шаг Г.
- Попробуйте завершить обработку одного образца в течение 30 мин. После облучения, перенести образец обратно в среде без Col-IV.
- Будьте крайне осторожны при проведении блюдо кубltured клетки и передачи образца от блюдо блюдо, чтобы предотвратить снятие из узорчатых клеток.
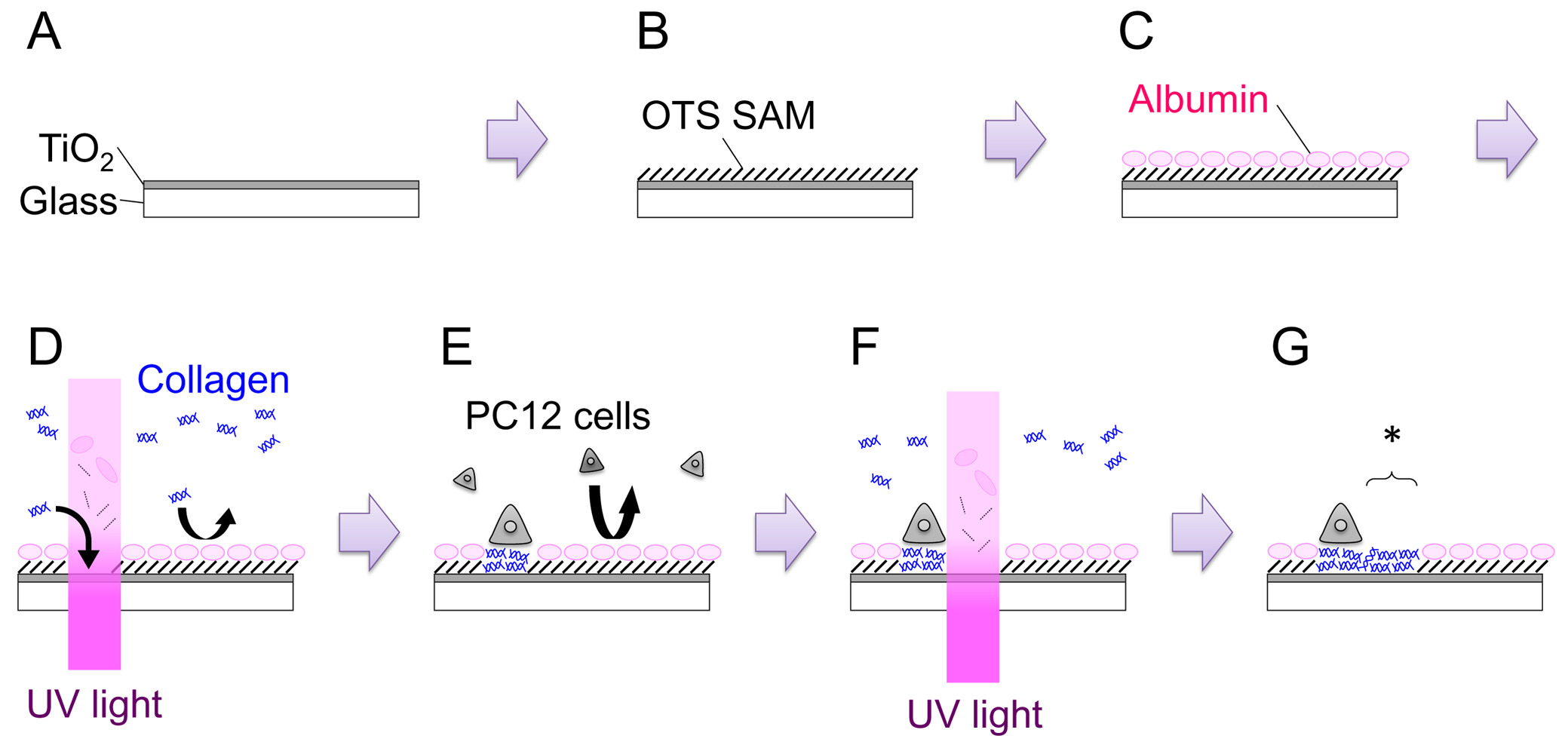
Рисунок 1. Схематическое изображение общего процесса. Подробности в тексте. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Результаты
2А показывает поперечное сечение сканирующей электронной микроскопии (СЭМ) изображение TiO 2 пленки распылением осаждают. Из наблюдений, толщина пленки была оценена приблизительно в 150 нм. Заметное здесь плоскостность осажденного TiO 2 фильма. Дальнейший анализ с помо...
Обсуждение
В нашем протоколе, TiO 2, фильм был сформирован РФ-магнетронного распыления. Мы выступаем этот метод осаждения, так как это позволяет нам воспроизводимо приготовить фотокаталитический TiO 2 фильма с суб-нм шероховатости. Хотя НАПЫЛЕНИЕМ процессы осаждения знакомы материалов у?...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Authors thank Mr. Kotaro Okubo for the kind assistance with SEM imaging. This work was supported by the Japan Society for the Promotion of Science Grant-in-Aid for Basic Research (B) (20310069), Grant-in-Aid for Research Activity Start-up (25880021), and by research grants from the Kurata Memorial Hitachi Science and Technology Foundation and the Nippon Sheet Glass Foundation for Materials Science and Engineering.
Материалы
| Name | Company | Catalog Number | Comments |
| Glass coverslip | Warner Instruments | CS-15R15 | 15 mm diameter, #1.5 thickness |
| Diamond scriber | Ogura Jewel Industry | D-Point Pen | |
| RF sputtering system | ANELVA | SPC350 | |
| TiO2 sputtering target | Kojundo Chemical Lab | Titanium (IV) oxide, target | Purity, 99.9% |
| Plasma reactor | Yamato | PR301 | |
| n-octadecyltrichlorosilane (OTS) | Aldrich | 104817 | |
| Toluene | Wako | 204-01866 | |
| Tissue-culture dish (35 mm) | Greiner | 627160 | |
| Tissue-culture dish (60 mm) | BD Falcon | 353002 | |
| Type-IV collagen | Nitta Gelatin | Cellmatrix Type IV | |
| D-PBS | Gibco | 14190-144 | |
| Dulbecco's modified Eagle's medium (DMEM) | Gibco | 11885-084 | |
| Fetal bovine serum | Gibco | 12483-020 | Heat-inactivate and pass through a 0.22 μm filter before use |
| Horse serum | Gibco | 26050-088 | Pass through a 0.22 μm filter before use |
| Penicillin-streptomycin (100x) | Nacalai tesque | 26253-84 | |
| 7S nerve growth factor (NGF) | Alomone Labs | N-130 | |
| Bovine serum albumin (BSA) | Sigma | A2153 | |
| EDTA | Dojindo | N001 | Stock solution in 0.5 M |
| TiO2 nanoparticle | Tayca | TKD-701 |
Ссылки
- Hughes, M. A., Brennan, P. M., Bunting, A. S., Shipston, M. J., Murray, A. F. Cell Patterning on Photolithographically Defined Parylene-C: SiO2 Substrates. J. Vis. Exp. (85), e50929 (2014).
- Kleinfeld, D., Kahler, K. H., Hockberger, P. E. Controlled Outgrowth of Dissociated Neurons on Patterned Substrates. J. Neurosci. 8, 4098-4120 (1988).
- Pensen, D., Heinz, W. F., Werbin, J. L., Hoh, J. H., Haviland, D. B. Electron Beam Patterning of Fibronectin Nanodots that Support Focal Adhesion Formation. Soft Matter. 3, 1280-1284 (2007).
- Tanii, T., et al. Application of Organosilane Monolayer Template to Quantitative Evaluation of Cancer Cell Adhesive Ability. Jpn. J. Appl. Phys. 50, 06GL01 (2011).
- Yamamoto, H., et al. In-Situ Guidance of Individual Neuronal Processes by Wet Femtosecond Laser Processing of Self-Assembled Monolayers. Appl. Phys. Lett. 99, 163701-1610 (2011).
- Yamamoto, H., et al. Differential Neurite Outgrowth is Required for Axon Specification by Cultured Hippocampal Neurons. J. Neurochem. 123, 904-910 (2012).
- Shen, K., Qi, J., Kam, L. C. Microcontact Printing of Proteins for Cell Biology. J. Vis. Exp. (22), e1065 (2008).
- Johnson, D. M., LaFranzo, N. A., Maurer, J. A. Creating Two-Dimensional Patterned Substrates for Protein and Cell Confinement. J. Vis. Exp. (55), e3164 (2011).
- Singhvi, R., et al. Engineering Cell Shape and Function. Science. 264, 696-698 (1126).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric Control of Cell Life and Death. Science. 276, 1425-1428 (1997).
- Degot, S., et al. Improved Visualization and Quantitative Analysis of Drug Effects using Micropatterned Cells. J. Vis. Exp. (46), e2514 (2010).
- Nakanishi, J., et al. Photoactivation of a Substrate for Cell Adhesion under Standard Fluorescence Microscopes. J. Am. Chem. Soc. 126, 16314-16315 (2004).
- Kim, M., et al. Addressable Micropatterning of Multiple Proteins and Cells by Microscope Projection Photolithography Based on a Protein Friendly Photoresist. Langmuir. 26, 12112-12118 (2010).
- Deka, G., Okano, K., Kao, F. -. J. Dynamic Photopatterning of Cells In Situ by Q-Switched Neodymium-Doped Yttrium Ortho-Vanadate. Laser. J. Biomed. Opt. 19, 011012 (2014).
- Robertus, J., Browne, W. R., Feringa, B. L. Dynamic Control over Cell Adhesive Properties using Molecular-Based Surface Engineering Strategies. Chem. Soc. Rev. 39, 354-378 (2010).
- Choi, I., Yeo, W. -. S. Self-Assembled Monolayers with Dynamicity Stemming from (Bio)chemical Conversions: From Construction to Application. ChemPhysChem. 14, 55-69 (2013).
- Nakanishi, J. Switchable Substrates for Analyzing and Engineering Cellular Functions. Chem. Asian J. 9, 406-417 (2014).
- Yamamoto, H., et al. In Situ Modification of Cell-Culture Scaffolds by Photocatalytic Decomposition of Organosilane Monolayers. Biofabrication. 6, 035021 (2014).
- Sekine, K., Yamamoto, H., Kono, S., Ikeda, T., Kuroda, A., Tanii, T. Surface Modification of Cell Scaffold in Aqueous Solution using TiO2 Photocatalysis and Linker Protein L2 for Patterning Primary Neurons. e-J. Surf. Sci. Nanotech. 13, 213-218 (2015).
- Arima, Y., Iwata, H. Effects of Surface Functional Groups on Protein Adsorption and Subsequent Cell Adhesion using Self-Assembled Monolayers. J. Mater. Chem. 17, 4079-4087 (2007).
- Fujishima, A., Zhang, X., Tryk, D. A. TiO2 Photocatalysis and Related Surface Phenomena. Surf. Sci. Rep. 63, 515-582 (2008).
- Sigal, G. B., Mrksich, M., Whitesides, G. M. Effect of Surface Wettability on the Adsorption of Proteins and Detergents. J. Am. Chem. Soc. 120, 3464-3473 (1998).
- Zhang, X., et al. A Transparent and Photo-Patternable Superhydrophobic Film. Chem. Commun. 2007, 4949-4951 (1039).
- Kaech, S., Banker, G. Culturing Hippocampal Neurons. Nat. Protoc. 1, 2406-2415 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены