Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
TiO kullanarak sulu bir ortamda Proteinler ve Hücreler photopatterning
Bu Makalede
Özet
We describe a protocol for modifying cell affinity of a scaffold surface in aqueous environment. The method takes advantage of titanium dioxide photocatalysis to decompose organic film in the photo-irradiated region. We show that it can be used to create microdomains of scaffolding proteins, both ex situ and in situ.
Özet
Titanyum dioksit yüzeyi (TiO2) üzerinde adsorbe organik kirletici ultraviyole (UV) ışık altında fotokatalizle çürümüş olabilir. Burada yerel alt tabaka yüzeyinin hücre yakınlık değiştirmek için TiO2 fotokatalizden kullanan yeni bir protokol açıklar. Bu deney için, ince bir TiO2 Film püskürtme ile kaplanmış bir cam lamel, ve TiO2 yüzey, daha sonra hücre yapışmasını inhibe eden oktadesiltriklorosilandır (OTS) türetilen bir organosilan tek tabaka ile modifiye edildi. Örnek bir hücre kültürü ortamı içine daldırılır ve UV ışığı sekizgen bölgeye ışınlandı odaklanmıştır. Bir nöronal hücre çizgisi PC12 hücreleri numune üzerine kaplandı, hücreler sadece UV-radyasyona alana bağlı kalmıştır. Biz daha hücre alt-tabaka üzerinde büyüyen bile bu yüzey modifikasyonu, aynı zamanda örneğin, in situ gerçekleştirilebilir göstermektedir. Yüzeyin düzgün modifikasyonu bir hücre dışı matris p gereklikollajen rotein UV ışınlaması sırasında ortam içinde mevcut olması mümkündür. Burada sunulan tekniğin potansiyel kültürü altında hücreleri Coculture sistemlerini inşa veya keyfi işlemek için desenleme çoklu hücre tiplerinde kullanılabilir.
Giriş
Yarıiletken litografi süreçleri ve türevleri - Böyle fotolitografi 1,2, elektron ışını litografi 3-6 ve 7-10 yazdırma microcontact olarak - şimdi tanımlanmış bir konum ve geometri yaşayan hücrelerin büyümesini hücre biyolojisinde kurulmuş bir araç haline gelmiştir. Model verme yöntemi, permisif olmayan arka plan hücre permisif kaplamanın mikro ada oluşan mikrofabrike substratların kullanımına dayanır. Bu gibi alt-tabaka desen hücreleri için bir şablon olarak hizmet vermektedir. Bu teknolojiler bize hücrelerinin içsel özelliklerinin ayıklamak ve hücre bazlı ilaç tarama 11 verimini artırmak için, bir tek ve çok hücresel düzeyde hücreleri ve bunların fonksiyonlarını mühendisi yeni yöntemler sağlamıştır.
Şablon desen geometrisi, yani yerinde değişmiş olabilir eğer hücreler s kültüre iken derecesi serbestlik hücre desenleme büyük ölçüde, artıracak, sert bir. Atmosferde veya vakumda örnekleri işleme sinyalinden oluşumu için olan klasik yöntemler, doğrudan, burada uygulanamamaktadır. Bu nedenle, çeşitli yeni yüzey modifikasyon teknikleri sadece birkaç isim için, fotoreaktif bileşikler 12,13 veya lazer ablasyon 5,14 tarihinde, örneğin, dayandığı öne sürülmüştür. Önerilen yöntemler güzel Choi ve ark., 16 ile ve Nakanishi'nin 17 tarafından daha yakın. Robertus ark 15 gözden ve oylandı.
İşte bu makalede, biz bir titanyum dioksit organik moleküllerin fotokatalitik ayrışma yararlanır in-situ yüzey modifikasyonu, (TiO2) yüzey 18,19 yeni bir protokol açıklar. Bu yöntemde, bir TiO2 filmi cam alt tabaka ve hücreleri arabirimleri, organik film arasında eklenir ve organik film yerel olarak ultraviyole (UV) ışınıma tabi tutulması işlemiyle in situ parçalanırÇevrede bir bölge (λ <388 nm) ışık. Yeni protokolü hücre dışı matris proteinleri ve canlı hücreler, hem ex situ ve in situ micropatterns oluşturmak için kullanılabileceğini göstermektedir. TiO2 hücre kültürü deneylerinde tanıtmak kolaylığına özellikleri olan, biyolojik olarak uyumlu, kimyasal olarak stabil, optik olarak saydamdır. Bu protokol, hücre kültürü ortamında hücre kültürü iskeleleri değiştirmek için bir malzeme bilimi tabanlı bir alternatif sunuyor.
Protokol
TiO2 hazırlanması 1. cam lamel -kaplı
- Sayı bir elmas Çizici kullanarak lamelleri. Bu, her lamelleri izlemek için değil, aynı zamanda numunenin doğru tarafı yukarı bakacak emin olmak için değil, sadece yardımcı olur. İlk pirana çözelti içine daldırılarak, sonra GKD 2 O akan, lamelleri temizleyin (H 2 SO 4: H2O 2 = 4: 1). 10 dakika sonra, GKD 2 O. iyice 8 kez lamelleri durulama N2 akışı altında lamelleri kurutun.
- Radyo frekans (RF) püskürtme sistemine TiO2 hedefi ayarlayın. Bir poliimid bant kullanarak püskürtme ekipmanı örnek tutucu üzerine lamelleri takın. Püskürtme hücresindeki numune tutucu yerleştirin. Basınç 2.0 × 10 ulaşana kadar odayı boşaltın -4 Pa.
- Odasına Ar gazı tanıtın ve 4.0 mTor için birikim basıncını ayarlamak. Deklanşör kapalı tutarken, yavaş yavaş artış70 W RF güç
- Deklanşör açın ve 120-150 nm'de (Şekil 1: Adım A) bir kalınlığa sahip bir film elde etmek üzere 15 dakika için püskürtmeyle çökeltilmesi. Filmin büyüme hızı, her bir makine için elde edilmesi gerekmektedir.
Hücre tutmayan Film ile 2. Yüzey Kaplama
- Plazma reaktörün üreticisi tarafından sağlanan yönergeleri izleyerek, O 2 plazma ile numuneyi tedavi ederek TiO2 hidrofilleştirecek. Biz 100 sccm'lik O 2 akışı ile W 200 ° C'de 5 dakika boyunca numune davranın. GKD 2 O numune daldırın ve yüzey süperhidrofilik olduğunu doğrulayın. İyice N2 akışı altında yüzeyi kurulayın.
- 100 ml toluen 39,6 ul OTS ekleyerek 1 mM oktadesiltriklorosilandır (OTS) çözeltisi hazırlayın. Oda sıcaklığında 1 saat için çözelti içinde numune bırakın. N 2 dolgulu eldiven torbası (: Adım B Şekil 1) içinde bu adımı gerçekleştirin.
- Physisorbed moleküllerini çıkartmak için, sonicate tolüen, aseton, etanol içinde örnek ve bu sırayla 5 dakika her biri için, GKD 2 O. Taze GKD 2 O örnek dört kez durulayın ve N2 akımı altında yüzeyi kurulayın. Yüzey 100-110 ° bir temas açısına sahip hidrofobik olmalıdır.
3. Eski Yerinde Yüzey Desenlendirme
- Laminer akış kaputu Çalışma, yüzeyde bir elmas Scriber birkaç çizik izleri çizin. Işaretleri işlenen bölgelerin kayıtlarını tutmak ve aynı zamanda odak noktası haline mikroskopları getirmekte yardımcı olur. 5 dakika boyunca% 70 etanol içinde örnek daldırarak OTS kaplı TiO 2 sterilize edin. Daha sonra sterilize edilmiş GKD 2 O. iki kez numune durulama
- 35 mm çanak örnek yerleştirin ve PC12 büyüme ortamının 2 ml ekleyin (Adım 4.2). Bir CO2 kuluçka makinesi içinde 3 saat boyunca (37 ° C) inkübe edin. Bu prosedür, serum albüminler yüzeye absorbe izin amaçlanmıştır. Adsorplanan albüminler diğer prote sonraki adsorpsiyonu inhibein ve hücreleri (Şekil 1: Adım C).
- Beklerken, ters floresan mikroskop kurdu.
- Ark lambasını açmak UV filtresi küp yerleştirin ve 20X objektif merceği ayarlayın.
- Işık yoğunluğu I (W cm-2) kullanılarak, bir UV-gerilimi ölçü ölçmek ve benzeri gibi (J cm -2) ve d bir doz için (saniye olarak) ışınlama süresi t hesaplayın: t = d / I.
Örneğin, 200 J sm bir dozda radyasyon sağlanması için -2 600 mW cm -2 arasında bir ışık kaynağı kullanılarak, ışınlama 333 sn gereklidir. - Bir sahne mikrometre kullanın ve bölgenin büyüklüğü, örneğin, 200 mikron, ışınlanmış olması ayarlamak için alan diyafram kapatın.
- (Nihai konsantrasyon 300 ug ml -1 Col-IV) 3 saat inkübasyondan sonra, 3.0 mg ml-1 tür IV kolajen 200 ul ortam ek.
- Mikroskop sahneye 35 mm çanak aktarın. Karalama m bulark, örnek yüzeyi üzerine bir mikroskop odak ve 200 J cm -2 (Şekil 1: Basamak D) bir dozda UV ışığını ışın tedavisi. UV ışınlaması alanı alan diyafram açılmasını ayarlayarak ya da tahkim geometri metal maskesi alanında diyafram değiştirerek ya da değişmiş olabilir.
- (Col-IV olmadan) taze büyüme ortamı ile orta değiştirin ve inkübatör geri numuneyi yerleştirin.
4. Hücre Kültürü
- PC12 hücrelerinin rutin kültürü kollajen kaplı plastik tabak üzerinde gerçekleştirilmektedir.
- Kat Col-IV ile 60 mm doku kültürü çanak için önce GKD 2 O ile yüzey ıslak ve tüm GKD 2 O. aspire
- 300 ug ml hazırlayın -1 Col-IV GKD 2 O. ile (3 mg ml -1) 10x orijinal bir çözüm seyreltilmesi ile
- 300 ug ml -1 60 mm tabak başına Col-IV, 200 ul ekleyin. Yüzeyden yayılan bir çözüm olsun.
- Kuru to yaklaşık 1 saat boyunca, bir laminar akış başlığı içinde çanak.
- Dulbecco fosfat tamponlu tuz (D-PBS) 4 ml ile iki kez yüzey durulayın. Hemen kaplı çanak kullanmadığınız zaman, GKD 2 O. 4 ml ile bir kez yıkayın çanak GKD 2 O aspire sonra, inkübatör çanak saklayın. Daha fazla iki hafta boyunca saklanan tutmaya çalışın.
- PC12 hücreleri oluşan bir büyüme ortamında büyütülür: Dulbecco'nun modifiye edilmiş Eagle ortamı (düşük glikoz) +% 10 cenin sığır serumu +% 5 at serumu +% 1 penisilin-streptomisin solüsyonu. Bir CO2 inkübatöründe inkübe hücreleri (37 ° C,% 5 CO2), ve her gün ortamın yarısı değiştirin. Passage hücreleri izdiham ulaşmadan.
- Aspire büyüme ortamı ve ek 2 ml PBS + (D-PBS + 10 mg mi -1 sığır serum albümini (BSA), 10 mM EDTA), 37 ° C'ye ön ısıtılmıştır. 37 ° C'de 5 dakika süreyle inkübe edilir. Yavaşça tüm ce ayırmak için çanak dokununlls.
- 15 ml konik tüp hücreleri toplayın. 37 ° C'ye ön ısıtılmıştır taze D-PBS 3 ml çanak yıkayın.
- 4 dakika boyunca 150 x g'de santrifüj tüpü.
- Süpernatanı havalandırın, ve büyüme ortamı 1 ml.
- 1: 3: Rutin kültür için, hücreler 1 bölünmüş 5.
- UV-modifiye OTS / TiO2 numune üzerinde hücreleri plaka hücre yoğunluğu saymak ve 35 mm çanak (Şekil 1: Adım E) 3.0 × 10 5 hücre eklemek için. 1-2 gün boyunca nemlendirilmiş bir inkübatör çanak (37 ° C,% 5 CO2) inkübe edin. Hem saf ve sinir büyüme faktörü (NGF) -differentiated PC12 hücreleri desen deneyleri için de kullanılabilir. NGF farklılaşma için, 7S-NGF'nin 100 ng ml -1 numune üzerine hücreleri kaplama önce büyüme ortamı birkaç gün eklenmektedir. NGF farklılaşma PC12 hücrelerinin adhesibility artırmak gibi görünüyor ve özellikle situ desenlendirme e, kolay taşıma yaparxperiments.
5. Yerinde Yüzey Desenlendirme
- Ex-situ modifiye yüzey üzerinde kültür 1-2 gün sonra hücreler ekleyerek ve UV-ışınlanmış bölgeye sadece büyüyor onaylayın. Adım 3.4 anlatıldığı gibi, mikroskop ayarlayın.
- Büyüme ortamı içeren yeni bir 35 mm doku kültürü çanağı numune aktarın (NGF diferansiye hücrelerin kullanılması halinde) 100 ng ml -1 NGF ve 100 ug ml -1 Col-IV.
- Mikroskop sahnede çanak yerleştirin. Uygun yerini bulur ve 200 J cm -2 (Şekil 1: Adım F, G) bir dozda UV ışığını ışın tedavisi. Yeni oluşturulan hoşgörülü bölge Şekil 1'de bir yıldızla gösterilir: Adım G.
- 30 dakika içinde tek bir örnek işlenmesini tamamlamaya çalışın. Işınlama sonrası, Col-IV olmadan geri ortama örnek aktarmak.
- Cu ile çanak taşırken çok dikkatli olunltured hücreleri ve çanak numune transfer desenli hücrelerin ayırma engellemek için çanak.
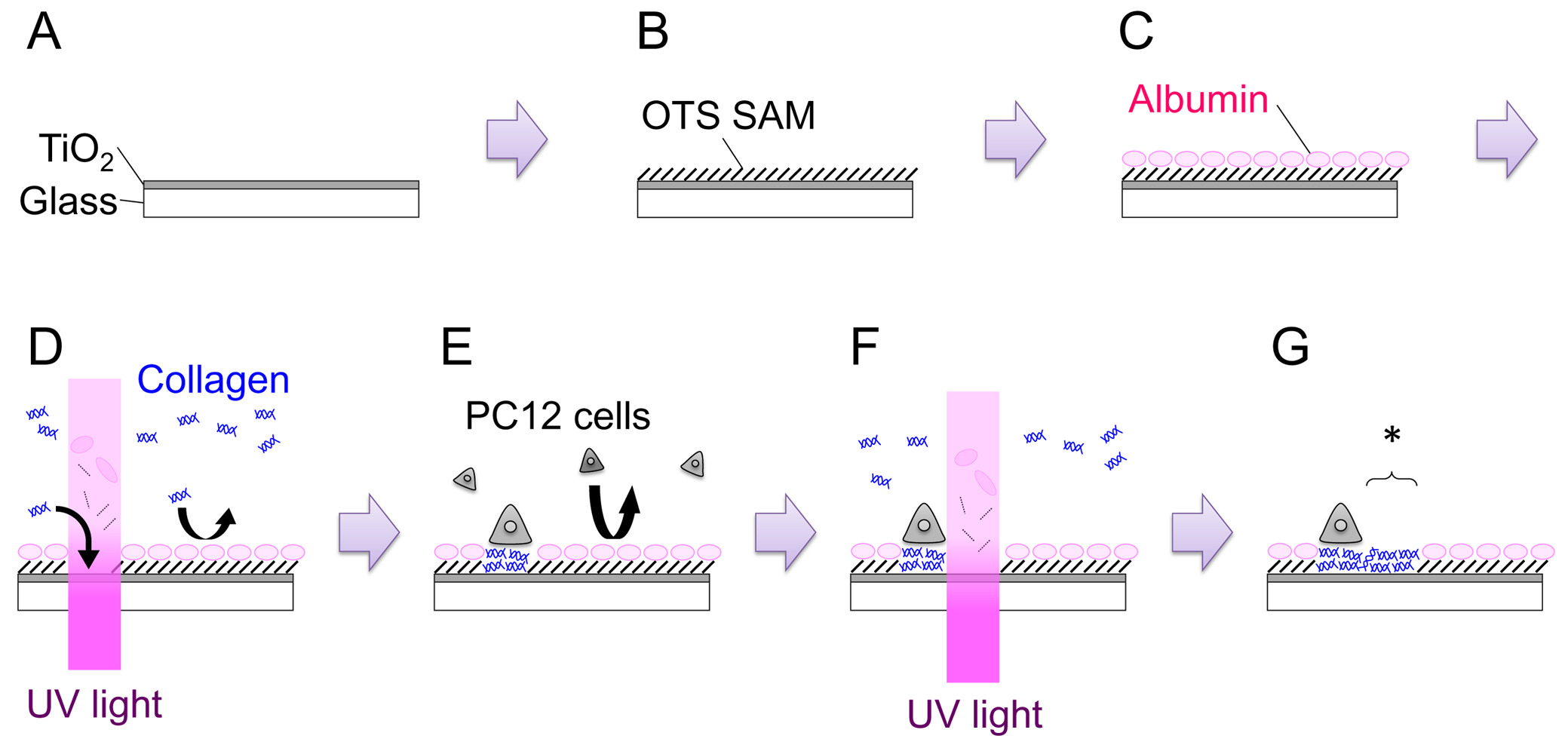
Genel sürecin 1. şematik çizimi Şekil. Ayrıntılar için metne bakınız. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Sonuçlar
Şekil 2A, püskürtme ile tevdi TiO2 filmin bir kesit tarama elektron mikroskobu (SEM) görüntüsünü göstermektedir. Gözlemlerden sonra filmin kalınlığı yaklaşık 150 nm olarak tahmin edilmiştir. Burada dikkat çekici tevdi TiO2 filmin düzlüğü olduğunu. Atomik kuvvet mikroskobu (AFM) ile daha fazla analiz yüzeyinin kök ortalama kare (rms) pürüz 0.2 nm (Şekil 2B) olduğunu ortaya koymuştur.
TiO2 yüzeyi ...
Tartışmalar
Mevcut protokolde, TiO2 filmi RF-manyetik alanda sıçratma tarafından kuruldu. Bize tekrarlanabilir bir alt-nm pürüzlülüğü ile fotokatalitik TiO2 filmi hazırlamak için izin verir çünkü biz birikimi bu yöntemi tercih. Püskürtülerek bırakma süreçleri malzeme bilim adamları ve mühendisleri elektronik tanıdık olmasına rağmen, biyologlar oldukça erişilebilir olmayabilir. Bu durumda, spin-kaplı TiO2 filmi alternatif bir seçenek 23 olacaktır. Bu yöntem...
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
Authors thank Mr. Kotaro Okubo for the kind assistance with SEM imaging. This work was supported by the Japan Society for the Promotion of Science Grant-in-Aid for Basic Research (B) (20310069), Grant-in-Aid for Research Activity Start-up (25880021), and by research grants from the Kurata Memorial Hitachi Science and Technology Foundation and the Nippon Sheet Glass Foundation for Materials Science and Engineering.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Glass coverslip | Warner Instruments | CS-15R15 | 15 mm diameter, #1.5 thickness |
| Diamond scriber | Ogura Jewel Industry | D-Point Pen | |
| RF sputtering system | ANELVA | SPC350 | |
| TiO2 sputtering target | Kojundo Chemical Lab | Titanium (IV) oxide, target | Purity, 99.9% |
| Plasma reactor | Yamato | PR301 | |
| n-octadecyltrichlorosilane (OTS) | Aldrich | 104817 | |
| Toluene | Wako | 204-01866 | |
| Tissue-culture dish (35 mm) | Greiner | 627160 | |
| Tissue-culture dish (60 mm) | BD Falcon | 353002 | |
| Type-IV collagen | Nitta Gelatin | Cellmatrix Type IV | |
| D-PBS | Gibco | 14190-144 | |
| Dulbecco's modified Eagle's medium (DMEM) | Gibco | 11885-084 | |
| Fetal bovine serum | Gibco | 12483-020 | Heat-inactivate and pass through a 0.22 μm filter before use |
| Horse serum | Gibco | 26050-088 | Pass through a 0.22 μm filter before use |
| Penicillin-streptomycin (100x) | Nacalai tesque | 26253-84 | |
| 7S nerve growth factor (NGF) | Alomone Labs | N-130 | |
| Bovine serum albumin (BSA) | Sigma | A2153 | |
| EDTA | Dojindo | N001 | Stock solution in 0.5 M |
| TiO2 nanoparticle | Tayca | TKD-701 |
Referanslar
- Hughes, M. A., Brennan, P. M., Bunting, A. S., Shipston, M. J., Murray, A. F. Cell Patterning on Photolithographically Defined Parylene-C: SiO2 Substrates. J. Vis. Exp. (85), e50929 (2014).
- Kleinfeld, D., Kahler, K. H., Hockberger, P. E. Controlled Outgrowth of Dissociated Neurons on Patterned Substrates. J. Neurosci. 8, 4098-4120 (1988).
- Pensen, D., Heinz, W. F., Werbin, J. L., Hoh, J. H., Haviland, D. B. Electron Beam Patterning of Fibronectin Nanodots that Support Focal Adhesion Formation. Soft Matter. 3, 1280-1284 (2007).
- Tanii, T., et al. Application of Organosilane Monolayer Template to Quantitative Evaluation of Cancer Cell Adhesive Ability. Jpn. J. Appl. Phys. 50, 06GL01 (2011).
- Yamamoto, H., et al. In-Situ Guidance of Individual Neuronal Processes by Wet Femtosecond Laser Processing of Self-Assembled Monolayers. Appl. Phys. Lett. 99, 163701-1610 (2011).
- Yamamoto, H., et al. Differential Neurite Outgrowth is Required for Axon Specification by Cultured Hippocampal Neurons. J. Neurochem. 123, 904-910 (2012).
- Shen, K., Qi, J., Kam, L. C. Microcontact Printing of Proteins for Cell Biology. J. Vis. Exp. (22), e1065 (2008).
- Johnson, D. M., LaFranzo, N. A., Maurer, J. A. Creating Two-Dimensional Patterned Substrates for Protein and Cell Confinement. J. Vis. Exp. (55), e3164 (2011).
- Singhvi, R., et al. Engineering Cell Shape and Function. Science. 264, 696-698 (1126).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric Control of Cell Life and Death. Science. 276, 1425-1428 (1997).
- Degot, S., et al. Improved Visualization and Quantitative Analysis of Drug Effects using Micropatterned Cells. J. Vis. Exp. (46), e2514 (2010).
- Nakanishi, J., et al. Photoactivation of a Substrate for Cell Adhesion under Standard Fluorescence Microscopes. J. Am. Chem. Soc. 126, 16314-16315 (2004).
- Kim, M., et al. Addressable Micropatterning of Multiple Proteins and Cells by Microscope Projection Photolithography Based on a Protein Friendly Photoresist. Langmuir. 26, 12112-12118 (2010).
- Deka, G., Okano, K., Kao, F. -. J. Dynamic Photopatterning of Cells In Situ by Q-Switched Neodymium-Doped Yttrium Ortho-Vanadate. Laser. J. Biomed. Opt. 19, 011012 (2014).
- Robertus, J., Browne, W. R., Feringa, B. L. Dynamic Control over Cell Adhesive Properties using Molecular-Based Surface Engineering Strategies. Chem. Soc. Rev. 39, 354-378 (2010).
- Choi, I., Yeo, W. -. S. Self-Assembled Monolayers with Dynamicity Stemming from (Bio)chemical Conversions: From Construction to Application. ChemPhysChem. 14, 55-69 (2013).
- Nakanishi, J. Switchable Substrates for Analyzing and Engineering Cellular Functions. Chem. Asian J. 9, 406-417 (2014).
- Yamamoto, H., et al. In Situ Modification of Cell-Culture Scaffolds by Photocatalytic Decomposition of Organosilane Monolayers. Biofabrication. 6, 035021 (2014).
- Sekine, K., Yamamoto, H., Kono, S., Ikeda, T., Kuroda, A., Tanii, T. Surface Modification of Cell Scaffold in Aqueous Solution using TiO2 Photocatalysis and Linker Protein L2 for Patterning Primary Neurons. e-J. Surf. Sci. Nanotech. 13, 213-218 (2015).
- Arima, Y., Iwata, H. Effects of Surface Functional Groups on Protein Adsorption and Subsequent Cell Adhesion using Self-Assembled Monolayers. J. Mater. Chem. 17, 4079-4087 (2007).
- Fujishima, A., Zhang, X., Tryk, D. A. TiO2 Photocatalysis and Related Surface Phenomena. Surf. Sci. Rep. 63, 515-582 (2008).
- Sigal, G. B., Mrksich, M., Whitesides, G. M. Effect of Surface Wettability on the Adsorption of Proteins and Detergents. J. Am. Chem. Soc. 120, 3464-3473 (1998).
- Zhang, X., et al. A Transparent and Photo-Patternable Superhydrophobic Film. Chem. Commun. 2007, 4949-4951 (1039).
- Kaech, S., Banker, G. Culturing Hippocampal Neurons. Nat. Protoc. 1, 2406-2415 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır