A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Photopatterning חלבונים ותאים בסביבה מימית שימוש Tio
In This Article
Summary
We describe a protocol for modifying cell affinity of a scaffold surface in aqueous environment. The method takes advantage of titanium dioxide photocatalysis to decompose organic film in the photo-irradiated region. We show that it can be used to create microdomains of scaffolding proteins, both ex situ and in situ.
Abstract
מזהמים אורגניים אשר נספחים על פני השטח של תחמוצת טיטניום (Tio 2) יכולים להיות מפורקים על ידי photocatalysis באור אולטרה סגול (UV). כאן אנו מתארים פרוטוקול רומן העסקת photocatalysis Tio 2 לשנות זיקת תא של משטח המצע מקומי. לצורך ניסוי זה, Tio 2 סרט דק היה על coverslip זכוכית מצופה גמגום, ופני שטח Tio 2 שונה לאחר מכן עם monolayer organosilane נגזר מoctadecyltrichlorosilane (OTS), אשר מעכב את הידבקות תא. המדגם היה שקוע במדיום תרבית תאים, והתמקד אור UV היה מוקרן לאזור מתומן. כאשר תאי PC12 שורת תאים עצביים היו מצופים על המדגם, תאים דבקו רק באזור המוקרן UV. בנוסף, אנו מראים כי שינוי פני השטח זה יכול גם להתבצע באתר, כלומר, גם כאשר תאים גדלים על המצע. שינוי נכון של פני השטח הנדרש עמ 'מטריקסrotein קולגן להיות נוכח במדיום בעת קרינת UV. הטכניקה המוצגת כאן יכולה להיות מועסקות פוטנציאלית בסוגי תאים מרובים דפוסים לבניית מערכות coculture או לתמרן באופן שרירותי תאים תחת התרבות.
Introduction
תהליכים ליתוגרפיה סמיקונדקטור ונגזרותיו - כגון 1,2 photolithography, ליתוגרפיה קרן האלקטרונים 3-6, וmicrocontact הדפסת 7-10 - הפכו להיות עכשיו כלי הוקם בביולוגיה של תא לגדול תאי חיים בעמדה וגיאומטריה מוגדרות. שיטת הדפוסים מסתמכת על השימוש במצעי microfabricated, בהיקף של מיקרו-האי של ציפוי מתירנית תא ברקע שאינו מתירנית. מצע כזה משמש כתבנית לתבנית התאים. טכנולוגיות אלה סיפקו לנו את שיטות הרומן להנדס תאים ותפקודם ברמה חד ורב-תאית, כדי לחלץ את המאפיינים הפנימיים של תאים, ולהגדיל את התפוקה של הקרנת סמים מבוססי תאים 11.
התואר של חופש בדפוסי תא היה להגדיל באופן משמעותי אם הגיאומטריה דפוס תבנית אפשר לשנות באתר, כלומר, בזמן שתאים בתרבית על יםurface. השיטות המקובלות להיווצרות דפוס לא ניתן ליישם ישירות כאן, שכן הם לעבד דגימות באווירה או בואקום. טכניקות שינוי פני השטח חדשות ולכן שונות הוצעו, המבוססים, למשל, על תרכובות photoreactive 12,13 או אבלציה לייזר 5,14, רק כדי שם כמה. השיטות המוצעות נבדקו יפה על ידי אל Robertus et. 15, ולאחרונה על ידי צ'וי et al. 16 ועל ידי נאקאנישי 17.
כאן במאמר זה, אנו מתארים פרוטוקול רומן של שינוי באתר פני השטח, אשר מנצל את פירוק photocatalytic של מולקולות אורגניות על דו תחמוצת טיטניום (Tio 2) משטח 18,19. בשיטה זו, סרט Tio 2 מוכנס בין מצע הזכוכית והסרט האורגני ממשקים התאים, והסרט האורגני מתפרק באתר על ידי מקומי הקרנת אור אולטרה סגול (UV)אור לאזור של עניין (λ <ננומטר 388). אנו מראים כי הפרוטוקול החדש יכול לשמש ליצירה של חלבונים תאיים micropatterns מטריצה ותאי חיים הן באתרו לשעבר ובאתרו. Tio 2 הוא ביולוגית, כימי יציב, ושקוף אופטי, תכונות שהופך אותו לידידותי להציג בניסויי תא-תרבות. פרוטוקול זה מספק אלטרנטיבה חומרים מבוסס מדע לשינוי פיגומי תא-תרבות בסביבת תא-תרבות.
Protocol
1. הכנת Tio 2 -coated זכוכית Coverslip
- מספר coverslips באמצעות חרט יהלומים. זה לא רק עוזר כדי לעקוב אחר כל coverslips אלא גם כדי להבטיח שהצד הנכון של המדגם פונה כלפי מעלה. נקה את coverslips, הראשון תחת זרם DDH 2 O, לאחר מכן על ידי טבילתם בפתרון פיראניה (H 2 SO 4: H 2 O 2 = 4: 1). לאחר 10 דקות, לשטוף ביסודיות את coverslips, 8 פעמים בDDH 2 O. יבש coverslips תחת N זרימת 2.
- הגדר Tio 2 יעד במערכת רדיו בתדר (RF) המקרטעת. צרף את coverslips על בעל מדגם של הציוד המקרטעת באמצעות קלטת polyimide. מניחים את בעל המדגם בתא המקרטעת. לפנות את החדר עד שהלחץ מגיע 2.0 × 10 -4 אבא.
- להציג את גז Ar לתוך התא ולהגדיר את הלחץ בתצהיר לmTorr 4.0. תוך שמירה על התריס סגור, להגדיל בהדרגהכוח RF 70 W.
- פתח את התריס וגמגום במשך 15 דקות כדי להשיג סרט בעובי של 120-150 ננומטר (איור 1: שלב). שיעור צמיחה של הסרט צריך להיות נגזר לכל מכונה.
ציפוי משטח 2. עם סרטים ניידים דוחה
- Hydrophilize משטח Tio 2 על ידי טיפול במדגם עם O 2 פלזמה, בעקבות הוראות הניתנות על ידי היצרן של כור הפלזמה. אנחנו מתייחסים למדגם במשך 5 דקות ב 200 W עם O 2 זרימה של 100 SCCM. לטבול את המדגם בDDH 2 O ולאשר כי פני השטח הוא סופר-הידרופילית. ייבש את המשטח ביסודיות תחת N זרימת 2.
- הכן 1 octadecyltrichlorosilane מ"מ פתרון (OTS) על ידי הוספת 39.6 OTS μl 100 מיליליטר טולואן. לטבול את המדגם בפתרון לשעה 1 ב RT. לנהל את הצעד הזה בתוך 2 שקית N -filled כפפה (איור 1: שלב ב ').
- כדי להסיר מולקולות physisorbed, sonicatדואר המדגם בטולואן, אצטון, אתנול, וDDH 2 O למשך 5 דקות כל אחד, על מנת ש. יש לשטוף את המדגם ארבע פעמים בDDH הטרי 2 O ולייבש את המשטח מתחת N זרימת 2. המשטח צריך להיות הידרופובי עם זווית מגע של 100-110 °.
דפוסים משטח 3. אקס-Situ
- עבודה בזרימה למינרית מכסה המנוע, לצייר כמה שריטות עם חרט יהלומים על פני השטח. הסימנים לעזור בשמירה על המסלול של אזורי מעובד וגם להביא מיקרוסקופים אל מוקד. לעקר את הדוד מצופה OTS 2 על ידי טבילת המדגם באתנול 70% במשך 5 דקות. לאחר מכן לשטוף את המדגם פעמיים בDDH 2 O. מעוקר
- מניחים את המדגם בצלחת בגודל 35 מ"מ, ולהוסיף 2 מיליליטר של מדיום גידול PC12 (ראה שלב 4.2). דגירה במשך 3 שעות בחממה CO 2 (37 מעלות צלזיוס). הליך זה נועד לתת albumins הסרום לספוג על פני השטח. albumins נספח לעכב הספיחה הבאה של הגנה של מחזור שניתוספות ותאים (איור 1: שלב ג).
- בזמן ההמתנה, להגדיר מיקרוסקופ פלואורסצנטי ההפוך.
- הפעל את מנורת הקשת, הכנס את קוביית מסנן UV, ולהגדיר את העדשה האובייקטיבית ל20X.
- למדוד את עוצמת אור ש( W סנטימטר -2) באמצעות מד UV-עוצמה, ולחשב זמן t קרינה (בשניות) למינון של ד (ב-2 סנטימטרים J) כ: t = ד / אני.
לדוגמא, כדי להקרין במינון של 200 סנטימטר J -2 שימוש במקור אור של סנטימטר 600 mW -2, נדרש 333 שניות של הקרנה. - השתמש במיקרומטר במה ולסגור את סרעפת השדה להגדיר את הגודל של האזור שמוקרן, למשל, 200 מיקרומטר.
- לאחר הדגירה 3 שעות, להשלים בינוני עם 200 μl של 3.0 מיליליטר מ"ג -1 קולגן מסוג IV (Col-IV; מיליליטר מיקרוגרם סופי ריכוז 300 -1).
- מעבירים את הצלחת בגודל 35 מ"מ לבמה מיקרוסקופ. מצא מ 'השריטההארון, להתמקד מיקרוסקופ על פני השטח המדגם, ולהקרין UV-אור במינון של 200 סנטימטר J -2 (איור 1: שלב ד '). האזור של קרינת UV ניתן לשנות או על ידי התאמת הפתיחה של הסרעפת השדה או על ידי החלפת סרעפת השדה עם מסכת מתכת של גיאומטריה בוררות.
- החלף את המדיום עם מדיום גידול טרי (ללא Col-IV), ומניח את המדגם בחזרה בחממה.
תרבות 4. סלולארי
- התרבות השגרתית של תאי PC12 מתבצעת על צלחת פלסטיק מצופה קולגן.
- למעייל צלחת רקמות תרבות 60 מ"מ עם Col-IV, להרטיב ראשון את פני השטח עם DDH 2 O ולשאוב את כל DDH 2 O.
- הכן 300 מיקרוגרם מיליליטר -1 Col-IV על ידי דילול הפתרון המקורי (3 מ"ג מיליליטר -1) 10x עם DDH 2 O.
- הוסף 200 μl של 300 מיליליטר מיקרוגרם -1 Col-IV לכל צלחת 60 מ"מ. תן הפתרון התפשט על פני השטח.
- לא יבשהוא המנה בזרימה למינרית כ 1 שעה.
- יש לשטוף את המשטח פעמיים עם 4 מיליליטר של פוספט שנאגרו מלוח של Dulbecco (D-PBS). כאשר לא משתמש בצלחת המצופה מייד, יש לשטוף את הצלחת פעם אחת עם 4 מיליליטר של DDH 2 O. לאחר aspirating DDH 2 O, לאחסן את המנה בחממה. נסה לא לשמור את זה מאוחסן במשך יותר משבועיים.
- תאי PC12 גדלים במדיום גידול שמורכבת: הבינוני (גלוקוז הנמוך) של הנשר שונה Dulbecco פתרון + 10% בסרום שור עוברי + סוס 5% סרום + 1% פניצילין, סטרפטומיצין. דגירה התאים בחממה CO 2 (37 מעלות צלזיוס, 5% CO 2), ולהחליף מחצית בינונית בכל יום אחר. תאי מעבר לפני שהם מגיעים למפגש.
- לשאוב את מדיום הגידול, ולהוסיף 2 מיליליטר של PBS + (D-PBS + 10 מיליליטר מ"ג -1 אלבומין בסרום שור (BSA) + 10 מ"מ EDTA) prewarmed עד 37 ° C. דגירה של 5 דקות על 37 מעלות צלזיוס. לטפוח בעדינות את הצלחת כדי לנתק את כל לסה"נLLS.
- איסוף תאים בצינור חרוטי 15 מיליליטר. יש לשטוף את הצלחת עם 3 מיליליטר של D-PBS הטרי, prewarmed עד 37 ° C.
- צנטריפוגה הצינור ב 150 × גרם במשך 4 דקות.
- לשאוב supernatant, ולהוסיף 1 מיליליטר של מדיום הגידול.
- לתרבות שגרה, לפצל את התאים 1: 3 ל -1: 5.
- לתאי צלחת על מדגם OTS / Tio 2-שונה UV, לספור צפיפות תאים ולהוסיף 3.0 × 10 5 תאים בצלחת 35 מ"מ (איור 1: שלב E). דגירה הצלחת בחממת humidified (37 מעלות צלזיוס, 5% CO 2) במשך 1-2 ימים. שני תאי PC12 -differentiated גורם גדילה נאיבי ועצב (NGF) יכולים לשמש לניסויי דפוסים. לבידול NGF, מיליליטר 100 ng -1 של 7S-NGF מתווסף לכמה ימי הצמיחה בינונית לפני ציפוי התאים על המדגם. נראה NGF-בידול להגדיל adhesibility של תאי PC12 והופך את הטיפול קל יותר, במיוחד בדואר הדפוסים-האתר בxperiments.
דפוסים משטח 5. באתר
- לאחר 1-2 ימים של תרבות על פני השטח לשעבר באתר שונה, לאשר כי התאים מצרפים וגדלו רק באזור המוקרן UV. הגדרת מיקרוסקופ, כמתואר בשלב 3.4.
- להעביר את המדגם לצלחת חדשה 35 מ"מ רקמת תרבות המכילה מדיום הגידול, 100 מיליליטר ng -1 NGF (במקרה של שימוש בתאים מובחנים-NGF), ו -100 מיקרוגרם מיליליטר -1 Col-IV.
- מניחים את הצלחת על הבמה מיקרוסקופ. מצא את המיקום המתאים, ולהקרין אור UV במינון של 200 סנטימטר J -2 (איור 1: שלב F, G). האזור מתירנית החדש שנוצר הוא מסומן בכוכבית באיור 1: שלב ג '
- לנסות להשלים את עיבוד של מדגם יחיד בתוך 30 דקות. לאחר הקרנה, להעביר את המדגם בחזרה לתוך המדיום ללא Col-IV.
- להיות זהיר מאוד בעת ביצוע את המנה עם מ"קתאי ltured והעברת הדגימה מצלחת לצלחת כדי למנוע ניתוק של התאים בדוגמת.
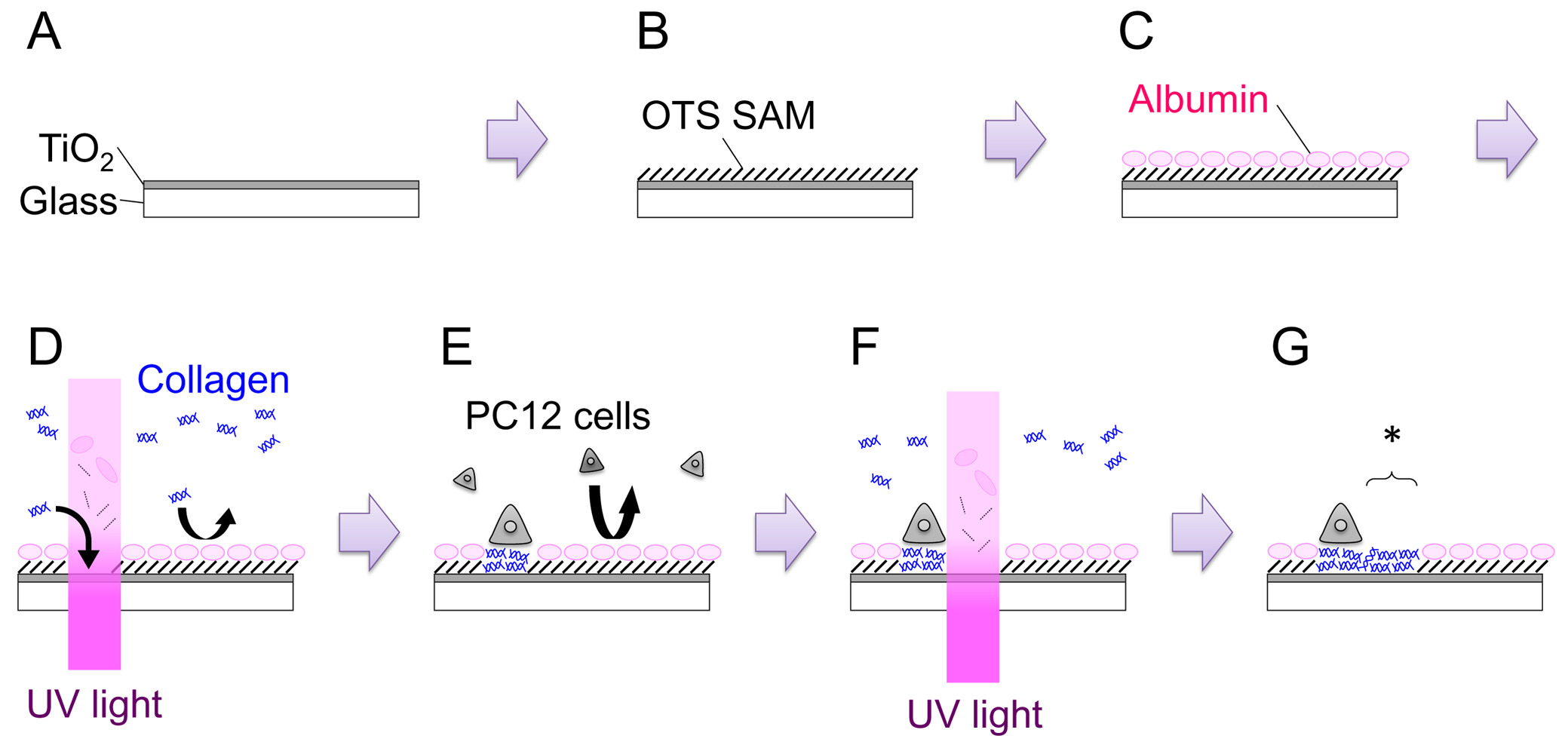
איור 1. איור סכמטי של התהליך הכולל. ראה טקסט לפרטים. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
תוצאות
איור 2 א מראה תמונת מיקרוסקופ אלקטרונים סורק חתך (SEM) של סרט Tio 2-הופקד גמגום. מהתצפית, עובי של הסרט נאמד בכ 150 ננומטר. בולט כאן היא השטיחות של Tio 2 סרט שהופקד. ניתוח נוסף על ידי מיקרוסקופ כוח האטומי (AFM) גילה כי חספוס שורש ממוצע רבוע (RMS) של פני השטח היה 0.2 ?...
Discussion
בפרוטוקול הנוכחי שלנו, Tio 2 סרט נוצר על ידי המקרטעת RF-magnetron. אנו דוגלים בשיטה זו בתצהיר שכן הוא מאפשר לנו להכין reproducibly Tio 2 סרט photocatalytic עם חספוס תת-ננומטר. למרות שתהליכי גמגום בתצהיר הם מוכרים למדעני חומרים ומהנדסי אלקטרוניקה, זה לא יכול להיות די נגיש לביולוג?...
Disclosures
The authors have nothing to disclose.
Acknowledgements
Authors thank Mr. Kotaro Okubo for the kind assistance with SEM imaging. This work was supported by the Japan Society for the Promotion of Science Grant-in-Aid for Basic Research (B) (20310069), Grant-in-Aid for Research Activity Start-up (25880021), and by research grants from the Kurata Memorial Hitachi Science and Technology Foundation and the Nippon Sheet Glass Foundation for Materials Science and Engineering.
Materials
| Name | Company | Catalog Number | Comments |
| Glass coverslip | Warner Instruments | CS-15R15 | 15 mm diameter, #1.5 thickness |
| Diamond scriber | Ogura Jewel Industry | D-Point Pen | |
| RF sputtering system | ANELVA | SPC350 | |
| TiO2 sputtering target | Kojundo Chemical Lab | Titanium (IV) oxide, target | Purity, 99.9% |
| Plasma reactor | Yamato | PR301 | |
| n-octadecyltrichlorosilane (OTS) | Aldrich | 104817 | |
| Toluene | Wako | 204-01866 | |
| Tissue-culture dish (35 mm) | Greiner | 627160 | |
| Tissue-culture dish (60 mm) | BD Falcon | 353002 | |
| Type-IV collagen | Nitta Gelatin | Cellmatrix Type IV | |
| D-PBS | Gibco | 14190-144 | |
| Dulbecco's modified Eagle's medium (DMEM) | Gibco | 11885-084 | |
| Fetal bovine serum | Gibco | 12483-020 | Heat-inactivate and pass through a 0.22 μm filter before use |
| Horse serum | Gibco | 26050-088 | Pass through a 0.22 μm filter before use |
| Penicillin-streptomycin (100x) | Nacalai tesque | 26253-84 | |
| 7S nerve growth factor (NGF) | Alomone Labs | N-130 | |
| Bovine serum albumin (BSA) | Sigma | A2153 | |
| EDTA | Dojindo | N001 | Stock solution in 0.5 M |
| TiO2 nanoparticle | Tayca | TKD-701 |
References
- Hughes, M. A., Brennan, P. M., Bunting, A. S., Shipston, M. J., Murray, A. F. Cell Patterning on Photolithographically Defined Parylene-C: SiO2 Substrates. J. Vis. Exp. (85), e50929 (2014).
- Kleinfeld, D., Kahler, K. H., Hockberger, P. E. Controlled Outgrowth of Dissociated Neurons on Patterned Substrates. J. Neurosci. 8, 4098-4120 (1988).
- Pensen, D., Heinz, W. F., Werbin, J. L., Hoh, J. H., Haviland, D. B. Electron Beam Patterning of Fibronectin Nanodots that Support Focal Adhesion Formation. Soft Matter. 3, 1280-1284 (2007).
- Tanii, T., et al. Application of Organosilane Monolayer Template to Quantitative Evaluation of Cancer Cell Adhesive Ability. Jpn. J. Appl. Phys. 50, 06GL01 (2011).
- Yamamoto, H., et al. In-Situ Guidance of Individual Neuronal Processes by Wet Femtosecond Laser Processing of Self-Assembled Monolayers. Appl. Phys. Lett. 99, 163701-1610 (2011).
- Yamamoto, H., et al. Differential Neurite Outgrowth is Required for Axon Specification by Cultured Hippocampal Neurons. J. Neurochem. 123, 904-910 (2012).
- Shen, K., Qi, J., Kam, L. C. Microcontact Printing of Proteins for Cell Biology. J. Vis. Exp. (22), e1065 (2008).
- Johnson, D. M., LaFranzo, N. A., Maurer, J. A. Creating Two-Dimensional Patterned Substrates for Protein and Cell Confinement. J. Vis. Exp. (55), e3164 (2011).
- Singhvi, R., et al. Engineering Cell Shape and Function. Science. 264, 696-698 (1126).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric Control of Cell Life and Death. Science. 276, 1425-1428 (1997).
- Degot, S., et al. Improved Visualization and Quantitative Analysis of Drug Effects using Micropatterned Cells. J. Vis. Exp. (46), e2514 (2010).
- Nakanishi, J., et al. Photoactivation of a Substrate for Cell Adhesion under Standard Fluorescence Microscopes. J. Am. Chem. Soc. 126, 16314-16315 (2004).
- Kim, M., et al. Addressable Micropatterning of Multiple Proteins and Cells by Microscope Projection Photolithography Based on a Protein Friendly Photoresist. Langmuir. 26, 12112-12118 (2010).
- Deka, G., Okano, K., Kao, F. -. J. Dynamic Photopatterning of Cells In Situ by Q-Switched Neodymium-Doped Yttrium Ortho-Vanadate. Laser. J. Biomed. Opt. 19, 011012 (2014).
- Robertus, J., Browne, W. R., Feringa, B. L. Dynamic Control over Cell Adhesive Properties using Molecular-Based Surface Engineering Strategies. Chem. Soc. Rev. 39, 354-378 (2010).
- Choi, I., Yeo, W. -. S. Self-Assembled Monolayers with Dynamicity Stemming from (Bio)chemical Conversions: From Construction to Application. ChemPhysChem. 14, 55-69 (2013).
- Nakanishi, J. Switchable Substrates for Analyzing and Engineering Cellular Functions. Chem. Asian J. 9, 406-417 (2014).
- Yamamoto, H., et al. In Situ Modification of Cell-Culture Scaffolds by Photocatalytic Decomposition of Organosilane Monolayers. Biofabrication. 6, 035021 (2014).
- Sekine, K., Yamamoto, H., Kono, S., Ikeda, T., Kuroda, A., Tanii, T. Surface Modification of Cell Scaffold in Aqueous Solution using TiO2 Photocatalysis and Linker Protein L2 for Patterning Primary Neurons. e-J. Surf. Sci. Nanotech. 13, 213-218 (2015).
- Arima, Y., Iwata, H. Effects of Surface Functional Groups on Protein Adsorption and Subsequent Cell Adhesion using Self-Assembled Monolayers. J. Mater. Chem. 17, 4079-4087 (2007).
- Fujishima, A., Zhang, X., Tryk, D. A. TiO2 Photocatalysis and Related Surface Phenomena. Surf. Sci. Rep. 63, 515-582 (2008).
- Sigal, G. B., Mrksich, M., Whitesides, G. M. Effect of Surface Wettability on the Adsorption of Proteins and Detergents. J. Am. Chem. Soc. 120, 3464-3473 (1998).
- Zhang, X., et al. A Transparent and Photo-Patternable Superhydrophobic Film. Chem. Commun. 2007, 4949-4951 (1039).
- Kaech, S., Banker, G. Culturing Hippocampal Neurons. Nat. Protoc. 1, 2406-2415 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved