A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الكشف عن وظيفية غير الترميز المتغيرات الوراثية عن طريق الكهربي التنقل التحول الفحص (EMSA) والحمض النووي تقارب الهطول الفحص (ضبا)
* These authors contributed equally
In This Article
Summary
We present a strategic plan and protocol for identifying non-coding genetic variants affecting transcription factor (TF) DNA binding. A detailed experimental protocol is provided for electrophoretic mobility shift assay (EMSA) and DNA affinity precipitation assay (DAPA) analysis of genotype-dependent TF DNA binding.
Abstract
Population and family-based genetic studies typically result in the identification of genetic variants that are statistically associated with a clinical disease or phenotype. For many diseases and traits, most variants are non-coding, and are thus likely to act by impacting subtle, comparatively hard to predict mechanisms controlling gene expression. Here, we describe a general strategic approach to prioritize non-coding variants, and screen them for their function. This approach involves computational prioritization using functional genomic databases followed by experimental analysis of differential binding of transcription factors (TFs) to risk and non-risk alleles. For both electrophoretic mobility shift assay (EMSA) and DNA affinity precipitation assay (DAPA) analysis of genetic variants, a synthetic DNA oligonucleotide (oligo) is used to identify factors in the nuclear lysate of disease or phenotype-relevant cells. For EMSA, the oligonucleotides with or without bound nuclear factors (often TFs) are analyzed by non-denaturing electrophoresis on a tris-borate-EDTA (TBE) polyacrylamide gel. For DAPA, the oligonucleotides are bound to a magnetic column and the nuclear factors that specifically bind the DNA sequence are eluted and analyzed through mass spectrometry or with a reducing sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE) followed by Western blot analysis. This general approach can be widely used to study the function of non-coding genetic variants associated with any disease, trait, or phenotype.
Introduction
التسلسل والدراسات التنميط الجيني أساس، بما في ذلك دراسات الجينوم على نطاق الرابطة (GWAS)، دراسات المرشح مكان، وأعماق التسلسل الدراسات، وقد حددت العديد من المتغيرات الجينية التي ترتبط إحصائيا مع المرض، وسمة، أو النمط الظاهري. وخلافا للتوقعات في وقت مبكر، وتقع معظم هذه المتغيرات (85-93٪) في مناطق غير الترميز ولا تغيير تسلسل الأحماض الأمينية للبروتينات 1،2. تفسير وظيفة من هذه المتغيرات غير الترميز وتحديد الآليات البيولوجية وربطها لمرض المرتبطة بها، وقد ثبت سمة، أو النمط الظاهري تحديا 3-6. لقد قمنا بتطوير استراتيجية عامة لتحديد الآليات الجزيئية التي تصل المتغيرات إلى النمط الظاهري وسيط مهم - التعبير الجيني. تم تصميم هذا الخط على وجه التحديد لتحديد التشكيل من فريق العمل ملزم المتغيرات الجينية. هذه الاستراتيجية يجمع بين النهج الحسابية وتقنيات البيولوجيا الجزيئية التي تهدف إلى التنبؤالآثار البيولوجية من المتغيرات مرشح في سيليكون، وتحقق هذه التنبؤات تجريبيا (الشكل 1).
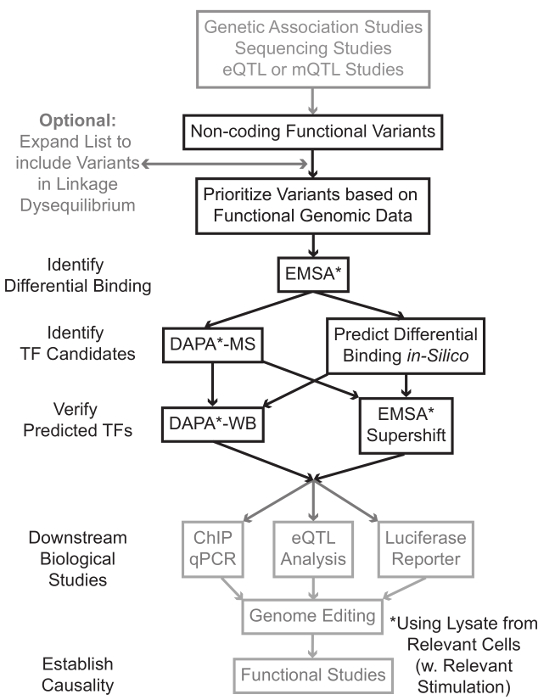
الشكل 1: النهج الاستراتيجي لتحليل خطوات غير ترميز المتغيرات الجينية التي لم يتم تضمينها في بروتوكول مفصلة المرتبطة مظللة باللون الرمادي هذا المخطوط الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
في كثير من الحالات، من المهم أن تبدأ من خلال توسيع قائمة المتغيرات بحيث يشمل جميع من في ارتفاع الربط-اختلال التوازن (LD) مع كل متغير يرتبط إحصائيا. LD هو مقياس لجمعية غير عشوائية من أليل على موقعين الكروموسومات المختلفة، والتي يمكن أن تقاس ص 2 الإحصائية 7. ص 2 هو مقياس للينكاجي اختلال التوازن بين الخيارين، مع ص 2 = 1 تدل على الربط المثالي بين الخيارين. تم العثور على الأليلات في LD عالية للمشاركة في فصل على كروموسوم عبر السكان الأسلاف. لا تشمل صفائف التنميط الجيني الحالية كافة المتغيرات المعروفة في الجينوم البشري. بدلا من ذلك، فإنها تستغل LD داخل الجينوم البشري وتشمل مجموعة فرعية من المتغيرات المعروفة التي تعمل كوكلاء للالمتغيرات الأخرى داخل منطقة معينة من LD 8. وهكذا، وهو البديل من دون أي نتيجة البيولوجية قد تترافق مع مرض معين لأنه في LD مع السببية البديل، البديل مع التأثير البيولوجي ذات مغزى. من الناحية الإجرائية، فمن المستحسن لتحويل الإصدار الأخير من 1000 الجينوم المشروع 9 ملفات دعوة البديل (VCF) في الملفات الثنائية متوافقة مع طقطقة 10،11، أداة مفتوحة المصدر للتحليل جمعية الجينوم بأكمله. وفي وقت لاحق، كل المتغيرات الجينية الأخرى مع LD ص 2> 0.8 مع كل فا الجيني المدخلاتويمكن تحديد RIANT كمرشحين. ومن المهم استخدام السكان إشارة المناسب لهذا خطوة- على سبيل المثال، إذا تم تحديد البديل في المواد من أصول أوروبية، وينبغي استخدام البيانات من موضوعات من أصل مماثل للتوسع دينار.
التوسع LD غالبا ما يؤدي إلى العشرات من المتغيرات مرشح، وأنه من المرجح أن جزءا صغيرا فقط من هذه تسهم في آلية المرض. في كثير من الأحيان، أصبح في حكم المستحيل لدراسة التجربة كل من هذه المتغيرات بشكل فردي. ولذا فمن المفيد الاستفادة من آلاف من مجموعات البيانات الجينومية الوظيفية المتاحة علنا كمرشح لتحديد أولويات المتغيرات. على سبيل المثال، اتحاد ترميز 12 قد أنجز الآلاف من تجارب رقاقة وما يليها واصفا ربط TFS والعوامل المشتركة، وعلامات هيستون في مجموعة واسعة من السياقات، جنبا إلى جنب مع البيانات لونين الوصول من التقنيات مثل الدناز تسلسل 13، أي تي أي سي -seq 14، وFAIRE وما يليها 15. DatabASES وخوادم الويب مثل متصفح UCSC الجينوم 16، خارطة الطريق Epigenomics 17، مخطط Epigenome 18، Cistrome 19، وإعادة رسم خريطة 20 توفر حرية الوصول إلى البيانات التي تنتجها هذه وتقنيات تجريبية أخرى عبر مجموعة واسعة من أنواع الخلايا والشروط. عندما يكون هناك الكثير من المتغيرات لدراسة التجربة، وهذه البيانات يمكن استخدامها لتحديد أولويات تلك التي تقع داخل المناطق التنظيمية المحتملة في أنواع الخلايا والأنسجة ذات الصلة. وعلاوة على ذلك، في الحالات التي يكون فيها البديل هو في ذروته في الشذرة وما يليها لبروتين معين، ويمكن لهذه البيانات توفير يؤدي المحتملة فيما يتعلق TF معين (ق) أو العوامل المشتركة التي الملزم قد تؤثر.
بعد ذلك، يتم فحص المتغيرات الناتجة الأولوية تجريبيا للتحقق من صحة توقع البروتين تعتمد على التركيب الوراثي ملزمة باستخدام EMSA 21،22. EMSA يقيس التغير في هجرة بنسبة ضئيلة على غير الحد هلام TBE. وحضنت بنسبة ضئيلة fluorescently المسمى معالمحللة النووي، وربط العوامل النووية في اعاقة حركة جزئية على هلام. في هذه الطريقة، بنسبة ضئيلة أن تربط بين العوامل النووية المزيد من سيقدم على أنه إشارة الفلورسنت أقوى على المسح الضوئي. والجدير بالذكر، EMSA لا تتطلب التنبؤات حول بروتينات معينة التي ستتأثر ملزم.
وبمجرد تحديد المتغيرات التي تقع داخل المناطق التنظيمية توقع وتكون قادرة على العوامل النووية ملزمة بشكل مختلف، واستخدام طرق الحسابية للتنبؤ TF معين (ق) الذي ملزمة لأنها قد تؤثر. ونحن نفضل استخدام CIS-BP 23،24، RegulomeDB 25، UniProbe 26، وJASPAR 27. وبمجرد تحديد مرشح TFS، هذه التنبؤات يمكن اختبار على وجه التحديد باستخدام أجسام مضادة ضد هذه TFS (EMSA-supershifts وضبا-الغرب). ينطوي على EMSA-supershift إضافة الضد-TF محددة لالمحللة النووي وبنسبة ضئيلة. ونتيجة إيجابية في EMSA-supershift هي represented تحولا آخر في الفرقة EMSA، أو خسارة من الفرقة (إعادة النظر في المرجع 28). في ضبا التكميلي، يتم تحضين على الوجهين بنسبة ضئيلة من 5'المعقدة البيروكسيديز تحتوي على البديل و 20 قاعدة الزوج المرافقة النيوكليوتيدات مع المحللة النووي من نوع من الخلايا ذات الصلة (ق) لالتقاط أي عوامل النووية ملزمة على وجه التحديد oligos. ويجمد بنسبة ضئيلة على الوجهين النووي مجمع عامل من قبل streptavidin ميكروبيدات في عمود المغناطيسي. يتم جمع العوامل النووية ملزمة مباشرة من خلال شطف 29،48. ويمكن بعد ذلك التنبؤات ملزم يتم تقييمها بواسطة لطخة غربية باستخدام الأجسام المضادة المحددة للبروتين. في الحالات التي لا توجد توقعات واضحة، أو الكثير من التوقعات، وelutions من البديل سحب هبوطا من التجارب ضبا يمكن إرسالها إلى نواة البروتينات لتحديد TFS مرشح باستخدام مطياف الكتلة، والتي يمكن بعد ذلك يمكن التحقق من صحة استخدام هذه الموصوفة سابقا أساليب.
في ما تبقى من الاعتده، يتم توفير بروتوكول مفصلة عن EMSA وضبا تحليل المتغيرات الجينية.
Protocol
1. إعداد حلول والكواشف
- عرف النظام تحقيقات الحمض النووي النوكليوتيد للاستخدام في EMSA وضبا.
- للحد من البروتين غير محددة ملزمة، تصميم oligos قصيرة (بين 35-45 أزواج قاعدة (بي بي) في الطول) 30، ووضع البديل من مصلحة مباشرة في وسط يحيط بها 17 سنة مضت تسلسل الجيني الذاتية لها. لoligos EMSA، إضافة "fluorophore 5. لoligos ضبا، إضافة علامة 5 "البيوتين.
- طلب كل من حبلا الشعور وحبلا لتكملة العكسي. بدلا من ذلك، أمر الطباعة على الوجهين (قبل صلب) oligos. عند تسمية oligos، قاعدة التسمية على الجينوم مرجعية راسخة.
ملاحظة: "المخاطر" و "غير خطر" تسمية يمكن أن يكون المرض ومشروع معين، في حين أن "المرجعية" و "غير مرجعية" هي أكثر أهمية عالميا. - فور وصول oligos، وتدور لفترة وجيزة إلى أسفل محتويات وresuspend في nuclease خالية من المياه إلى تركيز النهائي من 100 μ. M. متجر معلق السهم عند -20 درجة مئوية. حماية oligos الكلمات الدلالية مع fluorophore من الضوء من خلال التفاف بورق الألمنيوم.
| اسم | تسلسل |
| rs76562819_REF_FOR | GTAATGCCTTAATGAGAGAG وGTTAGTCATCTTCTCACTTC |
| rs76562819_REF_REV | GAAGTGAGAAGATGACTAAC تي CTCTCTCATTAAGGCATTAC |
| rs76562819_NONREF_FOR | GTAATGCCTTAATGAGAGAG G GTTAGTCATCTTCTCACTTC |
| rs76562819_NONREF_REV | GAAGTGAGAAGATGACTAAC C CTCTCTCATTAAGGCATTAC |
الجدول 1: مثال EMSA / ضبا تصميم النوكليوتيد لاختبار SNP بن لالتفاضليدينغ. "المرجع" لتقف على أليل إشارة، في حين أن "NONREF" لتقف على أليل غير مرجعية. "FOR" لتقف على حبلا إلى الأمام، في حين أن "REV" يشير مكملا لها. وينظر الحزب الوطني الاسكتلندي باللون الأحمر.
- إعداد استخراج حشوية (CE) عازلة مع تركيز النهائي من 10 ملي HEPES (الرقم الهيدروجيني 7.9)، و 10 ملي بوكل، و 0.1 ملي EDTA في الماء منزوع الأيونات.
- إعداد استخراج النووي (NE) العازلة مع تركيز النهائي من 20 ملي HEPES (درجة الحموضة 7.9) و 0.4 M كلوريد الصوديوم، و 1 ملي EDTA في الماء منزوع الأيونات.
- إعداد عازلة الصلب مع تركيز النهائي من 10 ملي تريس (درجة الحموضة 7،5-8،0)، 50 مم كلوريد الصوديوم، و 1 ملي EDTA في الماء منزوع الأيونات.
2. إعداد المحللة النووية من الخلايا المستزرعة
ملاحظة: تم تحسين هذا البروتوكول التجريبي باستخدام خطوط الخلايا-B lymphoblastoid، ولكن تم اختبارها في عدة خطوط الخلايا تمسكا / التعليق أخرى غير ذات صلة ويعمل عالميا.
- Cultuإعادة الخلايا B lymphoblastoid في معهد روزويل بارك التذكاري (RPMI) 1640 مع 2 مم L-الجلوتامين، و 10٪ الجنين المصل البقري، و1X المضادات الحيوية مضاد فطري تحتوي على 100 وحدة / مل من البنسلين، 100 ميكروغرام / مل من الستربتومايسين، و 250 نانوغرام / مل من أمفوتيريسين B.
- البذور على مجموعة من 200،000-500،000 قابلة للحياة خلية / مل واحتضان قوارير عند 37 درجة مئوية مع ثاني أكسيد الكربون بنسبة 5٪ في وضع مستقيم مع قبعات تنفيس أو فضفاضة.
ملاحظة: نمو الخلايا-B lymphoblastoid يبطئ عندما تصل إلى أكثر من 1،000،000 خلية / مل. تفريق تفجيرات خلية pipetting صعودا وهبوطا عدة مرات والعودة الخلايا 200،000-500،000 خلية / مل للحفاظ على المعدل السريع للنمو.
- البذور على مجموعة من 200،000-500،000 قابلة للحياة خلية / مل واحتضان قوارير عند 37 درجة مئوية مع ثاني أكسيد الكربون بنسبة 5٪ في وضع مستقيم مع قبعات تنفيس أو فضفاضة.
- غسل الخلايا المستزرعة مرتين مع 10 مل كريم الفوسفات الباردة مخزنة المالحة (PBS)، وتدور باستمرار في 4 درجات مئوية، 300 x ج لمدة 5 دقائق وإزالة برنامج تلفزيوني عبر الطموح.
- عد الخلايا باستخدام عدادة الكريات و resuspend بيليه ك 1 مل الجليد الباردة برنامج تلفزيوني في 10 7 خلايا.
ملاحظة: على سبيل المثال، إذا الناشر 2 × 10 7 </ sup> في الخلايا، resuspend في 2 مل برنامج تلفزيوني. - قسامة 1 مل إلى 1.5 مل أنابيب microcentrifuge بحيث يحتوي كل أنبوب 10 7 الخلايا في برنامج تلفزيوني. أجهزة الطرد المركزي في 3300 x ج لمدة 2 دقيقة 4 درجات مئوية، ونضح من برنامج تلفزيوني.
- قبل استخدامها، إضافة 1 ملم dithiothreitol (DTT)، 1X الفوسفاتيز المانع، والمانع 1X البروتيني لمخزون العمل من العازلة م. بيليه resuspend الخلايا مع 400 ميكرولتر من العازلة م، واحتضان على الجليد لمدة 15 دقيقة.
- إضافة 25 ميكرولتر من 10٪ Nonidet P-40 ومزيج من قبل pipetting. أجهزة الطرد المركزي في 4 درجات مئوية، أقصى سرعة لمدة 3 دقائق. صب وتجاهل طاف.
- قبل استخدامها، إضافة 1 ملم DTT، 1X الفوسفاتيز المانع، و1X مثبط البروتياز لمخزون العمل من العازلة NE. بيليه resuspend الخلايا مع 30 ميكرولتر من العازلة NE ومزيج من قبل vortexing.
- احتضان عند 4 درجات مئوية في الدوار أنبوب أو على الجليد لمدة 10 دقيقة. أجهزة الطرد المركزي 3300 x ج لمدة 2 دقيقة 4 درجات مئوية.
- جمع طاف واضح (المحللة النووي) وقسامة قبل تخزينها في -806؛ C لتجنب متعددة تجميد أذاب دورات التي قد تؤدي إلى تدهور البروتين. ترك قسامة 10 ميكرولتر لقياس تركيز البروتين باستخدام فحص الحمض bichoninic (BCA) 31.
3. الكهربي التنقل التحول الفحص (EMSA)
- إعداد جزئية المالية العاملة وEMSA جل.
- إذا أمرت oligos في الوجهين، ذوبان الجليد في الأوراق المالية 100 ميكرومتر وتمييع 1: 2000 في المخزن الصلب لتحقيق مخزون العمل 50 نانومتر.
- إذا أمرت oligos احد الذين تقطعت بهم السبل، ذوبان الجليد 100 ميكرومتر الأسهم وتمييع 01:10 في المخزن الصلب لتحقيق 100 سهم تعمل نانومتر. الجمع بين 100 ميكرولتر من 100 نانومتر حل تكملة حبلا مع بعضها البعض في أنبوب microcentrifuge.
- ضع في كتلة الحرارة على 95 درجة مئوية لمدة 5 دقائق. إيقاف كتلة الحرارة والسماح للoligos لتبرد ببطء إلى درجة حرارة الغرفة لمدة ساعة واحدة على الأقل قبل استخدامها.
- قبل تشغيل جل EMSA.
- إزالة الشريحة من قبل الصب 6٪ TBE جل وشطف تحت الماء منزوع الأيونات عدة مرات لإزالة أي العازلة من الآبار. إعداد 1 لتر من العازلة 0.5X TBE بإضافة 50 مل من 10X TBE إلى 950 مل من الماء منزوع الأيونات.
- تجميع الجهاز الكهربائي للهلام وتحقق من وجود تسرب عن طريق ملء الغرفة الداخلية مع العازلة 0.5X TBE. إذا لم يكن هناك عازلة تسرب الى داخل القاعة الخارجية، وملء الغرفة الخارجي تقريبا ثلثي الطريق.
- قبل تشغيل هلام في 100 فولت لمدة 60 دقيقة.
- طرد كل بئر مع 200 ميكرولتر من العازلة 0.5X TBE.
- إعداد الاحتياطي ملزم ميكس ماجستير.
- إعداد 10X العازلة ملزمة مع تركيز النهائي من 100 ملي تريس، 500 ملي بوكل، 10 ملي DTT. 7.5 درجة الحموضة في الماء منزوع الأيونات.
- في أنبوب microcentrifuge، وخلق مزيج رئيسية تتكون من الكواشف مشتركة لجميع ردود الفعل (10 ميكرولتر 10X العازلة ملزمة، 10 ميكرولتر DTT / بوليسوربات، 5 ميكرولتر بولي د (IC)، و 2.5 ميكرولتر السلمون الحمض النووي الحيوانات المنوية، الجدول 2). إعداد إضافية 10٪لحساب فقدان وحدة التخزين بسبب pipetting ل.
| كاشف | اضرب النهائي. | Rxn # 1 | Rxn # 2 | Rxn # 3 | Rxn # 4 |
| عالى النقاء المياه | إلى 20 ميكرولتر المجلد. | 13.5 ميكرولتر | 11.98 ميكرولتر | 13.5μl | 11.98 ميكرولتر |
| 10X الاحتياطي ملزم | 1X | 2 ميكرولتر | 2 ميكرولتر | 2 ميكرولتر | 2 ميكرولتر |
| DTT / TW-20 | 1X | 2 ميكرولتر | 2 ميكرولتر | 2 ميكرولتر | 2 ميكرولتر |
| سمك السلمون الحمض النووي الحيوانات المنوية | 500 نانوغرام / ميكرولتر | 0.5 ميكرولتر | 0.5 ميكرولتر | 0.5 ميكرولتر | 0.5 ميكرولتر |
| 1μg / ميكرولتر بولي د (IC) | 1 ميكروغرام | 1 ميكرولتر | 1 ميكرولتر | 1 ميكرولتر | 1 ميكرولتر |
| استخراج النووي (5.26 ميكروغرام / ميكرولتر) | 8 ميكروغرام | - | 1.52 ميكرولتر | - | 1.52 ميكرولتر |
| NE العازلة | 1.52 ميكرولتر | - | 1.52 ميكرولتر | - | |
| إشارة أليل بنسبة ضئيلة | 50 fmol | 1 ميكرولتر | 1 ميكرولتر | - | - |
| غير المرجعي-أليل بنسبة ضئيلة | 50 fmol | - | - | 1 ميكرولتر | 1 ميكرولتر |
الجدول 2: مثال EMSA رد فعل سيتوص يوضح الجدول مثال EMSA لاختبار الفرضية القائلة بأن هناك ربط TFS إلى SNP محددة تعتمد على التركيب الوراثي.
- إضافة nuclease خالية من المياه إلى كل أنبوب microcentrifuge مثل هذا الحجم النهائي بعد إضافة كل الكواشف سيكون 20 ميكرولتر.
- إضافة كمية مناسبة (5.5 ميكرولتر) من مزيج الرئيسي إلى كل أنبوب microcentrifuge.
- إضافة 8 ميكروغرام من المحللة النووي لأنابيب microcentrifuge المناسبة. تشمل الأنابيب التي تحتوي على جزئية دون استخراج النووي والضوابط السلبية (مثل الجدول 2، Rxn # 1 و Rxn # 3).
ملاحظة: يجب أن يتم تحديد مبلغ الأمثل للالمحللة في رد الفعل تجريبيا عن طريق المعايرة. عموما، المعايرة مجموعة من 2-10 ميكروغرام من المحللة غير كافية. - إضافة 50 fmol من جزئية إلى أنابيب microcentrifuge المناسبة. نفض الغبار إلى المزيج لفترة وجيزة تدور محتويات إلى أسفل الأنبوب. احتضان لمدة 20 دقيقة في درجة حرارة الغرفة.
ملاحظة: إذا attemptiنانوغرام في supershift، واحتضان الخليط المحللة مع الأجسام المضادة لمدة 20 دقيقة في درجة حرارة الغرفة قبل إضافة oligos. فمن المستحسن استخدام 1 ميكروغرام من الأجسام المضادة رقاقة الصف حصول على أفضل النتائج. - إضافة 2 ميكرولتر من 10X أورانج تحميل صبغ إلى كل أنبوب microcentrifuge. ماصة صعودا وهبوطا إلى المزيج.
- تحميل العينات في مرحلة ما قبل التشغيل 6٪ هلام TBE pipetting صعودا وهبوطا إلى المزيج ثم طرد كل عينة في بئر منفصل. تشغيل هلام في 80 V حتى هاجر الصبغة البرتقال 2/3 إلى 3/4 من الطريق هلام. وهذا ينبغي أن يستغرق حوالي 60-75 دقيقة.
- إزالة جل من كاسيت البلاستيك عن طريق التحديق مفتوحة بسكين جل ووضع الجل في وعاء مع العازلة TBE 0.5٪ لمنعها من الجفاف.
- وضع الجل على سطح نظام التصوير بالأشعة تحت الحمراء والتوهج، ويجري التأكد من القضاء على أي فقاعات أو الملوثات التي من شأنها عرقلة الصورة.
- باستخدام برنامج نظام المسح الضوئي، انقر فوق "اكتساب" علامة التبويبثم حدد "رسم جديد" لرسم مربع في جميع أنحاء المنطقة المقابلة لحيث يقع الجل على سطح الماسح الضوئي.
- في قسم "القنوات" من علامة التبويب "اكتساب"، حدد القناة الموافق الطول الموجي للعلامة fluorophore على جزئية. في قسم "الماسح الضوئي"، انقر "معاينة" للحصول على مسح معاينة منخفضة الجودة. ضبط منطقة المسح الضوئي عن طريق سحب المربع الأزرق المحيطة صورة المعاينة المكتسبة وصولا الى جزء من هلام للتصوير.
ملاحظة: على سبيل المثال، إذا كان استخدام oligos المسمى مع نانومتر fluorophore 700، تأكد من تحديد قناة "700 نانومتر" قبل المسح. - في قسم "الضوابط مسح"، حدد "84 ميكرومتر" خيار القرار و"متوسطة" خيار الجودة. تعيين التركيز لتعويض نصف سمك هلام. ملاحظة: على سبيل المثال، فإن جل 1 مم استخدام تركيز 0.5 ملم الإزاحة.
- في قسم "الماسح الضوئي"، انقر "ابدأ" إلى begin الفحص.
ملاحظة: أثناء الفحص، يمكن في كثير من الأحيان يتم تعديل مخطط السطوع والتباين، واللون يدويا اعتمادا على الشركة المصنعة للنظام المسح الضوئي. - بعد الانتهاء من المسح الضوئي، حدد "صورة" علامة التبويب وانقر على "تدوير أو فليب" في قسم "إنشاء" لتصحيح الاتجاه. حفظ ملف الصورة بالنقر على "تصدير" في القائمة الرئيسية، ثم حدد "واحد صورة عرض."
4. DNA الانجذاب تنقية الفحص (ضبا)
- إعداد 5 ميكرومتر الأسهم جزئية العامل.
- إذا أمرت oligos في الوجهين، ذوبان الجليد في الأوراق المالية 100 ميكرومتر وتمييع 01:20 في المخزن الصلب لتحقيق مخزون العمل 5 ميكرومتر.
- إذا أمرت oligos احد الذين تقطعت بهم السبل، ذوبان الجليد 100 ميكرومتر الأسهم وتمييع 01:10 في المخزن الصلب لتحقيق 10 ميكرومتر الأسهم العمل. الجمع بين 10 ميكرولتر من 10 ميكرومتر فروع متكاملة مع بعضها البعض. ضع في كتلة الحرارة على 95 درجة مئوية لمدة5 دقائق. إيقاف كتلة الحرارة والسماح للoligos لتبرد ببطء إلى درجة حرارة الغرفة قبل استخدامها.
- قبل البدء، تدفئة العازلة ملزمة، وانخفاض غسل العازلة صرامة، غسل العازلة عالية الصرامة، وشطف العازلة إلى درجة حرارة الغرفة.
ملاحظة: تركيز النهائي من 50 نانوغرام / مل بولي د (IC) يمكن أن تضاف إلى المخزن المؤقت ملزم، وانخفاض غسل العازلة صرامة، وغسل العازلة عالية صرامة للحد من إمكانية غير محددة وملزمة من البروتينات إلى oligos. - تحضير مخاليط ملزمة لكل متغير.
- مزيج 1 حجم المحللة النووي مع 2 مجلدات من العازلة ملزمة.
ملاحظة: يجب تحديد المبلغ المطلوب من المحللة تجريبيا نظرا لاختلاف وفرة من TFS. باستخدام بين 100-250 ميكروغرام من المحللة النووية في عمود غير كافية في معظم الحالات. - إضافة 1X المانع الفوسفاتيز، 1X مثبط البروتياز، ومحسن 1X ملزمة (اختياري) ومزيج عبها الأنبوب عدة مرات.
ملاحظة: 100X ملزمةيتكون محسن من 750 ملي MgCl 2 و 300MM ZnCl 2. إضافة محسن ملزم إذا كان ملزما لفريق العمل على الحمض النووي يعتمد على العوامل المساعدة أو الاختزال. إذا لم يعرف هذه المعلومات، إضافة محسن ملزمة. - إضافة 10 ميكرولتر من 5 ميكرومتر المعقدة البيروكسيديز الحمض النووي القبض على (50 بمول) لكل خليط ملزم منها. احتضان لمدة 20 دقيقة في درجة حرارة الغرفة.
ملاحظة: فترة حضانة ودرجة الحرارة قد تختلف تبعا لفريق العمل. تحتاج إلى أن تحدد تجريبيا القيم المثلى.
- مزيج 1 حجم المحللة النووي مع 2 مجلدات من العازلة ملزمة.
- إضافة 100 ميكرولتر من ميكروبيدات streptavidin. احتضان لمدة 10 دقيقة في درجة حرارة الغرفة.
- لكل التحقيق جزئية يجري اختبارها، ضع عمود ملزمة في فاصل المغناطيسي. وضع أنبوب microcentrifuge مباشرة تحت كل عمود ملزمة وتطبيق 100 ميكرولتر من العازلة ملزمة لشطف العمود.
- ماصة محتويات كل خليط ملزمة في أعمدة منفصلة، والسماح للسائل بالتدفق تماما من خلال عمود في microcentrifuge لأنبوب قبل المتابعة. تأكد من تسمية الأعمدة مع جزئية البديل الذي تم استخدامه في خليط ملزم. تسمية عينات التدفق من خلال استبدال أنابيب microcentrifuge جديدة لجمع يغسل-صرامة منخفضة.
- تطبيق 100 ميكرولتر من غسل العازلة-صرامة منخفضة إلى العمود. انتظر حتى الخزان عمود فارغ. تكرار غسل 4X. تسمية عينات غسيل صرامة المنخفضة واستبدال أنابيب microcentrifuge جديدة لجمع يغسل عالية صرامة.
- تطبيق 100 ميكرولتر من غسل العازلة عالية صرامة لالعمود. انتظر حتى الخزان عمود فارغ. تكرار غسل 4X. تسمية عينات غسل عالية صرامة واستبدال أنابيب microcentrifuge جديدة لجمع ما قبل شطف.
- إضافة 30 ميكرولتر من شطف العازلة الأصلي إلى العمود واسمحوا الوقوف لمدة 5 دقائق. تسمية عينات ما قبل شطف واستبدال أنابيب microcentrifuge جديدة لجمع شطف.
ملاحظة: هذا لا أزل بروتين ملزمة. فإنه يغسل ما تبقى عالية الصرامة،العازلة للخروج من عمود ويستبدلها مع شطف العازلة لتحقيق أقصى قدر من الكفاءة من شطف. - إضافة 50 ميكرولتر عازلة إضافية شطف الأصلي إلى أزل TFS ملزمة. لتحقيق عائد أعلى ولكن شطافة أقل تركيزا، إضافة 50 ميكرولتر إضافية من شطف العازلة الأصلي وجمع من خلال تدفق.
ملاحظة: تحليل عينات شطف من خلال قياس الطيف الكتلي لتحديد هوية TFS ملزمة 32. بعد ذلك، تحقق من النتائج البروتين من خلال دوديسيل الصوديوم كبريتيت هلام بولي أكريلاميد الكهربائي (SDS-PAGE)، يليه لطخة غربية 33. إذا قياس الطيف الكتلي ليست متاحة، تشغيل وصمة عار الفضة باستخدام تقنية القياسية بدلا من لطخة غربية لتحديد حجم البروتين (الصورة) تظهر تعتمد على التركيب الوراثي ملزمة. استخدام هذه المعلومات لتضييق قائمة TFS توقع من النهج الحسابية بالتفصيل في المقدمة.
النتائج
في هذا القسم، وتقدم نتائج ممثل عن ما يمكن توقعه عند إجراء EMSA أو ضبا، وتباين فيما يتعلق تتميز نوعية المحللة. على سبيل المثال، فقد قيل أن تجميد وعينات البروتين ذوبان عدة مرات قد يؤدي إلى تمسخ. من أجل استكشاف إمكانية استنساخ تحليل EMSA في سياق هذه الدورات ...
Discussion
وعلى الرغم من التقدم في مجال تكنولوجيا التسلسل والتنميط الجيني قد تتعزز بشكل كبير قدرتنا على تحديد المتغيرات الجينية المرتبطة بالمرض، لدينا القدرة على فهم الآليات الوظيفية تتأثر هذه المتغيرات متخلفة. مصدر رئيسي من المشكلة هو أن العديد من المتغيرات المرتبطة الم?...
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
We thank Erin Zoller, Jessica Bene, and Lindsey Hays for input and direction in protocol development. MTW was supported in part by NIH R21 HG008186 and a Trustee Award grant from the Cincinnati Children's Hospital Research Foundation. ZHP was supported in part by T32 GM063483-13.
Materials
| Name | Company | Catalog Number | Comments |
| Custom DNA Oligonucleotides | Integrated DNA Technologies | http://www.idtdna.com/site/order/oligoentry | |
| Potassium Chloride | Fisher Scientific | BP366-500 | KCl, for CE buffer |
| HEPES (1 M) | Fisher Scientific | 15630-080 | For CE and NE buffer |
| EDTA (0.5M), pH 8.0 | Life Technologies | R1021 | For CE, NE, and annealing buffer |
| Sodium Chloride | Fisher Scientific | BP358-1 | NaCl, for NE buffer |
| Tris-HCl (1M), pH 8.0 | Invitrogen | BP1756-100 | For annealing buffer |
| Phosphate Buffered Saline (1x) | Fisher Scientific | MT21040CM | PBS, for cell wash |
| DL-Dithiothreitol solution (1 M) | Sigma | 646563 | Reducing agent |
| Protease Inhibitor Cocktail | Thermo Scientific | 87786 | Prevents catabolism of TFs |
| Phosphatase Inhibitor Cocktail | Thermo Scientific | 78420 | Prevents dephosphorylation of TFs |
| Nonidet P-40 Substitute | IBI Scientific | IB01140 | NP-40, for nuclear extraction |
| BCA Protein Assay Kit | Thermo Scientific | 23225 | For measuring protein concentration |
| Odyssey EMSA Buffer Kit | Licor | 829-07910 | Contains all necessary EMSA buffers |
| TBE Gels, 6%, 12 Wells | Invitrogen | EC6265BOX | For EMSA |
| TBE Buffer (10x) | Thermo Scientific | B52 | For EMSA |
| FactorFinder Starting Kit | Miltenyi Biotec | 130-092-318 | Contains all necessary DAPA buffers |
| Licor Odyssey CLx | Licor | Recommended scanner for DAPA/EMSA | |
| Antibiotic-Antimycotic | Gibco | 15240-062 | Contains 10,000 units/ml of penicillin, 10,000 µg/ml of streptomycin, and 25 µg/ml of Fungizone® Antimycotic |
| Fetal Bovine Serum | Gibco | 26140-079 | FBS, for culture media |
| RPMI 1640 Medium | Gibco | 22400-071 | Contains L-glutamine and 25 mM HEPES |
References
- Hindorff, L. A., et al. Potential etiologic and functional implications of genome-wide association loci for human diseases and traits. Proc Natl Acad Sci U S A. 106 (23), 9362-9367 (2009).
- Maurano, M. T., et al. Systematic localization of common disease-associated variation in regulatory DNA. Science. 337 (6099), 1190-1195 (2012).
- Ward, L. D., Kellis, M. Interpreting noncoding genetic variation in complex traits and human disease. Nat Biotechnol. 30 (11), 1095-1106 (2012).
- Paul, D. S., Soranzo, N., Beck, S. Functional interpretation of non-coding sequence variation: concepts and challenges. Bioessays. 36 (2), 191-199 (2014).
- Zhang, F., Lupski, J. R. Non-coding genetic variants in human disease. Hum Mol Genet. , (2015).
- Lee, T. I., Young, R. A. Transcriptional regulation and its misregulation in disease. Cell. 152 (6), 1237-1251 (2013).
- Slatkin, M. Linkage disequilibrium--understanding the evolutionary past and mapping the medical future. Nat Rev Genet. 9 (6), 477-485 (2008).
- Bush, W. S., Moore, J. H. Chapter 11: Genome-wide association studies. PLoS Comput Biol. 8 (12), e1002822 (2012).
- 1000 Genomes Project Consortium. An integrated map of genetic variation from 1,092 human genomes. Nature. 491 (7422), 56-65 (2012).
- Chang, C. C., et al. Second-generation PLINK: rising to the challenge of larger and richer datasets. Gigascience. 4, 7 (2015).
- Purcell, S., et al. PLINK: a tool set for whole-genome association and population-based linkage analyses. Am J Hum Genet. 81 (3), 559-575 (2007).
- ENCODE Project Consortium. An integrated encyclopedia of DNA elements in the human genome. Nature. 489 (7414), 57-74 (2012).
- Crawford, G. E., et al. Genome-wide mapping of DNase hypersensitive sites using massively parallel signature sequencing (MPSS). Genome Res. 16 (1), 123-131 (2006).
- Buenrostro, J. D., Giresi, P. G., Zaba, L. C., Chang, H. Y., Greenleaf, W. J. Transposition of native chromatin for fast and sensitive epigenomic profiling of open chromatin, DNA-binding proteins and nucleosome position. Nat Methods. 10 (12), 1213-1218 (2013).
- Giresi, P. G., Kim, J., McDaniell, R. M., Iyer, V. R., Lieb, J. D. FAIRE Formaldehyde-Assisted Isolation of Regulatory Elements) isolates active regulatory elements from human chromatin. Genome Res. 17 (6), 877-885 (2007).
- Kent, W. J., et al. The human genome browser at UCSC. Genome Res. 12 (6), 996-1006 (2002).
- Roadmap Epigenomics Consortium. Integrative analysis of 111 reference human epigenomes. Nature. 518 (7539), 317-330 (2015).
- Martens, J. H., Stunnenberg, H. G. BLUEPRINT: mapping human blood cell epigenomes. Haematologica. 98 (10), 1487-1489 (2013).
- Liu, T., et al. Cistrome: an integrative platform for transcriptional regulation studies. Genome Biol. 12 (8), R83 (2011).
- Griffon, A., et al. Integrative analysis of public ChIP-seq experiments reveals a complex multi-cell regulatory landscape. Nucleic Acids Res. 43 (4), e27 (2015).
- Staudt, L. M., et al. A lymphoid-specific protein binding to the octamer motif of immunoglobulin genes. Nature. 323 (6089), 640-643 (1986).
- Singh, H., Sen, R., Baltimore, D., Sharp, P. A. A nuclear factor that binds to a conserved sequence motif in transcriptional control elements of immunoglobulin genes. Nature. 319 (6049), 154-158 (1986).
- Weirauch, M. T., et al. Determination and inference of eukaryotic transcription factor sequence specificity. Cell. 158 (6), 1431-1443 (2014).
- Ward, L. D., Kellis, M. HaploReg: a resource for exploring chromatin states, conservation, and regulatory motif alterations within sets of genetically linked variants. Nucleic Acids Res. 40 (Database issue), D930-D934 (2012).
- Boyle, A. P., et al. Annotation of functional variation in personal genomes using RegulomeDB. Genome Res. 22 (9), 1790-1797 (2012).
- Hume, M. A., Barrera, L. A., Gisselbrecht, S. S., Bulyk, M. L. UniPROBE, update 2015: new tools and content for the online database of protein-binding microarray data on protein-DNA interactions. Nucleic Acids Res. 43 (Database issue), D117-D122 (2015).
- Mathelier, A., et al. JASPAR 2014: an extensively expanded and updated open-access database of transcription factor binding profiles. Nucleic Acids Res. 42 (Database issue), 142-147 (2014).
- Smith, M. F., Delbary-Gossart, S. Electrophoretic Mobility Shift Assay (EMSA). Methods Mol Med. 50, 249-257 (2001).
- Franza, B. R., Josephs, S. F., Gilman, M. Z., Ryan, W., Clarkson, B. Characterization of cellular proteins recognizing the HIV enhancer using a microscale DNA-affinity precipitation assay. Nature. 330 (6146), 391-395 (1987).
- . BCA Protein Assay Kit: User Guide Available from: https://tools.thermofisher.com/content/sfs/manuals/MAN0011430_Pierce_BCA_Protein_Asy_UG.pdf (2014)
- Wijeratne, A. B., et al. Phosphopeptide separation using radially aligned titania nanotubes on titanium wire. ACS Appl Mater Interfaces. 7 (21), 11155-11164 (2015).
- Silva, J. M., McMahon, M. The Fastest Western in Town: A Contemporary Twist on the Classic Western Blot Analysis. J. Vis. Exp. (84), (2014).
- Lu, X., et al. Lupus Risk Variant Increases pSTAT1 Binding and Decreases ETS1 Expression. Am J Hum Genet. 96 (5), 731-739 (2015).
- Ramana, C. V., Chatterjee-Kishore, M., Nguyen, H., Stark, G. R. Complex roles of Stat1 in regulating gene expression. Oncogene. 19 (21), 2619-2627 (2000).
- Fillebeen, C., Wilkinson, N., Pantopoulos, K. Electrophoretic Mobility Shift Assay (EMSA) for the Study of RNA-Protein Interactions: The IRE/IRP Example. J. Vis. Exp. (94), e52230 (2014).
- Heng, T. S., Painter, M. W. Immunological Genome Project, C. The Immunological Genome Project: networks of gene expression in immune cells. Nat Immunol. 9 (10), 1091-1094 (2008).
- Wu, C., et al. BioGPS: an extensible and customizable portal for querying and organizing gene annotation resources. Genome Biol. 10 (11), R130 (2009).
- Wu, C., Macleod, I., Su, A. I. BioGPS and MyGene.info: organizing online, gene-centric information. Nucleic Acids Res. 41 (Database issue), D561-D565 (2013).
- Wang, J., et al. Sequence features and chromatin structure around the genomic regions bound by 119 human transcription factors. Genome Res. 22 (9), 1798-1812 (2012).
- Holden, N. S., Tacon, C. E. Principles and problems of the electrophoretic mobility shift assay. J Pharmacol Toxicol Methods. 63 (1), 7-14 (2011).
- Xu, J., Liu, H., Park, J. S., Lan, Y., Jiang, R. Osr1 acts downstream of and interacts synergistically with Six2 to maintain nephron progenitor cells during kidney organogenesis. Development. 141 (7), 1442-1452 (2014).
- Yang, T. -. P., et al. Genevar: a database and Java application for the analysis and visualization of SNP-gene associations in eQTL studies. Bioinformatics. 26 (19), 2474-2476 (2010).
- Fort, A., et al. A liver enhancer in the fibrinogen gene cluster. Blood. 117 (1), 276-282 (2011).
- Solberg, N., Krauss, S. Luciferase assay to study the activity of a cloned promoter DNA fragment. Methods Mol Biol. 977, 65-78 (2013).
- Rahman, M., et al. A repressor element in the 5'-untranslated region of human Pax5 exon 1A. Gene. 263 (1-2), 59-66 (2001).
- Mali, P., et al. RNA-Guided Human Genome Engineering via Cas9. Science. 339 (6121), 823-826 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved