A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التساهمية ملزم من الأجسام المضادة لالسليلوز أقراص الورق وتطبيقاتها في العين المجردة اللونية يمونواسايس
In This Article
Summary
In this manuscript, periodate oxidation and glutaraldehyde cross-linking methods for covalent immobilization of antibodies on paper discs are presented. The binding activity of immobilized antibodies was evaluated. Based on these results, a glutaraldehyde cross-linking method was used to develop a novel paper-based immunoassay for immunoglobulin G (IgG) detection.
Abstract
ويعرض هذا التقرير طريقتين لتجميد التساهمية من الأجسام المضادة القبض على مرشح السليلوز ورقة الصف رقم 1 (ورق الترشيح المتوسط التدفق) أقراص والصف رقم 113 (تدفق سريع ورقة فلتر) أقراص. والمطعمة هذه الأقراص رقة السليلوز مع المجموعات الوظيفية أمين من خلال تقنية اقتران سيلاني قبل أن يجمد الأجسام المضادة عليها. تم استخدام طرق ربط عبر بريودات الأكسدة وغلوتارالدهيد إلى الكسب غير المشروع الأجسام المضادة القبض على أقراص رقة السليلوز. من أجل ضمان أقصى قدر من القدرة ملزمة من الأجسام المضادة القبض على أهدافها بعد الشلل، وقد تم التحقيق آثار تركيزات مختلفة من بريودات الصوديوم، غلوتارالدهيد، والأجسام المضادة القبض على سطح الأقراص الورق. الأجسام المضادة التي تم المغلفة على أقراص رقة السليلوز functionalized أمين من خلال وكيل غلوتارالدهيد عبر ربط أظهرت تعزيز النشاط ملزما للهدف بالمقارنة مع طريقة الأكسدة بريودات. وقد استخدم مفتش (في الماوس المصل المرجعية) كهدف الإشارة في هذه الدراسة إلى اختبار التطبيق من الأجسام المضادة يجمد تساهمي من خلال غلوتارالدهيد. والورقية، انزيم مرتبط المناعي فحص جديد (ELISA) وضعت بنجاح والتحقق من صحتها للكشف عن مفتش. لا يتطلب هذا الأسلوب المعدات، ويمكن الكشف عن 100 نانوغرام / مل من مفتش. وكانت ورقة فلتر تدفق سريع أكثر حساسية من ورق الترشيح المتوسطة التدفق. كانت فترة حضانة هذا الاختبار قصيرة وتتطلب كميات عينة صغيرة. هذا بالعين المجردة، المناعية اللونية يمكن أن تمتد إلى كشف الأهداف الأخرى التي تم تحديدها مع إليسا التقليدية.
Introduction
الدراسة التشخيصية نقطة الرعاية السريرية (POCT) مهمة لتطوير استراتيجيات جديدة لعلاجات وأدوية شخصية، والرعاية المنزلية 1. وتستخدم أوراق السيلولوز على نطاق واسع منصات في المناعية، لأنها رخيصة، يمكن الوصول إليها، ومألوفة للمستخدمين 2. وبالإضافة إلى ذلك، فإن بنية مسامية من الورق السليلوز يملك القدرة على دفع تدفق السائل دون تأثير طاقة إضافية. سجلات التحاليل الطبية الورقية يمكن العثور في وقت مبكر من القرن ال 20، عندما اخترع اللوني ورقة لأول مرة في عام 1952. والمثال الأكثر انتشارا هو الاختبارات المناعي 3، مثل الحمل واختبار السكري شرائط. توفر هذه الاختبارات مرات فحص سريع نسبيا وتحليل غير مكلفة 4. نظرا لبساطتها، وقد استخدمت على نطاق واسع هذه الاختبارات قطاع الورقية التقليدية في التشخيص POCT 5.
طرق الكشف بما في ذلك اللونية 6، الكهربائيةوقد تم الإبلاغ عن مادة كيميائية 7، وelectrochemiluminescence 8 طرق لقياس أهداف في العينات البيولوجية. وبالإضافة إلى هذه الأساليب الكمية، وهي طريقة يمكن الاعتماد عليها لشل حركة الأجسام المضادة على ورق السيلولوز مهم لتطوير أجهزة التشخيص أيضا. الامتزاز غير محددة هو الاستراتيجية الرئيسية لتعديل الأجسام المضادة على سطح الأجهزة الورقية 9 و 10 لضمان قدرة ملزمة القصوى لأهدافها بعد الشلل. ومع ذلك، فإن دراسة سابقة أظهرت أن الأجسام المضادة التي كثف على ورق السيلولوز يمكن يلتفظ من الألياف 11 بنسبة 40٪. وهكذا، والامتزاز المباشر من الأجسام المضادة على السليلوز قد لا توفر نتائج استنساخه 12. التساهمية تجميد الأجسام المضادة التي يتم زرعها على أسطح الورقة هو طريقة بديلة لتطوير اختبارات بيولوجية الورقية فعالة 13. وقد تم الإبلاغ عن أساليب مختلفة لتعديل السليلوز 14، 15 . من الناحية المثالية، ينبغي أن الأجسام المضادة حفاظ على وظائف الأصلية بعد تجميد 12. Carbonyldiimidazole جنبا إلى جنب مع 1-cyano-4-dimethylaminopyridinium رباعي فلوروبورات 16؛ 1-الفلورية-2-نيترو-4-azidobenzene من خلال القائمة على الأشعة فوق البنفسجية استراتيجية تفعيل 17، 18؛ استراتيجية chemoenzymatic على أساس 19 تعديل xyloglucan. على 1،4-phenylenediisothiocyanate عامل ربط 20؛ عديد السكاريدات المتغاير الأكسدة 21 نقرة الكيمياء 22؛ والبروفيرين الموجبة 23 استخدمت لشل حركة تساهمي الجزيئات الحيوية على ورق السيلولوز. وقد استخدم الشيتوزان رقة معدلة لتطوير immunodevices الورقية 24-26 لأنها وفيرة وحيويا 27. الشيتوزان هو الموجبة وتتمسك بقوة إلى السليلوز الأنيونية 27. ويجمد الأجسام المضادة القبض على الورق من خلال طلاء الشيتوزان وغلوتارالدهيد عبر ربط. الأكسدة بريودات هي طريقة أخرى لتطعيم الكابتنأجسام مضادة لدى عودتهم على ورقة السليلوز 28. في هذه الطريقة، يتم رصدت بريودات الصوديوم على ورقة لتحويل مجموعة 1،2-dihydroxyl (جلايكول) في السليلوز مباشرة إلى مجموعة ألدهيد. ثم يتم استخدام مجموعة ألدهيد لتشكيل روابط تساهمية بين السكريات والأجسام المضادة 28. على الرغم من أن التصنيع هو بسيط، فمن الصعب أن يغسل تماما بريودات الصوديوم. وبريودات الصوديوم غير مغسولة يمكن أن يسبب المزيد من أكسدة الأجسام المضادة التي ثبتوا على ورقة السليلوز، مما يؤثر على النشاط والاستقرار من الأجسام المضادة N - (3-dimethylaminopropyl) - N هيدروكلوريد -ethylcarbodiimide وN تستخدم linkers عبر -hydroxysuccinimide أيضا تساهميا شل الأجسام المضادة على حامض وخلات السليلوز ألياف النانو بولي-L-اللبنيك electrospun لتطوير المقايسات القائمة على ألياف نانوية 29.
في هذه الدراسة، تم استخدام تقنية اقتران سيلاني إلى الكسب غير المشروع المجموعات الوظيفية أمين على cellulosأقراص البريد ورقة. هذه التقنية تساعد على الإبقاء على الحجم الأصلي المسام، فتل، ومعدل الترشيح للأوراق الترشيح السليلوز، مما يتيح أقصى العمودية المناعية تدفق من خلال في. وقد استخدمت هذه التقنية سيلاني اقتران على نطاق واسع في أجهزة الاستشعار لfunctionalize السطوح الركيزة مع مجموعات أمين الثانوية، تليها مزيد من التعديل باستخدام الجزيئات الحيوية. تطعيم الفئات أمين على سطح مصفوفة يتألف رد فعل التكثيف بين الجماعات أوه من وكلاء سيلاني organofunctional ومصفوفة الركيزة 30. تم functionalized الأقراص رقة السليلوز مع مجموعات أمين كتبها اقتران سيلاني من خلال 3-aminopropyltrimethoxysilane (APS) 31. وأعقب ذلك الأجسام المضادة القبض على شل حركة تساهميا باستخدام طريقتين مختلفتين. تشارك الطريقة الأولى ملزم من بريودات الأجسام المضادة القبض المؤكسد إلى أمين functionalized أقراص ورق السليلوز. استخدام الطريقة الثانية غلوتارالدهيد كعامل عبر ربط إرفاق antibodi القبضوفاق لأقراص أمين ورق السيلولوز functionalized المجموعة. وأكد وجود أجسام مضادة أسر أرنب مكافحة الإنسان ثيوسيانات مفتش-فلوريسئين (FITC)، وذلك باستخدام مضان تصوير الجزيئي. تم تقييم النشاط ملزمة الأرنب مكافحة الإنسان مفتش-FITC إلى الماعز المضادة للأرنب مفتش أيضا الركيزة البيروكسيداز. تمت دراسة تأثير تركيزات مختلفة من بريودات الصوديوم، غلوتارالدهيد، والأجسام المضادة القبض عليه. تم إجراء اختبار التطبيق من الأجسام المضادة القبض يجمد بنجاح من خلال الكشف عن مفتش المصل.
Protocol
1. مسمار أمين المجموعات الوظيفية على السليلوز ورقة أقراص
- إعداد قطعة واحدة من الورق مربع مع البعد من 1 سم × 1 سم، و 100 أقراص الورق المصنوع من الصف رقم (1) ورقة السليلوز التي يبلغ قطرها 6.0 مم (ورق الترشيح متوسط التدفق) باستخدام لكمة ثقب.
- لاشتقاق -NH 2 المجموعات على أقراص الورق، وخلط 1 مل و 10 مل وكالة الأنباء الجزائرية الأسيتون في زجاجة 50 مل في غطاء الدخان. إضافة أقراص الورق إلى الطازجة خليط APS الكاشف، واحتضان لمدة 5 ساعة مع التحريك المداري (200 دورة في الدقيقة) في درجة حرارة الغرفة (32).
تحذير: التعامل مع وكالة الأنباء الجزائرية والأسيتون في غطاء الدخان. - صب حل الزائدة من زجاجة 50 مل في وعاء النفايات العضوية.
- إضافة 10 مل من الاسيتون للزجاجة، وتخلط جيدا وصب تماما لإزالة أي APS غير المتفاعل وغيرها من الشوائب. كرر هذه الخطوة مرتين.
- نشر أقراص رقة على منشفة ورقية ومكان في C فرن 110 درجة لمدة 3 ساعة. السماح للأقراص رقة لتبرد. تخزين الأقراص في أنبوب 50 مل الطرد المركزي في درجة حرارة الغرفة.
- استخدام تحويل فورييه الطيفي بالأشعة تحت الحمراء (FTIR) للتحقق من تطعيم مجموعات أمين على ورقة مربع السليلوز، كما هو موضح أدناه (الشكل 3A).
- تشغيل الكمبيوتر وفتح أداة FTIR الطيفي.
- فتح البرنامج لFTIR الطيفي.
- انتقل إلى 'قياس → تهيئة. المستطيلات ل"BS: كي بي آر"،: سوف "مصباح الأشعة تحت الحمراء" و "الليزر" يتحول إلى اللون الأخضر عند الانتهاء من التهيئة.
- اختيار "بيانات" أسفل المستطيلات، واختر '٪ النفاذية'، 'هاب-Genzel'، '45'، '4.0'، و 'الحد الأدنى: 400، الحد الأقصى: 4000' ل 'الوضع القياس'، 'Apodization'، ' لا. من المسح '،' القرار '، و' المدى (سم-1).
- انقر على "قياس".
- اختر "ملف البيانات" للبيانات الخلفية. كتابةمن أهمية هذه التصريحات.
- انقر على "BKG" للحصول على خط الأساس للخلفية.
- إصلاح ورقة مربع على صاحب العينة الفيلم.
- اختر "ملف البيانات" للبيانات العينة. كتابة تعليق.
- انقر على "عينة" للحصول على الأطياف للعينة.
- إغلاق التطبيق الطيفي FTIR وإيقاف تشغيل الكمبيوتر.
- كرر الخطوات المذكورة أعلاه (الخطوات 1،1-1،6) للتحضير-أمين functionalized الصف رقم 113 السليلوز ورقة مربع، وأقراص (تدفق سريع ورق الترشيح)، والحصول على أطياف FTIR لورقة مربع الصف رقم 113 (الشكل 3B).
2. التساهمية الشلل من الأجسام المضادة على functionalized أمين-السليلوز ورقة أقراص
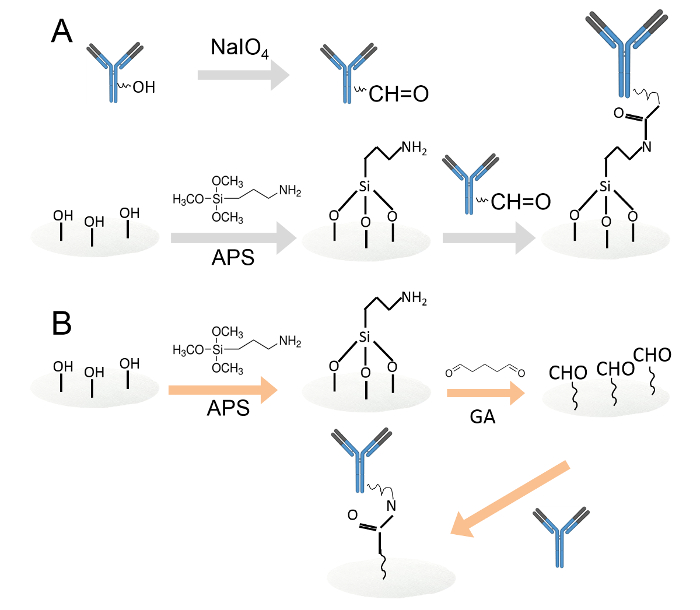
الشكل 1. التساهمية تجميد الأجسام المضادة من قبل اثنين من أساليب مختلفة.A. الأجسام المضادة يجمد على السليلوز أقراص الورق functionalized أمين عن طريق الأكسدة بريودات. تم أكسدة مخلفات الكربوهيدرات التي كتبها بريودات الصوديوم لإنتاج المجموعات الوظيفية ألدهيد. ثم، تم تحميل الأجسام المضادة المؤكسد على السليلوز أقراص الورق functionalized أمين. ب. وثم يجمد الأجسام المضادة على أقراص ورق السيلولوز functionalized أمين من خلال غلوتارالدهيد. كانت مغمورة أمين functionalized أقراص ورق السيلولوز في 0.05٪ محلول غلوتارالدهيد لتقديم مجموعة ألدهيد إلى أقراص الورق. بعد الغسيل، وتحميل الأجسام المضادة على ألدهيد functionalized أقراص الورق. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- لشل حركة الأجسام المضادة على السليلوز أقراص الورق functionalized أمين عن طريق الأكسدة بريودات (الشكل 1A).
- مزيج 1 ميكرولتر من 2.5 ملي perioda الصوديومالشركة المصرية للاتصالات مع 2 ميكرولتر من 0.1 ملغ / مل أرنب المضادة للبشرية مفتش-FITC و 7 ميكرولتر من 100 ملي درجة الحموضة 5.5 عازلة خلات في أنبوب 1.5 مل، واحتضان الخليط في الظلام لمدة 30 دقيقة.
ملاحظة: اتبع هذه النسبة حجم لإعداد الأجسام المضادة أكثر المؤكسد إذا لزم الأمر. تغيير نسبة حجم لتحسين تركيز بريودات الصوديوم والأرانب مكافحة الإنسان مفتش-FITC. - تمييع الحل الضد أعلاه مع 30 ميكرولتر من 50 ملي الفوسفات المالحة العازلة (PBS، ودرجة الحموضة 7.4) إلى الحجم النهائي من 40 ميكرولتر.
- إعداد ثلاث مرشح المتوسطة تدفق أقراص الورق أمين-functionalized وثلاثة تدفق سريع أقراص الورق functionalized أمين (كما هو موضح في القسم 1).
- تحميل 5 ميكرولتر من بريودات الصوديوم أكسدة أرنب مكافحة الإنسان مفتش-FITC على كل أسطوانة ورق الترشيح المتوسط تدفق و 8 ميكرولتر على كل أسطوانة ورقة مرشح تدفق سريع. حافظ على هذه الأقراص ورقة في الظلام لمدة ساعة واحدة في درجة حرارة الغرفة.
- يغسل كل من القرص ورقة مع 0.2 مل من غسل برتقاليإيه (50 ملي تريس العازلة مع 0.15 M كلوريد الصوديوم و 0.05٪ السطحي، ودرجة الحموضة 7.4). تكرار غسل ثلاث مرات.
- تصوير الصور مضان من خلال تصوير الجزيئي مضان لتحديد وجود أجسام مضادة في كل السليلوز ورقة القرص 32. استخدام أقراص رقة بيضاء (تعامل مع نفس تركيز الأجسام المضادة في حالة عدم وجود بريودات الصوديوم) كعنصر تحكم (الشكل S1 إلى الشكل S3).
ملاحظة: للحصول على تحسين التجريبية، تغيير التركيز من معلمة واحدة يحتاج إلى أن يكون الأمثل وتحديد تركيزات جميع المعلمات الأخرى. وكثافة عالية مضان يزيد من كمية من الأجسام المضادة القبض على أن يجمد على أقراص رقة السليلوز.
- مزيج 1 ميكرولتر من 2.5 ملي perioda الصوديومالشركة المصرية للاتصالات مع 2 ميكرولتر من 0.1 ملغ / مل أرنب المضادة للبشرية مفتش-FITC و 7 ميكرولتر من 100 ملي درجة الحموضة 5.5 عازلة خلات في أنبوب 1.5 مل، واحتضان الخليط في الظلام لمدة 30 دقيقة.
- لشل حركة الأجسام المضادة على أمين أقراص ورق السيلولوز functionalized من خلال غلوتارالدهيد (الشكل 1B).
- إضافة ثلاثة APS تعامل المتوسطة تدفق أقراص ورق الترشيح وتدفق سريع أقراص ورق الترشيح الثلاثة (ديسcribed في القسم 1) إلى 2 مل من 50 ملي برنامج تلفزيوني (الرقم الهيدروجيني 7.4) الذي يحتوي على 0.05٪ غلوتارالدهيد لمدة 1 ساعة، مع التحريك المداري في درجة حرارة الغرفة.
تحذير: التعامل مع غلوتارالدهيد في غطاء الدخان. - وضع ثلاثة أقراص في كل من اثنين من 1.5 مل أنابيب الطرد المركزي. إضافة 1 مل من الماء (DI) منزوع الأيونات إلى كل أنبوب ويهز الأنابيب لمدة 10 ثانية. إزالة المياه من خلال الشفط مع ماصة. كرر مرتين أخريين لإزالة أي غلوتارالدهيد غير المتفاعل.
- تحميل 5 ميكرولتر من 25 ميكروغرام / مل أرنب مكافحة الإنسان مفتش-FITC (التقاط الأجسام المضادة) على كل المتوسطة تدفق القرص ورقة مرشح functionalized ألدهيد، وإضافة 8 ميكرولتر على كل تدفق سريع القرص ورقة مرشح functionalized ألدهيد. احتضان في الظلام لمدة حوالي 20 دقيقة في درجة حرارة الغرفة. ثم، إضافة 10 ميكرولتر من 50 ملي برنامج تلفزيوني (الرقم الهيدروجيني 7.4) إلى كل أسطوانة ورقة دون إزالة الأجسام المضادة واحتضان لمدة 40 دقيقة للتفاعل الأمينات ألدهيد.
- غسل أقراص الورق مع 0.2 مل من غسل العازلة على رأس منشفة ورقية. تكرارغسل مرتين.
- تصوير الصور مضان من خلال تصوير الجزيئي مضان للتأكد من وجود أجسام مضادة في كل السليلوز ورقة القرص 33. استخدام أقراص رقة بيضاء كمجموعة تحكم.
ملاحظة: في الشكل (4)، '0' لتقف على القرص الورق الفارغ الذي تعامل مع نفس التركيز من FITC الأجسام المضادة في حالة عدم وجود غلوتارالدهيد. في الشكل 5A، تم علاج الأقراص ورقة بيضاء مع غلوتارالدهيد، ولكن تم تحميل أي الأجسام المضادة FITC على أقراص الورق.
- إضافة ثلاثة APS تعامل المتوسطة تدفق أقراص ورق الترشيح وتدفق سريع أقراص ورق الترشيح الثلاثة (ديسcribed في القسم 1) إلى 2 مل من 50 ملي برنامج تلفزيوني (الرقم الهيدروجيني 7.4) الذي يحتوي على 0.05٪ غلوتارالدهيد لمدة 1 ساعة، مع التحريك المداري في درجة حرارة الغرفة.
- تجفيف أقراص الورق (من أقسام 2.1 و 2.2) عند 37 درجة مئوية لمدة 10 دقيقة.
- منع أقراص الورق مع 15 ميكرولتر من عرقلة العازلة (10٪ منزوع الدسم مسحوق الحليب في 50 العازلة ملي تريس، ودرجة الحموضة 7.4، 0.15 م كلوريد الصوديوم) لمدة 10 دقيقة في درجة حرارة الغرفة.
- تحميل 5 ميكرولتر و 8 ميكرولتر من البيروكسيديز مترافق الماعز المضادة للأرنب مفتش في برنامج تلفزيوني (1: 10000) على متوسط تدفق وتدفق سريع أقراص ورق الترشيح، على التوالي. احتضان ل30 دقيقة في الظلام في درجة حرارة الغرفة.
- غسل أقراص الورق مع 0.2 مل من غسل العازلة على رأس منشفة ورقية. تكرار غسل ثلاث مرات.
ملاحظة: ليس من الضروري إزالة غسل العازلة كما لا تتأثر النتائج وفقا المخزن المؤقت. - تحميل مزيج 10 ميكرولتر من 3،3 '، 5،5'-tetramethylbenzidine (TMB) ومحلول فوق أكسيد الهيدروجين على كل أسطوانة.
- التقاط صور للأقراص الورق مع الكاميرا الرقمية أو الهواتف الذكية بعد 5 دقائق من الحضانة.
ملاحظة: في الشكل 5B، '0' وتقف على أقراص الورق التي كانت تعامل مع غلوتارالدهيد، تليها تحميل المترافقة في غياب FITC الضد الضد HRP (حصان الفجل البيروكسيديز).
إليسا 3. الورقية للكشف مفتش
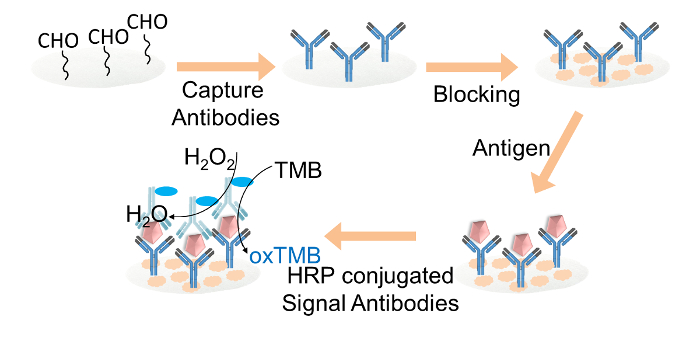
الشكل 2. تمثيل تخطيطي للELISA الورقية FOويجمد ص مفتش الكشف. التقاط الأجسام المضادة تساهميا على أقراص رقة السليلوز functionalized ألدهيد من خلال غلوتارالدهيد. تم حظر أقراص رقة السليلوز مع عازلة تمنع. ثم أضاف الهدف مفتش للأقراص، تليها تحميل الأجسام المضادة إشارة HRP مترافق. وأخيرا، تم تحميل حل تمب وخليط بيروكسيد الهيدروجين على كل أسطوانة ورقة للقراءة اللون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- إضافة 5 مل من محلول غلوتارالدهيد 0.05٪ (المعد في 50 العازلة ملي برنامج تلفزيوني، ودرجة الحموضة 7.4) لزجاجة 20 مل. تزج 15 متوسطة تدفق أقراص ورق الترشيح-functionalized أمين في هذا الحل وإبقاء لمدة 1 ساعة مع اهتزاز عند درجة حرارة الغرفة.
- وفي الوقت نفسه، كرر الخطوة 3.1 لإعداد 15 ألدهيد functionalized تدفق سريع أقراص الورق مرشح آخر.
الحذر: التعامل مع غلوتارالدهيد في الدخانالغطاء.
- وفي الوقت نفسه، كرر الخطوة 3.1 لإعداد 15 ألدهيد functionalized تدفق سريع أقراص الورق مرشح آخر.
- لإزالة غلوتارالدهيد غير المتفاعل من أقراص الورق، ووضع 15 متوسطة تدفق أقراص ورق الترشيح في أنبوب الطرد المركزي 15 مل، و15 التدفق السريع أقراص ورق الترشيح في أنبوب آخر الطرد المركزي 15 مل. إضافة 5 مل من الماء DI إلى كل أنبوب ويهز الأنابيب لمدة 10 ثانية. إزالة المياه من خلال الشفط مع ماصة. كرر مرتين لإزالة أي غلوتارالدهيد غير المتفاعل.
- تجفيف أقراص الورق في 37 درجة مئوية الفرن.
- إضافة 5 ميكرولتر و 8 ميكرولتر من 0.025 ملغ / مل الأجسام المضادة جزء الماوس مفتش-FC إلى كل من متوسط التدفق ورقة الترشيح تدفق سريع أقراص، على التوالي، واحتضان لمدة 20 دقيقة.
- إضافة 10 ميكرولتر من 50 ملي برنامج تلفزيوني (الرقم الهيدروجيني 7.4) إلى كل أسطوانة ورقة دون إزالة الأجسام المضادة واحتضان لمدة 40 دقيقة للتفاعل الأمينات ألدهيد.
- غسل أقراص الورق مع 0.2 مل من غسل العازلة على رأس منشفة ورقية. تكرار غسل ثلاث مرات.
- تجفيف أقراص رقة في الفرن عند 37 درجة مئوية.
- منع أقراص رقة ثإيث 15 ميكرولتر من عرقلة العازلة لمدة 10 دقيقة في درجة حرارة الغرفة.
- يغسل كل أسطوانة ورقة مع 0.2 مل من غسل العازلة على رأس منشفة ورقية. تكرار غسل ثلاث مرات.
- تشغيل معايير مفتش.
- تحميل 10 ميكرولتر من تركيزات مختلفة مفتش (على سبيل المثال، 0، 10، 125، 250، و 500 نانوغرام / مل في برنامج تلفزيوني) على كل أسطوانة في ثلاث نسخ. احتضان لمدة 1 ساعة في درجة حرارة الغرفة.
- غسل أقراص الورق مع 0.2 مل من غسل العازلة على رأس منشفة ورقية. تكرار غسل ثلاث مرات.
- تحميل 10 ميكرولتر من الأجسام المضادة HRP مترافق الماوس مفتش-FC جزء (1: 10000، 10 ملي برنامج تلفزيوني، ودرجة الحموضة 7.4)، واحتضان لمدة 1 ساعة في درجة حرارة الغرفة.
- غسل أقراص الورق مع 0.2 مل من غسل العازلة على رأس منشفة ورقية. تكرار غسل ثلاث مرات.
ملاحظة: ليس من الضروري إزالة غسل العازلة كما لا تتأثر نتائج من خلال وجود العازلة. - تحميل مزيج 10 ميكرولتر من تمب وبيروكسيد الهيدروجين على كل أسطوانة.
- تصور أك جميع أقراص الورق مع الكاميرا الرقمية أو الهواتف الذكية بعد 5 دقائق من الحضانة.
ملاحظة: في الشكل 6A، '0' لتقف على أقراص رقة تعامل مع تجميد التقاط الأجسام المضادة، والحل الضد HRP / TMB دون مفتش المصل. - تحليل كثافة كل قرص الورق في صورة من صورة J.
- تحويل الصور الملتقطة في خطوة 3.15 إلى تنسيق ". TIF.
- فتح 'صورة J' البرمجيات.
- انتقل إلى 'ملف → فتح'، واختيار صورة لتحليلها.
- اختر زر شكل "البيضاوي".
- انتقل إلى 'صورة → → نوع 32 بت.
- انتقل إلى 'تحرير → المقلوب ".
- انتقل إلى 'تحليل → التدبير.
- نسخ وتحليل البيانات في جدول بيانات.
النتائج
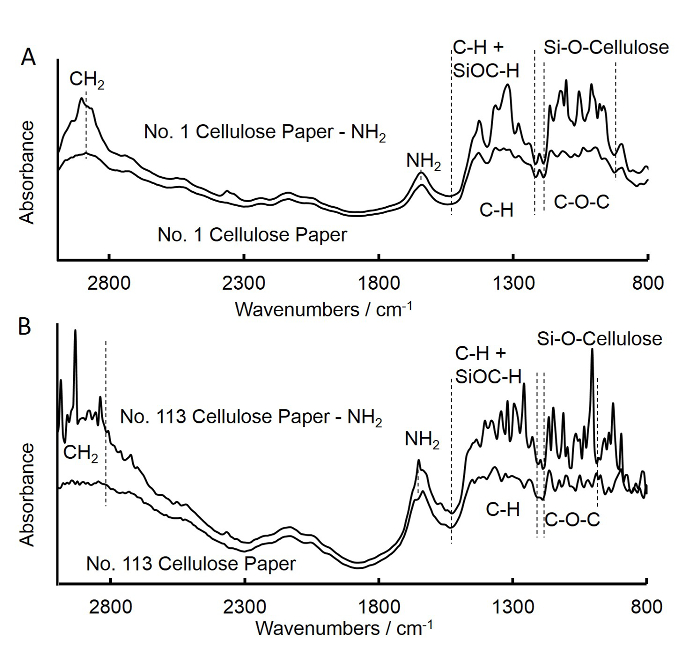
الشكل 3. تحويل فورييه الأشعة تحت الحمراء (FTIR) أطياف غير المعالجة أو المعالجة APS-فلتر المتوسط تدفق ورقة مربع (A) وتدفق سريع مرشح ورقة مربع (B). A. كان الأطياف لغير المعالجة مرشح المتوسط?...
Discussion
تم تنفيذ طلاء المباشر للتقارب تنقية الماعز المضادة للماوس مفتش-FC التقاط الأجسام المضادة على أقراص ورق السيلولوز معدلة للكشف عن تركيزات مفتش. وأشارت النتائج أن زيادة تثبيت الأجسام المضادة القبض على مطلوب للاستنساخ. استخدمت تقنية سيلاني بنجاح لإدخال المجموعات الوظي?...
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was financially supported by the Ministry of Education, Singapore through the Translational and Innovation Grant (MOE2012-TIF-2-G-009).
Materials
| Name | Company | Catalog Number | Comments |
| Cellulose filter paper, Grade 1 (medium flow filter paper) | GE Healthcare Pte Ltd Singapore | 1001 110 | |
| Cellulose filter paper, Grade 113 (Fast flow filter paper) | Sigma-Aldrich, Singapore | 1113-320 | |
| Glutaraldehyde | Sigma-Aldrich, Singapore | G6257 | Grade II, 25% in H2O |
| Surfactant | Tween-20, Sigma-Aldrich, Singapore | P2287 | |
| Bovine serum album | Sigma-Aldrich, Singapore | A2153 | |
| Skimmed milk powder | Louis François | Packed by Kitchen Capers, Singapore | |
| Tris base | Promega | H5135 | |
| Sodium periodate | Merck | 106597 | |
| Na2HPO4 | Merck | 106585 | |
| KH2PO4 | Merck | 104873 | |
| NaCl | CALBIOCHEM | 567441 | |
| NaOH | Merck | 106462 | |
| HCl | Merck | 100317 | |
| phosphate buffer saline (PBS) | N/A | N/A | PBS, containing 137 mmol/L NaCl, 2.7 mmol/L KCl, 8.0 mmol/L Na2HPO4 and 1.5 mmol/L KH2PO4, is prepared with water and adjusted to pH 7.4 with 0.1 mol/L NaOH or 0.1 mol/L HCl |
| Acetone | Tee Hai Chem Pte Ltd Singapore | 9005-68 | |
| Mixture of TMB and hydrogen peroxide solution | 1-Step ultra TMB-ELISA solution , Thermo Scientific Pierce | 34029 | 1 L |
| Rabbit anti-human IgG-FITC | TWC/Bio Pte Ltd Singapore | sc-2278 | |
| Peroxidase conjugated goat anti-rabbit IgG | TWC/Bio Pte Ltd Singapore | sc-2030 | |
| Affinity purified goat anti-Mouse IgG-Fc coating antibody | Bethyl Laboratories, Inc | A90-131A | |
| Mouse reference serum | Bethyl Laboratories, Inc | RS10-101-5 | 9.5 mg/ml |
| HRP conjugated goat anti-mouse IgG-Fc detection antibody | Bethyl Laboratories, Inc | A90-131P | |
| Equipment | |||
| Fourier transform infrared spectrophotometer | Shimadzu IR Prestige-21 | N/A | |
| Fluorescence molecular imager | Pharos FXTM plus molecular imager, Bio-Rad, Singapore | N/A | |
| Oven | NUVE FN500 | N/A | |
| Turbo mixer VM-2000 | MYC LTD | N/A | |
| ImageJ | RGB, free download | N/A |
References
- Curtis, K. A., Rudolph, D. L., Owen, S. M. Rapid detection of HIV-1 by reverse-transcription, loop-mediated isothermal amplification (RT-LAMP). J. Virol. Methods. 151 (2), 264-270 (2008).
- Martinez, A. W., Phillips, S. T., Carrilho, E., Thomas, S. W., Sindi, H., Whitesides, G. M. Simple telemedicine for developing regions: camera phones and paper-based microfluidic devices for real-time, off-site diagnosis. Anal. Chem. 80 (10), 3699-3707 (2008).
- Lode, P. V. Point-of-care immunotesting: approaching the analytical performance of central laboratory methods. Clin. Biochem. 38 (7), 591-606 (2005).
- Posthuma-Trumpie, G. A., Amerongen, A. V., Korf, J., Berkel, W. J. V. Perspectives for on-site monitoring of progesterone. Trends Biotechnol. 27 (11), 652-660 (2009).
- Lim, D. V., Simpson, J. M., Kearns, E. A., Kramer, M. F. Current and developing technologies for monitoring agents of bioterrorism and biowarfare. Clin. Microbiol. Rev. 18 (4), 583-607 (2005).
- Li, X., Tian, J., Shen, W. Progress in patterned paper sizing for fabrication of paperbased microfluidic sensors. Cellulose. 17 (3), 649-659 (2010).
- Nie, Z., et al. Electrochemical sensing in paper-based microfluidic devices. Lab Chip. 10, 477-483 (2010).
- Delaney, J. L., Hogan, C. F., Tian, J., Shen, W. Electrogenerated chemiluminescence detection in paper-based microfluidic sensors. Anal. Chem. 83 (4), 1300-1306 (2011).
- Oh, Y. K., Joung, H. A., Kim, S., Kim, M. G. Vertical flow immunoassay (VFA) biosensor for a rapid one-step immunoassay. Lab Chip. 13 (5), 768-772 (2013).
- Cheng, C. M., et al. Paper-based ELISA. Angew. Chem. 122 (28), 4881-4884 (2010).
- Jarujamrus, P., Tian, J., Li, X., Siripinyanond, A., Shiowatana, J., Shen, W. Mechanisms of red blood cells agglutination in antibody-treated paper. Analyst. 137 (9), 2205-2210 (2012).
- Credou, J., Volland, H., Dano, J., Berthelot, T. A one-step and biocompatible cellulose functionalization for covalent antibody immobilization on immunoassay membranes. J. Mat. Chem. B. 1, 3277-3286 (2013).
- Kong, F., Hu, Y. F. Biomolecule immobilization techniques for bioactive paper fabrication. Anal. Bioanal. Chem. 403, 7-13 (2012).
- Orelma, H., Teerinen, T., Johansson, L. S., Holappa, S., Laine, J. CMC-modified cellulose biointerface for antibody conjugation. Biomacromolecules. 13, 1051-1058 (2013).
- Yu, A., et al. Biofunctional paper via covalent modification of cellulose. Langmuir. 28 (30), 11265-11273 (2012).
- Stollner, D., Scheller, F. W., Warsinke, A. Activation of cellulose membranes with 1,1′-carbonyldiimidazole or 1-cyano-4-dimethylaminopyridinium tetrafluoroborate as a basis for the development of immunosensors. Anal Biochem. 304 (2), 157-165 (2002).
- Bora, U., Sharma, P., Kannan, K., Nahar, P. Photoreactive cellulose membrane - a novel matrix for covalent immobilization of biomolecules. J. Biotechnol. 126 (2), 220-229 (2006).
- Sharma, P., Basir, S. F., Nahar, P. Photoimmobilization of unmodified carbohydrates on activated surface. J Colloid Interface Sci. 342 (1), 202-204 (2010).
- Brumer, H., Zhou, Q., Baumann, M. J., Carlsson, K., Teeri, T. T. Activation of crystalline cellulose surfaces through the chemoenzymatic modification of xyloglucan. J. Am. Chem. Soc. 126 (18), 5715-5721 (2004).
- Araujo, A. C., Song, Y., Lundeberg, J., Stahl, P. L., Brumer, H. Activated paper surfaces for the rapid hybridization of DNA through capillary transport. Anal Chem. 84 (7), 3311-3317 (2012).
- Xu, C., Spadiut, O., Araujo, A. C., Nakhai, A., Brumer, H. Chemo-enzymatic Assembly of Clickable Cellulose Surfaces via Multivalent Polysaccharides. ChemSusChem. 5 (4), 661-665 (2012).
- Filpponen, I., et al. Generic method for modular surface modification of cellulosic materials in aqueous medium by sequential "click" reaction and adsorption. Biomacromolecules. 13 (3), 736-742 (2012).
- Feese, E., Sadeghifar, H., Gracz, H. S., Argyropoulos, D. S., Ghiladi, R. A. Photobactericidal porphyrin-cellulose nanocrystals: synthesis, characterization, and antimicrobial properties. Biomacromolecules. 12 (10), 3528-3539 (2011).
- Zang, D., Ge, L., Yan, M., Song, X., Yu, J. Electrochemical immunoassay on a 3D microfluidic paper-based device. Chem. Commun. 48 (39), 4683-4685 (2012).
- Ge, L., Yan, J. X., Song, X. R., Yan, M., Ge, S. J., Yu, J. H. Three-dimensional paper-based electrochemiluminescence immunodevice for multiplexed measurement of biomarkers and point-of-care testing. Biomaterials. 33 (4), 1024-1031 (2012).
- Wang, S., et al. Paper-based chemiluminescence ELISA: lab-on-paper based on chitosan modified paper device and wax-screen-printing. Biosens. Bioelectron. 31 (1), 212-218 (2012).
- Koev, S. T., et al. Chitosan: an integrative biomaterial for lab-on-a-chip devices. Lab Chip. 10, 3026-3042 (2010).
- Wang, S. M., et al. Simple and covalent fabrication of a paper device and its application in sensitive chemiluminescence immunoassay. Analyst. 137 (16), 3821-3827 (2012).
- Sadira, S., Prabhakaranc, M. P., Wicaksonob, D. H. B., Ramakrishna, S. Fiber based enzyme-linked immunosorbent assay for C-reactive protein. Sensor Actuat B-Chem. 205, 50-60 (2014).
- Koga, H., Kitaoka, T., Isogai, A. In situ modification of cellulose paper with amino groups for catalytic applications. J. Mater. Chem. 21, 9356-9361 (2011).
- Klemm, D., Heublein, B., Fink, H. P., Bohn, A. Cellulose: fascinating biopolymer and sustainable raw material. Angew. Chem., Int. Ed. 44 (22), 3358-3393 (2005).
- Fernandes, S. C. M., et al. Bioinspired antimicrobial and biocompatible bacterial cellulose membranes obtained by surface functionalization with aminoalkyl groups. ACS Appl. Mater. Interfaces. 5 (8), 3290-3297 (2013).
- . . Pharos FX plus molecular imager instructions, Catalog Number 170-9460. , (2005).
- Tee, Y. B., Talib, R. A., Abdan, K., Chin, N. L., Basha, R. K., Yunos, K. F. M. Aminosilane-grafted cellulose. BioResourses. 8 (3), 4468-4483 (2013).
- Xing, Y., et al. Bioconjugated quantum dots for multiplexed and quantitative immunohistochemistry. Nat Protoc. 2, 1152-1165 (2007).
- Guidi, A., Laricchia-Robbio, L., Gianfaldoni, D., Revoltella, R., Del Bono, G. Comparison of a conventional immunoassay (ELISA) with a surface plasmon resonance-based biosensor for IGF-1 detection in cows' milk. Biosens Bioelectron. 16, 971-977 (2001).
- Ahmed, S., Bui, M. N., Abbas, A. Paper-based chemical and biological sensors: Engineering aspects. Biosens Bioelectron. 77, 249-263 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved