JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
셀룰로오스 종이 디스크와 벌거 벗은 눈 색채 면역 측정법에 그들의 응용 프로그램에 항체의 결합 공유
요약
In this manuscript, periodate oxidation and glutaraldehyde cross-linking methods for covalent immobilization of antibodies on paper discs are presented. The binding activity of immobilized antibodies was evaluated. Based on these results, a glutaraldehyde cross-linking method was used to develop a novel paper-based immunoassay for immunoglobulin G (IgG) detection.
초록
이 보고서는 셀룰로오스 필터 종이 학년 1 위 (중간 흐름 여과지) 디스크 및 등급 번호 113 (빠른 흐름 여과지) 디스크에 캡처 항체의 공유 고정하는 두 가지 방법을 제시한다. 항체 그들에 고정되기 전에 이러한 셀룰로오스 종이 디스크는 실란 커플 링 기술을 통해 아민 작용기로 그래프트 하였다. 요오드 산 산화 및 글루 타르 알데히드 가교 방법은 셀룰로오스 종이 디스크에 포획 항체를 이식하는데 사용되었다. 고정화 후 목표물을 포획 항체의 최대 결합능을 보장하기 위해, 요오드 산 나트륨, 글루 타르 알데히드, 용지 디스크의 표면 상에 포획 항체의 다양한 농도의 영향을 조사 하였다. 요오 산화법에 비해 글루 타르 알데히드 가교제 통해 아민 - 작용 화 셀룰로스 페이퍼 디스크에 코팅 된 항체는 표적에 결합 활성을 강화 보였다. (마우스 혈청 참조)의 IgG는 글루 타르 알데히드를 통해 공유 적으로 고정화 된 항체의 애플리케이션을 테스트하기 위해이 연구를 기준 타겟으로서 사용 하였다. 새로운 종이 기반, 효소 면역 분석법 (ELISA)이 성공적으로 개발 및 IgG를 검출하기위한 검증 하였다. 이 방법은 장비를 필요로하지 않으며, IgG를 100 NG / ㎖를 검출 할 수있다. 고속 유동 여과지 매체 흐름 여과지보다 더 민감했다. 이 분석의 배양 기간은 짧았다 작은 샘플 볼륨이 필요합니다. 이 맨눈으로는 색채 면역 종래 ELISA로 식별되는 다른 대상을 검출하도록 확장 될 수있다.
서문
점의 케어 테스트 (POCT) 진단 연구는 치료제에 대한 새로운 전략의 개발, 맞춤 의학 및 홈 케어 1 중요합니다. 그들은 싼 접근, 사용자 2에 익숙한로 셀룰로오스 종이 널리 면역에서 플랫폼으로 사용됩니다. 또한 셀룰로스 종이의 다공성 구조는 추가적인 에너지에 영향을주지 않고, 액체 흐름을 유발할 수있는 능력을 가지고있다. 종이 기반 bioanalysis의 기록은 초기에 가장 널리 퍼진 예는 임신과 당뇨병 테스트 스트립과 같은 면역 크로마토 그래피 테스트 3, 1952 종이 크로마토 그래피에 처음 발명 된 20 세기, 같은 찾을 수 있습니다. 이 테스트는 상대적으로 빠른 분석 시간과 저렴한 분석 (4)를 제공합니다. 그들의 단순에, 이러한 종래의 종이 스트립 시험은 널리 POCT 진단 (5)에 사용되어왔다.
비색 6 전기 포함 검출 방법화학 (7) 및 (8) 전기 화학 발광 방법은 생물학적 샘플에서 표적을 측정하기 위해보고되었다. 이러한 양적 방법 이외에, 셀룰로오스 종이에 항체를 고정화하기위한 신뢰할 수있는 방법은 진단 장치의 개발이 중요하다. 비특이적 흡착 고정화 후 목표물을 최대 결합능을 보장하기 위해 종이 기반의 장치 (9), (10)의 표면 상에 항체를 수정하기위한 주요 전략이다. 그러나, 이전의 연구 셀룰로오스 종이에 흡착되는 항체가 40 %, 섬유 (11)로부터 탈착 될 수있는 것으로 나타났다. 따라서, 셀룰로오스 상에 항체의 직접 흡착 재현 가능한 결과 (12)를 제공하지 않을 수 있습니다. 종이 표면에 그라프 트되어 항체의 공유 고정화 효과 지필 생물 검정 (13)를 개발하는 다른 방법이다. 다양한 방법이 셀룰로오스 (14) (15)의 변형에 대해보고 된 . 이상적으로, 항체 고정화 (12) 후 원래의 기능을 유지해야한다. 카르 1- 시아 노 -4- 플루오로 보레이트 dimethylaminopyridinium 16과 결합; 18 UV 계 활성화 전략 17 내지 1- 플루오로 -2- 나이트로 -4- azidobenzene; 크 실로 글루칸 변성 (19)에 기초한 화학 효소 적 전략; 1,4- phenylenediisothiocyanate 링킹 에이전트 (20); 헤테로 다당류 산화 (21) 클릭 화학 (22) 양이온 포르피린 23은 공유 셀룰로오스 종이에 생체 분자를 고정하기 위해 사용되어왔다. 키토산 수정 용지가 풍부하고 27 생체 적합성 때문에 종이 기반 immunodevices 24-26을 개발하는 데 사용되었습니다. 키토산은 양이온과 음이온 셀룰로오스 (27)에 강력하게 준수합니다. 캡처 항체는 키토산 코팅 및 글루 타르 알데히드 가교를 통해 종이에 고정된다. 요오드 산화는 대위를 접목하는 또 다른 방법이다셀룰로오스 종이 (28)에 URE 항체. 이 방법에서, 소듐 페리오 데이트는 알데히드기 직접 셀룰로오스 1,2- 디 히드 록시 (글리콜) 그룹을 변환하는 종이 발견된다. 알데히드 그룹은 다당류 및 항체 (28) 사이에 공유 결합을 형성하기 위해 사용된다. 제조가 간단하지만, 완전히 요오드 산 나트륨을 세척하는 것은 어렵다. 미세 정 요오드 산 나트륨은 항체의 활성 및 안정성에 영향을 셀룰로오스 종이에 고정화 된 항체의 추가적인 산화를 일으킬 수 N을 -. (3- 디메틸 아미노 프로필) - N 다이이 미드 하이드로 클로라이드 및 N -hydroxysuccinimide 크로스 링커들도 사용되어 공유 나노 기반 분석 (29)의 발전을위한 전기 방사 폴리 L 락트산과 셀룰로오스 아세테이트 나노 파이버에 항체를 고정시킨다.
이 연구에서, 실란 커플 링 기술은 cellulos에 아민 작용기를 접목하는 데 사용전자 종이 디스크. 이 기술은 최대 세로 관류의 면역 있도록 원래의 기공 크기, 위킹 및 셀룰로스 여과지 여과 속도를 유지하도록 돕는다. 실란 커플 링 기술은 널리 다른 변형하여 생체이어서, 2 급 아민기를 갖는 기판의 표면을 기능화하는 바이오 센서에 사용되어왔다. 매트릭스 표면에 아민 기의 그 래프팅은 -OH 능성 실란 에이전트 그룹 및 매트릭스 기판 (30) 사이의 축합 반응을 포함한다. 셀룰로오스 종이 디스크 3- 아미노 프로필 트리 메 톡시 실란 (APS) 31 실란 커플 링에 의해 아민기로 작용 화 하였다. 이것은 두 가지 방법을 사용하여 공유 고정화 캡처 항체으로 이어졌습니다. 첫 번째 방법은 아민 관능 화 셀룰로스 페이퍼 디스크에 요오드 산화 캡쳐 항체의 결합을 포함했다. 두 번째 방법은 캡처 antibodi를 연결하는 가교 결합제로서 글루 타르 알데하이드를 사용아민 그룹 기능화 셀룰로오스 종이 디스크에 말이지. 포획 항체의 존재는, 형광 분자, 이미 저를 사용하여, 토끼 항 - 인간 IgG-형광 염료 (FITC)에 의해 확인 하였다. 항 - 토끼 IgG의 염소를 위해 토끼 항 - 인간 IgG-FITC의 결합 활성은 퍼 옥시 다제 기질로 평가 하였다. 과 요오드 산 나트륨, 글루 타르 알데히드 및 포획 항체의 다양한 농도의 효과를 조사 하였다. 고정화 된 포획 항체의 애플리케이션 테스트가 성공적 IgG의 혈청의 검출을 수행 하였다.
프로토콜
셀룰로오스 종이 디스크 1. 손톱 아민 기능성 그룹
- 구멍 펀치를 사용하여 6.0 mm (중간 흐름 여과지)의 직경 급 1 위 셀룰로오스 종이로 만든 1cm × 1cm, 100 종이 디스크의 차원과 정사각형 종이 한 장을 준비합니다.
- 용지에 디스크 -NH 2기를 유도 퓸 후드에서 50 ml의 유리 병에 1 ml의 APS에 10 ml의 아세톤을 혼합한다. 새롭게 준비 APS 시약 혼합물에 종이 디스크를 추가하고, 실온 (32)의 궤도 교반 (200 rpm으로) 5 시간 동안 배양한다.
주의 : 흄 후드에서 APS 및 아세톤을 처리합니다. - 유기 폐기물 용기에 50 ml의 유리 병에서 과잉 용액을 경사 분리한다.
- 유리 병에 아세톤 10 mL를 추가 잘 혼합하고 반응 APS 및 기타 불순물을 제거하기 위해 디 캔트 완전히. 이 단계를 두 번 반복합니다.
- 3 시간 동안 110 ℃로 오븐에서 종이 타월과 장소에서 용지 디스크 확산. 허용종이 디스크는 냉각합니다. 실온에서 50 mL의 원심 분리 튜브 내의 디스크 저장한다.
- 아래의 (그림 3A)에 설명 된 바와 같이, 셀룰로오스 정사각형 종이에 아민 그룹의 접목을 확인하기 위해 적외선 분광기 (FTIR)를 푸리에 변환을 사용합니다.
- 컴퓨터를 켜고 FTIR 분광 악기를 엽니 다.
- FTIR 스펙트럼을위한 소프트웨어를 엽니 다.
- '측정 → 초기화'로 이동합니다. 'BS : KBr을'의 직사각형 : 초기화가 완료되면 '램프 적외선'과 '레이저'는 녹색으로 바뀝니다.
- 사각형 아래에 '데이터'를 선택하고 '% 투과율', '햅 - 겐젤', '45', '4.0'및 '최소 400, 최대 : 4000'선택 '측정 모드'를 들어, '아포 다 이즈', ' 아니. 스캔 ','해상도 '와'범위 (cm-1) '의.
- '측정'을 클릭합니다.
- 백그라운드 데이터 '데이터 파일'을 선택합니다. 쓰다코멘트 아래로.
- 배경에 대한 기준을 얻기 위해 'BKG'을 클릭합니다.
- 필름 샘플 홀더에 정사각형 종이를 수정합니다.
- 샘플 데이터를 '데이터 파일'을 선택합니다. 주석을 기록합니다.
- 샘플의 스펙트럼을 얻기 위해 '샘플'을 클릭합니다.
- FTIR 분광학 응용 프로그램을 닫고 컴퓨터의 전원을 끄십시오.
- 위의 단계를 (1.6-1.1 단계) 아민 작용 등급 번호 (113) 셀룰로오스 정사각형 종이 및 디스크 (빠른 흐름 여과지)를 제조하는 반복 한 학년 제 113 정사각형 종이 (그림 3B)에 대한 FTIR 스펙트럼을 얻을 수 있습니다.
아민 기능화 된 셀룰로오스 종이 디스크에 항체 2. 공유 결합 고정화
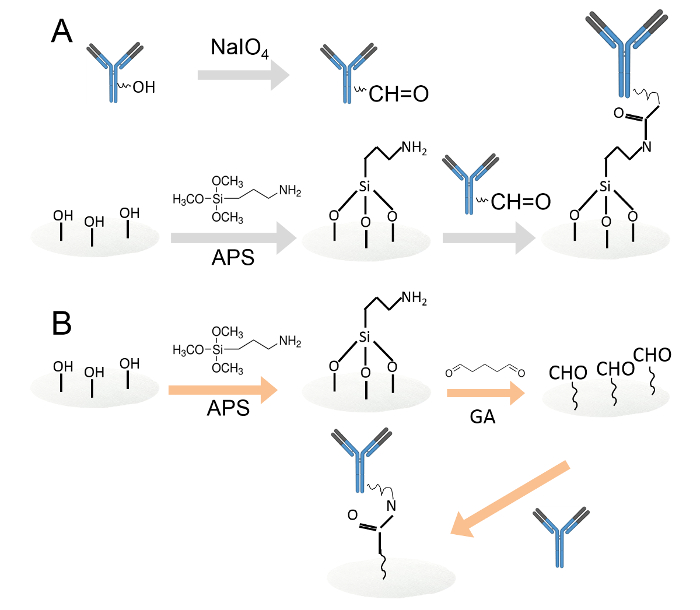
두 가지 다른 방법에 의해 항체 고정화 1. 공유 결합도.를했다. 요오드 산화를 통해 아민 작용 셀룰로오스 종이 디스크에 고정 항체. 탄수화물 잔기의 알데히드 작용기를 생성하는과 요오드 산 나트륨에 의해 산화했다. 그리고, 산화 된 항체는 아민 기능화 셀룰로오스 종이 디스크 상에 로딩 하였다. B한다. 항체는 다음 글루 타르 알데히드를 통해 아민 작용 셀룰로오스 종이 디스크에 고정되었다. 아민 작용 화 셀룰로스 종이 디스크 페이퍼 디스크에 알데히드기를 도입 0.05 % 글루 타르 알데히드 수용액에 침지 하였다. 세척 후, 항체 알데히드 작용 종이 디스크에로드 하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 요오드 산화 (그림 1A)를 통해 아민 작용 셀룰로오스 종이 디스크에 항체를 고정.
- 2.5 mM의 나트륨 perioda 1 μl를 혼합0.1 mg을 2 μL와 TE / ㎖의 토끼의 IgG-FITC 항 인간 및 1.5 ㎖의 튜브를 100mm의 pH를 5.5 초산 완충액 7 μL, 30 분 동안 어두운 데에서 상기 혼합물을 배양한다.
참고 : 필요한 경우 더 산화 된 항체를 준비하기 위해이 볼륨 비율을 따릅니다. 과 요오드 산 나트륨 및 토끼 항 - 인간 IgG-FITC의 농도를 최적화하기 위해 체적 비율을 변경한다. - (이 pH 7.4 PBS) 40 μL의 최종 부피의 50 mM 인산염 완충 식염수를 30 μL로 상기 항체 용액을 희석.
- 세 아민 관능 매체 흐름 여과지 디스크 및 (섹션 1에서 설명) 세 아민 기능화 패스트 플로우 페이퍼 디스크를 준비한다.
- 로드 각 매체 흐름 여과지 디스크에과 요오드 산 나트륨으로 산화 토끼 항 - 인간 IgG-FITC 5 μL를 각각의 빠른 흐름 여과지 디스크에 8 μL. 실온에서 1 시간 동안 어둠 속에서 이들 페이퍼 디스크를 유지한다.
- 세척 버프 0.2 ml의 종이 디스크의 각을 씻으십시오ER (50mM 트리스 0.15 M 염화나트륨 및 0.05 %의 계면 활성제, pH를 7.4로 버퍼). 세탁 세 번 반복합니다.
- 각 셀룰로스 페이퍼 디스크 (32) 상에 항체의 존재를 확인하기 형광 분자 이미 저를 통해 형광 이미지의 사진. (S3 그림도 S1)로서 제어부 (요오드 산 나트륨의 부재 하에서 항체를 동일한 농도로 처리) 빈 페이퍼 디스크를 사용한다.
참고 실험 최적화 최적화 및 기타 모든 파라미터들의 농도를 해결해야 할 하나의 파라미터의 농도를 변경. 높은 형광 강도는 셀룰로스 페이퍼 디스크에 고정화 캡쳐 항체의 양을 증가시킨다.
- 2.5 mM의 나트륨 perioda 1 μl를 혼합0.1 mg을 2 μL와 TE / ㎖의 토끼의 IgG-FITC 항 인간 및 1.5 ㎖의 튜브를 100mm의 pH를 5.5 초산 완충액 7 μL, 30 분 동안 어두운 데에서 상기 혼합물을 배양한다.
- 글루 타르 알데히드 (그림 1B)를 통해 아민 작용 셀룰로오스 종이 디스크에 항체를 고정.
- 세 APS 처리 매체 흐름 여과지 디스크 및 세 빠른 흐름 여과지 디스크를 추가 (DES실온에서 공전 교반하면서 1 시간 동안 0.05 %의 글루 타르 알데히드를 포함의 50 mM PBS (PH 7.4) 2 ㎖에 1 장)에 cribed.
주의 : 흄 후드에서 글루 타르 알데히드를 처리합니다. - 이 1.5 ml의 원심 분리기 튜브에 세 개의 디스크를 각각 배치합니다. 각 튜브에 탈 이온수 (DI) 물 1 ML을 추가하고 10 초 동안 튜브를 흔들. 피펫으로 흡입하여 물을 제거합니다. 어떤 반응 글루 타르 알데히드를 제거하기 위해 두 번 더 반복합니다.
- 로드 (5) 각각의 알데히드 - 관능 매체 흐름 여과지 디스크에 25 μg의 / ㎖의 토끼 항 - 인간 IgG-FITC (포획 항체)의 μL, 각각 알데히드 - 관능 빠른 흐름 여과지 디스크에 8 μL를 추가한다. 실온에서 약 20 분 동안 어두운 데에서 인큐베이션. 이어서, 항체를 제거하지 않고 각각 종이 디스크로의 50 mM PBS (PH 7.4)의 10 μL를 추가 아민 알데히드 반응을 40 분 동안 배양한다.
- 종이 타월 위에 세척 버퍼의 0.2 ml의 종이 디스크를 씻으십시오. 반복두 번 씻는다.
- 각 셀룰로스 종이 디스크 (33)에 대한 항체의 존재를 확인하기 위해, 이미 저 분자량 형광을 형광 영상 사진. 대조군으로 빈 종이 디스크를 사용합니다.
참고 :도 4에서, '0'글루 타르 알데히드의 부재하에 FITC 항체를 동일한 농도로 처리 하였다 백지 디스크을 나타내며; 도 5a에서, 빈 종이 디스크는 글루 타르 알데히드로 처리되지만-FITC 항체 페이퍼 디스크에로드되지 않았다.
- 세 APS 처리 매체 흐름 여과지 디스크 및 세 빠른 흐름 여과지 디스크를 추가 (DES실온에서 공전 교반하면서 1 시간 동안 0.05 %의 글루 타르 알데히드를 포함의 50 mM PBS (PH 7.4) 2 ㎖에 1 장)에 cribed.
- 10 분 동안 37 ° C에서 (섹션 2.1 및 2.2)에서 용지 디스크를 닦아냅니다.
- 블로킹 완충액 15 μL와 페이퍼 디스크를 차단하고 실온에서 10 분 동안 (10 % 0.15 M NaCl로 50 mM 트리스 완충액, pH 7.4의 분유 탈지).
- 로드 및 5 μL의 PBS 과산화 효소 접합 염소 항 - 토끼 IgG를 8 μL (1 : 10,000) 각각 매체 흐름 및 고속 유동 여과지 디스크 상에. 알을 품다실온에서 어두운 곳에서 30 분간.
- 종이 타월 위에 세척 버퍼의 0.2 ml의 종이 디스크를 씻으십시오. 세탁 세 번 반복합니다.
주 :이 결과가 버퍼에 의해 영향을받지 않는 것처럼 세척 완충액을 제거 할 필요가 없다. - 각 디스크에 3,3 ', 5,5'- 테트라 메틸 벤지딘 (TMB)과 과산화수소 용액 10 ㎕의 혼합물을로드.
- 배양의 5 분 후 디지털 카메라 나 스마트 폰으로 종이 디스크의 이미지를 가져 가라.
참고 :도 5b에, '0'항체 HRP (홀스 래 디쉬 퍼 옥시다아제) FITC 항체의 부재 접합체를 로딩 하였다 글루 타르 알데히드로 처리 한 페이퍼 디스크, 약자.
3. IgG의 검출을위한 ELISA를 종이 기반
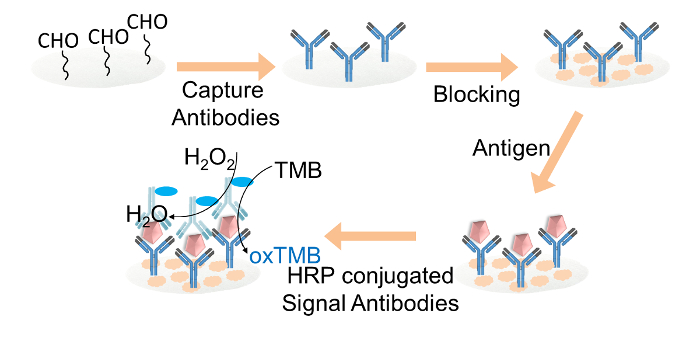
종이 기반의 ELISA FO 그림 2. 도식 표현R IgG의 검출. 캡처 항체는 공유 글루 타르 알데히드를 통해 알데히드 기능화 된 셀룰로오스 종이 디스크에 고정되었다. 셀룰로오스 종이 디스크 블록킹 완충액 (blocking buffer). 대상의 IgG는 HRP 컨쥬 게이트 신호 항체를 로딩 한 다음, 디스크에 첨가 하였다. 마지막으로, TMB과 과산화수소 혼합물 솔루션은 컬러 판독에 대한 각 용지 디스크에로드했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 20 ㎖의 유리 병 (50 mM의 PBS 완충액, pH 7.4의 제조) 0.05 % 글루 타르 알데히드 용액 5 mL를 추가한다. 이 솔루션 15 아민 기능화 중간 흐름 필터 종이 디스크를 담그고 실온에서 진탕 1 시간 동안 유지한다.
- 동시에, 단계를 반복 3.1 다른 15 알데히드 작용 빠른 흐름 필터 종이 디스크를 준비합니다.
주의 : 연기에 글루 타르 알데히드를 처리후드.
- 동시에, 단계를 반복 3.1 다른 15 알데히드 작용 빠른 흐름 필터 종이 디스크를 준비합니다.
- 페이퍼 디스크에서 미 반응의 글루 타르 알데히드를 제거하고, 또 다른 15 mL의 원심 분리 튜브에 15 mL의 원심 분리 튜브 내의 15 중간 흐름 여과지 디스크, 15 빠른 흐름 여과지 디스크를 배치했다. 각 튜브에 DI 물 5 ㎖를 추가하고 10 초 동안 튜브를 흔들. 피펫으로 흡입하여 물을 제거합니다. 어떤 반응 글루 타르 알데히드를 제거하기 위해 두 번 반복합니다.
- 37 ° C 오븐에서 용지 디스크를 닦아냅니다.
- 5 μL를 각각 매체 흐름 및 고속 유동 여과지 디스크, 각각 0.025 ㎎ / ㎖ 마우스 IgG-Fc 단편 항체 8 μL를 추가하고, 20 분 동안 배양한다.
- 항체를 제거하지 않고 각각 종이 디스크로의 50 mM PBS (PH 7.4) 10 μl를 첨가하고 아민 알데히드 반응을 40 분 동안 배양한다.
- 종이 타월 위에 세척 버퍼의 0.2 ml의 종이 디스크를 씻으십시오. 세탁 세 번 반복합니다.
- 37 ° C의 오븐에서 페이퍼 디스크를 건조.
- w 용지 디스크를 차단실온에서 10 분간 차단 완충액 15 μL의 제 i.
- 종이 타월 위에 세척 버퍼의 0.2 ml의 각 용지 디스크를 씻으십시오. 세탁 세 번 반복합니다.
- IgG의 표준을 실행합니다.
- 로드 IgG를 다양한 농도 10 μL (예를 들어, 0, 10, 125, 250, 500 ng를 / PBS에서의 ㎖) 중으로의 각 디스크에. 실온에서 1 시간 동안 인큐베이션.
- 종이 타월 위에 세척 버퍼의 0.2 ml의 종이 디스크를 씻으십시오. 세탁 세 번 반복합니다.
- 로드 (10) HRP 접합 마우스 IgG-Fc 단편 항체 (1 : 10,000, 10 mM의 PBS, pH 7.4의)의 μL 및 실온에서 1 시간 동안 배양한다.
- 종이 타월 위에 세척 버퍼의 0.2 ml의 종이 디스크를 씻으십시오. 세탁 세 번 반복합니다.
주 :이 결과가 버퍼의 존재에 의해 영향을받지 않는 것처럼 세척 완충액을 제거 할 필요가 없다. - 각각의 디스크 상에 TMB의 10 μl의 혼합물과 과산화수소를로드합니다.
- 티배양의 5 분 후 디지털 카메라 나 스마트 폰으로 모든 종이 디스크 아케 이미지.
참고 : 그림 6A에서 '0'캡처 항체 고정화 처리 한 종이 디스크를 의미하고, IgG의 혈청없이 항체 HRP / TMB 솔루션입니다. - J. 이미지로 이미지에서 각각 종이 디스크의 강도를 분석
- '이 .tif'형식으로 단계 3.15에서 촬영 한 이미지를 변환합니다.
- 열기 '이미지 J'소프트웨어.
- '파일 → 열기'로 이동하여 분석 할 이미지를 선택합니다.
- 모양 버튼 '타원형'를 선택합니다.
- '이미지 → 형 → 32 비트'로 이동합니다.
- '편집 → 반전'로 이동합니다.
- '→ 측정 분석'으로 이동합니다.
- 복사 및 스프레드 시트의 데이터를 분석 할 수 있습니다.
결과
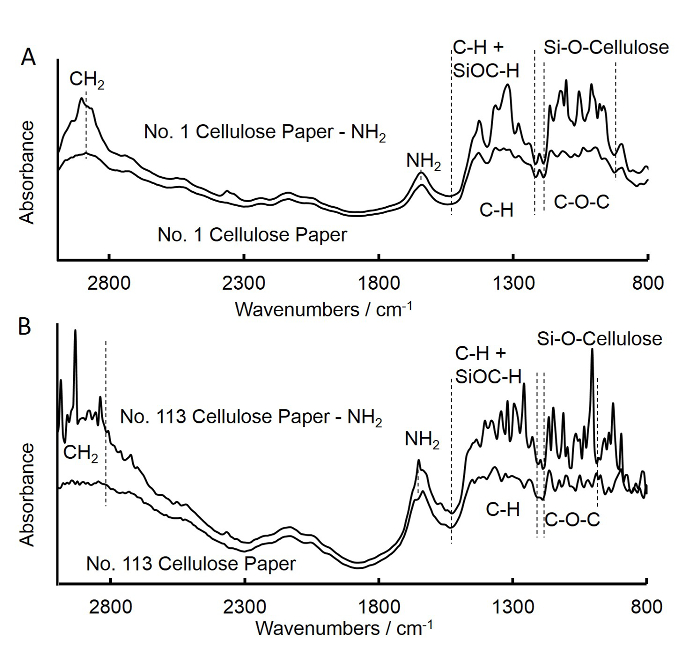
도 3 푸리에 치료 및 APS 처리 매체 흐름 필터 사각형 용지 (A) 및 고속 유동 필터 정사각형 종이 (B). (A)의 적외선 (FTIR) 스펙트럼을 변환. 미처리 매체 흐름 필터 사각형 종이의 스펙트럼은 APS 처리 매체가 흐르는 필터 사각형 종이의 것과 유사 하였다. 902-1,170 cm -1 1,210-1,500 cm...
토론
변성 셀룰로오스 종이 디스크의 친 화성 정제 된 염소 항 - 마우스 IgG-FC 캡쳐 항체의 직접적인 코팅은 IgG의 농도를 검출 하였다. 결과는 포획 항체의 추가 고정은 재현성이 요구되는 것으로 나타났다. 실란 기술이 성공적 셀룰로오스 종이 디스크 (34)에 아민 작용기를 도입하는 데 사용 하였다. APS의 농도는 항체의 고정화에 영향을 미친다. 따라서, 아세톤 APS의 양도 최적화 하였다. 아세톤 ...
공개
The authors have nothing to disclose.
감사의 말
This work was financially supported by the Ministry of Education, Singapore through the Translational and Innovation Grant (MOE2012-TIF-2-G-009).
자료
| Name | Company | Catalog Number | Comments |
| Cellulose filter paper, Grade 1 (medium flow filter paper) | GE Healthcare Pte Ltd Singapore | 1001 110 | |
| Cellulose filter paper, Grade 113 (Fast flow filter paper) | Sigma-Aldrich, Singapore | 1113-320 | |
| Glutaraldehyde | Sigma-Aldrich, Singapore | G6257 | Grade II, 25% in H2O |
| Surfactant | Tween-20, Sigma-Aldrich, Singapore | P2287 | |
| Bovine serum album | Sigma-Aldrich, Singapore | A2153 | |
| Skimmed milk powder | Louis François | Packed by Kitchen Capers, Singapore | |
| Tris base | Promega | H5135 | |
| Sodium periodate | Merck | 106597 | |
| Na2HPO4 | Merck | 106585 | |
| KH2PO4 | Merck | 104873 | |
| NaCl | CALBIOCHEM | 567441 | |
| NaOH | Merck | 106462 | |
| HCl | Merck | 100317 | |
| phosphate buffer saline (PBS) | N/A | N/A | PBS, containing 137 mmol/L NaCl, 2.7 mmol/L KCl, 8.0 mmol/L Na2HPO4 and 1.5 mmol/L KH2PO4, is prepared with water and adjusted to pH 7.4 with 0.1 mol/L NaOH or 0.1 mol/L HCl |
| Acetone | Tee Hai Chem Pte Ltd Singapore | 9005-68 | |
| Mixture of TMB and hydrogen peroxide solution | 1-Step ultra TMB-ELISA solution , Thermo Scientific Pierce | 34029 | 1 L |
| Rabbit anti-human IgG-FITC | TWC/Bio Pte Ltd Singapore | sc-2278 | |
| Peroxidase conjugated goat anti-rabbit IgG | TWC/Bio Pte Ltd Singapore | sc-2030 | |
| Affinity purified goat anti-Mouse IgG-Fc coating antibody | Bethyl Laboratories, Inc | A90-131A | |
| Mouse reference serum | Bethyl Laboratories, Inc | RS10-101-5 | 9.5 mg/ml |
| HRP conjugated goat anti-mouse IgG-Fc detection antibody | Bethyl Laboratories, Inc | A90-131P | |
| Equipment | |||
| Fourier transform infrared spectrophotometer | Shimadzu IR Prestige-21 | N/A | |
| Fluorescence molecular imager | Pharos FXTM plus molecular imager, Bio-Rad, Singapore | N/A | |
| Oven | NUVE FN500 | N/A | |
| Turbo mixer VM-2000 | MYC LTD | N/A | |
| ImageJ | RGB, free download | N/A |
참고문헌
- Curtis, K. A., Rudolph, D. L., Owen, S. M. Rapid detection of HIV-1 by reverse-transcription, loop-mediated isothermal amplification (RT-LAMP). J. Virol. Methods. 151 (2), 264-270 (2008).
- Martinez, A. W., Phillips, S. T., Carrilho, E., Thomas, S. W., Sindi, H., Whitesides, G. M. Simple telemedicine for developing regions: camera phones and paper-based microfluidic devices for real-time, off-site diagnosis. Anal. Chem. 80 (10), 3699-3707 (2008).
- Lode, P. V. Point-of-care immunotesting: approaching the analytical performance of central laboratory methods. Clin. Biochem. 38 (7), 591-606 (2005).
- Posthuma-Trumpie, G. A., Amerongen, A. V., Korf, J., Berkel, W. J. V. Perspectives for on-site monitoring of progesterone. Trends Biotechnol. 27 (11), 652-660 (2009).
- Lim, D. V., Simpson, J. M., Kearns, E. A., Kramer, M. F. Current and developing technologies for monitoring agents of bioterrorism and biowarfare. Clin. Microbiol. Rev. 18 (4), 583-607 (2005).
- Li, X., Tian, J., Shen, W. Progress in patterned paper sizing for fabrication of paperbased microfluidic sensors. Cellulose. 17 (3), 649-659 (2010).
- Nie, Z., et al. Electrochemical sensing in paper-based microfluidic devices. Lab Chip. 10, 477-483 (2010).
- Delaney, J. L., Hogan, C. F., Tian, J., Shen, W. Electrogenerated chemiluminescence detection in paper-based microfluidic sensors. Anal. Chem. 83 (4), 1300-1306 (2011).
- Oh, Y. K., Joung, H. A., Kim, S., Kim, M. G. Vertical flow immunoassay (VFA) biosensor for a rapid one-step immunoassay. Lab Chip. 13 (5), 768-772 (2013).
- Cheng, C. M., et al. Paper-based ELISA. Angew. Chem. 122 (28), 4881-4884 (2010).
- Jarujamrus, P., Tian, J., Li, X., Siripinyanond, A., Shiowatana, J., Shen, W. Mechanisms of red blood cells agglutination in antibody-treated paper. Analyst. 137 (9), 2205-2210 (2012).
- Credou, J., Volland, H., Dano, J., Berthelot, T. A one-step and biocompatible cellulose functionalization for covalent antibody immobilization on immunoassay membranes. J. Mat. Chem. B. 1, 3277-3286 (2013).
- Kong, F., Hu, Y. F. Biomolecule immobilization techniques for bioactive paper fabrication. Anal. Bioanal. Chem. 403, 7-13 (2012).
- Orelma, H., Teerinen, T., Johansson, L. S., Holappa, S., Laine, J. CMC-modified cellulose biointerface for antibody conjugation. Biomacromolecules. 13, 1051-1058 (2013).
- Yu, A., et al. Biofunctional paper via covalent modification of cellulose. Langmuir. 28 (30), 11265-11273 (2012).
- Stollner, D., Scheller, F. W., Warsinke, A. Activation of cellulose membranes with 1,1′-carbonyldiimidazole or 1-cyano-4-dimethylaminopyridinium tetrafluoroborate as a basis for the development of immunosensors. Anal Biochem. 304 (2), 157-165 (2002).
- Bora, U., Sharma, P., Kannan, K., Nahar, P. Photoreactive cellulose membrane - a novel matrix for covalent immobilization of biomolecules. J. Biotechnol. 126 (2), 220-229 (2006).
- Sharma, P., Basir, S. F., Nahar, P. Photoimmobilization of unmodified carbohydrates on activated surface. J Colloid Interface Sci. 342 (1), 202-204 (2010).
- Brumer, H., Zhou, Q., Baumann, M. J., Carlsson, K., Teeri, T. T. Activation of crystalline cellulose surfaces through the chemoenzymatic modification of xyloglucan. J. Am. Chem. Soc. 126 (18), 5715-5721 (2004).
- Araujo, A. C., Song, Y., Lundeberg, J., Stahl, P. L., Brumer, H. Activated paper surfaces for the rapid hybridization of DNA through capillary transport. Anal Chem. 84 (7), 3311-3317 (2012).
- Xu, C., Spadiut, O., Araujo, A. C., Nakhai, A., Brumer, H. Chemo-enzymatic Assembly of Clickable Cellulose Surfaces via Multivalent Polysaccharides. ChemSusChem. 5 (4), 661-665 (2012).
- Filpponen, I., et al. Generic method for modular surface modification of cellulosic materials in aqueous medium by sequential "click" reaction and adsorption. Biomacromolecules. 13 (3), 736-742 (2012).
- Feese, E., Sadeghifar, H., Gracz, H. S., Argyropoulos, D. S., Ghiladi, R. A. Photobactericidal porphyrin-cellulose nanocrystals: synthesis, characterization, and antimicrobial properties. Biomacromolecules. 12 (10), 3528-3539 (2011).
- Zang, D., Ge, L., Yan, M., Song, X., Yu, J. Electrochemical immunoassay on a 3D microfluidic paper-based device. Chem. Commun. 48 (39), 4683-4685 (2012).
- Ge, L., Yan, J. X., Song, X. R., Yan, M., Ge, S. J., Yu, J. H. Three-dimensional paper-based electrochemiluminescence immunodevice for multiplexed measurement of biomarkers and point-of-care testing. Biomaterials. 33 (4), 1024-1031 (2012).
- Wang, S., et al. Paper-based chemiluminescence ELISA: lab-on-paper based on chitosan modified paper device and wax-screen-printing. Biosens. Bioelectron. 31 (1), 212-218 (2012).
- Koev, S. T., et al. Chitosan: an integrative biomaterial for lab-on-a-chip devices. Lab Chip. 10, 3026-3042 (2010).
- Wang, S. M., et al. Simple and covalent fabrication of a paper device and its application in sensitive chemiluminescence immunoassay. Analyst. 137 (16), 3821-3827 (2012).
- Sadira, S., Prabhakaranc, M. P., Wicaksonob, D. H. B., Ramakrishna, S. Fiber based enzyme-linked immunosorbent assay for C-reactive protein. Sensor Actuat B-Chem. 205, 50-60 (2014).
- Koga, H., Kitaoka, T., Isogai, A. In situ modification of cellulose paper with amino groups for catalytic applications. J. Mater. Chem. 21, 9356-9361 (2011).
- Klemm, D., Heublein, B., Fink, H. P., Bohn, A. Cellulose: fascinating biopolymer and sustainable raw material. Angew. Chem., Int. Ed. 44 (22), 3358-3393 (2005).
- Fernandes, S. C. M., et al. Bioinspired antimicrobial and biocompatible bacterial cellulose membranes obtained by surface functionalization with aminoalkyl groups. ACS Appl. Mater. Interfaces. 5 (8), 3290-3297 (2013).
- . . Pharos FX plus molecular imager instructions, Catalog Number 170-9460. , (2005).
- Tee, Y. B., Talib, R. A., Abdan, K., Chin, N. L., Basha, R. K., Yunos, K. F. M. Aminosilane-grafted cellulose. BioResourses. 8 (3), 4468-4483 (2013).
- Xing, Y., et al. Bioconjugated quantum dots for multiplexed and quantitative immunohistochemistry. Nat Protoc. 2, 1152-1165 (2007).
- Guidi, A., Laricchia-Robbio, L., Gianfaldoni, D., Revoltella, R., Del Bono, G. Comparison of a conventional immunoassay (ELISA) with a surface plasmon resonance-based biosensor for IGF-1 detection in cows' milk. Biosens Bioelectron. 16, 971-977 (2001).
- Ahmed, S., Bui, M. N., Abbas, A. Paper-based chemical and biological sensors: Engineering aspects. Biosens Bioelectron. 77, 249-263 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유