Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Covalente La unión de anticuerpos a los discos de papel de celulosa y sus aplicaciones en-simple vista colorimétricos inmunoensayos
En este artículo
Resumen
In this manuscript, periodate oxidation and glutaraldehyde cross-linking methods for covalent immobilization of antibodies on paper discs are presented. The binding activity of immobilized antibodies was evaluated. Based on these results, a glutaraldehyde cross-linking method was used to develop a novel paper-based immunoassay for immunoglobulin G (IgG) detection.
Resumen
Este informe presenta dos métodos para la inmovilización covalente de anticuerpos de captura en papel de filtro de celulosa de grado N ° 1 (papel de filtro de flujo medio) y discos de grado Nº 113 (papel de filtro de flujo rápido) discos. Estos discos de papel de celulosa fueron injertados con grupos funcionales de amina a través de una técnica de acoplamiento de silano antes de que los anticuerpos se inmovilizan sobre ellos. métodos de reticulación periodato de oxidación y glutaraldehído fueron utilizados para injertar anticuerpos de captura en los discos de papel de celulosa. A fin de garantizar la capacidad de unión máxima de los anticuerpos de captura a sus objetivos después de la inmovilización, se investigaron los efectos de diversas concentraciones de peryodato de sodio, glutaraldehído, y anticuerpos de captura en la superficie de los discos de papel. Los anticuerpos que se recubrieron sobre los discos de papel de celulosa funcionalizada con amina a través de un agente de entrecruzamiento con glutaraldehído mostraron una mayor actividad de unión a la diana en comparación con el método de oxidación con peryodato. IgG (en suero de referencia de ratón) se utilizó como un objetivo de referencia en este estudio para probar la aplicación de anticuerpos inmovilizados covalentemente a través de glutaraldehído. Un nuevo, ensayo de inmunoabsorción ligado a enzimas basado en papel (ELISA) se desarrolló con éxito y validada para la detección de IgG. Este método no requiere un equipo, y puede detectar 100 ng / ml de IgG. El papel de filtro de flujo rápido era más sensible que el papel de filtro de flujo medio. El período de incubación de este ensayo fue corta y requiere volúmenes de muestra pequeños. Este simple vista, inmunoensayo colorimétrico puede extenderse para detectar otros objetivos que se identifican con ELISA convencional.
Introducción
El estudio de diagnóstico de la prueba de punto de atención (POCT) es importante para el desarrollo de nuevas estrategias para la terapéutica, la medicina personalizada y la atención domiciliaria 1. Papeles de celulosa son ampliamente utilizados como plataformas en inmunoensayos, ya que son baratos, accesible y familiar para los usuarios 2. Además, la estructura porosa del papel de celulosa posee la potencia para impulsar el flujo de líquido sin impacto adicional de energía. Los registros de bioanálisis en papel se pueden encontrar ya en el siglo 20, cuando la cromatografía en papel fue inventado por primera vez en 1952. El ejemplo más frecuente es pruebas de inmunocromatografía 3, tales como tiras de prueba de embarazo y la diabetes. Estas pruebas proporcionan tiempos de ensayo relativamente rápido y barato análisis 4. Debido a su simplicidad, estas pruebas tira de papel convencionales se han usado ampliamente en el diagnóstico POCT 5.
Los métodos de detección colorimétrica incluyendo 6, electroSe han reportado químicos 7, y 8 de electroquimioluminiscencia métodos para medir los objetivos en muestras biológicas. Además de estos métodos cuantitativos, un método fiable para la inmovilización de anticuerpos sobre papel de celulosa también es importante para el desarrollo de dispositivos de diagnóstico. La adsorción no específica es la principal estrategia para la modificación de anticuerpos en la superficie de los dispositivos basados en papel 9, 10 para asegurar la capacidad de unión máxima a sus objetivos después de la inmovilización. Sin embargo, un estudio previo mostraron que los anticuerpos que se adsorben sobre papel de celulosa pueden desorber de las fibras 11 en un 40%. Por lo tanto, la adsorción directa de anticuerpos en celulosa no puede proporcionar resultados reproducibles 12. La inmovilización covalente de anticuerpos que se injertan en las superficies de papel es un método alternativo de desarrollo de bioensayos eficaces basados en papel 13. Varios métodos han sido reportados para la modificación de celulosa 14, 15 . Idealmente, los anticuerpos deben mantener su funcionalidad original después de la inmovilización 12. Carbonildiimidazol combina con tetrafluoroborato de 1-ciano-4-dimetilaminopiridinio 16; 1-fluoro-2-nitro-4-azidobenzene a través de una estrategia de activación a base de UV 17, 18; chemoenzymatic una estrategia basada en la modificación xiloglucano 19; un agente de enlace 1,4-phenylenediisothiocyanate 20; heteropolisacárido oxidación química clic 21 22; y porfirinas catiónicas 23 se han utilizado para inmovilizar covalentemente biomoléculas sobre papel de celulosa. Papel modificado Chitosan se ha utilizado para desarrollar immunodevices en papel 24-26 ya que es abundante y biocompatible 27. El quitosano es catiónico y se adhiere fuertemente a celulosa aniónico 27. Los anticuerpos de captura se inmovilizan sobre el papel a través de revestimiento de quitosano y entrecruzamiento con glutaraldehído. La oxidación del peryodato es otro método para injertar la captanticuerpos ure en el papel de celulosa 28. En este método, peryodato de sodio es descubierto en el papel para convertir grupos 1,2-dihidroxilado (glicol) en celulosa directamente a grupos aldehído. Los grupos aldehído se utilizan entonces para formar enlaces covalentes entre polisacáridos y anticuerpos 28. Aunque la fabricación es simple, es difícil de lavar completamente fuera de peryodato de sodio. El peryodato sódico sin lavar puede causar oxidación adicional de los anticuerpos que están inmovilizados sobre el papel de celulosa, que afectan a la actividad y la estabilidad de los anticuerpos N -. (3-dimetilaminopropil) - N hidrocloruro de etilcarbodiimida y N hidroxisuccinimida reticulantes también se utilizan para covalentemente inmovilizar anticuerpos en ácido y de acetato de celulosa nanofibras de poli-L-láctico electrospun para el desarrollo de ensayos basados en nanofibras 29.
En este estudio, se utilizó una técnica de acoplamiento de silano para injertar grupos funcionales de amina en cellulosdiscos de papel e. Esta técnica ayuda a retener el tamaño original de poros, efecto de mecha, y la tasa de filtración de los papeles de filtro de celulosa, lo que permite un máximo de inmunoensayos de flujo continuo en verticales. La técnica de acoplamiento de silano ha sido ampliamente utilizado en los biosensores para funcionalizar superficies de sustrato con grupos amina secundaria, seguido de la modificación adicional utilizando biomoléculas. El injerto de grupos amina en la superficie de la matriz comprende una reacción de condensación entre grupos -OH de los agentes de silano organofuncional y el sustrato de la matriz 30. Los discos de papel de celulosa fueron funcionalizados con grupos amino de acoplamiento de silano a través de 3-aminopropiltrimetoxisilano (APS) 31. Esto fue seguido por anticuerpos de captura covalentemente inmovilización utilizando dos métodos diferentes. El primer método implicó la unión de anticuerpos de captura oxidados con peryodato de los discos de papel de celulosa de amina funcionalizado. El segundo método usa glutaraldehído como agente de reticulación para unir el Antibodi capturaES para los discos de papel de celulosa funcionalizado grupos amina. La presencia de anticuerpos de captura fue confirmada por conejo isotiocianato de fluoresceína IgG-anti-humano (FITC), utilizando un generador de imágenes de fluorescencia molecular. La actividad de unión de conejo anti-humano IgG-FITC de IgG de cabra anti-conejo también fue evaluada por sustrato de peroxidasa. Se investigaron los efectos de diversas concentraciones de peryodato de sodio, glutaraldehído, y anticuerpos de captura. La prueba de la aplicación del anticuerpo de captura inmovilizado se realizó con éxito a través de la detección de suero IgG.
Protocolo
1. Injerto grupos funcionales amina sobre los discos de papel de celulosa
- Preparar una hoja de papel cuadrada con una dimensión de 1 cm x 1 cm, y 100 discos de papel hechas de papel de celulosa de grado No. 1 con un diámetro de 6,0 mm (papel de filtro de flujo medio) usando una perforadora.
- Para derivar grupos -NH2 en los discos de papel, mezclar 1 ml de APS y 10 ml de acetona en una botella de vidrio de 50 ml en la campana de humos. Añadir discos de papel a la mezcla de reactivo de APS recién preparado, y se incuba durante 5 horas con agitación orbital (200 rpm) a temperatura ambiente 32.
Precaución: Manipular APS y acetona en la campana de humos. - Decantar el exceso de solución de la botella de vidrio de 50 ml en un recipiente de residuos orgánicos.
- Añadir 10 ml de acetona a la botella de vidrio, mezclar bien y decantar completamente para eliminar cualquier APS sin reaccionar y otras impurezas. Repita este paso dos veces.
- Difundir los discos de papel sobre la toalla de papel y colocar en un horno a 110ºC durante 3 horas. permitir que eldiscos de papel se enfríen. Guarde los discos en un tubo de centrífuga de 50 ml a temperatura ambiente.
- Utilice transformada de Fourier espectroscopia infrarroja (FTIR) para comprobar el injerto de grupos amina en el papel cuadrado de celulosa, como se describe a continuación (Figura 3A).
- Encienda el ordenador y abra el instrumento de espectroscopia FTIR.
- Abra el software para la espectroscopia FTIR.
- Ir a "Medición → Inicializar '. Los rectángulos para 'BS: KBr', 'Lámpara: Infrared' y 'Laser' adquieren un color verde cuando haya finalizado la inicialización.
- Elija "Datos" por debajo de los rectángulos, y seleccione '% Transmitancia', 'Happ-Genzel', '45', '4.0', y 'Min: 400, Max: 4000 "para" Modo de medición "," Apodización', ' No. de exploraciones ',' Resolución ', y' Rango (cm-1) '.
- Haga clic en "Medir".
- Seleccione 'archivo de datos' para los datos de fondo. Escribirpor los comentarios.
- Haga clic en "BKG 'para obtener la línea de base para el fondo.
- Fijar el papel cuadrado en el soporte de muestra de película.
- Seleccione 'archivo de datos' para los datos de la muestra. Anote los comentarios.
- Haga clic en "muestra" para obtener los espectros de la muestra.
- Cierre la aplicación de la espectroscopia FTIR y apagar el equipo.
- Repita los pasos anteriores (pasos 1.1 a 1.6) para preparar grado Nº 113 de celulosa y papel (papel discos de filtro de flujo rápido) cuadrados con funcionalidad amina, y obtener los espectros FTIR para el grado Nº 113 de papel cuadrado (Figura 3B).
2. La inmovilización covalente de anticuerpos en los discos de papel de celulosa funcionalizados-Amina
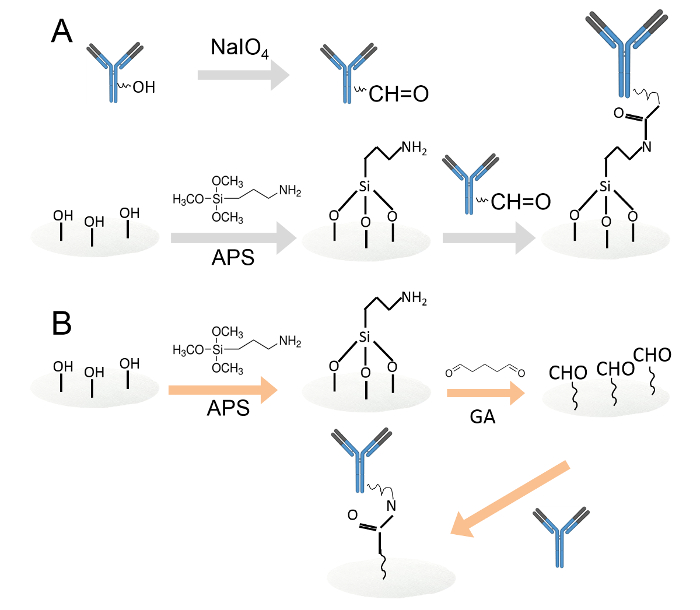
Figura 1. La inmovilización covalente de anticuerpos por dos métodos diferentes.A. Los anticuerpos inmovilizados sobre discos de papel de celulosa funcionalizada con amina a través de la oxidación con peryodato. Los residuos de hidratos de carbono se oxidaron por peryodato de sodio para producir grupos funcionales aldehído. Entonces, los anticuerpos oxidados se cargaron en discos de papel de celulosa funcionalizada con amina. B. Los anticuerpos fueron entonces inmovilizados sobre discos de papel de celulosa funcionalizada con amina a través de glutaraldehído. Los discos de papel de celulosa de amina funcionalizado se sumergieron en solución de glutaraldehído al 0,05% para introducir grupos aldehído a los discos de papel. Después del lavado, los anticuerpos se cargaron en los discos de papel de aldehído funcionalizado. Por favor, haga clic aquí para ver una versión más grande de esta figura.
- Inmovilizar anticuerpos sobre discos de papel de celulosa funcionalizada con amina a través de la oxidación con peryodato (Figura 1A).
- Mezclar 1 l de sodio 2,5 mM periodate con 2 l de 0,1 mg / ml de conejo anti-humano IgG-FITC y 7 l de mM pH 5,5 tampón de acetato 100 en un tubo de 1,5 ml, y se incuba la mezcla en la oscuridad durante 30 min.
NOTA: Siga esta relación en volumen para preparar anticuerpos más oxidado si es necesario. Cambiar la relación de volumen para optimizar la concentración de peryodato de sodio y de conejo anti-IgG humana-FITC. - Diluir la solución de anticuerpo de arriba con 30 l de 50 mM solución salina tamponada con fosfato (PBS, pH 7,4) hasta un volumen final de 40 l.
- Preparar tres discos de papel de filtro de flujo medio-amina funcionalizados y tres discos de papel de flujo rápido con funcionalidad amina (como se describe en la Sección 1).
- Carga de 5 l de la peryodato de sodio conejo oxidado anti-humano IgG-FITC en cada disco de papel de filtro de flujo medio y 8 l sobre cada disco de papel de filtro de flujo rápido. Mantener estos discos de papel en la oscuridad durante una hora a temperatura ambiente.
- Lavar cada uno de los discos de papel con 0,2 ml de lavado de piel de anteer (50 mM de tampón Tris con 0,15 M NaCl y 0,05% de tensioactivo, pH 7,4). Repita el lavado tres veces.
- Fotografía de las imágenes de fluorescencia a través de un generador de imágenes de fluorescencia molecular para identificar la presencia de anticuerpos en cada disco de papel de celulosa 32. Utilice discos de papel en blanco (tratados con la misma concentración de anticuerpos en ausencia de peryodato de sodio) como control (Figura S1 a la figura S3).
NOTA: Para la optimización experimental, cambiar la concentración de un parámetro que necesita ser optimizado y fijar las concentraciones de todos los otros parámetros. Una alta intensidad de la fluorescencia aumenta la cantidad de anticuerpos de captura que se inmoviliza sobre los discos de papel de celulosa.
- Mezclar 1 l de sodio 2,5 mM periodate con 2 l de 0,1 mg / ml de conejo anti-humano IgG-FITC y 7 l de mM pH 5,5 tampón de acetato 100 en un tubo de 1,5 ml, y se incuba la mezcla en la oscuridad durante 30 min.
- Inmovilizar anticuerpos sobre discos de papel de celulosa funcionalizadas de amina a través de glutaraldehído (Figura 1B).
- Añadir las tres de flujo medio tratado discos de papel de filtro de APS y los tres discos de papel de filtro de flujo rápido (described en la Sección 1) a 2 ml de PBS 50 mM (pH 7,4) que contiene 0,05% de glutaraldehído durante 1 hora, con agitación orbital a temperatura ambiente.
Precaución: Manipular glutaraldehído en la campana de humos. - Coloque tres discos cada uno en dos tubos de centrífuga de 1,5 ml. Añadir 1 ml de agua desionizada (DI) a cada tubo y agitar los tubos durante 10 seg. Eliminar el agua por aspiración con una pipeta. Repetir dos veces más para eliminar cualquier glutaraldehído sin reaccionar.
- De carga 5 l de 25 mg / ml de IgG de conejo-FITC (anticuerpo de captura) anti-humano en cada flujo de medio disco de papel de filtro de aldehído-funcionalizado, y añadir 8 l en cada flujo rápido disco de papel de filtro de aldehído-funcionalizado. Incubar en la oscuridad durante aproximadamente 20 min a temperatura ambiente. A continuación, añadir 10 l de PBS 50 mM (pH 7,4) a cada disco de papel sin la eliminación de los anticuerpos y se incuba durante 40 min para la reacción de aldehído amina.
- Lavar los discos de papel con 0,2 ml de tampón de lavado en la parte superior de una toalla de papel. Repite ellavar dos veces.
- Fotografía de las imágenes de fluorescencia a través de un generador de imágenes de fluorescencia molecular para comprobar la presencia de anticuerpos en cada disco de papel de celulosa 33. Utilice discos de papel en blanco como control.
NOTA: En la Figura 4, '0' significa que el disco de papel en blanco que se trató con la misma concentración de FITC-anticuerpo en ausencia de glutaraldehído; en la Figura 5A, los discos de papel en blanco se trataron con glutaraldehído, pero no hay FITC-anticuerpos se cargaron en los discos de papel.
- Añadir las tres de flujo medio tratado discos de papel de filtro de APS y los tres discos de papel de filtro de flujo rápido (described en la Sección 1) a 2 ml de PBS 50 mM (pH 7,4) que contiene 0,05% de glutaraldehído durante 1 hora, con agitación orbital a temperatura ambiente.
- Se secan los discos de papel (de las secciones 2.1 y 2.2) a 37 ° C durante 10 minutos.
- Bloquear los discos de papel con 15 l de tampón de bloqueo (10% leche en polvo desnatada en tampón Tris 50 mM, pH 7,4, con 0,15 M NaCl) durante 10 minutos a temperatura ambiente.
- Carga de 5 l y 8 l de conjugado con peroxidasa de cabra anti-IgG de conejo en PBS (1: 10.000) en medio-flujo y discos de papel de filtro de flujo rápido, respectivamente. incubar durante30 min en la oscuridad a temperatura ambiente.
- Lavar los discos de papel con 0,2 ml de tampón de lavado en la parte superior de una toalla de papel. Repita el lavado tres veces.
NOTA: No es necesario retirar el tampón de lavado ya que los resultados no son afectados por la memoria intermedia. - Cargar una mezcla de 10 l de 3,3 ', 5,5'-tetrametilbencidina (TMB) y una solución de peróxido de hidrógeno en cada disco.
- Tomar imágenes de los discos de papel con una cámara digital o un teléfono inteligente después de 5 minutos de incubación.
NOTA: En la Figura 5B, '0' significa que los discos de papel que fueron tratadas con glutaraldehído, seguido de la carga de anticuerpo-HRP (peroxidasa de rábano picante) conjugado en ausencia de FITC-anticuerpo.
ELISA 3. Papel de base para la detección de IgG
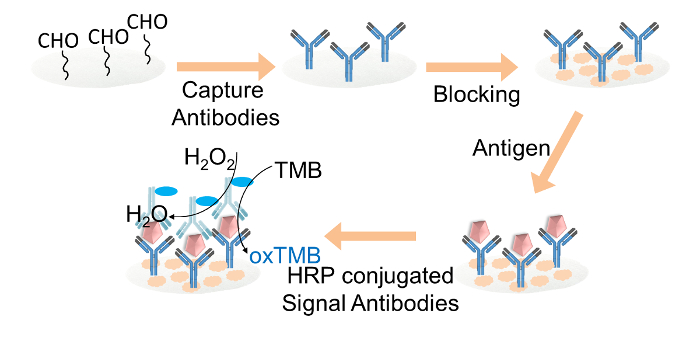
Figura 2. Representación esquemática de la ELISA basado en papel fodetección. Captura de anticuerpos IgG r se inmovilizaron covalentemente sobre los discos de papel de celulosa de aldehído-funcionalizado a través de glutaraldehído. Los discos de papel de celulosa se bloquearon con tampón de bloqueo. entonces Target IgG se añadió a los discos, seguido por la carga de anticuerpos de señal HRP-conjugados. Por último, la solución de TMB y mezcla de peróxido de hidrógeno se cargó en cada disco de papel para la lectura del color. Por favor, haga clic aquí para ver una versión más grande de esta figura.
- Añadir 5 ml de solución de glutaraldehído al 0,05% (preparado en tampón de PBS 50 mM, pH 7,4) a una botella de vidrio de 20 ml. Sumergir 15 de flujo de medio de discos de papel de filtro con amina funcionalizado en esta solución y mantener durante 1 hora con agitación a temperatura ambiente.
- Al mismo tiempo, repita el paso 3.1 para preparar otro aldehído 15 discos de papel de filtro de flujo rápido funcionalizados.
Precaución: Manipular glutaraldehído en el humocapucha.
- Al mismo tiempo, repita el paso 3.1 para preparar otro aldehído 15 discos de papel de filtro de flujo rápido funcionalizados.
- Para eliminar el glutaraldehído sin reaccionar de los discos de papel, colocar los discos de papel de filtro de 15 medio de flujo en un tubo de centrífuga de 15 ml, y los discos de papel de filtro 15 de flujo rápido en otro tubo de centrífuga de 15 ml. Añadir 5 ml de agua DI a cada tubo y agitar los tubos durante 10 seg. Eliminar el agua por aspiración con una pipeta. Repetir dos veces para eliminar cualquier glutaraldehído sin reaccionar.
- Se secan los discos de papel en un horno de 37 ° C.
- Añadir 5 l y 8 l de anticuerpos de fragmentos 0,025 mg / ml de IgG de ratón-Fc a cada uno de los discos de medio de flujo y de papel de filtro de flujo rápido, respectivamente, y se incuba durante 20 min.
- Añadir 10 l de PBS 50 mM (pH 7,4) a cada disco de papel sin la eliminación de los anticuerpos y se incuba durante 40 min para la reacción de aldehído amina.
- Lavar los discos de papel con 0,2 ml de tampón de lavado en la parte superior de una toalla de papel. Repita el lavado tres veces.
- Se secan los discos de papel en un horno a 37 ° C.
- Bloquear los discos de papel wITH 15 l de tampón de bloqueo durante 10 min a temperatura ambiente.
- Lavar cada disco de papel con 0,2 ml de tampón de lavado en la parte superior de una toalla de papel. Repita el lavado tres veces.
- Ejecutar estándares de IgG.
- Carga de 10 l de diversas concentraciones de IgG (por ejemplo, 0, 10, 125, 250, y 500 ng / ml en PBS) a cada disco por triplicado. Incubar durante 1 hora a temperatura ambiente.
- Lavar los discos de papel con 0,2 ml de tampón de lavado en la parte superior de una toalla de papel. Repita el lavado tres veces.
- Carga de 10 l de anticuerpos HRP de ratón conjugado IgG-Fc de fragmentos (1: 10.000, mM PBS 10, pH 7,4), y se incuba durante 1 hora a temperatura ambiente.
- Lavar los discos de papel con 0,2 ml de tampón de lavado en la parte superior de una toalla de papel. Repita el lavado tres veces.
NOTA: No es necesario retirar el tampón de lavado ya que los resultados no se ven afectados por la presencia de tampón. - Cargar una mezcla de 10 l de TMB y peróxido de hidrógeno en cada disco.
- Take imágenes de todos los discos de papel con una cámara digital o un teléfono inteligente después de 5 minutos de incubación.
NOTA: En la Figura 6A, '0' significa discos de papel tratados con inmovilización anticuerpo de captura, y la solución de anticuerpo-HRP / TMB sin suero IgG. - Analizar la intensidad de cada disco de papel en la imagen por imagen J.
- Convertir las imágenes tomadas en el paso 3.15 a formato '.tif'.
- software abierto 'la imagen J'.
- Ir a "Archivo → Abrir", seleccione la imagen a analizar.
- Seleccione el botón de la forma 'Oval'.
- Ir a "imagen → Tipo → 32 bits".
- Ir a "Editar → Invertir '.
- Ir a "Analizar → Medida '.
- Copiar y analizar los datos en una hoja de cálculo.
Resultados
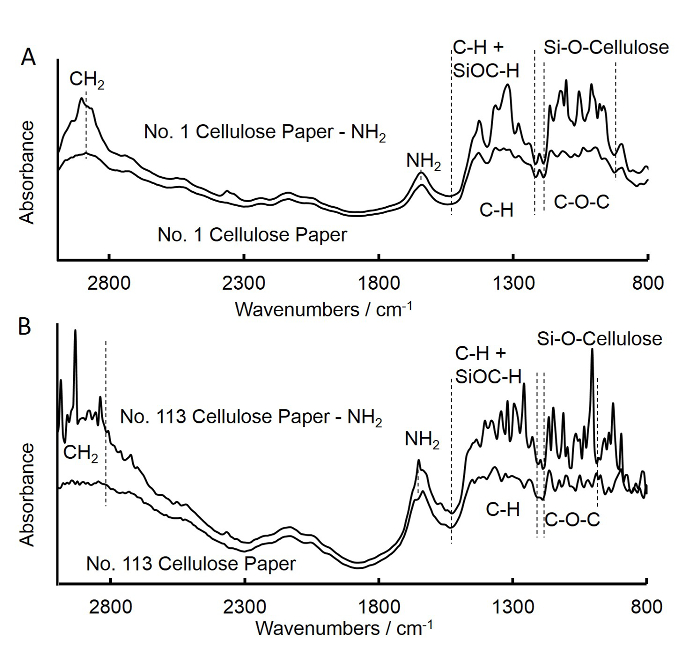
Figura 3. transformada de Fourier infrarroja (FTIR) de papel de filtro de flujo medio no tratado y tratado con APS cuadrada (A) y filtro de flujo rápido del papel cuadrado (B). A. Los espectros de papel cuadrado filtro de flujo medio sin tratar fue similar a la de APS papel cuadrado filtro de flujo medio tratado. El aumento de las intensidades en bandas de 902-1,170...
Discusión
El recubrimiento directo de afinidad purificada de cabra anti-ratón de anticuerpo de captura IgG-Fc sobre discos de papel de celulosa no modificada se realizó para detectar concentraciones de IgG. Los resultados indicaron que, se requiere más la fijación de los anticuerpos de captura para la reproducibilidad. La técnica de silano fue utilizado con éxito para introducir grupos funcionales de amina a los discos de papel de celulosa 34. La concentración de APS afecta a la inmovilización de anticuerpos. P...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This work was financially supported by the Ministry of Education, Singapore through the Translational and Innovation Grant (MOE2012-TIF-2-G-009).
Materiales
| Name | Company | Catalog Number | Comments |
| Cellulose filter paper, Grade 1 (medium flow filter paper) | GE Healthcare Pte Ltd Singapore | 1001 110 | |
| Cellulose filter paper, Grade 113 (Fast flow filter paper) | Sigma-Aldrich, Singapore | 1113-320 | |
| Glutaraldehyde | Sigma-Aldrich, Singapore | G6257 | Grade II, 25% in H2O |
| Surfactant | Tween-20, Sigma-Aldrich, Singapore | P2287 | |
| Bovine serum album | Sigma-Aldrich, Singapore | A2153 | |
| Skimmed milk powder | Louis François | Packed by Kitchen Capers, Singapore | |
| Tris base | Promega | H5135 | |
| Sodium periodate | Merck | 106597 | |
| Na2HPO4 | Merck | 106585 | |
| KH2PO4 | Merck | 104873 | |
| NaCl | CALBIOCHEM | 567441 | |
| NaOH | Merck | 106462 | |
| HCl | Merck | 100317 | |
| phosphate buffer saline (PBS) | N/A | N/A | PBS, containing 137 mmol/L NaCl, 2.7 mmol/L KCl, 8.0 mmol/L Na2HPO4 and 1.5 mmol/L KH2PO4, is prepared with water and adjusted to pH 7.4 with 0.1 mol/L NaOH or 0.1 mol/L HCl |
| Acetone | Tee Hai Chem Pte Ltd Singapore | 9005-68 | |
| Mixture of TMB and hydrogen peroxide solution | 1-Step ultra TMB-ELISA solution , Thermo Scientific Pierce | 34029 | 1 L |
| Rabbit anti-human IgG-FITC | TWC/Bio Pte Ltd Singapore | sc-2278 | |
| Peroxidase conjugated goat anti-rabbit IgG | TWC/Bio Pte Ltd Singapore | sc-2030 | |
| Affinity purified goat anti-Mouse IgG-Fc coating antibody | Bethyl Laboratories, Inc | A90-131A | |
| Mouse reference serum | Bethyl Laboratories, Inc | RS10-101-5 | 9.5 mg/ml |
| HRP conjugated goat anti-mouse IgG-Fc detection antibody | Bethyl Laboratories, Inc | A90-131P | |
| Equipment | |||
| Fourier transform infrared spectrophotometer | Shimadzu IR Prestige-21 | N/A | |
| Fluorescence molecular imager | Pharos FXTM plus molecular imager, Bio-Rad, Singapore | N/A | |
| Oven | NUVE FN500 | N/A | |
| Turbo mixer VM-2000 | MYC LTD | N/A | |
| ImageJ | RGB, free download | N/A |
Referencias
- Curtis, K. A., Rudolph, D. L., Owen, S. M. Rapid detection of HIV-1 by reverse-transcription, loop-mediated isothermal amplification (RT-LAMP). J. Virol. Methods. 151 (2), 264-270 (2008).
- Martinez, A. W., Phillips, S. T., Carrilho, E., Thomas, S. W., Sindi, H., Whitesides, G. M. Simple telemedicine for developing regions: camera phones and paper-based microfluidic devices for real-time, off-site diagnosis. Anal. Chem. 80 (10), 3699-3707 (2008).
- Lode, P. V. Point-of-care immunotesting: approaching the analytical performance of central laboratory methods. Clin. Biochem. 38 (7), 591-606 (2005).
- Posthuma-Trumpie, G. A., Amerongen, A. V., Korf, J., Berkel, W. J. V. Perspectives for on-site monitoring of progesterone. Trends Biotechnol. 27 (11), 652-660 (2009).
- Lim, D. V., Simpson, J. M., Kearns, E. A., Kramer, M. F. Current and developing technologies for monitoring agents of bioterrorism and biowarfare. Clin. Microbiol. Rev. 18 (4), 583-607 (2005).
- Li, X., Tian, J., Shen, W. Progress in patterned paper sizing for fabrication of paperbased microfluidic sensors. Cellulose. 17 (3), 649-659 (2010).
- Nie, Z., et al. Electrochemical sensing in paper-based microfluidic devices. Lab Chip. 10, 477-483 (2010).
- Delaney, J. L., Hogan, C. F., Tian, J., Shen, W. Electrogenerated chemiluminescence detection in paper-based microfluidic sensors. Anal. Chem. 83 (4), 1300-1306 (2011).
- Oh, Y. K., Joung, H. A., Kim, S., Kim, M. G. Vertical flow immunoassay (VFA) biosensor for a rapid one-step immunoassay. Lab Chip. 13 (5), 768-772 (2013).
- Cheng, C. M., et al. Paper-based ELISA. Angew. Chem. 122 (28), 4881-4884 (2010).
- Jarujamrus, P., Tian, J., Li, X., Siripinyanond, A., Shiowatana, J., Shen, W. Mechanisms of red blood cells agglutination in antibody-treated paper. Analyst. 137 (9), 2205-2210 (2012).
- Credou, J., Volland, H., Dano, J., Berthelot, T. A one-step and biocompatible cellulose functionalization for covalent antibody immobilization on immunoassay membranes. J. Mat. Chem. B. 1, 3277-3286 (2013).
- Kong, F., Hu, Y. F. Biomolecule immobilization techniques for bioactive paper fabrication. Anal. Bioanal. Chem. 403, 7-13 (2012).
- Orelma, H., Teerinen, T., Johansson, L. S., Holappa, S., Laine, J. CMC-modified cellulose biointerface for antibody conjugation. Biomacromolecules. 13, 1051-1058 (2013).
- Yu, A., et al. Biofunctional paper via covalent modification of cellulose. Langmuir. 28 (30), 11265-11273 (2012).
- Stollner, D., Scheller, F. W., Warsinke, A. Activation of cellulose membranes with 1,1′-carbonyldiimidazole or 1-cyano-4-dimethylaminopyridinium tetrafluoroborate as a basis for the development of immunosensors. Anal Biochem. 304 (2), 157-165 (2002).
- Bora, U., Sharma, P., Kannan, K., Nahar, P. Photoreactive cellulose membrane - a novel matrix for covalent immobilization of biomolecules. J. Biotechnol. 126 (2), 220-229 (2006).
- Sharma, P., Basir, S. F., Nahar, P. Photoimmobilization of unmodified carbohydrates on activated surface. J Colloid Interface Sci. 342 (1), 202-204 (2010).
- Brumer, H., Zhou, Q., Baumann, M. J., Carlsson, K., Teeri, T. T. Activation of crystalline cellulose surfaces through the chemoenzymatic modification of xyloglucan. J. Am. Chem. Soc. 126 (18), 5715-5721 (2004).
- Araujo, A. C., Song, Y., Lundeberg, J., Stahl, P. L., Brumer, H. Activated paper surfaces for the rapid hybridization of DNA through capillary transport. Anal Chem. 84 (7), 3311-3317 (2012).
- Xu, C., Spadiut, O., Araujo, A. C., Nakhai, A., Brumer, H. Chemo-enzymatic Assembly of Clickable Cellulose Surfaces via Multivalent Polysaccharides. ChemSusChem. 5 (4), 661-665 (2012).
- Filpponen, I., et al. Generic method for modular surface modification of cellulosic materials in aqueous medium by sequential "click" reaction and adsorption. Biomacromolecules. 13 (3), 736-742 (2012).
- Feese, E., Sadeghifar, H., Gracz, H. S., Argyropoulos, D. S., Ghiladi, R. A. Photobactericidal porphyrin-cellulose nanocrystals: synthesis, characterization, and antimicrobial properties. Biomacromolecules. 12 (10), 3528-3539 (2011).
- Zang, D., Ge, L., Yan, M., Song, X., Yu, J. Electrochemical immunoassay on a 3D microfluidic paper-based device. Chem. Commun. 48 (39), 4683-4685 (2012).
- Ge, L., Yan, J. X., Song, X. R., Yan, M., Ge, S. J., Yu, J. H. Three-dimensional paper-based electrochemiluminescence immunodevice for multiplexed measurement of biomarkers and point-of-care testing. Biomaterials. 33 (4), 1024-1031 (2012).
- Wang, S., et al. Paper-based chemiluminescence ELISA: lab-on-paper based on chitosan modified paper device and wax-screen-printing. Biosens. Bioelectron. 31 (1), 212-218 (2012).
- Koev, S. T., et al. Chitosan: an integrative biomaterial for lab-on-a-chip devices. Lab Chip. 10, 3026-3042 (2010).
- Wang, S. M., et al. Simple and covalent fabrication of a paper device and its application in sensitive chemiluminescence immunoassay. Analyst. 137 (16), 3821-3827 (2012).
- Sadira, S., Prabhakaranc, M. P., Wicaksonob, D. H. B., Ramakrishna, S. Fiber based enzyme-linked immunosorbent assay for C-reactive protein. Sensor Actuat B-Chem. 205, 50-60 (2014).
- Koga, H., Kitaoka, T., Isogai, A. In situ modification of cellulose paper with amino groups for catalytic applications. J. Mater. Chem. 21, 9356-9361 (2011).
- Klemm, D., Heublein, B., Fink, H. P., Bohn, A. Cellulose: fascinating biopolymer and sustainable raw material. Angew. Chem., Int. Ed. 44 (22), 3358-3393 (2005).
- Fernandes, S. C. M., et al. Bioinspired antimicrobial and biocompatible bacterial cellulose membranes obtained by surface functionalization with aminoalkyl groups. ACS Appl. Mater. Interfaces. 5 (8), 3290-3297 (2013).
- . . Pharos FX plus molecular imager instructions, Catalog Number 170-9460. , (2005).
- Tee, Y. B., Talib, R. A., Abdan, K., Chin, N. L., Basha, R. K., Yunos, K. F. M. Aminosilane-grafted cellulose. BioResourses. 8 (3), 4468-4483 (2013).
- Xing, Y., et al. Bioconjugated quantum dots for multiplexed and quantitative immunohistochemistry. Nat Protoc. 2, 1152-1165 (2007).
- Guidi, A., Laricchia-Robbio, L., Gianfaldoni, D., Revoltella, R., Del Bono, G. Comparison of a conventional immunoassay (ELISA) with a surface plasmon resonance-based biosensor for IGF-1 detection in cows' milk. Biosens Bioelectron. 16, 971-977 (2001).
- Ahmed, S., Bui, M. N., Abbas, A. Paper-based chemical and biological sensors: Engineering aspects. Biosens Bioelectron. 77, 249-263 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados