È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Covalente legame degli anticorpi al cellulosa dischi di carta e le loro applicazioni a occhio nudo colorimetrici Immunoassays
In questo articolo
Riepilogo
In this manuscript, periodate oxidation and glutaraldehyde cross-linking methods for covalent immobilization of antibodies on paper discs are presented. The binding activity of immobilized antibodies was evaluated. Based on these results, a glutaraldehyde cross-linking method was used to develop a novel paper-based immunoassay for immunoglobulin G (IgG) detection.
Abstract
Questo rapporto presenta due metodi per l'immobilizzazione covalente di anticorpi di cattura su filtro di cellulosa grado di carta n ° 1 (carta da filtro di media portata) dischi e di grado n ° 113 (carta da filtro rapido flusso) dischi. Questi dischi di carta di cellulosa sono stati innestati con gruppi funzionali amminici tramite una tecnica di accoppiamento silano prima gli anticorpi sono stati immobilizzati su di essi. metodi di reticolazione periodato di ossidazione e glutaraldeide sono stati usati per innestare anticorpi di cattura sui dischi di carta di cellulosa. Per garantire la massima capacità di legame degli anticorpi di cattura ai loro bersagli dopo l'immobilizzazione, sono stati studiati gli effetti di varie concentrazioni di periodato di sodio, glutaraldeide, e anticorpi di cattura sulla superficie dei dischi di carta. Gli anticorpi che sono stati rivestiti sui dischi di carta di cellulosa ammina-funzionalizzata tramite un agente reticolante glutaraldeide mostrato migliorata attività di legame al bersaglio rispetto al metodo di ossidazione periodato. IgG (nel siero riferimento mouse) è stato usato come target di riferimento in questo studio per testare l'applicazione di anticorpi immobilizzati covalentemente attraverso glutaraldeide. Un nuovo cartaceo, enzimatico test immunoenzimatico (ELISA) è stato sviluppato con successo e convalidato per l'individuazione di IgG. Questo metodo non richiede attrezzature, e può rilevare 100 ng / ml di IgG. La carta da filtro a flusso rapido era più sensibile della carta da filtro flusso medio. Il periodo di incubazione di questo test è stato breve e richiedeva piccoli volumi di campione. Questo occhio nudo, immunologico colorimetrica può essere esteso per rilevare altri obiettivi che sono identificati con ELISA convenzionale.
Introduzione
Lo studio diagnostico point-of-care (POCT) è importante per lo sviluppo di nuove strategie per la terapia, la medicina personalizzata, e assistenza domiciliare 1. Carte cellulosa sono ampiamente usati come piattaforme in saggi immunologici, come sono economici, accessibili e familiare agli utenti 2. Inoltre, la struttura porosa della carta di cellulosa possiede il potere di guidare il flusso di liquido senza ulteriore impatto energetico. Le registrazioni dei bioanalisi cartaceo può essere trovato già nel 20 ° secolo, quando cromatografia su carta è stato inventato nel 1952. L'esempio più diffuso è test immunocromatografici 3, come le strisce di gravidanza e test per il diabete. Questi test forniscono tempi di analisi relativamente veloce e analisi economica 4. Grazie alla loro semplicità, questi test striscia di carta convenzionali sono stati ampiamente utilizzati in diagnostica POCT 5.
Metodi di rilevamento tra colorimetrico 6, elettroSono stati riportati chimici 7 e 8 ElettroChemiLuminescenza metodi per misurare bersagli in campioni biologici. In aggiunta a questi metodi quantitativi, un metodo affidabile per immobilizzare anticorpi su carta di cellulosa è anche importante per lo sviluppo di dispositivi diagnostici. Adsorbimento non specifico è la strategia principale per modificare gli anticorpi sulla superficie dei dispositivi cartacei 9, 10 per garantire la massima capacità di legame ai loro obiettivi dopo immobilizzazione. Tuttavia, uno studio precedente hanno dimostrato che gli anticorpi che vengono assorbiti dalla carta di cellulosa possono desorbire dalle fibre 11 del 40%. Così, adsorbimento diretta degli anticorpi su cellulosa non può fornire risultati riproducibili 12. Immobilizzazione covalente di anticorpi che si innestano sulle superfici di carta è un metodo alternativo di sviluppare efficaci biotest cartacei 13. Vari metodi sono stati segnalati per la modifica della cellulosa 14, 15 . Idealmente, gli anticorpi dovrebbero mantenere la loro funzionalità originale dopo l'immobilizzazione 12. Carbonildiimidazolo combinato con 1-ciano-4-dimethylaminopyridinium tetrafluoroborate 16; 1-fluoro-2-nitro-4-azidobenzene attraverso una strategia di attivazione UV a base 17, 18; una strategia basata su chemoenzimatica xyloglucan 19 modifica; un agente di collegamento 1,4-phenylenediisothiocyanate 20; eteropolisaccaride ossidazione 21 click chemistry 22; e porfirine cationiche 23 sono stati utilizzati per immobilizzare covalentemente biomolecole su carta di cellulosa. Chitosano carta modificato è stato usato per sviluppare immunodevices cartacei 24-26 poiché è abbondante e biocompatibile 27. Il chitosano è cationico e aderisce con forza alla cellulosa anionici 27. Gli anticorpi di cattura sono immobilizzati sulla carta attraverso rivestimento chitosano e glutaraldeide reticolazione. ossidazione periodato è un altro metodo per l'innesto del captanticorpi ure sulla carta di cellulosa 28. In questo metodo, periodato di sodio è depositata su carta per convertire gruppi 1,2-dihydroxyl (glicole) di cellulosa direttamente ai gruppi aldeidici. I gruppi aldeidici sono quindi utilizzate per formare legami covalenti tra polisaccaridi e anticorpi 28. Sebbene la fabbricazione è semplice, è difficile lavare completamente periodato di sodio. Il periodato di sodio non lavato può causare ulteriore ossidazione degli anticorpi che sono immobilizzati sulla carta di cellulosa, influenzando l'attività e la stabilità degli anticorpi N -. (3-dimetilamminopropil) - N cloridrato -ethylcarbodiimide e N linkers croce -hydroxysuccinimide sono utilizzati anche per covalentemente immobilizzare anticorpi sulla acide e acetato di cellulosa nanofibre poli-L-lattico elettrofilate per lo sviluppo di saggi nanofibre a base 29.
In questo studio, una tecnica di accoppiamento silano è stato usato per innestare gruppi funzionali amminici su cellulosdischi di carta e. Questa tecnica aiuta a mantenere le dimensioni originali dei pori, traspirante, e velocità di filtrazione delle carte da filtro di cellulosa, consentendo la massima verticali flow-through in saggi immunologici. La tecnica di accoppiamento silano è stato ampiamente utilizzato in biosensori per funzionalizzare superfici dei substrati con gruppi amminici secondari, seguita da un'ulteriore modifica utilizzando biomolecole. L'innesto di gruppi amminici sulla superficie matrice comprende una reazione di condensazione tra i gruppi -OH degli agenti silano organo e matrice substrato 30. I dischi di carta di cellulosa sono stati funzionalizzati con gruppi amminici di silano attraverso 3-amminopropiltrimetossisilano (APS) 31. Questa è stata seguita da anticorpi di cattura covalente immobilizzanti utilizzando due metodi diversi. Il primo metodo ha coinvolto legame di periodato anticorpi di cattura ossidati alle ammine funzionalizzate dischi di carta di cellulosa. Il secondo metodo utilizzato glutaraldeide come agente reticolante per collegare la Antibodi catturaes ai dischi di carta di cellulosa di gruppo-funzionalizzati ammina. La presenza di anticorpi di cattura è stata confermata da rabbit IgG isotiocianato-fluoresceina anti-umano (FITC), utilizzando un sensore molecolare fluorescenza. L'attività di legame di coniglio anti-IgG umane-FITC per capra anti-IgG di coniglio è stata anche valutata substrato perossidasi. Gli effetti di varie concentrazioni di periodato di sodio, glutaraldeide, e anticorpi di cattura sono stati studiati. Il test applicazione della anticorpo di cattura immobilizzato è stato eseguito con successo attraverso l'individuazione di IgG nel siero.
Protocollo
1. L'innesto Amine gruppi funzionali di cellulosa dischi di carta
- Preparare un pezzo di carta quadrato con una dimensione di 1 cm x 1 cm e 100 dischi di carta in carta di cellulosa di grado n ° 1 con un diametro di 6,0 mm (carta flusso medio filtro) utilizzando un punzone buco.
- Per derivare gruppi -NH 2 sui dischi di carta, mescolare 1 ml APS e 10 ml di acetone in una bottiglia di vetro da 50 ml sotto cappa. Aggiungere dischi di carta alla miscela APS reagente appena preparato, e incubare per 5 ore con agitazione orbitale (200 rpm) a temperatura ambiente 32.
Attenzione: maneggiare APS e acetone nella cappa. - Decantare la soluzione in eccesso dalla bottiglia di vetro da 50 ml in un contenitore di rifiuti organici.
- Aggiungere 10 ml di acetone alla bottiglia di vetro, mescolare bene e decantare completamente di togliere qualunque APS reagito e altre impurità. Ripetere questa operazione due volte.
- Stendere i dischi di carta sul tovagliolo di carta e mettere in un forno a 110 C ° per 3 ore. Lasciare che ildischi di carta per il raffreddamento. Conservare i dischi in una provetta da centrifuga da 50 ml a temperatura ambiente.
- Utilizzare trasformata di Fourier spettroscopia infrarossa (FTIR) per verificare l'innesto di gruppi amminici sulla carta quadrato di cellulosa, come descritto di seguito (Figura 3A).
- Accendere il computer e aprire lo strumento spettroscopia FTIR.
- Aprire il software per la spettroscopia FTIR.
- Vai a 'misura → Inizializzare'. I rettangoli per 'BS: KBr', 'Lampada: a raggi infrarossi' e 'Laser' diventa verde quando l'inizializzazione è terminata.
- Scegliere 'dati' al di sotto dei rettangoli, e selezionare '% di trasmissione', 'Happ-Genzel', '45', '4.0', e 'minima: 400, Max: 4000' per 'modalità di misura', 'Apodizzazione', ' No. di scansioni ',' Resolution ', e' Range (cm-1) '.
- Fare clic su 'misura'.
- Selezionare 'File di dati' per i dati di fondo. Scrivigiù i commenti.
- Fare clic su 'BKG' per ottenere la linea di base per lo sfondo.
- Fissare la carta quadrato sul supporto del campione pellicola.
- Selezionare 'File di dati' per i dati di esempio. Annotare i commenti.
- Fare clic su 'campione' per ottenere gli spettri per il campione.
- Chiudere l'applicazione della spettroscopia FTIR e spegnere il computer.
- Ripetere i passaggi precedenti (passi da 1.1 a 1.6) per preparare ammina-funzionalizzati grado No. 113 cellulosa carta quadrati e dischi (carta da filtro rapido flusso), e di ottenere gli spettri FTIR per il grado No. 113 quadrato di carta (Figura 3B).
2. immobilizzazione covalente di anticorpi su Amine-funzionalizzati dischi di carta di cellulosa
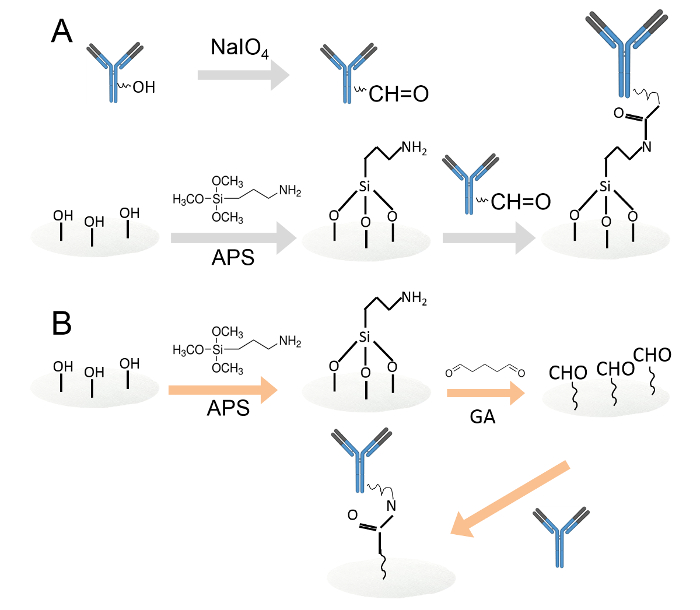
Figura 1. immobilizzazione covalente di anticorpi con due metodi differenti.Un. Gli anticorpi immobilizzati su dischi di carta di cellulosa di ammine-funzionalizzati per ossidazione periodato. I residui di carboidrati sono stati ossidati da periodato di sodio per la produzione di aldeide gruppi funzionali. Quindi, gli anticorpi ossidati sono stati caricati su dischi di carta di cellulosa ammina-funzionalizzato. B. Gli anticorpi sono stati poi immobilizzate su dischi di carta di cellulosa ammine funzionalizzate attraverso glutaraldeide. L'ammina funzionalizzato dischi di carta di cellulosa sono stati immersi in soluzione di glutaraldeide 0,05% per introdurre gruppi aldeidici ai dischi di carta. Dopo il lavaggio, gli anticorpi sono stati caricati sui aldeide funzionalizzato dischi di carta. Cliccate qui per vedere una versione più grande di questa figura.
- Immobilizzare anticorpi su dischi di carta di cellulosa ammina-funzionalizzato mediante ossidazione con periodato (Figura 1A).
- Mescolare 1 ml di perioda di sodio 2,5 mMte con 2 ml di 0,1 mg / ml di coniglio anti-IgG umane-FITC e 7 ml di 100 mM pH 5,5 tampone acetato in una provetta da 1,5 ml, e incubare la miscela al buio per 30 min.
NOTA: Seguire questa rapporto volume di preparare anticorpi più ossidate, se necessario. Modificare il rapporto volumetrico di ottimizzare la concentrazione di periodato di sodio e di coniglio anti-IgG umane-FITC. - Diluire la soluzione di anticorpi sopra con 30 ml di 50 mM tampone fosfato isotonico (PBS, pH 7,4) ad un volume finale di 40 microlitri.
- Preparare tre dischi di carta filtro medio-flow ammina-funzionalizzati e tre dischi di carta veloce flusso di ammina-funzionalizzati (come descritto nella sezione 1).
- Carico 5 ml di periodato di sodio coniglio ossidato IgG anti-umane-FITC viene eseguito su ciascun disco di carta filtro di media portata e 8 ml viene eseguito su ciascun disco di carta filtro rapido flusso. Mantenere questi dischi di carta al buio per un'ora a temperatura ambiente.
- Lavare ogni disco carta con 0,2 ml di lavaggio appassionatoer (50 mM tampone Tris 0,15 M NaCl e 0,05% di tensioattivo, pH 7,4). Ripetere il lavaggio tre volte.
- Fotografare le immagini di fluorescenza attraverso un imager molecolare di fluorescenza per identificare la presenza di anticorpi su ciascun disco di carta di cellulosa 32. Utilizzare dischi di carta in bianco (trattati con la stessa concentrazione di anticorpi in assenza di periodato di sodio) come un controllo (Figura S1 alla Figura S3).
NOTA: per l'ottimizzazione sperimentale, modificare la concentrazione di un parametro che deve essere ottimizzato e fissare le concentrazioni degli altri parametri. Una alta intensità di fluorescenza aumenta la quantità di anticorpi di cattura che sono immobilizzati sui dischi di carta di cellulosa.
- Mescolare 1 ml di perioda di sodio 2,5 mMte con 2 ml di 0,1 mg / ml di coniglio anti-IgG umane-FITC e 7 ml di 100 mM pH 5,5 tampone acetato in una provetta da 1,5 ml, e incubare la miscela al buio per 30 min.
- Immobilizzare anticorpi su dischi di carta di cellulosa funzionalizzati amminici tramite glutaraldeide (Figura 1B).
- Aggiungere i tre dischi di carta filtro APS medio-flow trattati e le tre dischi di carta filtro fast-flow (described sezione 1) a 2 ml di 50 mM PBS (pH 7,4) contenente 0,05% glutaraldeide per 1 ora, sotto agitazione orbitale a temperatura ambiente.
Attenzione: maneggiare glutaraldeide nella cappa. - Mettere tre dischi ciascuno in due da 1,5 ml provette da centrifuga. Aggiungere 1 ml di acqua deionizzata (DI) a ciascuna provetta e agitare le provette per 10 sec. Rimuovere l'acqua aspirando con una pipetta. Ripetere altre due volte per rimuovere eventuali glutaraldeide non reagito.
- Carico 5 ml di 25 mg / ml di coniglio IgG-FITC (anticorpo di cattura) anti-umano su ogni disco carta da filtro medio-flow aldeidi-funzionalizzati, e aggiungere 8 ml su ogni disco carta da filtro rapido flusso di aldeide-funzionalizzati. Incubare al buio per circa 20 min a temperatura ambiente. Quindi, aggiungere 10 ml di 50 mM PBS (pH 7,4) per ciascun disco di carta senza rimuovere gli anticorpi e incubare per 40 min per la reazione ammina aldeidi.
- Lavare i dischi di carta con 0,2 ml di soluzione di lavaggio sulla cima di un tovagliolo di carta. ripetere lalavare due volte.
- Fotografare le immagini di fluorescenza attraverso un imager molecolare di fluorescenza per verificare la presenza di anticorpi su ogni disco carta di cellulosa 33. Utilizzare dischi di carta bianco come controllo.
NOTA: In figura 4, '0' indica il disco di carta bianca che è stata trattata con la stessa concentrazione di FITC-anticorpo in assenza di glutaraldeide; in figura 5A, i dischi di carta vuoti sono stati trattati con glutaraldeide, ma nessun FITC-anticorpi stati caricati sul dischi di carta.
- Aggiungere i tre dischi di carta filtro APS medio-flow trattati e le tre dischi di carta filtro fast-flow (described sezione 1) a 2 ml di 50 mM PBS (pH 7,4) contenente 0,05% glutaraldeide per 1 ora, sotto agitazione orbitale a temperatura ambiente.
- Essiccare i dischi di carta (da sezioni 2.1 e 2.2) a 37 ° C per 10 min.
- Bloccare le dischi di carta con 15 microlitri di tampone di bloccaggio (10% di latte scremato in polvere in 50 mM tampone Tris, pH 7,4, con 0,15 M NaCl) per 10 min a temperatura ambiente.
- Carico 5 ml e 8 ml di perossidasi coniugato capra anti-IgG di coniglio in PBS (1: 10.000) sui rispettivamente medie di flusso e dischi di carta filtro rapido flusso,. incubare per30 min al buio a temperatura ambiente.
- Lavare i dischi di carta con 0,2 ml di soluzione di lavaggio sulla cima di un tovagliolo di carta. Ripetere il lavaggio tre volte.
NOTA: Non è necessario rimuovere il tampone di lavaggio come i risultati non sono influenzati dal buffer. - Caricare una miscela di 10 ml di 3,3 ', 5,5'-tetrametilbenzidina (TMB) e perossido di idrogeno su ogni disco.
- Prendere immagini dei dischi di carta con una fotocamera digitale o telefono intelligente dopo 5 min di incubazione.
NOTA: In figura 5B, '0' significa i dischi di carta che sono stati trattati con glutaraldeide, seguita caricando anticorpo-HRP (perossidasi di rafano) coniugato in assenza di FITC-anticorpo.
3. a base di carta ELISA per il rilevamento IgG
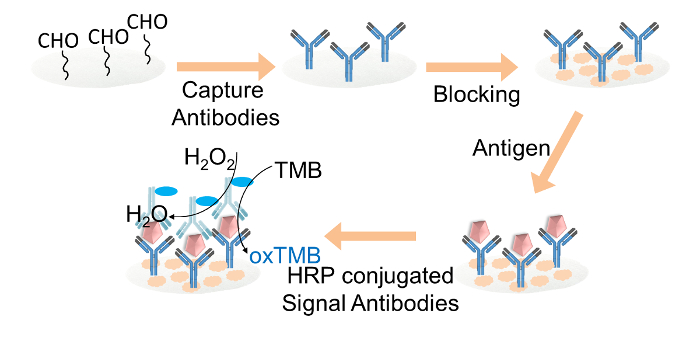
Figura 2. Rappresentazione schematica della ELISA cartaceo for IgG rilevamento. Cattura anticorpi sono stati covalentemente immobilizzati su dischi di carta di cellulosa aldeide-funzionalizzati attraverso glutaraldeide. I dischi di carta di cellulosa sono state bloccate con tampone di bloccaggio. Obiettivo IgG è stato quindi aggiunto ai dischi, seguita dal caricamento di anticorpi segnale HRP-coniugati. Infine, la soluzione di TMB e la miscela di perossido di idrogeno è stato caricato su ogni disco di carta per la lettura del colore. Clicca qui per vedere una versione più grande di questa figura.
- Aggiungere 5 ml di soluzione di glutaraldeide 0,05% (preparato in 50 mM tampone PBS, pH 7,4) ad una bottiglia di vetro da 20 ml. Immergere 15 medio-flow dischi di carta filtro ammina-funzionalizzata in questa soluzione e conservare per 1 ora con agitazione a temperatura ambiente.
- Allo stesso tempo, ripetere il punto 3.1 per preparare un altro 15 aldeide funzionalizzati dischi di carta filtro rapido flusso.
ATTENZIONE: Maneggiare glutaraldeide nel fumecappuccio.
- Allo stesso tempo, ripetere il punto 3.1 per preparare un altro 15 aldeide funzionalizzati dischi di carta filtro rapido flusso.
- Per rimuovere glutaraldeide non reagito dai dischi di carta, posizionare i dischi di carta filtro 15 medie di flusso in un tubo da centrifuga da 15 ml, ei dischi di carta filtro 15 fast-flow in un'altra provetta da centrifuga da 15 ml. Aggiungere 5 ml di acqua deionizzata ad ogni provetta e agitare le provette per 10 sec. Rimuovere l'acqua aspirando con una pipetta. Ripetere due volte per rimuovere qualsiasi glutaraldeide non reagito.
- Asciugare i dischi di carta in un forno a 37 ° C.
- Aggiungere 5 microlitri e 8 ml di 0,025 mg / ml anticorpi frammento IgG di topo-Fc per ciascuno dei dischi di media portata e carta da filtro a flusso veloce, rispettivamente, e incubare per 20 min.
- Aggiungere 10 ml di 50 mM PBS (pH 7,4) per ciascun disco di carta senza rimuovere gli anticorpi e incubare per 40 min per la reazione ammina aldeidi.
- Lavare i dischi di carta con 0,2 ml di soluzione di lavaggio sulla cima di un tovagliolo di carta. Ripetere il lavaggio tre volte.
- Essiccare i dischi di carta in un forno a 37 ° C.
- Bloccare i dischi di carta wesima 15 ml di tampone di bloccaggio per 10 min a temperatura ambiente.
- Lavare ogni disco di carta con 0,2 ml di soluzione di lavaggio sulla cima di un tovagliolo di carta. Ripetere il lavaggio tre volte.
- Eseguire standard IgG.
- Carico 10 ml di varie concentrazioni di IgG (ad esempio, 0, 10, 125, 250, e 500 ng / ml in PBS) su ogni disco in triplicato. Incubare per 1 ora a temperatura ambiente.
- Lavare i dischi di carta con 0,2 ml di soluzione di lavaggio sulla cima di un tovagliolo di carta. Ripetere il lavaggio tre volte.
- Carico 10 ml di anticorpi HRP coniugato IgG di topo-Fc frammento (1: 10.000, 10 mM PBS, pH 7,4), e incubare per 1 ora a temperatura ambiente.
- Lavare i dischi di carta con 0,2 ml di soluzione di lavaggio sulla cima di un tovagliolo di carta. Ripetere il lavaggio tre volte.
NOTA: Non è necessario rimuovere il tampone di lavaggio come i risultati non sono influenzati dalla presenza di tampone. - Caricare una miscela di 10 ml di TMB e perossido di idrogeno su ogni disco.
- Timmagini Ake di tutti i dischi di carta con una fotocamera digitale o telefono intelligente dopo 5 min di incubazione.
NOTA: In figura 6A, '0' sta per dischi di carta trattati con anticorpo di cattura immobilizzazione e la soluzione di anticorpo-HRP / TMB senza siero IgG. - Analizzare l'intensità di ciascun disco di carta nell'immagine da Image J.
- Convertire le immagini scattate nel passo 3.15 nel formato '.tif'.
- Aprire il software 'immagine J'.
- Vai a 'File → Open', scegliere l'immagine da analizzare.
- Scegliere il pulsante di forma 'ovale'.
- Vai a 'Immagine → Tipo → 32 bit'.
- Vai a 'Modifica → Inverti'.
- Vai a 'Analizzare → Misura'.
- Copia e analizzare i dati in un foglio di calcolo.
Risultati
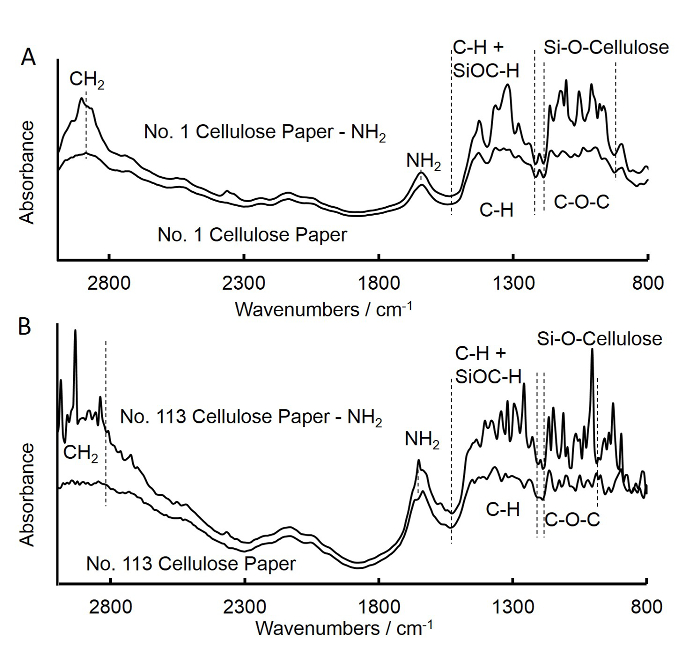
Figura 3. trasformata di Fourier (FTIR) spettri di filtro flusso medio greggia e APS-trattata carta quadrato (A) e il filtro a flusso rapido carta quadrato (B). A. Gli spettri per non trattata filtro medio-flow quadrato di carta era simile a quella di APS trattate filtro medio-flusso di carta quadrato. L'aumento della intensità a bande di 902-1,170 cm -1
Discussione
dirette di verniciatura affinità purificato capra anti-mouse IgG-Fc anticorpo di cattura su dischi di carta non modificato di cellulosa è stato eseguito per rilevare le concentrazioni di IgG. I risultati hanno indicato che, ulteriormente fissaggio degli anticorpi di cattura è richiesto per la riproducibilità. La tecnica silano è stata usata con successo per introdurre gruppi funzionali amminici ai dischi di carta di cellulosa 34. La concentrazione di APS colpisce l'immobilizzazione di anticorpi. Pert...
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
This work was financially supported by the Ministry of Education, Singapore through the Translational and Innovation Grant (MOE2012-TIF-2-G-009).
Materiali
| Name | Company | Catalog Number | Comments |
| Cellulose filter paper, Grade1 (medium flow filter paper) | GE Healthcare Pte Ltd Singapore | 1001 110 | |
| Cellulose filter paper, Grade113 (Fast flow filter paper) | Sigma-Aldrich, Singapore | 1113-320 | |
| 3-Aminopropyltrimethoxysilane | Sigma-Aldrich, Singapore | T1255 | >96% |
| Glutaraldehyde | Sigma-Aldrich, Singapore | G6257 | Grade II, 25% in H2O |
| Surfactant | Tween-20, Sigma-Aldrich, Singapore | P2287 | |
| Bovine serum album | Sigma-Aldrich, Singapore | A2153 | |
| Skimmed milk powder | Louis François | Packed by Kitchen Capers, Singapore | |
| Tris base | Promega | H5135 | |
| Sodium periodate | Merck | 106597 | |
| Na2HPO4 | Merck | 106585 | |
| KH2PO4 | Merck | 104873 | |
| NaCl | CALBIOCHEM | 567441 | |
| NaOH | Merck | 106462 | |
| HCL | Merck | 100317 | |
| phosphate buffer saline (PBS) | N/A | N/A | PBS, containing 137 mmol/L NaCl, 2.7 mmol/L KCl, 8.0 mmol/L Na2HPO4 and 1.5 mmol/L KH2PO4, is prepared with water and adjusted to pH 7.4 with 0.1 mol/L NaOH or 0.1 mol/L HCl |
| Acetone | Tee Hai Chem Pte Ltd Singapore | 9005-68 | |
| Mixture of TMB and hydrogen peroxide solution | 1-Step ultra TMB-ELISA solution , Thermo Scientific Pierce | 34029 | 1 L |
| Rabbit anti-human IgG-FITC | TWC/Bio Pte Ltd Singapore | sc-2278 | |
| Peroxidase conjugated goat anti-rabbit IgG | TWC/Bio Pte Ltd Singapore | sc-2030 | |
| Affinity purified goat anti-Mouse IgG-Fc coating antibody | Bethyl Laboratories, Inc | A90-131A | |
| Mouse reference serum | Bethyl Laboratories, Inc | RS10-101-5 | 9.5 mg/mL |
| HRP conjugated goat anti-mouse IgG-Fc detection antibody | Bethyl Laboratories, Inc | A90-131P | |
| Equipment | |||
| Fourier transform infrared spectrophotometer | Shimadzu IR Prestige-21 | N/A | |
| Fluorescence molecular imager | Pharos FXTM plus molecular imager, Bio-Rad, Singapore | N/A | |
| Oven | NUVE FN500 | N/A | |
| Turbo mixer VM-2000 | MYC LTD | N/A | |
| Image J | RGB, free download | N/A | |
Riferimenti
- Curtis, K. A., Rudolph, D. L., Owen, S. M. Rapid detection of HIV-1 by reverse-transcription, loop-mediated isothermal amplification (RT-LAMP). J. Virol. Methods. 151 (2), 264-270 (2008).
- Martinez, A. W., Phillips, S. T., Carrilho, E., Thomas, S. W., Sindi, H., Whitesides, G. M. Simple telemedicine for developing regions: camera phones and paper-based microfluidic devices for real-time, off-site diagnosis. Anal. Chem. 80 (10), 3699-3707 (2008).
- Lode, P. V. Point-of-care immunotesting: approaching the analytical performance of central laboratory methods. Clin. Biochem. 38 (7), 591-606 (2005).
- Posthuma-Trumpie, G. A., Amerongen, A. V., Korf, J., Berkel, W. J. V. Perspectives for on-site monitoring of progesterone. Trends Biotechnol. 27 (11), 652-660 (2009).
- Lim, D. V., Simpson, J. M., Kearns, E. A., Kramer, M. F. Current and developing technologies for monitoring agents of bioterrorism and biowarfare. Clin. Microbiol. Rev. 18 (4), 583-607 (2005).
- Li, X., Tian, J., Shen, W. Progress in patterned paper sizing for fabrication of paperbased microfluidic sensors. Cellulose. 17 (3), 649-659 (2010).
- Nie, Z., et al. Electrochemical sensing in paper-based microfluidic devices. Lab Chip. 10, 477-483 (2010).
- Delaney, J. L., Hogan, C. F., Tian, J., Shen, W. Electrogenerated chemiluminescence detection in paper-based microfluidic sensors. Anal. Chem. 83 (4), 1300-1306 (2011).
- Oh, Y. K., Joung, H. A., Kim, S., Kim, M. G. Vertical flow immunoassay (VFA) biosensor for a rapid one-step immunoassay. Lab Chip. 13 (5), 768-772 (2013).
- Cheng, C. M., et al. Paper-based ELISA. Angew. Chem. 122 (28), 4881-4884 (2010).
- Jarujamrus, P., Tian, J., Li, X., Siripinyanond, A., Shiowatana, J., Shen, W. Mechanisms of red blood cells agglutination in antibody-treated paper. Analyst. 137 (9), 2205-2210 (2012).
- Credou, J., Volland, H., Dano, J., Berthelot, T. A one-step and biocompatible cellulose functionalization for covalent antibody immobilization on immunoassay membranes. J. Mat. Chem. B. 1, 3277-3286 (2013).
- Kong, F., Hu, Y. F. Biomolecule immobilization techniques for bioactive paper fabrication. Anal. Bioanal. Chem. 403, 7-13 (2012).
- Orelma, H., Teerinen, T., Johansson, L. S., Holappa, S., Laine, J. CMC-modified cellulose biointerface for antibody conjugation. Biomacromolecules. 13, 1051-1058 (2013).
- Yu, A., et al. Biofunctional paper via covalent modification of cellulose. Langmuir. 28 (30), 11265-11273 (2012).
- Stollner, D., Scheller, F. W., Warsinke, A. Activation of cellulose membranes with 1,1′-carbonyldiimidazole or 1-cyano-4-dimethylaminopyridinium tetrafluoroborate as a basis for the development of immunosensors. Anal Biochem. 304 (2), 157-165 (2002).
- Bora, U., Sharma, P., Kannan, K., Nahar, P. Photoreactive cellulose membrane - a novel matrix for covalent immobilization of biomolecules. J. Biotechnol. 126 (2), 220-229 (2006).
- Sharma, P., Basir, S. F., Nahar, P. Photoimmobilization of unmodified carbohydrates on activated surface. J Colloid Interface Sci. 342 (1), 202-204 (2010).
- Brumer, H., Zhou, Q., Baumann, M. J., Carlsson, K., Teeri, T. T. Activation of crystalline cellulose surfaces through the chemoenzymatic modification of xyloglucan. J. Am. Chem. Soc. 126 (18), 5715-5721 (2004).
- Araujo, A. C., Song, Y., Lundeberg, J., Stahl, P. L., Brumer, H. Activated paper surfaces for the rapid hybridization of DNA through capillary transport. Anal Chem. 84 (7), 3311-3317 (2012).
- Xu, C., Spadiut, O., Araujo, A. C., Nakhai, A., Brumer, H. Chemo-enzymatic Assembly of Clickable Cellulose Surfaces via Multivalent Polysaccharides. ChemSusChem. 5 (4), 661-665 (2012).
- Filpponen, I., et al. Generic method for modular surface modification of cellulosic materials in aqueous medium by sequential "click" reaction and adsorption. Biomacromolecules. 13 (3), 736-742 (2012).
- Feese, E., Sadeghifar, H., Gracz, H. S., Argyropoulos, D. S., Ghiladi, R. A. Photobactericidal porphyrin-cellulose nanocrystals: synthesis, characterization, and antimicrobial properties. Biomacromolecules. 12 (10), 3528-3539 (2011).
- Zang, D., Ge, L., Yan, M., Song, X., Yu, J. Electrochemical immunoassay on a 3D microfluidic paper-based device. Chem. Commun. 48 (39), 4683-4685 (2012).
- Ge, L., Yan, J. X., Song, X. R., Yan, M., Ge, S. J., Yu, J. H. Three-dimensional paper-based electrochemiluminescence immunodevice for multiplexed measurement of biomarkers and point-of-care testing. Biomaterials. 33 (4), 1024-1031 (2012).
- Wang, S., et al. Paper-based chemiluminescence ELISA: lab-on-paper based on chitosan modified paper device and wax-screen-printing. Biosens. Bioelectron. 31 (1), 212-218 (2012).
- Koev, S. T., et al. Chitosan: an integrative biomaterial for lab-on-a-chip devices. Lab Chip. 10, 3026-3042 (2010).
- Wang, S. M., et al. Simple and covalent fabrication of a paper device and its application in sensitive chemiluminescence immunoassay. Analyst. 137 (16), 3821-3827 (2012).
- Sadira, S., Prabhakaranc, M. P., Wicaksonob, D. H. B., Ramakrishna, S. Fiber based enzyme-linked immunosorbent assay for C-reactive protein. Sensor Actuat B-Chem. 205, 50-60 (2014).
- Koga, H., Kitaoka, T., Isogai, A. In situ modification of cellulose paper with amino groups for catalytic applications. J. Mater. Chem. 21, 9356-9361 (2011).
- Klemm, D., Heublein, B., Fink, H. P., Bohn, A. Cellulose: fascinating biopolymer and sustainable raw material. Angew. Chem., Int. Ed. 44 (22), 3358-3393 (2005).
- Fernandes, S. C. M., et al. Bioinspired antimicrobial and biocompatible bacterial cellulose membranes obtained by surface functionalization with aminoalkyl groups. ACS Appl. Mater. Interfaces. 5 (8), 3290-3297 (2013).
- . . Pharos FX plus molecular imager instructions, Catalog Number 170-9460. , (2005).
- Tee, Y. B., Talib, R. A., Abdan, K., Chin, N. L., Basha, R. K., Yunos, K. F. M. Aminosilane-grafted cellulose. BioResourses. 8 (3), 4468-4483 (2013).
- Xing, Y., et al. Bioconjugated quantum dots for multiplexed and quantitative immunohistochemistry. Nat Protoc. 2, 1152-1165 (2007).
- Guidi, A., Laricchia-Robbio, L., Gianfaldoni, D., Revoltella, R., Del Bono, G. Comparison of a conventional immunoassay (ELISA) with a surface plasmon resonance-based biosensor for IGF-1 detection in cows' milk. Biosens Bioelectron. 16, 971-977 (2001).
- Ahmed, S., Bui, M. N., Abbas, A. Paper-based chemical and biological sensors: Engineering aspects. Biosens Bioelectron. 77, 249-263 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon