このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
セルロース紙ディスクおよび裸眼比色イムノアッセイにおけるそれらのアプリケーションへの抗体の共有結合
要約
In this manuscript, periodate oxidation and glutaraldehyde cross-linking methods for covalent immobilization of antibodies on paper discs are presented. The binding activity of immobilized antibodies was evaluated. Based on these results, a glutaraldehyde cross-linking method was used to develop a novel paper-based immunoassay for immunoglobulin G (IgG) detection.
要約
このレポートでは、セルロース濾紙グレード1号(メディアフローろ紙)ディスクやグレード番号113(高速フローろ紙)ディスク上の捕捉抗体の共有結合固定化するための2つの方法を提示します。抗体は、それらの上に固定される前に、これらのセルロース紙ディスクは、シランカップリング技術によりアミン官能基がグラフトしました。過ヨウ素酸酸化およびグルタルアルデヒド架橋方法は、セルロース紙ディスク上に捕捉抗体を移植するために使用しました。固定化後のその標的への捕捉抗体の最大結合能力を確保するために、過ヨウ素酸ナトリウム、グルタルアルデヒド、及び紙ディスクの表面上の捕捉抗体の様々な濃度の影響を調べました。過ヨウ素酸酸化法と比較した場合、グルタルアルデヒド架橋剤を介してアミン官能化セルロースペーパーディスク上にコーティングされた抗体は、標的への増強された結合活性を示しました。。 (マウス参照血清中の)IgGは、グルタルアルデヒドを介して共有結合的に固定化された抗体のアプリケーションをテストするために、本研究で基準ターゲットとして使用しました。新たな紙ベースの、酵素結合免疫吸着アッセイ(ELISA)の開発に成功し、IgGの検出のために検証されました。この方法では、機器を必要とせず、それは、IgGの100ng / mlのを検出することができます。高速フローフィルタ紙媒体流ろ紙より感受性でした。このアッセイのインキュベーション期間は短く、少量の試料を必要としました。この裸眼、比色イムノアッセイは、従来のELISAを用いて同定される他の標的を検出するために拡張することができます。
概要
ポイント・オブ・ケア検査(POCT)診断の研究では、治療のための新しい戦略の開発、個別化医療、ホームケアの1のために重要です。彼らは、安価なアクセス、およびユーザ2によく知られているとして、セルロース紙は広く、イムノアッセイでのプラットフォームとして使用されています。また、セルロース紙の多孔質構造は、付加的なエネルギーの影響を与えることなく、液体の流れを駆動するための電力を有しています。ペーパークロマトグラフィーは、最初1952年に発明されたときに紙ベースのバイオ分析のレコードは早ければ20 世紀に発見することができ、最も一般的な例は、妊娠と糖尿病テストストリップとしてイムノクロマトグラフィー検査3、です。これらのテストは、比較的高速な分析時間と安価な分析4を提供します 。それらの単純さのために、これらの従来の紙ストリップテストは、広くPOCT診断5で使用されてきました。
測色6を含む検出方法、電気化学7、及び電気化学発光8の方法は、生体試料中の標的を測定することが報告されています。これらの定量的な方法に加えて、セルロース紙に抗体を固定化するための信頼できる方法はまた、診断用デバイスの開発のために重要です。非特異的吸着は、固定化後のその標的への最大結合容量を確保するために、紙ベースのデバイス9,10の表面上に抗体を修飾するための主な戦略です。しかし、以前の研究 セルロース紙に吸着された抗体は、40%の繊維11から脱着することができることを示しました。したがって、セルロースへの抗体の直接吸着は、再現性のある結果12を提供することはできません。紙の表面上にグラフトされた抗体の共有結合固定化は、効果的な紙ベースのバイオアッセイ13を開発する代替的な方法です。種々の方法は、セルロース14,15の変形のために報告されています。理想的には、抗体が固定化12後に元の機能を維持する必要があります。カルボニルは、1-シアノ-4-ジメチルアミノテトラフルオロボレート16と組み合わせます。 1-フルオロ-2-ニトロ-4- azidobenzene UVベースの活性化戦略17、18を介し。キシログルカン修正19に基づく化学酵素戦略。 1,4-フェニレンジイソチオシアネートの連結剤20;ヘテロ酸化21クリックケミストリー22;そしてカチオン性ポルフィリン23は、共有セルロース紙に生体分子を固定化するために使用されています。キトサン修飾紙は、それが豊富で27生体適合性であるため、紙ベースimmunodevices 24-26を開発するために使用されてきました。キトサンは、カチオンであり、アニオン性セルロース27に強力に接着します。捕捉抗体は、キトサンコーティングおよびグルタルアルデヒド架橋を介して紙の上に固定されています。過ヨウ素酸酸化はCAPTをグラフトするための別の方法でありますセルロース紙28上のURE抗体。この方法では、過ヨウ素酸ナトリウムは、アルデヒド基に直接セルロース1,2-ジヒドロキシ(エチレングリコール)基に変換するために紙の上にスポットします。アルデヒド基は、次いで、多糖類および抗体28の間に共有結合を形成するために使用されます。製造が簡単であるが、完全に過ヨウ素酸ナトリウムを洗い流すことが困難です。未洗浄の過ヨウ素酸ナトリウムは、抗体の活性および安定性に影響を与える、セルロース紙に固定化された抗体のさらなる酸化を引き起こすことができるNが - (3-ジメチルアミノプロピル) - Nエチルカルボジイミド塩酸塩およびN-ヒドロキシスクシンイミド架橋剤をも使用されています共有ナノファイバーベースのアッセイ29の開発のための電界紡糸ポリL-乳酸および酢酸セルロースナノファイバー上に抗体を固定化します。
この研究では、シランカップリング技術はcellulos上のアミン官能基をグラフトするために使用されました電子ペーパーディスク。この技術は、イムノアッセイにおいて最大垂直フロースルーを可能にする、元の孔径、ウィッキング、及びセルロース濾紙の濾過速度を維持するのに役立ちます。シランカップリング技術は、広く生体分子を用いてさらに修飾に続いて第二級アミン基を有する基板表面を官能化するためにバイオセンサーに使用されています。マトリックス表面上のアミン基のグラフトは、有機官能性シラン剤とマトリクス基板30の-OH基との縮合反応を含みます。セルロース紙ディスクは3-アミノプロピルトリメトキシシラン(APS)31を介して、シランカップリングによってアミノ基で官能化しました。これは、2つの異なる方法を使用して共有結合固定化捕捉抗体が続きました。第一の方法は、アミン官能化セルロースペーパーディスクに素酸酸化捕捉抗体の結合を含んでいました。第二の方法は、キャプチャを添付し、架橋剤としてグルタルアルデヒドを使用antibodiアミン基官能化セルロースペーパーディスクにエス。捕捉抗体の存在は、蛍光分子イメージャーを用いて、ウサギ抗ヒトIgGのフルオレセインイソチオシアネート(FITC)で確認しました。抗ウサギIgGヤギに対するウサギ抗ヒトIgG-FITCの結合活性は、ペルオキシダーゼ基質により評価しました。過ヨウ素酸ナトリウム、グルタルアルデヒド、および捕捉抗体の様々な濃度の影響を調べました。固定化捕捉抗体の適用試験は正常IgG血清の検出により行いました。
プロトコル
セルロース紙ディスク上の1グラフトのアミン官能基
- 1cm角、およびパンチを用いて、6.0ミリメートル(中流量ろ紙)の直径を有するグレード第1セルロース紙から作られた100ペーパーディスクの大きさの正方形の紙1枚を準備します。
- ペーパーディスク上に-NH 2基を導出するために、ドラフト内で50mlのガラスボトル内の1mLのAPS、10mlのアセトンを混合します。新たに調製したAPS試薬混合物にペーパーディスクを追加し、室温32での軌道攪拌(200rpm)しながら5時間インキュベートします。
注意:ドラフト内でAPSおよびアセトンを処理します。 - 有機性廃棄物容器に50ミリリットルのガラス瓶から余分な溶液をデカント。
- 、ガラスボトルにアセトン10mlを加え、よく混ぜ、任意の未反応のAPSおよび他の不純物を除去するために、完全にデカント。このステップを2回繰り返します。
- 3時間110℃のオーブンでペーパータオルや場所にペーパーディスクを広げます。許可しますペーパーディスクを冷却します。室温で50 ml遠心チューブ内のディスクを保管してください。
- 下記( 図3A)に記載のように、セルロース正方形の紙の上にアミン基のグラフト化を確認するために、赤外分光法(FTIR)をフーリエ変換を使用してください。
- コンピュータの電源をオンにし、FTIR分光装置を開きます。
- FTIR分光法のためのソフトウェアを開きます。
- 「測定→初期化」に移動します。 「BS:KBr法 'の長方形は、:初期化が終了したときに「ランプ赤外線」と「レーザー」は緑色に変わります。
- 長方形の下に「データ」を選択し、「%の透過率」、「ハップ-Genzelアポ '、' 45 '、' 4.0 '、および'ミン:400、最大:4000」を選択し「測定モード」のために、 "アポダイゼーション '、'いいえ。 「スキャン」、「解像度」、および「レンジ(CM-1)の。
- 「測定」をクリックしてください。
- 背景データのための「データファイル」を選択します。書きますコメントダウン。
- 背景のベースラインを取得するには「BKG]をクリックします。
- フィルム試料ホルダー上の正方形の紙を修正しました。
- サンプルデータのための「データファイル」を選択します。コメントを書き留めます。
- サンプルのためのスペクトルを得るために「サンプル」をクリックしてください。
- FTIR分光法のアプリケーションを閉じて、コンピュータの電源をオフにします。
- 上記の手順を(1.6から1.1ステップ)アミン官能グレード号113セルロース正方形の紙及びディスク(高速フローろ紙)を調製するために繰り返し、グレード番号113平方紙( 図3B)のためのFTIRスペクトルを得ます。
アミン官能化セルロースペーパーディスク上の抗体の2.共有固定化
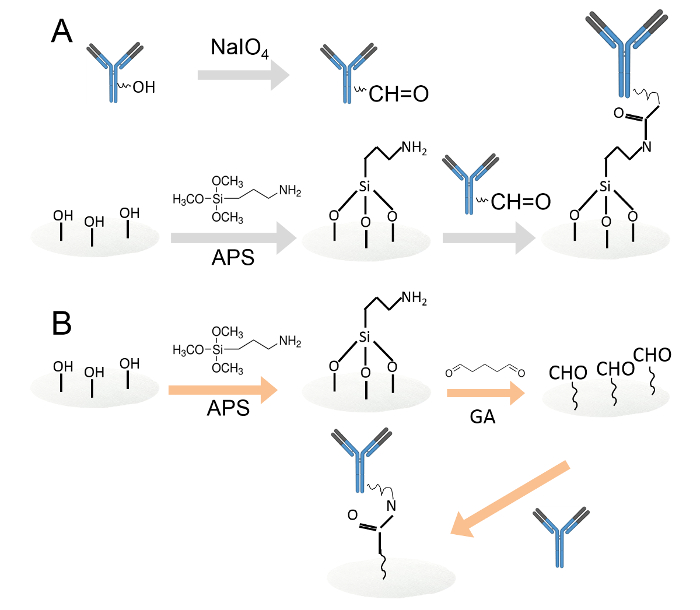
2つの異なる方法によって抗体の1.共有結合固定化を図。過ヨウ素酸酸化を介してアミン官能化セルロース紙ディスク上に固定化することができる。抗体。炭水化物残基は、アルデヒド官能基を生成する過ヨウ素酸ナトリウムで酸化しました。次に、酸化された抗体は、アミン官能化セルロースペーパーディスクにロードした。B。抗体は、その後、グルタルアルデヒドを介してアミン官能化セルロースペーパーディスク上に固定化しました。アミン官能化セルロースペーパーディスクは、紙ディスクにアルデヒド基を導入するために0.05%グルタルアルデヒド溶液に浸漬しました。洗浄後、抗体は、アルデヒド官能ペーパーディスクにロードした。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- 過ヨウ素酸酸化( 図1A)を介してアミン官能化セルロース紙ディスク上に抗体を固定化します。
- 2.5 mMのナトリウムperioda1μlのミックス0.1mg / mlのウサギ抗ヒトIgG-FITCおよび1.5ミリリットルチューブ中の100mM pH5.5の酢酸緩衝液の7μlに2μlのTE、そして暗所で30分間混合物をインキュベートします。
注:必要に応じて、複数の酸化抗体を調製するために、この体積比に従ってください。過ヨウ素酸ナトリウムとウサギ抗ヒトIgG-FITCの濃度を最適化するために、容積比を変えます。 - 40μlの最終容量まで、50 mMリン酸緩衝生理食塩水(pH7.4のPBS)を30μlの上記抗体溶液を希釈します。
- 三アミン官能媒体流濾紙ディスク及び(セクション1で説明したように)は、3つのアミン官能ファストフローペーパーディスクを準備します。
- 各メディアフローフィルターペーパーディスク、各ファストフロー濾紙ディスクに8μlの上に過ヨウ素酸ナトリウム酸化ウサギ抗ヒトIgG-FITCの負荷を5μl。室温で1時間暗所でこれらのペーパーディスクを保管してください。
- 洗濯バフの0.2ミリリットルでペーパーディスクのそれぞれを洗いますER(50mMのトリス、0.15MのNaCl及び0.05%の界面活性剤、pH7.4で緩衝液)。洗浄を3回繰り返します。
- 各セルロースペーパーディスク32上の抗体の存在を同定するために蛍光分子イメージャーを介して蛍光画像を撮影します。 (S3図には、 図S1)を対照として(過ヨウ素酸ナトリウムの不存在下での抗体の同じ濃度で処理された)白紙のディスクを使用してください。
注:実験的最適化のために、最適化され、他のすべてのパラメータの濃度を修正する必要がある一つのパラメータの濃度を変更します。高い蛍光強度は、セルロースペーパーディスク上に固定化された捕捉抗体の量を増加させます。
- 2.5 mMのナトリウムperioda1μlのミックス0.1mg / mlのウサギ抗ヒトIgG-FITCおよび1.5ミリリットルチューブ中の100mM pH5.5の酢酸緩衝液の7μlに2μlのTE、そして暗所で30分間混合物をインキュベートします。
- グルタルアルデヒド( 図1B)を介して、アミン官能基化セルロース紙ディスク上に抗体を固定化します。
- 3つのAP処置した媒体流濾紙ディスク三ファストフロー濾紙ディスクを追加する(DES室温でオービタル攪拌しながら、1時間、0.05%グルタルアルデヒドが含まれている50mMのPBS(pH7.4)中の2ミリリットルのセクション1)でcribed。
注意:ドラフト内でグルタルアルデヒドを処理します。 - 2 1.5ミリリットルの遠心分離管に3枚のディスクをそれぞれ配置します。各チューブに、脱イオン(DI)水1mlを加え、10秒間チューブを振ります。ピペットで吸引することにより、水を除去します。未反応のグルタルアルデヒドを除去するために、さらに2回繰り返します。
- 負荷5の各アルデヒド官能メディアフローフィルターペーパーディスク上に25 / mlのウサギ抗ヒトIgG-FITC(捕捉抗体)のμlを、各アルデヒド官能高速フロー濾紙ディスクに8μlを添加します。室温で約20分間、暗所でインキュベートします。次に、抗体を除去することなく、各ペーパーディスクに50mMのPBS(pH7.4)中の10μlを添加し、アミンアルデヒド反応のために40分間インキュベートします。
- ペーパータオルの上に洗浄用緩衝液の0.2ミリリットルでペーパーディスクを洗ってください。繰り返し2回洗浄します。
- 各セルロースペーパーディスク33上の抗体の存在を確認するために蛍光分子イメージャーを介して蛍光画像を撮影。コントロールとして白紙のディスクを使用してください。
注: 図4で、 '0'は、グルタルアルデヒドの非存在下でFITC抗体と同じ濃度で処理した白紙のディスクを表し、 図5Aに、白紙ディスクはグルタルアルデヒドで処理した、しかしFITC抗体は、ペーパーディスク上にロードされませんでした。
- 3つのAP処置した媒体流濾紙ディスク三ファストフロー濾紙ディスクを追加する(DES室温でオービタル攪拌しながら、1時間、0.05%グルタルアルデヒドが含まれている50mMのPBS(pH7.4)中の2ミリリットルのセクション1)でcribed。
- 37℃で10分間(セクション2.1および2.2からの)紙ディスクを乾燥させます。
- ブロッキング緩衝液15μlのペーパーディスクをブロック室温で10分間(10%0.15 M NaClで、50mMのトリス緩衝液、pH7.4中脱脂粉乳)。
- 負荷5μLおよびPBS(1:10,000)でペルオキシダーゼ結合ヤギ抗ウサギIgG8μlの媒体流をそれぞれ高速流濾紙ディスク上へ。インキュベート室温で暗所で30分。
- ペーパータオルの上に洗浄用緩衝液の0.2ミリリットルでペーパーディスクを洗ってください。洗浄を3回繰り返します。
注:これは、結果がバッファに影響されないように洗浄緩衝液を除去する必要はありません。 - 各ディスクに3,3 '、5,5'-テトラメチルベンジジン(TMB)及び過酸化水素溶液の10μlの混合物をロードします。
- インキュベーションの5分後に、デジタルカメラやスマートフォンでペーパーディスクの画像を撮影します。
注: 図5Bには、 '0' FITC抗体の非存在下で抗体HRP(ホースラディッシュペルオキシダーゼ)コンジュゲートをロードし、その後グルタルアルデヒドで処理したペーパーディスクを表します。
IgGの検出のための3紙ベースELISA
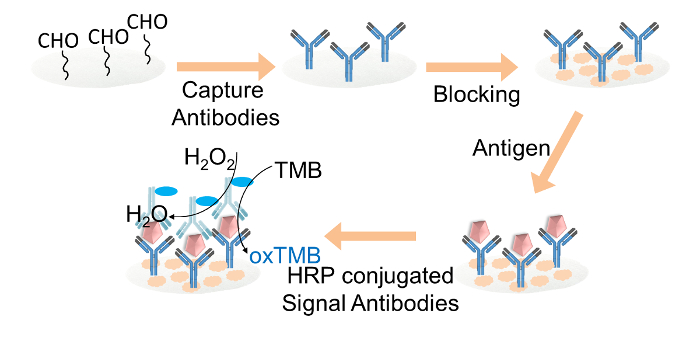
紙ベースのELISA FOの図2.略図R IgGを検出。キャプチャ抗体は、共有結合、グルタルアルデヒドを介して、アルデヒド官能化セルロースペーパーディスク上に固定化しました。セルロース紙ディスクを、ブロッキング緩衝液でブロックしました。ターゲットIgGは、次にHRPコンジュゲート信号の抗体のローディングに続いて、ディスクに添加しました。最後に、TMB及び過酸化水素の混合溶液は、カラー読み出しのため、各ペーパーディスクにロードした。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- 20mLのガラス瓶に(50mMのPBS緩衝液、pH7.4に調製した)0.05%グルタルアルデヒド溶液5mlを加えます。この溶液中の15アミン官能メディアフローフィルターペーパーディスクを浸し、室温で振とうしながら1時間保ちます。
- 同時に、繰り返しステップ3.1は、他の15のアルデヒド官能ファストフロー濾紙ディスクを作製しました。
注意:ヒューム中のグルタルアルデヒドをハンドルフード。
- 同時に、繰り返しステップ3.1は、他の15のアルデヒド官能ファストフロー濾紙ディスクを作製しました。
- ペーパーディスクから未反応のグルタルアルデヒドを除去するために、別の15mL遠心管に15mlの遠心管中15中のフロー濾紙ディスク、及び15ファストフロー濾紙ディスクを置きます。各チューブに脱イオン水5mlを加え、10秒間チューブを振ります。ピペットで吸引することにより、水を除去します。未反応のグルタルアルデヒドを除去するために、2回繰り返します。
- 37℃のオーブンペーパーディスクを乾燥させます。
- それぞれ、メディアフローと速い流れのろ紙ディスクのそれぞれに5μlの0.025 mg / mlでマウスIgG-Fc断片抗体の8μlを添加し、20分間インキュベートします。
- 抗体を除去することなく、各ペーパーディスクに50mMのPBS(pH7.4)中の10μlを添加して、アミンアルデヒド反応のために40分間インキュベートします。
- ペーパータオルの上に洗浄用緩衝液の0.2ミリリットルでペーパーディスクを洗ってください。洗浄を3回繰り返します。
- 37℃のオーブンペーパーディスクを乾燥させます。
- ワットペーパーディスクをブロック室温で10分間ブロッキング緩衝液15μlのi番目。
- ペーパータオルの上に洗浄用緩衝液の0.2ミリリットルで、各ペーパーディスクを洗ってください。洗浄を3回繰り返します。
- IgGの標準を実行します。
- 負荷様々なIgGの濃度の10μlの( 例えば 、0、10、125、250、および500 ngの/ PBS中ミリリットル)三連の各ディスク上に。室温で1時間インキュベートします。
- ペーパータオルの上に洗浄用緩衝液の0.2ミリリットルでペーパーディスクを洗ってください。洗浄を3回繰り返します。
- 負荷HRP結合マウスIgG-Fc断片抗体を10μl(1:10,000 10mMのPBS、pH7.4)中、室温で1時間インキュベートします。
- ペーパータオルの上に洗浄用緩衝液の0.2ミリリットルでペーパーディスクを洗ってください。洗浄を3回繰り返します。
注記:結果は、緩衝液の存在によって影響されないように洗浄緩衝液を除去する必要はありません。 - 各ディスクにTMB10μlの混合物と過酸化水素をロードします。
- Tインキュベーションの5分後にデジタルカメラやスマートフォンを持つすべてのペーパーディスクのイメージAKE。
注: 図6Aでは、 '0'捕捉抗体固定化で処理されたペーパーディスク、およびIgGの血清を含まない抗体HRP / TMB溶液を意味します。 - イメージJ.ことにより、画像内の各ペーパーディスクの強度を分析
- ステップ3.15で撮影した画像は、「tifファイル」形式に変換します。
- 「イメージJ」ソフトウェアを開きます。
- 「ファイル→開く」に移動し、分析するための画像を選択します。
- 形状ボタン「オーバル」を選択します。
- 「イメージ→タイプ→32ビット」に移動します。
- 「編集→反転」に移動します。
- 「分析→メジャー」に移動します。
- コピーし、スプレッドシート内のデータを分析します。
結果
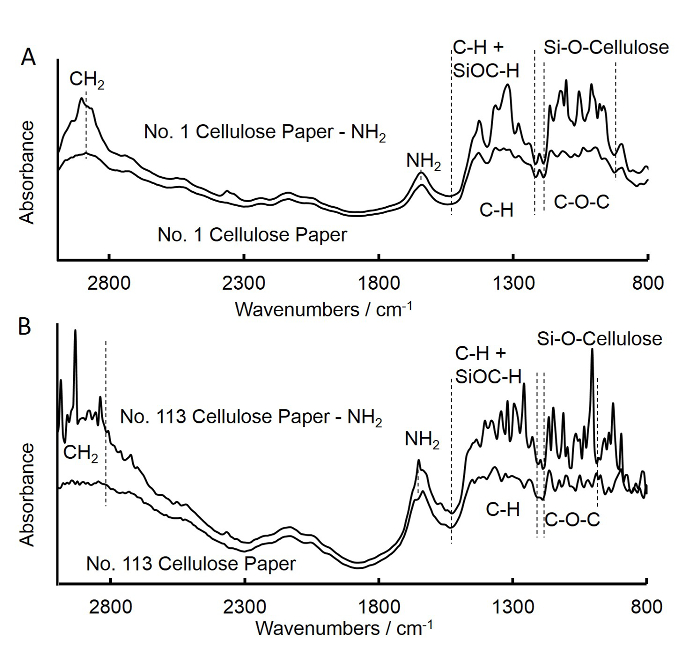
図3. フーリエ変換は、未処理およびAPS処理されたメディアフローフィルター平方紙(A)と高速フローフィルター平方紙(B)。Aの赤外(FTIR)スペクトルを変換します。未処理のメディアフローフィルタの正方形の紙のためのスペクトルは、APS処理されたメディアフローフィルタ...
ディスカッション
非修飾セルロースペーパーディスク上のアフィニティー精製したヤギ抗マウスIgG-Fcの捕捉抗体の直接コーティングは、IgG濃度を検出するために行きました。結果は、捕捉抗体のさらなる固定が再現性のために必要とされることを示しました。シラン化技術は、正常セルロースペーパーディスク34にアミン官能基を導入するために使用されました。 APSの濃度は、抗体の固定化に影響を?...
開示事項
The authors have nothing to disclose.
謝辞
This work was financially supported by the Ministry of Education, Singapore through the Translational and Innovation Grant (MOE2012-TIF-2-G-009).
資料
| Name | Company | Catalog Number | Comments |
| Cellulose filter paper, Grade 1 (medium flow filter paper) | GE Healthcare Pte Ltd Singapore | 1001 110 | |
| Cellulose filter paper, Grade 113 (Fast flow filter paper) | Sigma-Aldrich, Singapore | 1113-320 | |
| Glutaraldehyde | Sigma-Aldrich, Singapore | G6257 | Grade II, 25% in H2O |
| Surfactant | Tween-20, Sigma-Aldrich, Singapore | P2287 | |
| Bovine serum album | Sigma-Aldrich, Singapore | A2153 | |
| Skimmed milk powder | Louis François | Packed by Kitchen Capers, Singapore | |
| Tris base | Promega | H5135 | |
| Sodium periodate | Merck | 106597 | |
| Na2HPO4 | Merck | 106585 | |
| KH2PO4 | Merck | 104873 | |
| NaCl | CALBIOCHEM | 567441 | |
| NaOH | Merck | 106462 | |
| HCl | Merck | 100317 | |
| phosphate buffer saline (PBS) | N/A | N/A | PBS, containing 137 mmol/L NaCl, 2.7 mmol/L KCl, 8.0 mmol/L Na2HPO4 and 1.5 mmol/L KH2PO4, is prepared with water and adjusted to pH 7.4 with 0.1 mol/L NaOH or 0.1 mol/L HCl |
| Acetone | Tee Hai Chem Pte Ltd Singapore | 9005-68 | |
| Mixture of TMB and hydrogen peroxide solution | 1-Step ultra TMB-ELISA solution , Thermo Scientific Pierce | 34029 | 1 L |
| Rabbit anti-human IgG-FITC | TWC/Bio Pte Ltd Singapore | sc-2278 | |
| Peroxidase conjugated goat anti-rabbit IgG | TWC/Bio Pte Ltd Singapore | sc-2030 | |
| Affinity purified goat anti-Mouse IgG-Fc coating antibody | Bethyl Laboratories, Inc | A90-131A | |
| Mouse reference serum | Bethyl Laboratories, Inc | RS10-101-5 | 9.5 mg/ml |
| HRP conjugated goat anti-mouse IgG-Fc detection antibody | Bethyl Laboratories, Inc | A90-131P | |
| Equipment | |||
| Fourier transform infrared spectrophotometer | Shimadzu IR Prestige-21 | N/A | |
| Fluorescence molecular imager | Pharos FXTM plus molecular imager, Bio-Rad, Singapore | N/A | |
| Oven | NUVE FN500 | N/A | |
| Turbo mixer VM-2000 | MYC LTD | N/A | |
| ImageJ | RGB, free download | N/A |
参考文献
- Curtis, K. A., Rudolph, D. L., Owen, S. M. Rapid detection of HIV-1 by reverse-transcription, loop-mediated isothermal amplification (RT-LAMP). J. Virol. Methods. 151 (2), 264-270 (2008).
- Martinez, A. W., Phillips, S. T., Carrilho, E., Thomas, S. W., Sindi, H., Whitesides, G. M. Simple telemedicine for developing regions: camera phones and paper-based microfluidic devices for real-time, off-site diagnosis. Anal. Chem. 80 (10), 3699-3707 (2008).
- Lode, P. V. Point-of-care immunotesting: approaching the analytical performance of central laboratory methods. Clin. Biochem. 38 (7), 591-606 (2005).
- Posthuma-Trumpie, G. A., Amerongen, A. V., Korf, J., Berkel, W. J. V. Perspectives for on-site monitoring of progesterone. Trends Biotechnol. 27 (11), 652-660 (2009).
- Lim, D. V., Simpson, J. M., Kearns, E. A., Kramer, M. F. Current and developing technologies for monitoring agents of bioterrorism and biowarfare. Clin. Microbiol. Rev. 18 (4), 583-607 (2005).
- Li, X., Tian, J., Shen, W. Progress in patterned paper sizing for fabrication of paperbased microfluidic sensors. Cellulose. 17 (3), 649-659 (2010).
- Nie, Z., et al. Electrochemical sensing in paper-based microfluidic devices. Lab Chip. 10, 477-483 (2010).
- Delaney, J. L., Hogan, C. F., Tian, J., Shen, W. Electrogenerated chemiluminescence detection in paper-based microfluidic sensors. Anal. Chem. 83 (4), 1300-1306 (2011).
- Oh, Y. K., Joung, H. A., Kim, S., Kim, M. G. Vertical flow immunoassay (VFA) biosensor for a rapid one-step immunoassay. Lab Chip. 13 (5), 768-772 (2013).
- Cheng, C. M., et al. Paper-based ELISA. Angew. Chem. 122 (28), 4881-4884 (2010).
- Jarujamrus, P., Tian, J., Li, X., Siripinyanond, A., Shiowatana, J., Shen, W. Mechanisms of red blood cells agglutination in antibody-treated paper. Analyst. 137 (9), 2205-2210 (2012).
- Credou, J., Volland, H., Dano, J., Berthelot, T. A one-step and biocompatible cellulose functionalization for covalent antibody immobilization on immunoassay membranes. J. Mat. Chem. B. 1, 3277-3286 (2013).
- Kong, F., Hu, Y. F. Biomolecule immobilization techniques for bioactive paper fabrication. Anal. Bioanal. Chem. 403, 7-13 (2012).
- Orelma, H., Teerinen, T., Johansson, L. S., Holappa, S., Laine, J. CMC-modified cellulose biointerface for antibody conjugation. Biomacromolecules. 13, 1051-1058 (2013).
- Yu, A., et al. Biofunctional paper via covalent modification of cellulose. Langmuir. 28 (30), 11265-11273 (2012).
- Stollner, D., Scheller, F. W., Warsinke, A. Activation of cellulose membranes with 1,1′-carbonyldiimidazole or 1-cyano-4-dimethylaminopyridinium tetrafluoroborate as a basis for the development of immunosensors. Anal Biochem. 304 (2), 157-165 (2002).
- Bora, U., Sharma, P., Kannan, K., Nahar, P. Photoreactive cellulose membrane - a novel matrix for covalent immobilization of biomolecules. J. Biotechnol. 126 (2), 220-229 (2006).
- Sharma, P., Basir, S. F., Nahar, P. Photoimmobilization of unmodified carbohydrates on activated surface. J Colloid Interface Sci. 342 (1), 202-204 (2010).
- Brumer, H., Zhou, Q., Baumann, M. J., Carlsson, K., Teeri, T. T. Activation of crystalline cellulose surfaces through the chemoenzymatic modification of xyloglucan. J. Am. Chem. Soc. 126 (18), 5715-5721 (2004).
- Araujo, A. C., Song, Y., Lundeberg, J., Stahl, P. L., Brumer, H. Activated paper surfaces for the rapid hybridization of DNA through capillary transport. Anal Chem. 84 (7), 3311-3317 (2012).
- Xu, C., Spadiut, O., Araujo, A. C., Nakhai, A., Brumer, H. Chemo-enzymatic Assembly of Clickable Cellulose Surfaces via Multivalent Polysaccharides. ChemSusChem. 5 (4), 661-665 (2012).
- Filpponen, I., et al. Generic method for modular surface modification of cellulosic materials in aqueous medium by sequential "click" reaction and adsorption. Biomacromolecules. 13 (3), 736-742 (2012).
- Feese, E., Sadeghifar, H., Gracz, H. S., Argyropoulos, D. S., Ghiladi, R. A. Photobactericidal porphyrin-cellulose nanocrystals: synthesis, characterization, and antimicrobial properties. Biomacromolecules. 12 (10), 3528-3539 (2011).
- Zang, D., Ge, L., Yan, M., Song, X., Yu, J. Electrochemical immunoassay on a 3D microfluidic paper-based device. Chem. Commun. 48 (39), 4683-4685 (2012).
- Ge, L., Yan, J. X., Song, X. R., Yan, M., Ge, S. J., Yu, J. H. Three-dimensional paper-based electrochemiluminescence immunodevice for multiplexed measurement of biomarkers and point-of-care testing. Biomaterials. 33 (4), 1024-1031 (2012).
- Wang, S., et al. Paper-based chemiluminescence ELISA: lab-on-paper based on chitosan modified paper device and wax-screen-printing. Biosens. Bioelectron. 31 (1), 212-218 (2012).
- Koev, S. T., et al. Chitosan: an integrative biomaterial for lab-on-a-chip devices. Lab Chip. 10, 3026-3042 (2010).
- Wang, S. M., et al. Simple and covalent fabrication of a paper device and its application in sensitive chemiluminescence immunoassay. Analyst. 137 (16), 3821-3827 (2012).
- Sadira, S., Prabhakaranc, M. P., Wicaksonob, D. H. B., Ramakrishna, S. Fiber based enzyme-linked immunosorbent assay for C-reactive protein. Sensor Actuat B-Chem. 205, 50-60 (2014).
- Koga, H., Kitaoka, T., Isogai, A. In situ modification of cellulose paper with amino groups for catalytic applications. J. Mater. Chem. 21, 9356-9361 (2011).
- Klemm, D., Heublein, B., Fink, H. P., Bohn, A. Cellulose: fascinating biopolymer and sustainable raw material. Angew. Chem., Int. Ed. 44 (22), 3358-3393 (2005).
- Fernandes, S. C. M., et al. Bioinspired antimicrobial and biocompatible bacterial cellulose membranes obtained by surface functionalization with aminoalkyl groups. ACS Appl. Mater. Interfaces. 5 (8), 3290-3297 (2013).
- . . Pharos FX plus molecular imager instructions, Catalog Number 170-9460. , (2005).
- Tee, Y. B., Talib, R. A., Abdan, K., Chin, N. L., Basha, R. K., Yunos, K. F. M. Aminosilane-grafted cellulose. BioResourses. 8 (3), 4468-4483 (2013).
- Xing, Y., et al. Bioconjugated quantum dots for multiplexed and quantitative immunohistochemistry. Nat Protoc. 2, 1152-1165 (2007).
- Guidi, A., Laricchia-Robbio, L., Gianfaldoni, D., Revoltella, R., Del Bono, G. Comparison of a conventional immunoassay (ELISA) with a surface plasmon resonance-based biosensor for IGF-1 detection in cows' milk. Biosens Bioelectron. 16, 971-977 (2001).
- Ahmed, S., Bui, M. N., Abbas, A. Paper-based chemical and biological sensors: Engineering aspects. Biosens Bioelectron. 77, 249-263 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved