É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A ligação covalente de anticorpos para celulose discos de papel e suas aplicações em visível a olho nu colorimétricos imunoensaios
Neste Artigo
Resumo
In this manuscript, periodate oxidation and glutaraldehyde cross-linking methods for covalent immobilization of antibodies on paper discs are presented. The binding activity of immobilized antibodies was evaluated. Based on these results, a glutaraldehyde cross-linking method was used to develop a novel paper-based immunoassay for immunoglobulin G (IgG) detection.
Resumo
Este relatório apresenta dois métodos para a imobilização covalente de anticorpos de captura na filtro de celulose tipo de papel No. 1 (papel de filtro de médio fluxo) discos e grau No. 113 (papel de filtro fast-fluxo) discos. Estes discos de papel de celulose foram enxertado com grupos funcionais de amina através de uma técnica de acoplamento de silano antes de os anticorpos foram imobilizados sobre eles. métodos de ligação cruzada de oxidação e glutaraldeído periodato foram usadas para enxertar anticorpos de captura sobre os discos de papel de celulose. A fim de garantir a capacidade máxima de ligação dos anticorpos de captura para os seus alvos após imobilização, foram investigados os efeitos de várias concentrações de periodato de sódio, o glutaraldeído, e anticorpos de captura na superfície dos discos de papel. Os anticorpos que foram revestidas sobre os discos de papel de celulose funcionalizada com amina por meio de um agente de reticulação com glutaraldeído observado aumento na actividade de ligação ao alvo, quando comparado com o método de oxidação com periodato. IgG (no soro do rato de referência) foi usado como um alvo de referência neste estudo para testar a aplicação de anticorpos imobilizados covalentemente através de glutaraldeído. Um novo à base de papel, ensaio imunoabsorvente ligado a enzima (ELISA) foi desenvolvido e validado para a detecção de anticorpos IgG com sucesso. Este método não necessita de equipamento, e pode detectar de 100 ng / ml de IgG. O papel de filtro rápido de fluxo foi mais sensível do que o papel de filtro de média de fluxo. O período de incubação do presente ensaio foi de curta e necessário pequenos volumes de amostra. Este visível a olho nu, imunoensaio colorimétrica pode ser estendido para detectar outros alvos que estão identificados com ELISA convencional.
Introdução
O estudo de diagnóstico testes point-of-care (POCT) é importante para o desenvolvimento de novas estratégias para a terapêutica, medicina personalizada e atendimento domiciliar 1. Papéis de celulose são amplamente utilizados como plataformas em imunoensaios, porque são baratos, acessível, e familiar para os utilizadores 2. Além disso, a estrutura porosa de papel de celulose possui a capacidade de dirigir o fluxo de líquido sem impacto de energia adicional. Registros de bioanalysis baseado em papel pode ser encontrada já no século 20, quando a cromatografia em papel foi inventado pela primeira vez em 1952. O exemplo mais comum é os testes imunocromatográficos 3, tais como a gravidez e testes de diabetes tiras. Estes testes fornecem tempos de ensaio relativamente rápidos e análises barato 4. Devido à sua simplicidade, estes testes em tiras de papel convencionais têm sido amplamente utilizados em diagnósticos POCT 5.
Métodos de detecção, incluindo colorimétrico 6, electroquímicas 7, 8 e de electroquimioluminescência têm sido relatados métodos para medir alvos em amostras biológicas. Em adição a estes métodos quantitativos, um método fiável para a imobilização de anticorpos sobre papel de celulose também é importante para o desenvolvimento de dispositivos de diagnóstico. Adsorção não específica é a principal estratégia para modificar anticorpos na superfície dos dispositivos à base de papel 9, 10 para garantir uma capacidade de ligação máxima aos seus alvos após imobilização. No entanto, um estudo anterior mostraram que os anticorpos que são adsorvidos sobre papel de celulose pode dessorver a partir das fibras 11 em 40%. Assim, a adsorção direta de anticorpos sobre a celulose podem não fornecer resultados reproduzíveis 12. Imobilização covalente de anticorpos que são enxertadas sobre as superfícies de papel é um método alternativo para o desenvolvimento de bioensaios baseados em papel eficazes 13. Vários métodos têm sido relatados para a modificação de celulose 14, 15 . Idealmente, os anticorpos devem manter a sua funcionalidade original após imobilização 12. Carbonildiimidazole combinado com tetrafluoroborato de 1-ciano-4-dimetilaminopiridínio 16; 1-fluoro-2-nitro-4-azidobenzene através de uma estratégia de activação à base de UV 17, 18; quimioenzimáticas uma estratégia baseada em 19 de modificação xiloglucano; um agente de ligação 1,4-phenylenediisothiocyanate 20; heteropolysaccharide oxidação 21 click chemistry 22; e porfirinas catiónicos 23 têm sido utilizados para imobilizar biomoléculas covalentemente em papel de celulose. Papel modificado quitosano tem sido usado para desenvolver immunodevices base de papel 24-26, uma vez que é abundante e biocompatível 27. O quitosano é catiónico e adere fortemente à celulose aniónico 27. Os anticorpos de captura são imobilizadas no papel por meio de revestimento de quitosano e reticulação com glutaraldeído. oxidação por periodato é outro método para enxerto do captanticorpos Ure no papel de celulose 28. Neste método, periodato de sódio é manchada no papel para converter os grupos 1,2-di-hidroxilo (glicol) em celulose directamente para grupos aldeído. Os grupos aldeído são então utilizadas para formar ligações covalentes entre polissacarídeos e anticorpos 28. Embora o fabrico é simples, que é difícil de lavar completamente fora de periodato de sódio. O periodato de sódio não lavado pode causar oxidação adicional dos anticorpos que são imobilizadas no papel de celulose, que afectam a actividade e a estabilidade dos anticorpos N -. (3-dimetilaminopropil) - N-etilcarbodiimida e N-hidroxissuccinimida reticuladores são também utilizados para covalentemente imobilizar anticorpos em nanofibras de celulose e acetato de ácido poli-L-láctico electrospun para o desenvolvimento de ensaios baseados em nanofibras 29.
Neste estudo, uma técnica de acoplamento de silano foi usada para enxertar grupos funcionais amina sobre cellulosDiscos de papel e. Esta técnica ajuda a reter o tamanho original dos poros, em torcida, e taxa de filtração dos filtros de papel de celulose, permitindo imunoensaios verticais máximos de fluxo de passagem em. A técnica de acoplamento de silano tem sido amplamente utilizada em biossensores para funcionalizar superfícies do substrato com grupos amina secundária, seguida de modificação adicional utilizando biomoléculas. A enxertia de grupos amina sobre a superfície da matriz compreende uma reacção de condensação entre os grupos -OH de os agentes de silano organofuncional e substrato de matriz 30. Os discos de papel de celulose foram funcionalizada com grupos de amina por meio de acoplamento de silano de 3-aminopropiltrimetoxissilano (APS) 31. Isto foi seguido de anticorpos de captura covalentemente imobilizantes usando dois métodos diferentes. O primeiro método envolveu a ligação de anticorpos de captura oxidados de periodato para os discos de papel de celulose amina funcionalizada. O segundo método utilizado o glutaraldeído como agente de reticulação para ligar o antibodi capturaES para os discos de papel de celulose funcionalizada com grupos de amina. A presença de anticorpos de captura foi confirmada por coelho isotiocianato de fluoresceína IgG anti-humano (FITC), utilizando um gerador de imagens de fluorescência molecular. A actividade de ligação de anticorpo de coelho anti-IgG humana-FITC de cabra anti-IgG de coelho foi também avaliado pelo substrato da peroxidase. Foram investigados os efeitos de várias concentrações de periodato de sódio, o glutaraldeído, e anticorpos de captura. O teste de aplicação do anticorpo de captura imobilizado foi realizada com sucesso, através da detecção de IgG do soro.
Protocolo
1. Os grupos funcionais amina sobre a celulose Alongamento discos de papel
- Preparar um pedaço de papel quadrado com uma dimensão de 1 cm x 1 cm, e de 100 discos de papel feitas a partir de uma série No. papel de celulose com um diâmetro de 6,0 mm (papel de filtro de média de fluxo) utilizando um furador.
- Para derivar grupos -NH2 sobre os discos de papel, mistura de 1 ml APS e 10 ml de acetona num frasco de vidro de 50 ml, na hotte. Adicionar discos de papel para a mistura reagente APS recentemente preparada, e incuba-se durante 5 h com agitação orbital (200 rpm) a temperatura ambiente de 32.
Cuidado: Pega APS e acetona na coifa. - Decantar o excesso de solução do frasco de vidro de 50 ml em um recipiente de lixo orgânico.
- Adicionam-se 10 ml de acetona para o frasco de vidro, misturar bem e decanta-se completamente para remover quaisquer APS que não reagiram e de outras impurezas. Repita esta etapa duas vezes.
- Espalhe os discos de papel sobre a toalha de papel e coloque em um forno a 110 ° C durante 3 h. permitir que odiscos de papel para esfriar. Armazenar os discos em um tubo de centrífuga de 50 ml à temperatura ambiente.
- Use transformada de Fourier espectroscopia de infravermelho (FTIR) para verificar a enxertia de grupos amina sobre o quadrado de papel de celulose, tal como descrito abaixo (Figura 3A).
- Ligue o computador e abra o instrumento de espectroscopia FTIR.
- Abra o software para a espectroscopia FTIR.
- Ir para 'Measurement → Inicializar ". Os rectângulos para 'BS: KBr', 'Lamp: Infravermelho' e 'Laser' fica verde quando a inicialização é concluída.
- Escolha 'Dados' abaixo dos retângulos, e selecione '% Transmitância', 'Happ-Genzel', '45', '4.0', e 'Min: 400, Max: 4000 "para" Modo de Medição', 'Apodização', ' Não. de Scans ',' resolução ', e' Range (cm-1) '.
- Clique em 'Medida'.
- Selecione "arquivo de dados 'para os dados de fundo. Escrevapara baixo os comentários.
- Clique em 'BKG "para obter a linha de base para o fundo.
- Fixar o papel quadrado no suporte de amostras filme.
- Selecione "arquivo de dados" para os dados de exemplo. Anote os comentários.
- Clique "amostra" de obtenção dos espectros da amostra.
- Feche a aplicação espectroscopia FTIR e desligue o computador.
- Repita os passos acima (passos 1.1 a 1.6) para preparar grau nº 113, de celulose de papel e discos (papel de filtro fast-fluxo) quadrado amina funcionalizada, e obter o espectro de FTIR para o papel quadrado grau No. 113 (Figura 3B).
2. imobilização covalente de anticorpos em discos de papel de celulose Amine-funcionalizados
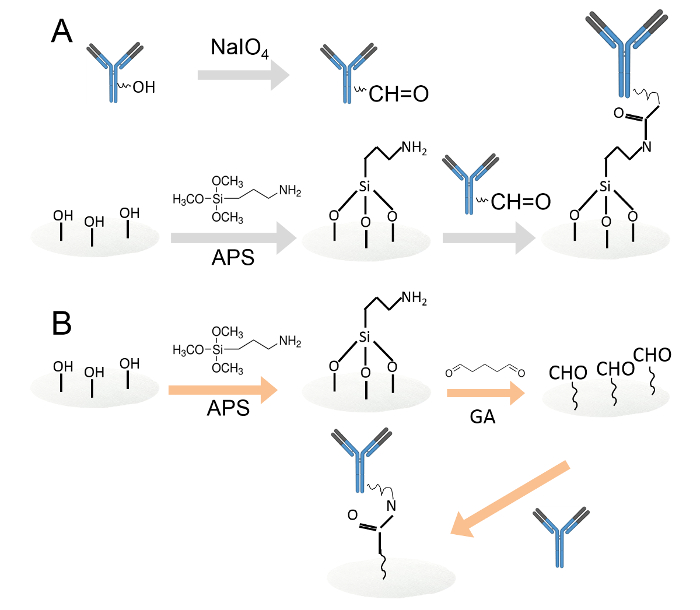
Figura 1. imobilização covalente de anticorpos por dois métodos diferentes.Um. Os anticorpos imobilizados sobre discos de papel de celulose funcionalizada com amina por meio de oxidação com periodato. Os resíduos de açúcar foram oxidadas por periodato de sódio para produzir grupos funcionais de aldeído. Em seguida, os anticorpos oxidados foram carregadas em discos de papel de celulose funcionalizada com amina. B. Os anticorpos foram então imobilizadas em discos de papel de celulose funcionalizada com amina por meio de glutaraldeído. Os discos de papel de celulose de amina funcionalizados foram imersos em solução de glutaraldeido a 0,05%, para introduzir grupos aldeído no discos de papel. Após a lavagem, os anticorpos foram carregados nos discos de papel aldeído funcionalizado. Por favor clique aqui para ver uma versão maior desta figura.
- Imobilizar os anticorpos sobre discos de papel de celulose funcionalizada com amina por meio de oxidação com periodato (Figura 1A).
- Misturar 1 ul de perioda de sódio 2,5 mMte com 2 ul de 0,1 mg / ml de anticorpo de coelho anti-IgG humana-FITC e 7 ul de tampão de pH 5,5 mM de acetato de 100 em um tubo de 1,5 ml, e incubar a mistura no escuro durante 30 min.
NOTA: Siga este rácio de volume para preparar anticorpos mais oxidados, se necessário. Alterar a relação de volume para optimizar a concentração de periodato de sódio e de coelho anti-IgG humana-FITC. - Dilui-se a solução de anticorpo acima com 30 ul de 50 mM de solução salina de tampão fosfato (PBS; pH 7,4) até um volume final de 40 ul.
- Prepare três discos de papel de filtro de médio fluxo de amina-funcionalizados e três discos de papel de fast-fluxo funcionalizado com amina (como descrito na Seção 1).
- Carga de 5 ul de periodato de sódio oxidado coelho anti-IgG humana-FITC em cada disco de papel de filtro de média de fluxo e 8 ul em cada disco de papel de filtro rápido de fluxo. Manter estes discos de papel no escuro durante uma hora à temperatura ambiente.
- Lava-se cada do disco de papel com 0,2 ml de lavagem lustreer (tampão Tris 50 mM com NaCl 0,15 M e 0,05% de agente tensioactivo, pH 7,4). Repetir a lavagem três vezes.
- Fotografar as imagens de fluorescência através de um gerador de imagens de fluorescência molecular para identificar a presença de anticorpos em cada disco de papel de celulose 32. Use discos de papel em branco (tratado com a mesma concentração de anticorpos na ausência de periodato de sódio) como um controlo (Figura S1 a Figura S3).
NOTA: Para a optimização experimental, alterar a concentração de um parâmetro que deve ser optimizado e corrigir as concentrações de todos os outros parâmetros. Uma elevada intensidade de fluorescência aumenta a quantidade de anticorpos de captura que são imobilizadas sobre os discos de papel de celulose.
- Misturar 1 ul de perioda de sódio 2,5 mMte com 2 ul de 0,1 mg / ml de anticorpo de coelho anti-IgG humana-FITC e 7 ul de tampão de pH 5,5 mM de acetato de 100 em um tubo de 1,5 ml, e incubar a mistura no escuro durante 30 min.
- Imobilizar os anticorpos sobre discos de papel de celulose por meio de amina funcionalizados glutaraldeído (Figura 1B).
- Adicione as três APS tratada médio de fluxo discos de papel de filtro e os três discos de papel de filtro de fast-fluxo (descrita no ponto 1) a 2 ml de PBS 50 mM (pH 7,4) que contém 0,05% de glutaraldeído, durante 1 h, com agitação orbital à temperatura ambiente.
Cuidado: Pega glutaraldeído na coifa. - Coloque três discos cada um em dois 1,5 ml tubos de centrífuga. Adicionar 1 ml de água deionizada (DI) de água a cada tubo e agitar os tubos durante 10 segundos. Remover a água por aspiração com uma pipeta. Repita duas vezes mais para remover todo o glutaraldeído que não reagiu.
- Carga de 5 ul de 25 ug / mL de IgG de coelho-FITC (anticorpo de captura) anti-humano em cada disco de papel de filtro de fluxo médio funcionalizados com aldeo, e adicionar 8 ul em cada disco de papel de filtro rápido de fluxo funcionalizada-aldeído. Incubar no escuro durante cerca de 20 min à temperatura ambiente. Em seguida, adicionar 10 ul de PBS 50 mM (pH 7,4) a cada disco de papel sem remover os anticorpos e incubar durante 40 minutos para a reacção de amina aldeído.
- Lavar os discos de papel com 0,2 ml de tampão de lavagem na parte superior de uma toalha de papel. Repita olavar duas vezes.
- Fotografar as imagens de fluorescência através de um gerador de imagens de fluorescência molecular para verificar a presença de anticorpos em cada disco de papel de celulose 33. Use discos de papel em branco como controlo.
NOTA: Na Figura 4, '0' está para o disco de papel em branco, que foi tratada com a mesma concentração de FITC-anticorpo na ausência de glutaraldeído; na Figura 5A, os discos de papel em branco foram tratadas com glutaraldeído, mas não há anticorpos com FITC foram carregadas para os discos de papel.
- Adicione as três APS tratada médio de fluxo discos de papel de filtro e os três discos de papel de filtro de fast-fluxo (descrita no ponto 1) a 2 ml de PBS 50 mM (pH 7,4) que contém 0,05% de glutaraldeído, durante 1 h, com agitação orbital à temperatura ambiente.
- Secam-se os discos de papel (a partir de secções 2.1 e 2.2) a 37 ° C durante 10 min.
- Bloquear os discos de papel com 15 ul de tampão de bloqueio (10% de leite desnatado em pó em tampão Tris 50 mM, pH 7,4, com NaCl a 0,15 M) durante 10 min à temperatura ambiente.
- Carga de 5 uL e 8 uL de IgG anti-coelho de cabra conjugado com peroxidase em PBS (1: 10000) em meio-fluxo e discos de papel de filtro rápido de fluxo, respectivamente. incubar durante30 min no escuro à temperatura ambiente.
- Lavar os discos de papel com 0,2 ml de tampão de lavagem na parte superior de uma toalha de papel. Repetir a lavagem três vezes.
NOTA: Não é necessário para remover o tampão de lavagem como os resultados não são afectados pelo tampão. - Carregar uma mistura de 10 ul de 3,3 ', 5,5'-tetrametilbenzidina (TMB) e peróxido de hidrogénio para cada disco.
- Tomar imagens dos discos de papel com uma câmera digital ou telefone inteligente após 5 min de incubação.
NOTA: Na Figura 5B, '0' significa os discos de papel que foram tratados com glutaraldeído, seguido por conjugado de carregamento na ausência de anticorpo FITC-anticorpo-HRP (peroxidase de rábano).
ELISA 3. Papel à base de Detecção de IgG
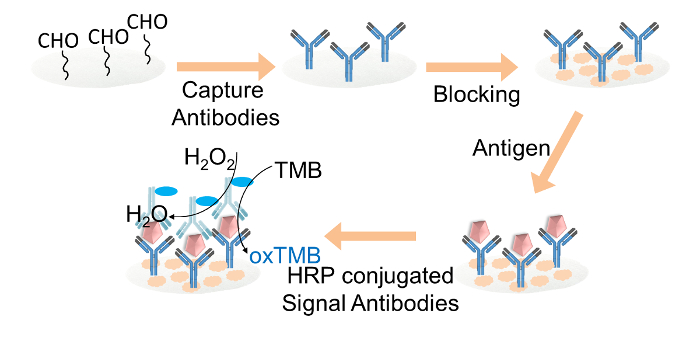
Figura 2. Representação esquemática do ELISA baseado em papel foOs anticorpos de detecção. captura de R IgG foram covalentemente imobilizada sobre os discos de papel de celulose funcionalizada-aldeído através de glutaraldeído. Os discos de papel de celulose foram bloqueadas com tampão de bloqueio. Alvo de IgG foi então adicionada aos discos, seguido do carregamento de sinal de anticorpos conjugados com HRP. Finalmente, a solução TMB e mistura de peróxido de hidrogênio foi carregado em cada disco de papel para a leitura de cor. Por favor clique aqui para ver uma versão maior desta figura.
- Adicionar 5 ml de solução de glutaraldeído a 0,05% (preparado em tampão PBS 50 mM, pH 7,4) para um frasco de vidro de 20 ml. Imergir 15 discos de papel de filtro de média de fluxo funcionalizado com amina nesta solução e manter durante 1 hora com agitação à temperatura ambiente.
- Ao mesmo tempo, repita o Passo 3.1 para preparar mais 15 aldeído discos de papel de filtro de fast-fluxo funcionalizados.
Cuidado: Pega glutaraldeído no fumecapuz.
- Ao mesmo tempo, repita o Passo 3.1 para preparar mais 15 aldeído discos de papel de filtro de fast-fluxo funcionalizados.
- Para remover o glutaraldeído que não reagiu a partir de discos de papel, colocar os discos de papel de filtro 15 meio de fluxo em um tubo de centrífuga de 15 ml, e os discos de papel de filtro 15 de escoamento rápido em mais 15 ml de tubo de centrifugação. Adicionar 5 ml de água DI a cada tubo e agitar os tubos durante 10 segundos. Remover a água por aspiração com uma pipeta. Repita duas vezes para remover todo o glutaraldeído que não reagiu.
- Secam-se os discos de papel num forno de 37 ° C.
- Adicionar 5 uL e 8 uL de anticorpos de fragmentos ml 0,025 mg / murganho de IgG-Fc a cada um dos discos de média de fluxo e de papel de filtro rápido de fluxo, respectivamente, e incubar durante 20 min.
- Adicionar 10 ul de PBS 50 mM (pH 7,4) a cada disco de papel sem remover os anticorpos e incubar durante 40 minutos para a reacção de amina aldeído.
- Lavar os discos de papel com 0,2 ml de tampão de lavagem na parte superior de uma toalha de papel. Repetir a lavagem três vezes.
- Secam-se os discos de papel numa estufa a 37 ° C.
- Bloquear os discos de papel wom 15 ul de tampão de bloqueio durante 10 minutos à temperatura ambiente.
- Lava-se cada disco de papel com 0,2 ml de tampão de lavagem na parte superior de uma toalha de papel. Repetir a lavagem três vezes.
- Executar padrões de IgG.
- Carga de 10 ul de várias concentrações de IgG (por exemplo, 0, 10, 125, 250, e 500 ng / ml em PBS) em cada disco, em triplicado. Incubar durante 1 h à temperatura ambiente.
- Lavar os discos de papel com 0,2 ml de tampão de lavagem na parte superior de uma toalha de papel. Repetir a lavagem três vezes.
- Carga de 10 ul de anticorpos IgG de ratinho conjugado com HRP-Fc (fragmento 1: 10.000, de PBS 10 mM, pH 7,4), e incubar durante 1 hora à temperatura ambiente.
- Lavar os discos de papel com 0,2 ml de tampão de lavagem na parte superior de uma toalha de papel. Repetir a lavagem três vezes.
NOTA: Não é necessário para remover o tampão de lavagem como os resultados não são afectados pela presença de tampão. - Carregar uma mistura de 10 ul de TMB e peróxido de hidrogénio para cada disco.
- Timagens ake de todos os discos de papel com uma câmera digital ou telefone inteligente após 5 min de incubação.
Nota: Na figura 6A, '0' meios discos de papel tratados com imobilização do anticorpo de captura, e a solução de anticorpo-HRP / TMB sem soro IgG. - Analisar a intensidade de cada disco de papel na imagem por imagem J.
- Converter as imagens tiradas na etapa 3.15 para o formato "tif".
- software Open 'Imagem J'.
- Ir para 'arquivo → Open', escolher a imagem a ser analisada.
- Escolha o botão de forma "Oval".
- Ir para 'Imagem → Tipo → 32 bit'.
- Ir para "Editar → Inverter '.
- Ir para "Analisar → Medida '.
- Copiar e analisar os dados em uma planilha.
Resultados
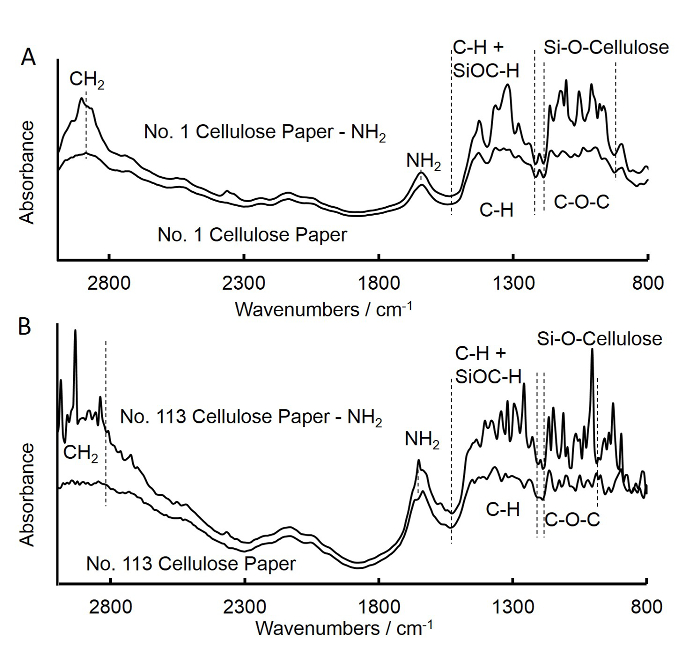
Figura 3. transformada de Fourier espectro de infravermelho (FTIR) de papel de filtro de média de fluxo não tratado e APS-tratado quadrado (A) e filtro de fluxo rápido-quadrado de papel (B). Uma. Os espectros de papel quadrado não tratada do filtro de média de fluxo foi semelhante ao do APS papel quadrado tratada filtro de média de fluxo. O aumento das intensid...
Discussão
revestimento directo de captura de anticorpo purificado por afinidade de cabra anti-IgG de rato-Fc em discos de papel de celulose não modificado foi realizado para detectar concentrações de IgG. Os resultados indicaram que, adicionalmente a fixação dos anticorpos de captura é necessário para reprodutibilidade. A técnica de silano foi utilizado com sucesso para introduzir grupos funcionais de amina para os discos de papel de celulose 34. A concentração de EPA afecta a imobilização dos anticorpos. P...
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work was financially supported by the Ministry of Education, Singapore through the Translational and Innovation Grant (MOE2012-TIF-2-G-009).
Materiais
| Name | Company | Catalog Number | Comments |
| Cellulose filter paper, Grade 1 (medium flow filter paper) | GE Healthcare Pte Ltd Singapore | 1001 110 | |
| Cellulose filter paper, Grade 113 (Fast flow filter paper) | Sigma-Aldrich, Singapore | 1113-320 | |
| Glutaraldehyde | Sigma-Aldrich, Singapore | G6257 | Grade II, 25% in H2O |
| Surfactant | Tween-20, Sigma-Aldrich, Singapore | P2287 | |
| Bovine serum album | Sigma-Aldrich, Singapore | A2153 | |
| Skimmed milk powder | Louis François | Packed by Kitchen Capers, Singapore | |
| Tris base | Promega | H5135 | |
| Sodium periodate | Merck | 106597 | |
| Na2HPO4 | Merck | 106585 | |
| KH2PO4 | Merck | 104873 | |
| NaCl | CALBIOCHEM | 567441 | |
| NaOH | Merck | 106462 | |
| HCl | Merck | 100317 | |
| phosphate buffer saline (PBS) | N/A | N/A | PBS, containing 137 mmol/L NaCl, 2.7 mmol/L KCl, 8.0 mmol/L Na2HPO4 and 1.5 mmol/L KH2PO4, is prepared with water and adjusted to pH 7.4 with 0.1 mol/L NaOH or 0.1 mol/L HCl |
| Acetone | Tee Hai Chem Pte Ltd Singapore | 9005-68 | |
| Mixture of TMB and hydrogen peroxide solution | 1-Step ultra TMB-ELISA solution , Thermo Scientific Pierce | 34029 | 1 L |
| Rabbit anti-human IgG-FITC | TWC/Bio Pte Ltd Singapore | sc-2278 | |
| Peroxidase conjugated goat anti-rabbit IgG | TWC/Bio Pte Ltd Singapore | sc-2030 | |
| Affinity purified goat anti-Mouse IgG-Fc coating antibody | Bethyl Laboratories, Inc | A90-131A | |
| Mouse reference serum | Bethyl Laboratories, Inc | RS10-101-5 | 9.5 mg/ml |
| HRP conjugated goat anti-mouse IgG-Fc detection antibody | Bethyl Laboratories, Inc | A90-131P | |
| Equipment | |||
| Fourier transform infrared spectrophotometer | Shimadzu IR Prestige-21 | N/A | |
| Fluorescence molecular imager | Pharos FXTM plus molecular imager, Bio-Rad, Singapore | N/A | |
| Oven | NUVE FN500 | N/A | |
| Turbo mixer VM-2000 | MYC LTD | N/A | |
| ImageJ | RGB, free download | N/A |
Referências
- Curtis, K. A., Rudolph, D. L., Owen, S. M. Rapid detection of HIV-1 by reverse-transcription, loop-mediated isothermal amplification (RT-LAMP). J. Virol. Methods. 151 (2), 264-270 (2008).
- Martinez, A. W., Phillips, S. T., Carrilho, E., Thomas, S. W., Sindi, H., Whitesides, G. M. Simple telemedicine for developing regions: camera phones and paper-based microfluidic devices for real-time, off-site diagnosis. Anal. Chem. 80 (10), 3699-3707 (2008).
- Lode, P. V. Point-of-care immunotesting: approaching the analytical performance of central laboratory methods. Clin. Biochem. 38 (7), 591-606 (2005).
- Posthuma-Trumpie, G. A., Amerongen, A. V., Korf, J., Berkel, W. J. V. Perspectives for on-site monitoring of progesterone. Trends Biotechnol. 27 (11), 652-660 (2009).
- Lim, D. V., Simpson, J. M., Kearns, E. A., Kramer, M. F. Current and developing technologies for monitoring agents of bioterrorism and biowarfare. Clin. Microbiol. Rev. 18 (4), 583-607 (2005).
- Li, X., Tian, J., Shen, W. Progress in patterned paper sizing for fabrication of paperbased microfluidic sensors. Cellulose. 17 (3), 649-659 (2010).
- Nie, Z., et al. Electrochemical sensing in paper-based microfluidic devices. Lab Chip. 10, 477-483 (2010).
- Delaney, J. L., Hogan, C. F., Tian, J., Shen, W. Electrogenerated chemiluminescence detection in paper-based microfluidic sensors. Anal. Chem. 83 (4), 1300-1306 (2011).
- Oh, Y. K., Joung, H. A., Kim, S., Kim, M. G. Vertical flow immunoassay (VFA) biosensor for a rapid one-step immunoassay. Lab Chip. 13 (5), 768-772 (2013).
- Cheng, C. M., et al. Paper-based ELISA. Angew. Chem. 122 (28), 4881-4884 (2010).
- Jarujamrus, P., Tian, J., Li, X., Siripinyanond, A., Shiowatana, J., Shen, W. Mechanisms of red blood cells agglutination in antibody-treated paper. Analyst. 137 (9), 2205-2210 (2012).
- Credou, J., Volland, H., Dano, J., Berthelot, T. A one-step and biocompatible cellulose functionalization for covalent antibody immobilization on immunoassay membranes. J. Mat. Chem. B. 1, 3277-3286 (2013).
- Kong, F., Hu, Y. F. Biomolecule immobilization techniques for bioactive paper fabrication. Anal. Bioanal. Chem. 403, 7-13 (2012).
- Orelma, H., Teerinen, T., Johansson, L. S., Holappa, S., Laine, J. CMC-modified cellulose biointerface for antibody conjugation. Biomacromolecules. 13, 1051-1058 (2013).
- Yu, A., et al. Biofunctional paper via covalent modification of cellulose. Langmuir. 28 (30), 11265-11273 (2012).
- Stollner, D., Scheller, F. W., Warsinke, A. Activation of cellulose membranes with 1,1′-carbonyldiimidazole or 1-cyano-4-dimethylaminopyridinium tetrafluoroborate as a basis for the development of immunosensors. Anal Biochem. 304 (2), 157-165 (2002).
- Bora, U., Sharma, P., Kannan, K., Nahar, P. Photoreactive cellulose membrane - a novel matrix for covalent immobilization of biomolecules. J. Biotechnol. 126 (2), 220-229 (2006).
- Sharma, P., Basir, S. F., Nahar, P. Photoimmobilization of unmodified carbohydrates on activated surface. J Colloid Interface Sci. 342 (1), 202-204 (2010).
- Brumer, H., Zhou, Q., Baumann, M. J., Carlsson, K., Teeri, T. T. Activation of crystalline cellulose surfaces through the chemoenzymatic modification of xyloglucan. J. Am. Chem. Soc. 126 (18), 5715-5721 (2004).
- Araujo, A. C., Song, Y., Lundeberg, J., Stahl, P. L., Brumer, H. Activated paper surfaces for the rapid hybridization of DNA through capillary transport. Anal Chem. 84 (7), 3311-3317 (2012).
- Xu, C., Spadiut, O., Araujo, A. C., Nakhai, A., Brumer, H. Chemo-enzymatic Assembly of Clickable Cellulose Surfaces via Multivalent Polysaccharides. ChemSusChem. 5 (4), 661-665 (2012).
- Filpponen, I., et al. Generic method for modular surface modification of cellulosic materials in aqueous medium by sequential "click" reaction and adsorption. Biomacromolecules. 13 (3), 736-742 (2012).
- Feese, E., Sadeghifar, H., Gracz, H. S., Argyropoulos, D. S., Ghiladi, R. A. Photobactericidal porphyrin-cellulose nanocrystals: synthesis, characterization, and antimicrobial properties. Biomacromolecules. 12 (10), 3528-3539 (2011).
- Zang, D., Ge, L., Yan, M., Song, X., Yu, J. Electrochemical immunoassay on a 3D microfluidic paper-based device. Chem. Commun. 48 (39), 4683-4685 (2012).
- Ge, L., Yan, J. X., Song, X. R., Yan, M., Ge, S. J., Yu, J. H. Three-dimensional paper-based electrochemiluminescence immunodevice for multiplexed measurement of biomarkers and point-of-care testing. Biomaterials. 33 (4), 1024-1031 (2012).
- Wang, S., et al. Paper-based chemiluminescence ELISA: lab-on-paper based on chitosan modified paper device and wax-screen-printing. Biosens. Bioelectron. 31 (1), 212-218 (2012).
- Koev, S. T., et al. Chitosan: an integrative biomaterial for lab-on-a-chip devices. Lab Chip. 10, 3026-3042 (2010).
- Wang, S. M., et al. Simple and covalent fabrication of a paper device and its application in sensitive chemiluminescence immunoassay. Analyst. 137 (16), 3821-3827 (2012).
- Sadira, S., Prabhakaranc, M. P., Wicaksonob, D. H. B., Ramakrishna, S. Fiber based enzyme-linked immunosorbent assay for C-reactive protein. Sensor Actuat B-Chem. 205, 50-60 (2014).
- Koga, H., Kitaoka, T., Isogai, A. In situ modification of cellulose paper with amino groups for catalytic applications. J. Mater. Chem. 21, 9356-9361 (2011).
- Klemm, D., Heublein, B., Fink, H. P., Bohn, A. Cellulose: fascinating biopolymer and sustainable raw material. Angew. Chem., Int. Ed. 44 (22), 3358-3393 (2005).
- Fernandes, S. C. M., et al. Bioinspired antimicrobial and biocompatible bacterial cellulose membranes obtained by surface functionalization with aminoalkyl groups. ACS Appl. Mater. Interfaces. 5 (8), 3290-3297 (2013).
- . . Pharos FX plus molecular imager instructions, Catalog Number 170-9460. , (2005).
- Tee, Y. B., Talib, R. A., Abdan, K., Chin, N. L., Basha, R. K., Yunos, K. F. M. Aminosilane-grafted cellulose. BioResourses. 8 (3), 4468-4483 (2013).
- Xing, Y., et al. Bioconjugated quantum dots for multiplexed and quantitative immunohistochemistry. Nat Protoc. 2, 1152-1165 (2007).
- Guidi, A., Laricchia-Robbio, L., Gianfaldoni, D., Revoltella, R., Del Bono, G. Comparison of a conventional immunoassay (ELISA) with a surface plasmon resonance-based biosensor for IGF-1 detection in cows' milk. Biosens Bioelectron. 16, 971-977 (2001).
- Ahmed, S., Bui, M. N., Abbas, A. Paper-based chemical and biological sensors: Engineering aspects. Biosens Bioelectron. 77, 249-263 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados