Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Ковалентного связывания антител с целлюлозой дисков бумаги и их применение в видимую невооруженным глазом колориметрические иммуноанализа
В этой статье
Резюме
In this manuscript, periodate oxidation and glutaraldehyde cross-linking methods for covalent immobilization of antibodies on paper discs are presented. The binding activity of immobilized antibodies was evaluated. Based on these results, a glutaraldehyde cross-linking method was used to develop a novel paper-based immunoassay for immunoglobulin G (IgG) detection.
Аннотация
В настоящем докладе представлены два метода для ковалентной иммобилизации антител захвата на целлюлозный фильтр сорта бумаги № 1 (фильтровальной бумаги среднего потока) диски и комплектация № 113 (фильтровальная бумага быстро потока) дисков. Эти диски целлюлозной бумаги были привиты с аминными функциональными группами посредством силана методики сочетания, прежде чем антитела иммобилизовали на них. Окислению солью йодной кислоты и глутаральдегид методы сшивания использовали для прививки захвата антител на бумаге из целлюлозы дисков. Для того, чтобы обеспечить максимальную связывающую способность антител захвата к цели после иммобилизации, исследовали влияние различных концентраций периодата натрия, глутаровый альдегид, а также захватить антител на поверхности бумажных дисков. Антитела, которые были нанесены на аминных функционализованных целлюлозной бумаги дисков через глутаральдегид сшивающего агента показал повысить активность связывания мишени по сравнению с методом окисления периодатом, IgG (в сыворотке мыши эталонной) использовали в качестве эталонной цели в данном исследовании, чтобы проверить применение ковалентно иммобилизованных антител через глутаровый альдегид. Новый документ на основе, твердофазный иммуноферментный анализ (ELISA), был успешно разработан и утвержден для выявления IgG. Этот метод не требует оборудования, и он может обнаружить 100 нг / мл IgG. Фильтровальная бумага быстропроточных был более чувствителен, чем бумажный фильтр среднего потока. Инкубационный период этого анализа был коротким и требует небольших объемов образцов. Это невооруженным глазом, колориметрический иммунологический может быть расширен для обнаружения других целей, которые определены с обычным ELISA.
Введение
Диагностическое исследование пункт-ухода тестирование (POCT) имеет важное значение для разработки новых стратегий для терапии, персонализированной медицины и ухода на дому 1. Целлюлоза документы широко используются в качестве платформ в иммунологических, так как они являются дешевыми, доступными и привычными для пользователей 2. Кроме того, пористая структура целлюлозной бумаги обладает силой управлять поток жидкости без дополнительного энергетического воздействия. Записи на бумажной основе биоанализа можно найти еще в 20 - м веке, когда бумажная хроматография была впервые изобретен в 1952 году Наиболее распространенным примером является Иммунохроматографические испытания 3, такие как беременность и тест - полосок диабет. Эти тесты обеспечивают относительно быстрое время этого анализа и недорогой анализ 4. Из - за своей простоты, эти обычные тесты полоска бумаги широко используются в Poct диагностики 5.
Методы обнаружения , включая колориметрического 6, электрохимические 7, и 8 Электрохемилюминесценцию методы были зарегистрированы для измерения целевых показателей в биологических пробах. В дополнение к этим количественным методам, надежным методом иммобилизации антител на бумаге из целлюлозы также имеет важное значение для разработки диагностических устройств. Неспецифической адсорбции является основной стратегией для модификации антител на поверхности бумажных устройств 9, 10 , чтобы обеспечить максимальную связывающую способность к их целям после иммобилизации. Тем не менее, предыдущее исследование показали , что антитела , которые адсорбируются на целлюлозной бумаги могут десорбируют из волокон 11 на 40%. Таким образом, прямой адсорбции антител на целлюлозы не может обеспечить воспроизводимые результаты 12. Ковалентной иммобилизации антител , которые прививают на поверхности бумаги является альтернативным способом разработки эффективных бумажных биоанализа 13. Различные методы были зарегистрированы для модификации целлюлозы 14, 15 . В идеале, антитела должны сохранять свою первоначальную функциональность после иммобилизации 12. Карбонилдиимидазола в сочетании с 1-циано-4-dimethylaminopyridinium тетрафторбората 16; 1-фтор-2-нитро-4-azidobenzene посредством стратегии активации УФ на основе 17, 18; chemoenzymatic стратегия , основанная на ксилоглюкана модификации 19; 1,4-phenylenediisothiocyanate связывающий агент 20; гетерополисахарный окисление 21 химия нажмите 22; и катионные порфирины 23 были использованы для ковалентно иммобилизации биомолекул на бумаге из целлюлозы. Хитозан модифицированная бумага была использована для разработки immunodevices 24-26 на бумажной основе , поскольку она богата и биосовместимый 27. Хитозан является катионным и прочно прилипает к анионным целлюлозы 27. Антитела захвата иммобилизуют на бумаге через хитозана покрытия и глутаральдегида сшивания. Периодатное окисления является еще одним способом для прививания САРТURE антитела на целлюлозной бумаге 28. В этом методе, периодата натрия наносили на бумагу, чтобы преобразовать 1,2-дигидроксильного (гликоль) группы в целлюлозе непосредственно в альдегидные группы. Эти альдегидные группы затем используются для формирования ковалентных связей между полисахаридами и антителами 28. Хотя изготовление проста, трудно полностью промыть периодата натрия. Немытая периодата натрия может вызвать дальнейшее окисление антител, иммобилизованных на бумаге из целлюлозы, влияющих на активность и стабильность антител N -. (3-диметиламинопропил) - N -ethylcarbodiimide гидрохлорид и N -hydroxysuccinimide сшиватели также используются для ковалентно иммобилизации антитела на electrospun поли-L-молочной кислоты и ацетата целлюлозы нановолокон для развития нановолокон на основе анализов 29.
В этом исследовании силановый метод св зывани использовали дл прививки аминные функциональные группы на cellulosе бумажные диски. Этот метод позволяет сохранить первоначальный размер пор, впитывания и скорость фильтрации из целлюлозного фильтра бумаг, что позволяет максимальный вертикальный проточные в иммунологических. Методика силановый широко используется в биосенсоров для функционализации поверхностей подложек с вторичными аминогруппами, с последующим дальнейшим использованием модификации биомолекул. Прививка аминных групп на поверхности матрицы включает реакцию конденсации между группами -ОН органофункционального силана агентов и подложкой матрицы 30. Диски целлюлозной бумаги были функционализированные с аминогруппами силиконовым соединением через 3-аминопропилтриметоксисилана (APS) 31. За этим последовало ковалентно иммобилизации антител захвата с использованием двух различных методов. Первый метод включает связывание периодатом окисленные антител захвата к аминогруппами целлюлозной бумаги дисков. Второй метод, используемый глутаральдегида в качестве сшивающего агента для прикрепления захвата antibodiэс в амин-функционализированные группы бумажной целлюлозы дисков. Наличие антител захвата было подтверждено кроличьей античеловеческой IgG-изотиоцианат флуоресцеина (FITC), с помощью флуоресцентного молекулярного формирования изображения. Активность связывания кроличьей античеловеческой IgG-FITC с козьими антителами против IgG кролика также оценивали с помощью субстрата пероксидазы. Исследовали влияние различных концентраций периодата натрия, глутаровый альдегид, и захват антител. Испытание применение иммобилизованного антитела захвата была успешно выполнена путем выявления IgG сыворотки.
протокол
1. Прививка Амин функциональные группы на целлюлозе бумаги Диски
- Приготовьте один кусок квадратной бумаги с размером 1 см × 1 см, и 100 бумажных дисков, изготовленных из класса №1, целлюлозной бумаги диаметром 6,0 мм (фильтровальная бумага среднего потока) с использованием дырокола.
- Для получения -NH 2 групп на бумажных дисков, смешайте 1 мл APS и 10 мл ацетона в стеклянной бутылке емкостью 50 мл , в вытяжном шкафу. Добавить бумажные диски к свежеприготовленной смеси реагентов АПС, и инкубируют в течение 5 ч при орбитальном перемешивании (200 оборотов в минуту) при комнатной температуре 32.
Внимание: Ручка APS и ацетона в вытяжном шкафу. - Декантируйте избыток раствора из флакона 50 мл стекла в контейнер органических отходов.
- Добавить 10 мл ацетона в стеклянной бутылке, хорошо перемешать и переливать полностью удалить непрореагировавшие APS и других примесей. Повторите этот шаг в два раза.
- Разведите бумажные диски на бумажное полотенце и поместить в C духовке 110 ° в течение 3 ч. Разрешитьбумажных дисков для охлаждения. Храните диски в 50 мл центрифужные пробирки при комнатной температуре.
- С помощью ИК - фурье - спектроскопии (FTIR) , чтобы проверить , прививкой аминогрупп на целлюлозной бумаги квадратной, как описано ниже (Рисунок 3А).
- Включите компьютер и откройте прибор ИК-Фурье спектроскопии.
- Открытое программное обеспечение для ИК-Фурье-спектроскопии.
- Перейти к папке "Measurement → Initialize '. Прямоугольники для 'BS: KBr', 'Светильник: Инфракрасный' и 'Laser' станет зеленым, когда инициализация завершена.
- Выберите 'Data' ниже прямоугольников, и выберите '% пропускаемость', 'Happ-Genzel', '45', '4.0' и 'Мин: 400, Макс: 4000' для 'режим измерения', 'Аподизация', ' Нет. сканирований ',' Разрешение 'и' Range (см-1) '.
- Нажмите на кнопку "Мера".
- Выберите "файл данных" для фоновых данных. Написатьвниз комментариев.
- Нажмите кнопку "BKG", чтобы получить базовую линию для фона.
- Зафиксируйте квадратную бумагу на держателе образца пленки.
- Выберите "файл данных" для выборки данных. Запишите комментарии.
- Нажмите 'Sample', чтобы получить спектры для образца.
- Закройте приложение спектроскопии FTIR и выключить компьютер.
- Повторите описанные выше шаги (шаги 1,1 до 1,6) с получением амина-функционализированного сорта № 113 целлюлозы квадратный бумаги и дисков (фильтровальной бумаги быстро потока), а также получить спектры FTIR для класса № 113 квадратных бумаги (рис 3B).
2. Ковалентная иммобилизация антител на Амин-функционализированных Диски целлюлозной бумаги
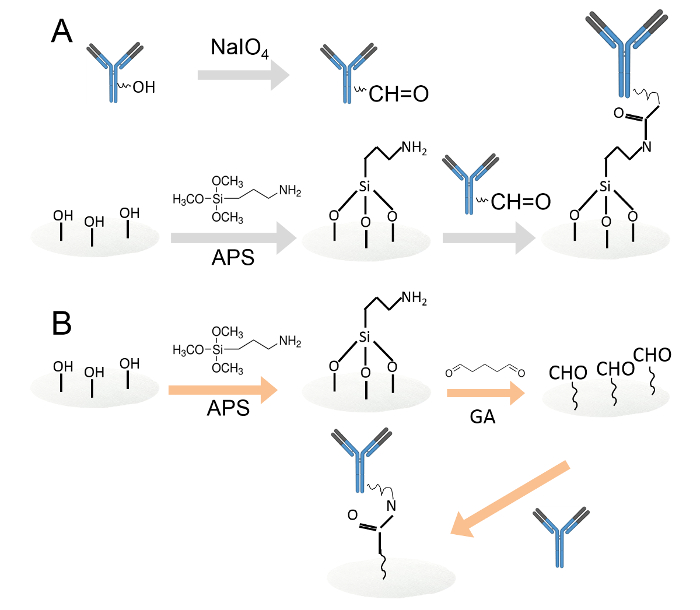
Рисунок 1. ковалентной иммобилизации антител двумя различными способами.A. Антитела , иммобилизованные на амин-функционализированные целлюлозных бумажных дисков через периодатном окисления. В углеводных остатков окисляют периодатом натрия для получения альдегидных функциональных групп. Затем окисленные антитела наносили на амин-функционализированные целлюлозных бумажных дисков. B. Затем антитела, иммобилизованного на амин-функционализированные целлюлозной бумаги дисков через глутаровый альдегид. Амин, функционализированный целлюлозные бумажные диски были погружены в 0,05% растворе глутарового альдегида вводить альдегидных групп на бумажных дисков. После промывания антитела наносили на альдегидных функционализированный бумажных дисков. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Зафиксировать антитела на амин-функционализированные целлюлозных бумажных дисков через периодатном окисления (рис 1А).
- Смешайте 1 мкл 2,5 мМ perioda натрияТЕ с 2 мкл 0,1 мг / мл кроличьих антител-человеческим IgG-FITC и 7 мкл 100 мМ, рН 5,5 ацетатного буфера в 1,5 мл пробирку, и инкубируют смесь в темноте в течение 30 мин.
Примечание: Следуйте этому отношение объема для подготовки более окисленных антител, если это необходимо. Изменение объемного соотношения для оптимизации концентрации периодата натрия и кроличьей античеловеческой IgG-FITC. - Развести выше раствор антител с 30 мкл 50 мМ фосфатного буфера физиологический раствор (ЗФР, рН 7,4) до конечного объема 40 мкл.
- Подготовьте три аминные-функционализированные фильтра среднего потока бумажных дисков и три аминовых функционализированных быстрого потока бумажных дисков (как описано в разделе 1).
- Нагрузка 5 мкл периодата натрия окисляется кроличьей античеловеческой IgG-FITC на каждый носитель потока диска фильтровальной бумаги и 8 мкл на каждую быстропроточного диска фильтровальной бумаги. Храните эти бумажные диски в темноте в течение одного часа при комнатной температуре.
- Промыть каждый из бумажного диска с 0,2 мл промывной баффаэр (50 мМ трис-буфера с 0,15 М NaCl и 0,05% поверхностно-активного вещества, рН 7,4). Повторите для стирки три раза.
- Сфотографировать флуоресцентные изображения с помощью флуоресцентного молекулярного томографа , чтобы определить наличие антител на каждой целлюлозной бумаги диска 32. Используйте чистые бумажные диски (обработанных такой же концентрацией антител в отсутствие периодата натрия) в качестве контроля (рис S1 к рисунку S3).
Примечание: Для экспериментальной оптимизации, приводят к изменению концентрации одного параметра, который должен быть оптимизирован и фиксировать концентрации всех других параметров. Высокой интенсивностью флуоресценции увеличивает количество антител захвата, которые иммобилизованным на бумаге из целлюлозы дисков.
- Смешайте 1 мкл 2,5 мМ perioda натрияТЕ с 2 мкл 0,1 мг / мл кроличьих антител-человеческим IgG-FITC и 7 мкл 100 мМ, рН 5,5 ацетатного буфера в 1,5 мл пробирку, и инкубируют смесь в темноте в течение 30 мин.
- Зафиксировать антитела на аминогруппами целлюлозной бумаги дисков через глутаральдегид (рис 1B).
- Добавьте три APS обрабатывают среднего потока фильтровальной бумаги дисков и три быстрых потоков диски фильтровальной бумаги (дезсываются в разделе 1), в 2 мл 50 мМ ЗФР (рН 7,4), содержащего 0,05% глутаральдегида в течение 1 ч, при орбитальном перемешивании при комнатной температуре.
Внимание: Ручка глутаральдегид в вытяжном шкафу. - Поместите три диска каждый из двух 1,5 мл центрифужные пробирки. Добавить 1 мл деионизованной (ДИ) воды в каждую пробирку и встряхните пробирки в течение 10 сек. Удалите воду отсасыванием с пипеткой. Повторите еще два раза, чтобы удалить непрореагировавший глутаральдегид.
- Нагрузка 5 мкл 25 мкг / мл кроличьих антител против человеческого IgG-FITC (захват антител) на каждый альдегид функционализированных среднего потока диска фильтровальной бумаги и добавить 8 мкл на каждый альдегид-функционализированного быстропроточного диска фильтровальной бумаги. Инкубируют в темноте в течение примерно 20 мин при комнатной температуре. Затем добавляют 10 мкл 50 мМ PBS (рН 7,4) в каждый бумажный диск без удаления антител и инкубировать в течение 40 мин для реакции амина альдегидом.
- Промыть бумажные диски с 0,2 мл буфера для промывки на верхней части бумажного полотенца. Повторитьмыть два раза.
- Сфотографировать флуоресцентные изображения с помощью флуоресцентного молекулярного томографа , чтобы проверить наличие антител на каждой целлюлозной бумаги диска 33. Используйте чистые бумажные диски в качестве контроля.
Примечание: На рисунке 4, '0' означает чистый лист бумаги диска , который был обработан с такой же концентрацией FITC-антител при отсутствии глутаровый альдегид; на фиг.5А, пустые бумажные диски были обработаны с помощью глутаральдегида, но не FITC-антитела не были загружены на бумажные диски.
- Добавьте три APS обрабатывают среднего потока фильтровальной бумаги дисков и три быстрых потоков диски фильтровальной бумаги (дезсываются в разделе 1), в 2 мл 50 мМ ЗФР (рН 7,4), содержащего 0,05% глутаральдегида в течение 1 ч, при орбитальном перемешивании при комнатной температуре.
- Сухие бумажные диски (из разделов 2.1 и 2.2) при 37 ° С в течение 10 мин.
- Блок бумажных дисков с 15 мкл блокирующего буфера (10% сухого обезжиренного молока в 50 мМ трис-буфера, рН 7,4, 0,15 М NaCl) в течение 10 мин при комнатной температуре.
- Нагрузка 5 мкл и 8 мкл конъюгированного с пероксидазой козьего анти-кроличьего IgG в PBS (1: 10000) на средней потока и быстропроточных дисков фильтровальной бумаги соответственно. Инкубировать30 мин в темноте при комнатной температуре.
- Промыть бумажные диски с 0,2 мл буфера для промывки на верхней части бумажного полотенца. Повторите для стирки три раза.
Примечание: Не обязательно, чтобы удалить промывочный буфер, поскольку результаты не зависят от буфера. - Нагрузка 10 мкл смеси 3,3 ', 5,5'-тетраметилбензидина (ТМВ) и раствора перекиси водорода на каждый диск.
- Возьмите образы бумажных дисков с цифровой камеры или смартфона через 5 мин инкубации.
Примечание: На фигуре 5В, '0' означает бумажные диски , которые были обработаны с помощью глутаральдегида, а затем загружая антитело-HRP (пероксидаза хрена) конъюгат в отсутствии FITC-антитела.
3. Бумага на основе ELISA для обнаружения IgG
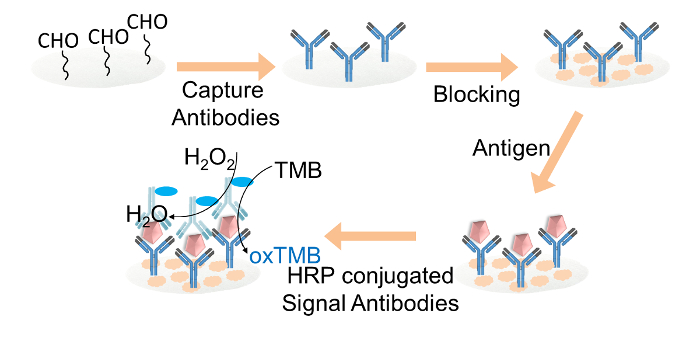
Рисунок 2. Схематическое изображение на бумажной основе ELISA Foг IgG обнаружения. Захват антител были ковалентно иммобилизованы на альдегид функционализированных бумажной целлюлозы дисков через глутаральдегид. Диски целлюлозной бумаги блокировали блокирующим буфером. Целевой IgG, затем добавляли к дискам, а затем загрузку HRP-конъюгированные антитела сигнала. Наконец, раствор ТМВ и перекись водорода смесь загружали на каждый бумажный диск для цвета считывания. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Добавляют 5 мл 0,05% -ного раствора глутарового альдегида (полученного в 50 мМ PBS буфере, рН 7,4) в стеклянной бутылке 20 мл. Погружают 15 аминные функционализованных среднего потока фильтра бумажных дисков в этом растворе, и держать в течение 1 часа при встряхивании при комнатной температуре.
- Одновременно с этим, повторите шаг 3.1 подготовить еще 15 альдегидных функционализированные быстропроточного фильтровальной бумаги дисков.
Внимание: Ручка глутаральдегид в дымукапот.
- Одновременно с этим, повторите шаг 3.1 подготовить еще 15 альдегидных функционализированные быстропроточного фильтровальной бумаги дисков.
- Для того, чтобы удалить непрореагировавший глутаральдегид из бумажных дисков, место 15 среднего потока фильтра бумажных дисков в центрифужные пробирки объемом 15 мл, и 15 быстропроточных диски фильтровальной бумаги в другой 15 мл центрифужную пробирку. Добавьте 5 мл дистиллированной воды в каждую пробирку и встряхните пробирки в течение 10 сек. Удалите воду отсасыванием с пипеткой. Повторите два раза для удаления любого количества непрореагировавшего глутаральдегида.
- Сухие бумажные диски в 37 ° C духовке.
- Добавьте 5 мкл и 8 мкл 0,025 мг / мл фрагментов антител мыши IgG-Fc к каждому из среднего потока и фильтровальной бумаги быстро потока дисков, соответственно, и инкубировать в течение 20 мин.
- Добавляют 10 мкл 50 мМ PBS (рН 7,4) в каждый бумажный диск без удаления антител и инкубировать в течение 40 мин для реакции амина альдегидом.
- Промыть бумажные диски с 0,2 мл буфера для промывки на верхней части бумажного полотенца. Повторите для стирки три раза.
- Сухие бумажные диски в сушильном шкафу при температуре 37 ° С.
- Блок бумажных дисков WIth 15 мкл блокирующего буфера в течение 10 мин при комнатной температуре.
- Промыть каждый бумажный диск с 0,2 мл буфера для промывки на верхней части бумажного полотенца. Повторите для стирки три раза.
- Выполнить стандарты IgG.
- Нагрузка 10 мкл различных концентраций IgG (например, 0, 10, 125, 250, и 500 нг / мл в PBS) , на каждый диск в трех экземплярах. Инкубировать в течение 1 часа при комнатной температуре.
- Промыть бумажные диски с 0,2 мл буфера для промывки на верхней части бумажного полотенца. Повторите для стирки три раза.
- Нагрузка 10 мкл фрагмента антител с пероксидазой хрена конъюгированная мышь IgG-Fc (1: 10000, 10 мМ PBS, рН 7,4), и инкубируют в течение 1 ч при комнатной температуре.
- Промыть бумажные диски с 0,2 мл буфера для промывки на верхней части бумажного полотенца. Повторите для стирки три раза.
Примечание: Не обязательно, чтобы удалить промывочный буфер, поскольку результаты не зависят от наличия буфера. - Нагрузка 10 мкл смеси ТМВ и перекиси водорода на каждый диск.
- Tобразы готовит в всех бумажных дисков с цифровой камеры или смартфона через 5 минут инкубации.
Примечание: на фиг.6А, '0' означает бумажных дисков , обработанных иммобилизации антител захвата, и раствор антитела-HRP / ТМВ без IgG сыворотки. - Анализ интенсивности каждого бумажного диска в изображения в прямом направлении J.
- Преобразование изображения, полученные на шаге 3.15 в формате «.tif».
- Открытое программное обеспечение "Image J '.
- Перейти к папке "Файл → Открыть", выберите изображение для анализа.
- Выберите кнопку формы "Овал".
- Перейти к 'Изображение → Type → 32 бит'.
- Перейти к 'Edit → Invert'.
- Перейти к "Анализ → Измерить '.
- Копирование и анализировать данные в электронной таблице.
Результаты
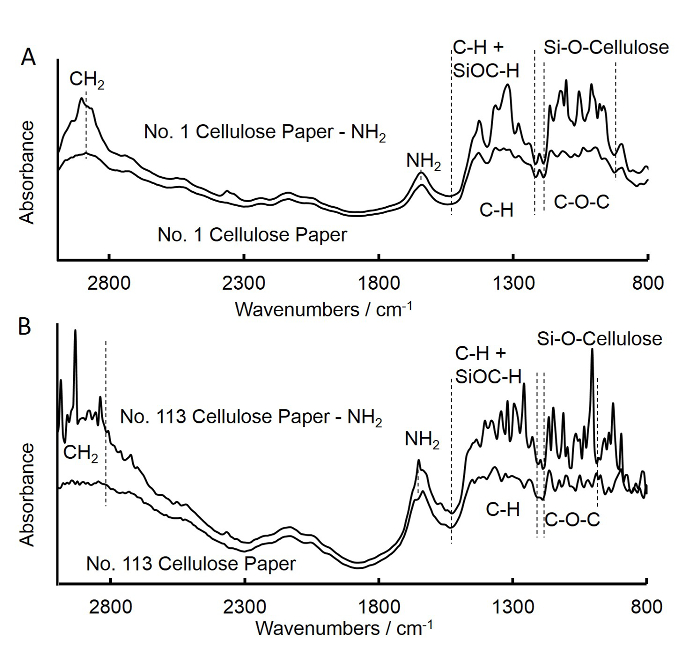
Рисунок 3. ИК - фурье (FTIR) спектры необработанной и APS обработанного фильтром среднего потока квадратного бумаги (A) и фильтр быстрого потока квадратной бумаги (B). A. Спектры для необработанно...
Обсуждение
Прямое покрытие, очищенный по сродству козьего анти-мышиного IgG-Fc захвата антитела на немодифицированной целлюлозы бумажных дисков проводили для определения концентраций IgG. Результаты показали, что, кроме того фиксация антител захвата необходима для воспроизводимости. Метод Силан б?...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This work was financially supported by the Ministry of Education, Singapore through the Translational and Innovation Grant (MOE2012-TIF-2-G-009).
Материалы
| Name | Company | Catalog Number | Comments |
| Cellulose filter paper, Grade 1 (medium flow filter paper) | GE Healthcare Pte Ltd Singapore | 1001 110 | |
| Cellulose filter paper, Grade 113 (Fast flow filter paper) | Sigma-Aldrich, Singapore | 1113-320 | |
| Glutaraldehyde | Sigma-Aldrich, Singapore | G6257 | Grade II, 25% in H2O |
| Surfactant | Tween-20, Sigma-Aldrich, Singapore | P2287 | |
| Bovine serum album | Sigma-Aldrich, Singapore | A2153 | |
| Skimmed milk powder | Louis François | Packed by Kitchen Capers, Singapore | |
| Tris base | Promega | H5135 | |
| Sodium periodate | Merck | 106597 | |
| Na2HPO4 | Merck | 106585 | |
| KH2PO4 | Merck | 104873 | |
| NaCl | CALBIOCHEM | 567441 | |
| NaOH | Merck | 106462 | |
| HCl | Merck | 100317 | |
| phosphate buffer saline (PBS) | N/A | N/A | PBS, containing 137 mmol/L NaCl, 2.7 mmol/L KCl, 8.0 mmol/L Na2HPO4 and 1.5 mmol/L KH2PO4, is prepared with water and adjusted to pH 7.4 with 0.1 mol/L NaOH or 0.1 mol/L HCl |
| Acetone | Tee Hai Chem Pte Ltd Singapore | 9005-68 | |
| Mixture of TMB and hydrogen peroxide solution | 1-Step ultra TMB-ELISA solution , Thermo Scientific Pierce | 34029 | 1 L |
| Rabbit anti-human IgG-FITC | TWC/Bio Pte Ltd Singapore | sc-2278 | |
| Peroxidase conjugated goat anti-rabbit IgG | TWC/Bio Pte Ltd Singapore | sc-2030 | |
| Affinity purified goat anti-Mouse IgG-Fc coating antibody | Bethyl Laboratories, Inc | A90-131A | |
| Mouse reference serum | Bethyl Laboratories, Inc | RS10-101-5 | 9.5 mg/ml |
| HRP conjugated goat anti-mouse IgG-Fc detection antibody | Bethyl Laboratories, Inc | A90-131P | |
| Equipment | |||
| Fourier transform infrared spectrophotometer | Shimadzu IR Prestige-21 | N/A | |
| Fluorescence molecular imager | Pharos FXTM plus molecular imager, Bio-Rad, Singapore | N/A | |
| Oven | NUVE FN500 | N/A | |
| Turbo mixer VM-2000 | MYC LTD | N/A | |
| ImageJ | RGB, free download | N/A |
Ссылки
- Curtis, K. A., Rudolph, D. L., Owen, S. M. Rapid detection of HIV-1 by reverse-transcription, loop-mediated isothermal amplification (RT-LAMP). J. Virol. Methods. 151 (2), 264-270 (2008).
- Martinez, A. W., Phillips, S. T., Carrilho, E., Thomas, S. W., Sindi, H., Whitesides, G. M. Simple telemedicine for developing regions: camera phones and paper-based microfluidic devices for real-time, off-site diagnosis. Anal. Chem. 80 (10), 3699-3707 (2008).
- Lode, P. V. Point-of-care immunotesting: approaching the analytical performance of central laboratory methods. Clin. Biochem. 38 (7), 591-606 (2005).
- Posthuma-Trumpie, G. A., Amerongen, A. V., Korf, J., Berkel, W. J. V. Perspectives for on-site monitoring of progesterone. Trends Biotechnol. 27 (11), 652-660 (2009).
- Lim, D. V., Simpson, J. M., Kearns, E. A., Kramer, M. F. Current and developing technologies for monitoring agents of bioterrorism and biowarfare. Clin. Microbiol. Rev. 18 (4), 583-607 (2005).
- Li, X., Tian, J., Shen, W. Progress in patterned paper sizing for fabrication of paperbased microfluidic sensors. Cellulose. 17 (3), 649-659 (2010).
- Nie, Z., et al. Electrochemical sensing in paper-based microfluidic devices. Lab Chip. 10, 477-483 (2010).
- Delaney, J. L., Hogan, C. F., Tian, J., Shen, W. Electrogenerated chemiluminescence detection in paper-based microfluidic sensors. Anal. Chem. 83 (4), 1300-1306 (2011).
- Oh, Y. K., Joung, H. A., Kim, S., Kim, M. G. Vertical flow immunoassay (VFA) biosensor for a rapid one-step immunoassay. Lab Chip. 13 (5), 768-772 (2013).
- Cheng, C. M., et al. Paper-based ELISA. Angew. Chem. 122 (28), 4881-4884 (2010).
- Jarujamrus, P., Tian, J., Li, X., Siripinyanond, A., Shiowatana, J., Shen, W. Mechanisms of red blood cells agglutination in antibody-treated paper. Analyst. 137 (9), 2205-2210 (2012).
- Credou, J., Volland, H., Dano, J., Berthelot, T. A one-step and biocompatible cellulose functionalization for covalent antibody immobilization on immunoassay membranes. J. Mat. Chem. B. 1, 3277-3286 (2013).
- Kong, F., Hu, Y. F. Biomolecule immobilization techniques for bioactive paper fabrication. Anal. Bioanal. Chem. 403, 7-13 (2012).
- Orelma, H., Teerinen, T., Johansson, L. S., Holappa, S., Laine, J. CMC-modified cellulose biointerface for antibody conjugation. Biomacromolecules. 13, 1051-1058 (2013).
- Yu, A., et al. Biofunctional paper via covalent modification of cellulose. Langmuir. 28 (30), 11265-11273 (2012).
- Stollner, D., Scheller, F. W., Warsinke, A. Activation of cellulose membranes with 1,1′-carbonyldiimidazole or 1-cyano-4-dimethylaminopyridinium tetrafluoroborate as a basis for the development of immunosensors. Anal Biochem. 304 (2), 157-165 (2002).
- Bora, U., Sharma, P., Kannan, K., Nahar, P. Photoreactive cellulose membrane - a novel matrix for covalent immobilization of biomolecules. J. Biotechnol. 126 (2), 220-229 (2006).
- Sharma, P., Basir, S. F., Nahar, P. Photoimmobilization of unmodified carbohydrates on activated surface. J Colloid Interface Sci. 342 (1), 202-204 (2010).
- Brumer, H., Zhou, Q., Baumann, M. J., Carlsson, K., Teeri, T. T. Activation of crystalline cellulose surfaces through the chemoenzymatic modification of xyloglucan. J. Am. Chem. Soc. 126 (18), 5715-5721 (2004).
- Araujo, A. C., Song, Y., Lundeberg, J., Stahl, P. L., Brumer, H. Activated paper surfaces for the rapid hybridization of DNA through capillary transport. Anal Chem. 84 (7), 3311-3317 (2012).
- Xu, C., Spadiut, O., Araujo, A. C., Nakhai, A., Brumer, H. Chemo-enzymatic Assembly of Clickable Cellulose Surfaces via Multivalent Polysaccharides. ChemSusChem. 5 (4), 661-665 (2012).
- Filpponen, I., et al. Generic method for modular surface modification of cellulosic materials in aqueous medium by sequential "click" reaction and adsorption. Biomacromolecules. 13 (3), 736-742 (2012).
- Feese, E., Sadeghifar, H., Gracz, H. S., Argyropoulos, D. S., Ghiladi, R. A. Photobactericidal porphyrin-cellulose nanocrystals: synthesis, characterization, and antimicrobial properties. Biomacromolecules. 12 (10), 3528-3539 (2011).
- Zang, D., Ge, L., Yan, M., Song, X., Yu, J. Electrochemical immunoassay on a 3D microfluidic paper-based device. Chem. Commun. 48 (39), 4683-4685 (2012).
- Ge, L., Yan, J. X., Song, X. R., Yan, M., Ge, S. J., Yu, J. H. Three-dimensional paper-based electrochemiluminescence immunodevice for multiplexed measurement of biomarkers and point-of-care testing. Biomaterials. 33 (4), 1024-1031 (2012).
- Wang, S., et al. Paper-based chemiluminescence ELISA: lab-on-paper based on chitosan modified paper device and wax-screen-printing. Biosens. Bioelectron. 31 (1), 212-218 (2012).
- Koev, S. T., et al. Chitosan: an integrative biomaterial for lab-on-a-chip devices. Lab Chip. 10, 3026-3042 (2010).
- Wang, S. M., et al. Simple and covalent fabrication of a paper device and its application in sensitive chemiluminescence immunoassay. Analyst. 137 (16), 3821-3827 (2012).
- Sadira, S., Prabhakaranc, M. P., Wicaksonob, D. H. B., Ramakrishna, S. Fiber based enzyme-linked immunosorbent assay for C-reactive protein. Sensor Actuat B-Chem. 205, 50-60 (2014).
- Koga, H., Kitaoka, T., Isogai, A. In situ modification of cellulose paper with amino groups for catalytic applications. J. Mater. Chem. 21, 9356-9361 (2011).
- Klemm, D., Heublein, B., Fink, H. P., Bohn, A. Cellulose: fascinating biopolymer and sustainable raw material. Angew. Chem., Int. Ed. 44 (22), 3358-3393 (2005).
- Fernandes, S. C. M., et al. Bioinspired antimicrobial and biocompatible bacterial cellulose membranes obtained by surface functionalization with aminoalkyl groups. ACS Appl. Mater. Interfaces. 5 (8), 3290-3297 (2013).
- . . Pharos FX plus molecular imager instructions, Catalog Number 170-9460. , (2005).
- Tee, Y. B., Talib, R. A., Abdan, K., Chin, N. L., Basha, R. K., Yunos, K. F. M. Aminosilane-grafted cellulose. BioResourses. 8 (3), 4468-4483 (2013).
- Xing, Y., et al. Bioconjugated quantum dots for multiplexed and quantitative immunohistochemistry. Nat Protoc. 2, 1152-1165 (2007).
- Guidi, A., Laricchia-Robbio, L., Gianfaldoni, D., Revoltella, R., Del Bono, G. Comparison of a conventional immunoassay (ELISA) with a surface plasmon resonance-based biosensor for IGF-1 detection in cows' milk. Biosens Bioelectron. 16, 971-977 (2001).
- Ahmed, S., Bui, M. N., Abbas, A. Paper-based chemical and biological sensors: Engineering aspects. Biosens Bioelectron. 77, 249-263 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены