A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
محاكاة وظيفة من البروتينات اشارة: نحو الاصطناعي الإشارة العلاج تنبيغ
In This Article
Summary
We present guidelines for developing synthetic 'chemical transducers' that can induce communication between naturally unrelated proteins. In addition, detailed protocols are presented for synthesizing and testing a specific 'transducer' that enables a growth factor to activate a detoxifying enzyme and consequently, to regulate the cleavage of an anticancer prodrug.
Abstract
Signal transduction pathways, which control the response of cells to various environmental signals, are mediated by the function of signaling proteins that interact with each other and activate one other with high specificity. Synthetic agents that mimic the function of these proteins might therefore be used to generate unnatural signal transduction steps and consequently, alter the cell's function. We present guidelines for designing 'chemical transducers' that can induce artificial communication between native proteins. In addition, we present detailed protocols for synthesizing and testing a specific 'transducer', which can induce communication between two unrelated proteins: platelet-derived growth-factor (PDGF) and glutathione-S-transferase (GST). The way by which this unnatural PDGF-GST communication could be used to control the cleavage of an anticancer prodrug is also presented, indicating the potential for using such systems in 'artificial signal transduction therapy'. This work is intended to facilitate developing additional 'transducers' of this class, which may be used to mediate intracellular protein-protein communication and consequently, to induce artificial cell signaling pathways.
Introduction
مسارات نقل الإشارة تلعب دورا هاما في عملية الخلوية تقريبا كل وتسمح للخلية للرد السريع للإشارات البيئية. 1 وغالبا ما تسبب هذه الممرات من قبل ملزم لجزيء إشارة إلى مستقبلات الخلية، مما يؤدي إلى تنشيط الانزيمات داخل الخلايا. وتوسط التضخيم ونشر هذا إشارة داخل الخلية عن طريق وظيفة يشير البروتينات التي تشكل شبكة من التفاعلات البروتين البروتين الذي الانزيمات يتم تنشيط عكسية مع خصوصية عالية. بسبب التقلبات من هذه الشبكات في كثير من الأحيان يؤدي إلى تطور مرض السرطان، وكان هناك الكثير من الاهتمام في إنشاء "إشارة العلاج تنبيغ السرطان، 2 حيث تم تصميم عقاقير لتعطيل مسارات الإشارات الخبيثة. لقد اقترحت مؤخرا نهجا بديلا للإشارة إلى العلاج التنبيغ التي تعتمد على قدرة الأدوية لتوليد غير طبيعية مسارات نقل الإشارة. 3 على وجه الخصوص، ونحن نعتقد أن من خلال تصميم وكلاء الاصطناعية التي تحاكي وظيفة من البروتينات مما يشير إلى أنه سيكون من الممكن لتعديل وظيفة الخلية بشكل غير مباشر. على سبيل المثال، قد تكون هذه الشبكات الاصطناعية تمكن المؤشرات الحيوية البروتين لتنشيط الانزيمات التي يلتصق طلائع الأدوية. بدلا من ذلك، قد تكون هذه محاكيات البروتين يشير قادرة على تنشيط مسارات غير طبيعية خلية الإشارات، مما أدى إلى الآثار العلاجية.
للتدليل على جدوى هذا النهج، وقد انشأنا مؤخرا الاصطناعية "محول الكيميائي" 4 التي تمكن عامل النمو المشتق من الصفيحات (PDGF) لتحريك الانقسام من دواء مساعد المضادة للسرطان من خلال تفعيل الجلوتاثيون-ق-ترانسفيراز (GST)، وهو لا شريك ملزم الطبيعي. هيكل هذا "محول" يتكون من مضاد PDGF-أبتمر الحمض النووي التي تم تعديلها مع مثبط ثنائي التكافؤ لضريبة السلع والخدمات. وبالتالي، فإن هذا عامل الاصطناعية ينتمي إلى عائلة من الجزيئات مع مواقع الربط لالبروتينات المختلفة، مثل 5-7 محرضات الكيميائية من dimerization (رقم تعريفي للعملاء) 10/08، وكذلك إلى مجموعة البروتينات والمواد اللاصقة على أساس تقارن جزيء النوكليوتيد الاصطناعية. 11-21
المبادئ العامة التي يقوم عليها تصميم هذه النظم يوصف هنا ووتقدم بروتوكولات مفصلة لتجميع واختبار وظيفة هذا "محول" مع المقايسات الأنزيمية التقليدية. ويهدف هذا العمل إلى تسهيل النامية محولات "إضافية من هذه الفئة، والتي يمكن استخدامها للتوسط بين الخلايا الاتصالات البروتين البروتين، وبالتالي، للحث الاصطناعية مسارات الخلية إشارات.
الشكل 1 يصف الخطوط العريضة لمبادئ التشغيل من "محولات الكيماوية الاصطناعية التي يمكن أن توسط غير طبيعية الاتصالات البروتين البروتين. في هذا التوضيح، وهو 'محول الكيميائية "، الذي يجمع بين المجلدات الاصطناعية لبروتتمكن EINS الأول والثاني (المجلدات الأول والثاني)، والبروتين الثاني لتحريك النشاط التحفيزي من البروتين الأول، الذي لا شريك له ملزم الطبيعي. في غياب البروتين الثاني، محول يربط الموقع الحفاز للانزيم (البروتين الأول) ويمنع نشاطها (الشكل 1، الدولة الثانية). الربط من "محول" لبروتين الثاني، ومع ذلك، يعزز التفاعل بين الموثق الأول وسطح البروتين الثاني (الشكل 1، دولة ج)، مما يقلل من تقارب تجاه بروتين أولا ونتيجة لذلك، فإن التركيز الفعال لل" يتم تقليل الحرة 'محول في الحل، الأمر الذي يؤدي إلى تفكك محول البروتين أنا معقد وتنشيط بروتين الأول (الشكل 1، الدولة رابعا). معا، وتبرز هذه الخطوات الثلاث المبادئ الأساسية التي يقوم عليها تصميم "محولات" فعالة: (1) "محول" يجب أن يكون الموثق محددة لكل من الأهداف البروتين، (2) betwe التفاعلأون الموثق الثاني والبروتين يجب أن يكون الثاني أقوى من التفاعل بين الموثق الأول والبروتين الأول، و (3) الموثق يجب أن تكون قادرة على التفاعل مع سطح البروتين الثاني. هذا المبدأ الأخير لا يتطلب بالضرورة أن الموثق أنا وحدي سيكون له قابلية عالية والانتقائية تجاه بروتين الثاني. بدلا من ذلك، لأنه يقوم على دراساتنا الأخيرة التي أظهرت أن جلب جزيء اصطناعي على مقربة من البروتين من المرجح أن تعزيز التفاعل بين هذا الجزيء وسطح البروتين. 19،22،23
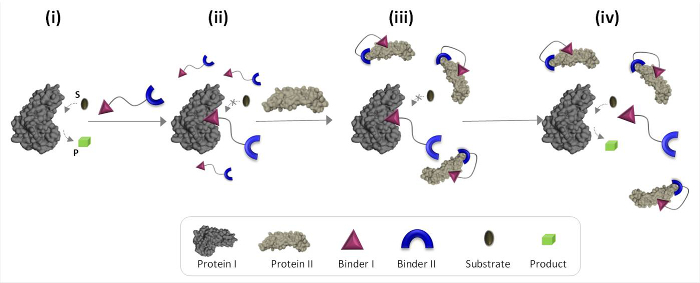
الشكل 1: التشغيل مبادئ "محولات الطاقة الكيميائية" عندما يتم إضافة "محول الكيميائية" إلى البروتين النشط أنا (ولاية ط)، فإنه يلزم لموقعها النشط من خلال الموثق الأول ويمنع نشاطها (ولاية ب). في وجود البروتين الثاني، ومع ذلك، فإن غير منضم 'ر الكيميائيةransducer "يتفاعل مع البروتين الثاني عن طريق الموثق الثاني، الذي يعزز التفاعل بين الموثق الأول وسطح البروتين الثاني. هذا الموثق يسببها I-بروتين الثاني التفاعل يقلل من التركيز الفعال من الموثق الأول، الأمر الذي يؤدي إلى التفكك من 'transducer' البروتين أنا مجمع والبروتين أنا تنشيط (ولاية الرابع). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم .
Access restricted. Please log in or start a trial to view this content.
Protocol
1. توليف "محول الكيميائية"
- التحضيرات الأولية
- إعداد 2 M triethylammonium خلات (TEAA) عازلة عن طريق خلط 278 مل من ثلاثي الإيثيلامين مع 114 مل من حمض الخليك و 400 مل من الماء عالى النقاء. ضبط درجة الحموضة إلى 7 وإضافة الماء إلى الحجم النهائي من 1 L. يبقيه في زجاجة داكنة.
ملاحظة: هذا الحل هو مستقر لسنوات. - إعداد محلول حامض الاسكوربيك 5 مم عن طريق إذابة 18 ملغ من حامض الاسكوربيك في 20 مل من الماء عالى النقاء. استخدام حل العذبة؛ والحل هو مستقر لمدة يوم واحد.
- إعداد 10 ملم النحاس (II) / ليجند تيم (TBTA) حل عن طريق إذابة 25 ملغ من النحاس (II) pentahydrate كبريتات في 10 مل من الماء عالى النقاء و 58 ملغ من TBTA في 11 مل ثنائي ميثيل سلفوكسيد (DMSO). مزيج من الحلين. يبقيه في درجة حرارة الغرفة، وحمايتها من الضوء.
- إعداد 2 M triethylammonium خلات (TEAA) عازلة عن طريق خلط 278 مل من ثلاثي الإيثيلامين مع 114 مل من حمض الخليك و 400 مل من الماء عالى النقاء. ضبط درجة الحموضة إلى 7 وإضافة الماء إلى الحجم النهائي من 1 L. يبقيه في زجاجة داكنة.
- إجراء الاقتران
- حل 100 نانومول من النوكليوتيد المعدلة (ODN-1) في 80 ميكرولترمن الماء عالى النقاء جديدة. إضافة 20 ميكرولتر من 2 M TEAA، ودرجة الحموضة = 7. إضافة 80 ميكرولتر من محلول تقدم طازجة من حامض الاسكوربيك (5 ملم في الماء).
- حل 1.5 مكرومول (574.5 ميكروغرام) من حمض الإيثاكرينيك المعدلة azido في 180 ميكرولتر من DMSO وإضافته إلى الحل. ديغا الحل باستخدام الأرجون لمدة 60 ثانية، وبسرعة إضافة 40 ميكرولتر من (II) / حل TBTA النحاس (10 ملم في 55٪ (ت / ت) DMSO / الماء).
- تطهير مرة أخرى مع الأرجون، على مقربة بإحكام، ويقلب بين عشية وضحاها.
- رصد التقدم المحرز في رد الفعل وتنقية المترافقة بواسطة RP-HPLC (الطور المتحرك: أ) 5٪ الأسيتونيتريل، 5٪ TEAA، 90٪ ماء عالى النقاء. ب) 65٪ الأسيتونيتريل، 5٪ TEAA، 30٪ ماء عالى النقاء). 24
2. السيطرة على آخر ضريبة السلع والخدمات من قبل PDGF
- التحضيرات الأولية
- تجهيز 50 مل من العازلة الفحص عن طريق خلط 33.9 مل من الفوسفات مخزنة المالحة (PBSx1) مع 16.1 مل من الماء عالى النقاء لتحقيق 8 ملي تركيز الفوسفات النهائي والإعلاند 23.8 ملغ من MgCl 2 لتحقيق 5 ملي تركيز النهائي.
- إعداد محلول المخزون من ضريبة السلع والخدمات M1-1 عن طريق إذابة البروتين في العازلة التي تحتوي على 50 ملي تريس درجة الحموضة 7.5، 50 ملي كلوريد الصوديوم، 1 ملم dithiothreitol (DTT)، و 5 ملي ثنائي أمين الإيثيلين رباعي حمض الخل (EDTA) لتركيز النهائي من 30 ميكرومتر. تقسيم هذا الحل إلى قسامات الصغيرة ومخزن في -80 مئوية. تمييع حديثا، وفقا للمادة 2.1.5.1، في المنطقة العازلة الفحص والحفاظ على الجليد.
ملاحظة: الحل أن تكون مستقرة لمدة 5 ساعة، أو حتى يكون هناك انخفاض في نشاط الإنزيم. - إعداد الركيزة وفقا للتعليمات التالية:
- حل 10 ملغ من انخفاض الجلوتاثيون (GSH) في 325 ميكرولتر من الماء عالى النقاء إلى تركيز النهائي من 100 ملي حل الأوراق المالية. تمييع 21 ميكرولتر من هذا الحل الأسهم في 979 ميكرولتر من العازلة الفحص لتركيز النهائي من 2.1 ملي حل العاملة.
- حل 10 ملغ من 2،4-ثنائي نتروكلوروبنزين (CDNB) في 492 ميكرولتر من البريدthanol إلى تركيز النهائي من 100 ملي حل الأوراق المالية. تمييع 43.2 ميكرولتر من محلول المخزون في 956.8 ميكرولتر من وجود مخزن مؤقت الفحص لتركيز النهائي من 4.32 ملي حل العاملة.
- في لوحة 96-جيدا، وطرح كل الركيزة في سطر منفصل (12 بئرا). إدراج لا يقل عن 60 ميكرولتر في كل بئر للسماح للانسحاب سريع وسهل من الحل. تغطية لوحة مع ورقة الألمنيوم لحماية الخفيفة.
- إعداد الحلول الأوراق المالية التالية في المخزن المؤقت الفحص:
- تمييع GST M1-1 بنسبة 50 إلى تركيز النهائي من 0.6 ميكرومتر من ديمر.
- تمييع "محول الكيميائية" إلى 30 ميكرومتر حل الأسهم.
- تمييع PDGF إلى تركيز النهائي من 40 ميكرومتر.
- تمييع PDGF أبتمر إلى التركيز النهائي من 250 ميكرومتر.
- قياس النشاط ضريبة السلع والخدمات في وجود ظاهرة "محول الكيميائية" وPDGF.
- انشاء ط الإجراء التجريبين قارئ لوحة لقياس الحركية.
- خلق تجربة جديدة ك "بروتوكول قياسي".
- اضغط على "إجراء" لفتح نافذة إعدادات الإجراء.
- في القائمة المنبثقة على الجانب العلوي من النافذة، اختر '384 لوحة' نوع وفقا لالصانع لوحة.
- اضغط على "اقرأ" في القائمة اليسرى.
- وفيما يتعلق طريقة الكشف اختيار "الامتصاصية".
- فيما يتعلق بنوع قراءة اختيار "نقطة النهاية".
- إرسال 340 نانومتر على النافذة الطول الموجي.
- اضغط على الجزء السفلي "لوحة الكاملة" على الجانب الأيمن العلوي واختيار جيد للقياس.
- اضغط على "موافق" لإغلاق "اقرأ" نافذة.
- اختر 'بدء الحركية "في القائمة اليسرى.
- جعل تشغيل الساعة 10 دقيقة.
- حدد الخيار فترات الحد الأدنى.
- اضغط على "موافق" لإغلاق الإطار الحركي.
- اسحب 'قراءة' ط خطn لقياس الحركية.
- اضغط على زر 'التحقق من صحة "ثم انقر فوق الزر" موافق ".
- حفظ التجربة.
- اضغط على زر "تشغيل". سيظهر مربع الحوار - الضغط على زر "موافق" فقط عندما يجب أن تبدأ القياس.
- من أجل إجراء التجربة يثلث، وإعداد أربع عينات تحتوي كل منها على 3.25 ميكرولتر من 'محول الكيميائية "و 3.25 ميكرولتر من ضريبة السلع والخدمات M1-1. إضافة إلى كل عينة 0، 1.2، 2.4، أو 4.9 ميكرولتر من PDGF و123.5، 122.3، 121.1، 118.6 أو ميكرولتر من العازلة الفحص، على التوالي.
- احتضان الحل في درجة حرارة الغرفة لمدة 10 دقيقة.
- في لوحة جيدا 384 شفافة، تضاف 40 ميكرولتر من العينة إلى كل بئر. إدراج عينات فقط في الآبار الفردية أو فقط حتى في الآبار في نفس الخط للسماح للاستخدام متعدد pipettor لإضافة الركيزة.
- باستخدام 12 قناة متعددة pipettor، بسرعة إضافة 10 ميكرولتر من كل من رانه ركائز التي كانت معدة سلفا في لوحة 96-جيدا (القسم 2.1.4). المزيج بلطف وبسرعة لتجنب الفقاعات. إدراج لوحة في القارئ والبدء في قياس الحركية. منذ حركية ضريبة السلع والخدمات بشكل سريع جدا، في محاولة لتقليل الوقت بين الجمع الركيزة وبداية قياس الحركية.
- انشاء ط الإجراء التجريبين قارئ لوحة لقياس الحركية.
- GST تفعيل دورات / تثبيط وساطة من قبل 'محول الكيميائية.
- من أجل إجراء التجربة يثلث، وإعداد 5 عينات تحتوي كل منها على 84.5 ميكرولتر من العازلة الفحص، 3.25 ميكرولتر من "محول الكيميائية، و 3.25 ميكرولتر من ضريبة السلع والخدمات M1-1. يحضن في درجة حرارة الغرفة لمدة 3 دقائق.
- إضافة 3.65 ميكرولتر من العازلة الفحص لعينة 1 و 3.65 ميكرولتر من PDGF لعينات 2-5. يحضن في درجة حرارة الغرفة لمدة 3 دقائق.
- إضافة 3.12 ميكرولتر من العازلة الفحص لعينات 1-2 و 3.12 ميكرولتر من PDGF أبتمر لعينات 3-5. يحضن في درجة حرارة الغرفة لمدة 3 دقائق.
- إضافة 24.4 ميكرولتر من العازلة الفحص لعينات1-3 و 24.4 ميكرولتر من PDGF لعينات 4-5. يحضن في درجة حرارة الغرفة لمدة 3 دقائق.
- إضافة 7.8 ميكرولتر من العازلة الفحص لعينات 1-4 و 7.8 ميكرولتر من PDGF أبتمر لعينة 5. احتضان في درجة حرارة الغرفة لمدة 5 دقائق.
- في لوحة جيدا 384 شفافة، تضاف 40 ميكرولتر من العينة في كل بئر. إدراج عينات فقط إلى الغريب أو فقط إلى حتى الآبار في نفس السطر.
- باستخدام 12 قناة متعددة pipettor، بسرعة إضافة 10 ميكرولتر من كل الركيزة (معدة سلفا في لوحة 96 أيضا). المزيج بلطف وبسرعة لتجنب الفقاعات. إدراج لوحة في القارئ والبدء في قياس الحركية.
- حساب الخامس 0 [وزارة الدفاع / دقيقة] تحت كل حالة عن طريق طرح OD قياس في 340 نانومتر في تي = 0.5 دقيقة من OD قياس في 340 نانومتر في تي = 1.5 دقيقة لتقييم تنشيط / تثبيط إعادة التدوير. 25
- تقييم الاستجابة في الوقت الحقيقي من 'محول الكيميائية "إلى التغييرات في البيئة.
- <لى> تأثير في الوقت الحقيقي من PDGF إضافة
- إنشاء إجراء التجارب في قارئ لوحة لقياس الحركية.
- كرر الخطوات من 2.2.1.1-2.2.1.10.
- جعل وقت التشغيل 3.5 دقيقة.
- حدد الخيار فترات الحد الأدنى.
- اضغط على "موافق" لإغلاق الإطار الحركي.
- اسحب 'قراءة' خط في قياس الحركية.
- اختيار لوحة خارج / في القائمة اليسرى.
- اختر الخيار "لوحة من أصل (أي الحوار).
- اختر الخيار "تأخير" في القائمة اليمنى وإدخال 30 ثانية.
- اختيار لوحة خارج / في القائمة اليسرى.
- اختر "لوحة في (أي الحوار) 'الخيار.
- إنشاء قياس الحركي الثاني بتكرار الخطوات 2.2.1.4 - 2.2.1.14 ولكن في القسم 2.2.1.11 تعيين الحركية لتكون 25 دقيقة بدلا من 10 دقيقة.
- اضغط على زر 'التحقق من صحة "ثم انقر فوق الزر" موافق ".
- حفظ التجربة.
- اضغط على "جيش التحرير الشعبى الصينىذ 'زر. سيظهر مربع الحوار - الضغط على زر "موافق" فقط عندما يجب أن تبدأ القياس.
- إعداد عينتين عن طريق خلط 1 ميكرولتر من ضريبة السلع والخدمات M1-1 و 1 ميكرولتر من 'محول الكيميائية "في 38 ميكرولتر من العازلة الفحص. إدراج العينات في بئرين لوحة جيدا 384 شفافة، وترك بئر فارغة بين هذه الآبار اثنين.
- باستخدام 12 قناة متعددة pipettor، بسرعة إضافة 10 ميكرولتر من كل الركيزة، مزيج بلطف وبسرعة لتجنب الفقاعات، أدخل لوحة في القارئ والبدء في قياس الحركية.
- عند فتح لوحة حتى (بعد 3.5 دقيقة)، إضافة بسرعة 1.125 ميكرولتر من PDGF إلى إحدى الآبار، وتخلط بلطف، والسماح لوحة يقفل مرتفعا للقياسات الحركية المتبقية.
- تأثير في الوقت الحقيقي من إضافة أبتمر PDGF
- كرر الخطوات من 2.4.1.1-2.4.1.15.
- إعداد عينتين عن طريق خلط 1 ميكرولتر من ضريبة السلع والخدمات M1-1، 1 ميكرولتر من 'محول الكيميائية، و1.125 ميكرولتر من PDGF في 36.9 ميكرولتر من العازلة الفحص. إدراج العينات في بئرين لوحة جيدا 384 شفافة، وترك بئر فارغة بين هذه الآبار اثنين.
- باستخدام 12 قناة متعددة pipettor، بسرعة إضافة 10 ميكرولتر من كل الركيزة، مزيج بلطف وبسرعة لتجنب الفقاعات، أدخل لوحة في القارئ، والبدء في قياس الحركية.
- عند فتح لوحة حتى (بعد 1.5 دقيقة)، إضافة بسرعة 1.2 ميكرولتر من PDGF أبتمر إلى إحدى الآبار، وتخلط بلطف والسماح لوحة يقفل مرتفعا للقياسات الحركية المتبقية.
- قياس JS-K دواء مساعد التنشيط من قبل ضريبة السلع والخدمات في وجود ظاهرة "محول الكيميائية" وPDGF.
- إنشاء إجراء التجارب في قارئ لوحة لقياس الحركية.
- خلق تجربة جديدة ك "بروتوكول قياسي".
- اضغط على "إجراء" لفتح نافذة إعدادات الإجراء.
- في القائمة المنبثقة على الجانب العلوي من النافذة اختر '384 لوحة' نوع وفقا لالصانع لوحة.
- اضغط على "اقرأ" في القائمة اليسرى.
- وفيما يتعلق اختار طريقة الكشف "الامتصاصية".
- فيما يتعلق بنوع قراءة اختيار "نقطة النهاية".
- إرسال 305 نانومتر على النافذة الطول الموجي.
- اضغط على زر 'لوحة الكاملة "على الجانب الأيمن العلوي واختيار جيد للقياس.
- اضغط على "موافق" لإغلاق "اقرأ" نافذة.
- اختر 'بدء الحركية "في القائمة اليسرى.
- جعل تشغيل الساعة 10 دقيقة.
- حدد الخيار فترات الحد الأدنى.
- اضغط على "موافق" لإغلاق الإطار الحركي.
- اسحب 'قراءة' خط في قياس الحركية.
- اضغط على زر 'التحقق من صحة "ثم انقر فوق الزر" موافق ".
- حفظ التجربة.
- اضغط على زر "تشغيل". وبو الحوارس سوف تظهر - اضغط على زر 'موافق' فقط عندما يجب أن تبدأ القياس.
- لأي إنتاج قياسات تستخدم عدة مقياس الكالوري النتريت / نترات. في لوحة 96-جيدا إدراج 50 ميكرولتر من العازلة الفحص في صف واحد، و 70 ميكرولتر من Griess أنا الكاشف في الصف الثاني، و 70 ميكرولتر من Griess الثاني كاشف في الصف الثالث.
- من أجل إجراء التجربة يثلث، وإعداد أربع عينات تحتوي كل منها على 4.8 ميكرولتر من 'محول الكيميائية. لعينة 1، إضافة 155.2 ميكرولتر من العازلة الفحص، لعينة 2، إضافة 3.2 ميكرولتر من GST-M1-1 و 152 ميكرولتر من العازلة الفحص، لعينة 3، إضافة 9.6 ميكرولتر من PDGF و145.6 ميكرولتر من العازلة الفحص، وأخذ عينات 4، إضافة 3.2 ميكرولتر من GST-M1-1، 9.6 ميكرولتر من PDGF، و142.4 ميكرولتر من العازلة الفحص.
- احتضان الحل في درجة حرارة الغرفة لمدة 10 دقيقة.
- في لوحة جيدا 384 شفافة، تضاف 50 ميكرولتر من العينة في كل بئر. إدراج عينات فقط في الغريب أو فقط فيحتى الآبار في نفس الخط للسماح للاستخدام متعدد pipettor لإضافة الركيزة.
- إضافة 0.54 ميكرولتر من JS-K (5 ملم في DMSO) إلى كل بئر.
- باستخدام 12 قناة متعددة pipettor، بسرعة إضافة 10 ميكرولتر من محلول GSH (معدة سلفا في لوحة 96-جيدا)، مزيج بلطف وبسرعة لتجنب الفقاعات. إدراج لوحة في القارئ والبدء في قياس الحركية.
- مباشرة بعد قياس الحركية، وذلك باستخدام 12 قناة متعددة pipettor، واتخاذ 50 ميكرولتر من كل عينة في الصف عازلة فحص في لوحة 96-جيدا أعدت مسبقا وبسرعة إضافة إلى ذلك 50 ميكرولتر من Griess أنا كاشف و 50 ميكرولتر من Griess الثاني كاشف. احتضان مع حماية من ضوء لمدة 10 دقيقة في RT وقياس الامتصاصية في 550 نانومتر.
ملاحظة: المخزن المؤقت فحص وكميات الكواشف تعتمد على بروتوكول مجموعات.
- إنشاء إجراء التجارب في قارئ لوحة لقياس الحركية.
Access restricted. Please log in or start a trial to view this content.
النتائج
تصميم وتركيب، وقدم آلية عمل ل"محول الكيميائية" التي يمكن أن تحدث الاتصالات الاصطناعي بين PDGF وضريبة السلع والخدمات في الشكل 2. هيكل "محول" يدمج أبتمر PDGF الحمض النووي وأميد مكرر الإيثاكرينيك (BEA )، وهي ضريبة السلع والخدمات المانع الم...
Access restricted. Please log in or start a trial to view this content.
Discussion
We presented a method for designing and testing of a 'chemical transducer' that can induce artificial communication between two naturally unrelated proteins, GST and PDGF, without modifying the native proteins. The unnatural GST-PDGF communications could be detected in real time by using enzymatic assays that follow the changes in the activity of GST in the presence of the 'chemical transducer' and increasing the concentrations of PDGF. In addition to detecting the activation of GST by PDGF, these assays were used to fol...
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors have nothing to disclose.
Acknowledgements
وأيد هذا البحث من قبل مؤسسة منيرفا، ومنظمة HFSP، ومجلس بحوث غرانت الأوروبي (بدءا جرانت 338265).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1-chloro-2,4-dinitrobenzene | Sigma-Aldrich | 237329 | |
| Acetic acid | Bio Lab | 01070521 | |
| Acetnitrile | J.T.Baker | 9017-03 | |
| Ascorbic acid | Sigma-Aldrich | A4544 | |
| Copper(II) Sulfate pentahydrate | Merck-Millipore | 102790 | |
| Dimethyl sulfoxide | Merck-Millipore | 802912 | |
| Dulbecco's Phosphate Buffered Saline | Biological Industries | 02-023-5A | |
| Ethacrynic acid | Tokyo Chemical Industry Co. Ltd | E0526 | |
| Glutathione-s-transferase M1-1 | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| JS-K | Sigma-Aldrich | J4137 | |
| L-glutathione reduced | Sigma-Aldrich | G4251 | |
| Magnesium Chloride | J.T.Baker | 0162 | |
| nitrate/nitrite colorimetric assay kit | Cayman Chemical | 780001 | |
| Oligonucleotides | W. M. Keck Foundation Biotechnology at Yale University | custom order | |
| PDGF-BB | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| TBTA | Sigma-Aldrich | 678937 | |
| Triethylamine | Sigma-Aldrich | T0886 | |
| Desalting column | GE Healthcare | illustra MicroSpin G-25 Columns | |
| HPLC | Waters | 2695 separation module | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 4.6 mm × 50 mm) | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 10 mm × 50 mm) | |
| Plate reader | BioTek | synergy H4 hybrid |
References
- Hunter, T. Signaling—2000 and Beyond. Cell. 100, 113-127 (2000).
- Levitzki, A., Klein, S. Signal transduction therapy of cancer. Mol Aspects Med. 31, 287-329 (2010).
- Peri-Naor, R., Motiei, L., Margulies, D. Artificial signal transduction therapy: a futuristic approach to disease treatment. Future Med. Chem. 7, 2091-2093 (2015).
- Peri-Naor, R., Ilani, T., Motiei, L., Margulies, D. Protein-Protein Communication and Enzyme Activation Mediated by a Synthetic Chemical Transducer. J. Am. Chem. Soc. 137, 9507-9510 (2015).
- Corson, T. W., Aberle, N., Crews, C. M. Design and Applications of Bifunctional Small Molecules: Why Two Heads Are Better Than One. ACS Chem. Biol. 3, 677-692 (2008).
- Rutkowska, A., Schultz, C. Protein Tango: The Toolbox to Capture Interacting Partners. Angew. Chem. Int. Ed. 51, 8166-8176 (2012).
- Meyer, C., Köhn, M. A Molecular Tête-à-Tête Arranged by a Designed Adaptor Protein. Angew. Chem. Int. Ed. 51, 8160-8162 (2012).
- Klemm, J. D., Schreiber, S. L., Crabtree, G. R. Dimerization as a Regulatory Mechanism in Signal Transduction. Annu. Rev. Immunol. 16, 569-592 (1998).
- DeRose, R., Miyamoto, T., Inoue, T. Manipulating signaling at will: chemically-inducible dimerization (CID) techniques resolve problems in cell biology. Pflugers Arch. 465, 409-417 (2013).
- Gestwicki, J. E., Marinec, P. S. Chemical control over protein-protein interactions: beyond inhibitors. Comb. Chem. High Throughput. Screen. 10, 667-675 (2007).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. 25, 848-862 (2013).
- Diezmann, F., Seitz, O. DNA-guided display of proteins and protein ligands for the interrogation of biology. Chem. Soc. Rev. 40, 5789-5801 (2011).
- Röglin, L., Ahmadian, M. R., Seitz, O. DNA-Controlled Reversible Switching of Peptide Conformation and Bioactivity. Angew. Chem. Int. Ed. 46, 2704-2707 (2007).
- Röglin, L., Altenbrunn, F., Seitz, O. DNA and RNA-Controlled Switching of Protein Kinase Activity. ChemBioChem. 10, 758-765 (2009).
- Harris, D. C., Chu, X., Jayawickramarajah, J. DNA-Small Molecule Chimera with Responsive Protein-Binding Ability. J. Am. Chem. Soc. 130, 14950-14951 (2008).
- Harris, D. C., Saks, B. R., Jayawickramarajah, J. Protein-Binding Molecular Switches via Host-Guest Stabilized DNA Hairpins. J. Am. Chem. Soc. 133, 7676-7679 (2011).
- Kim, Y., Cao, Z., Tan, W. Molecular assembly for high-performance bivalent nucleic acid inhibitor. Proc. Nat. Acad. Sci. U.S.A. 105, 5664-5669 (2008).
- Han, D., et al. A Logical Molecular Circuit for Programmable and Autonomous Regulation of Protein Activity Using DNA Aptamer-Protein Interactions. J. Am. Chem. Soc. 134, 20797-20804 (2012).
- Motiei, L., Pode, Z., Koganitsky, A., Margulies, D. Targeted Protein Surface Sensors as a Tool for Analyzing Small Populations of Proteins in Biological Mixtures. Angew. Chem. Int. Ed. 53, 9289-9293 (2014).
- Ranallo, S., Rossetti, M., Plaxco, K. W., Vallée-Bélisle, A., Ricci, F. A Modular, DNA-Based Beacon for Single-Step Fluorescence Detection of Antibodies and Other Proteins. Angew. Chem. Int. Ed. 54, 13214-13218 (2015).
- Franzini, R. M., et al. Identification of Structure-Activity Relationships from Screening a Structurally Compact DNA-Encoded Chemical Library. Angew. Chem. Int. Ed. 54, 3927-3931 (2015).
- Unger-Angel, L., et al. Protein recognition by bivalent, 'turn-on' fluorescent molecular probes. Chem. Sci. 6, 5419-5425 (2015).
- Nissinkorn, Y., et al. Sensing Protein Surfaces with Targeted Fluorescent Receptors. Chem. Eur. J. 21, 15981-15987 (2015).
- Huber, C. G., Oefner, P. J., Bonn, G. K. High-Resolution Liquid Chromatography of Oligonucleotides on Nonporous Alkylated Styrene-Divinylbenzene Copolymers. Anal. Biochem. 212, 351-358 (1993).
- Lyon, R. P., Hill, J. J., Atkins, W. M. Novel class of bivalent glutathione S-transferase inhibitors. Biochemistry. 42, 10418-10428 (2003).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. , 1-16 (2013).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved