A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מחק את תפקודם של חלבוני איתות: לקראת תרפים התמר איתותים מלאכותיות
In This Article
Summary
We present guidelines for developing synthetic 'chemical transducers' that can induce communication between naturally unrelated proteins. In addition, detailed protocols are presented for synthesizing and testing a specific 'transducer' that enables a growth factor to activate a detoxifying enzyme and consequently, to regulate the cleavage of an anticancer prodrug.
Abstract
Signal transduction pathways, which control the response of cells to various environmental signals, are mediated by the function of signaling proteins that interact with each other and activate one other with high specificity. Synthetic agents that mimic the function of these proteins might therefore be used to generate unnatural signal transduction steps and consequently, alter the cell's function. We present guidelines for designing 'chemical transducers' that can induce artificial communication between native proteins. In addition, we present detailed protocols for synthesizing and testing a specific 'transducer', which can induce communication between two unrelated proteins: platelet-derived growth-factor (PDGF) and glutathione-S-transferase (GST). The way by which this unnatural PDGF-GST communication could be used to control the cleavage of an anticancer prodrug is also presented, indicating the potential for using such systems in 'artificial signal transduction therapy'. This work is intended to facilitate developing additional 'transducers' of this class, which may be used to mediate intracellular protein-protein communication and consequently, to induce artificial cell signaling pathways.
Introduction
מסלולי העברת אותות לשחק תפקיד משמעותי כמעט בכל תהליך הסלולר המאפשרים לתא להגיב לאותות סביבתיים במהירות. 1 מסלולים אלה הם בדרך כלל מופעלים על ידי הקשירה של מולקולת איתות קולטן תאי, שתוצאתה הפעלה של אנזימים תאיים. הגברת התפשטות של האיתותים בתוך התא מתווכת על ידי הפונקציה של איתות חלבונים יוצרים רשת של אינטראקציות בין חלבונים שבו אנזימים מופעלים הפיך עם סגוליות גבוהות. בגלל חוסר ויסות של רשתות אלה לעיתים קרובות מוביל להתפתחות סרטן, חלה התעניינות רבה בהקמת 'טיפול הולכת אותות של סרטן', 2 לפיה תרופות נועדו לשבש מסלולי איתות ממאיר. הצענו לאחרונה גישה חלופית לאותת טיפול תמרה המסתמך על היכולת של תרופות כדי ליצור מסלולי העברת אותות טבעיים. 3 בפרט, אנו מאמינים כי על ידי עיצוב סוכנים סינטטיים המחקים את תפקודם של חלבוני איתות, אפשר יהיה לווסת את הפונקציה של התא בעקיפין. לדוגמא, רשתות המלאכותיות אלה עשויות לאפשר סמנים ביולוגיים חלבון להפעיל אנזימים לבקע prodrugs. לחלופין, mimetics חלבון איתות אלה יוכל להפעיל מסלולי איתות תאי טבעי, וכתוצאה מכך השפעות טיפוליות.
כדי להוכיח את ההיתכנות של גישה זו, יצרנו לאחרונה 'מתמר כימי "סינתטי 4 המאפשר גורם גדילה הנגזרות טסיות (PDGF) כדי לעורר את המחשוף של prodrug נגד סרטן על ידי הפעלת גלוטתיון-s-transferase (GST), אשר הוא לא שותף המחייב טבעי. המבנה של "מתמר" זה מורכב aptamer DNA אנטי PDGF כי הוא שונה עם מעכב הדו-ערכי עבור GST. לפיכך, סוכן סינתטי זה שייך למשפחה של מולקולות עם אתרי הקישור כדיחלבונים שונים, 5-7 כגון מעוררים כימיים של dimerization (מספרי CID) 8-10 וגם לקבוצת חלבון-קלסרים מבוססת על conjugates מולקולה סינטטי oligonucleotide. 11-21
העקרונות הכלליים שבבסיס העיצוב של מערכות כאלה מתוארים במסמך זה ו פרוטוקולים מפורטים סינתזה ובדיקת התפקוד של זה 'מתמר' עם מבחני האנזימטית קונבנציונליים מסופקים. עבודה זו נועדה להקל על פיתוח 'מתמרים' נוסף של מחלקה זו, אשר עשוי לשמש לתווך תקשורת בין חלבונים תאיים וכתוצאה מכך, לגרום מסלולי איתות תאים מלאכותיים.
איור 1 סכמטי המתאר את עקרונות ההפעלה של הסינתטי "מתמר כימי 'שיכול לתווך תקשורת בין חלבונים טבעיים. באיור זה, א 'מתמר כימית', משלבת קלסרים סינטטי protEins I ו- II (קלסרים I ו- II), מאפשרים חלבון השני כדי לעורר את הפעילות הקטליטית של חלבון לי, שהוא לא שותף המחייב טבעי. בהיעדר חלבון II, מתמר נקשר לאתר הקטליטית של האנזים (אני חלבון) ומעכב את פעילותו (איור 1, המדינה השנייה). הכריכה של "מתמר" לחלבון השני, לעומת זאת, מקדם אינטראקציות בין לי קלסר ועל פני השטח של חלבון II (איור 1, מדינת iii), אשר מפחית זיקה כלפי I. חלבון כתוצאה מכך, הוא הריכוז היעיל של ' מתמר חינם 'בפתרון הצטמצם, מה שמוביל דיסוציאציה של החלבון מתמר שאני מורכב וכדי מחדש של חלבון אני (איור 1, מדינת iv). יחדיו, את הפעולות הבאות להדגיש שלושה עקרונות יסוד שביסוד העיצוב של 'מתמר' יעיל: (1) "מתמר" צריך קלסר ספציפי עבור כל אחת מן מטרות החלבון, (2) betwe האינטראקציהen קלסר השני והחלבון שני צריכים להיות חזק יותר את האינטראקציה בין לי קלסר והחלבון לי, ו- (3) קלסר אני חייב להיות מסוגל לקיים אינטראקציה עם פני השטח של חלבון II. העיקרון אחרון זה לא בהכרח דורש קלסר שאני לבד תהיה זיקה גבוהה סלקטיביות לכיוון החלבון השני. במקום זאת, היא מבוססת על המחקרים עדכניים שלנו שהראו כי הבאת מולקולה סינטתית בסמיכות חלבון עשויה לקדם אינטראקציות בין מולקולה זו ועל פני השטח של החלבון. 19,22,23
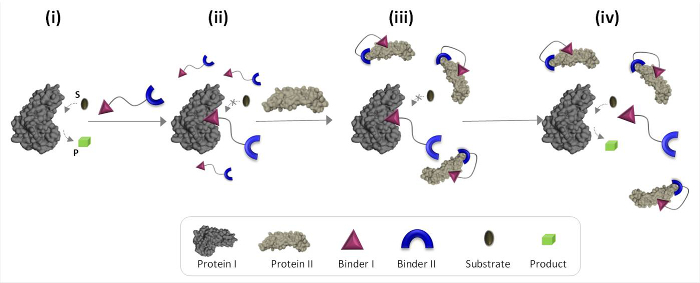
איור 1:. הפעלת עקרונות 'מתמר כימי' כאשר 'מתמר הכימית' מתווסף חלבון פעיל אני (מדינת i), הוא נקשר לאתר הפעיל שלה באמצעות קלסר לי ומעכב את פעילותו (המדינה השנייה). בנוכחות החלבון השני, לעומת זאת, לא כרוך לא כימיתransducer 'אינטראקציה עם חלבון II באמצעות קלסר השנייה, המקדמת אינטראקציות בין לי קלסר ועל פני השטח של חלבון II. קלסר המושרה זה I-חלבון II אינטראקציה מפחית את ריכוז יעיל של קלסר לי, מה שמוביל דיסוציאציה של שנות ה-חלבון transducer' שאני מורכבים לחלבון שאני מחדש (המדינה iv). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו .
Access restricted. Please log in or start a trial to view this content.
Protocol
1. סינתזה של 'מתמר הכימי "
- הכנות מוקדמות
- הכן 2 M triethylammonium אצטט (TEAA) חיץ על ידי ערבוב 278 מ"ל של triethylamine עם 114 מ"ל של חומצה אצטית 400 מ"ל מים ultrapure. התאם את ה- pH עד 7 ומוסיפים מים עד נפח סופי של 1 ל Keep it בבקבוק כהה.
הערה: פתרון זה הוא יציב במשך שנים. - כן פתרון חומצה אסקורבית 5 מ"מ על ידי המסת 18 מ"ג של חומצת אסקורבית ב 20 מ"ל מי ultrapure. השתמש פתרון חדש; הפתרון הוא יציב במשך יום אחד.
- הכן 10 מ"מ Cu (II) / טריס (benzyltriazolylmethyl) אמין פתרון (TBTA) על ידי המסת 25 מ"ג נחושת (II) pentahydrate סולפט ב 10 מ"ל מים ultrapure ו -58 מ"ג של TBTA ב 11 מ"ל דימתיל sulfoxide (DMSO). מערבבים את שני פתרונות. שמור את זה בטמפרטורת החדר ולהגן עליו מפני האור.
- הכן 2 M triethylammonium אצטט (TEAA) חיץ על ידי ערבוב 278 מ"ל של triethylamine עם 114 מ"ל של חומצה אצטית 400 מ"ל מים ultrapure. התאם את ה- pH עד 7 ומוסיפים מים עד נפח סופי של 1 ל Keep it בבקבוק כהה.
- נוהל הצמיד
- ממיסים 100 nmol של oligonucleotide שונה (ODN-1) ב 80 μlמי ultrapure טריים. הוסף 20 μl של 2 M TEAA, pH = 7. הוסף 80 μl של פתרון עתה הוצעה חומצה אסקורבית (5 מ"מ במים).
- ממיסים 1.5 μmol (574.5 מיקרוגרם) של חומצה ethacrynic-modified azido ב 180 μl של DMSO ולהוסיף אותו הפתרון. דגה את הפתרון באמצעות ארגון למשך 60 שניות ובמהירות להוסיף 40 μl מן Cu (II) / פתרון TBTA (10 מ"מ ב -55% (v / v) DMSO / מים).
- טהר שוב עם ארגון וסוגרים היטב, ומערבבים לילה.
- מעקב אחר ההתקדמות של התגובה ולטהר המצומד ידי RP-HPLC (שלב נייד: א) 5% אצטוניטריל, 5% TEAA, מי ultrapure 90%; B) 65% אצטוניטריל, 5% TEAA, 30% מים ultrapure). 24
2. שליטה פעילות GST ידי PDGF
- הכנות מוקדמות
- כן 50 מיליליטר של חיץ assay על ידי ערבוב 33.9 מיליליטר של פוספט שנאגר מלוח (PBSx1) עם 16.1 מיליליטר מי ultrapure להשיג ריכוז פוספט סופי 8 מ"מ ו מודעהד 23.8 מ"ג של MgCl 2 כדי להשיג ריכוז סופי 5 מ"מ.
- הכן פתרון המניות של GST M1-1 ידי המסת החלבון חוצץ המכיל 50 מ"מ טריס pH 7.5, 50 mM NaCl, 1 מ"מ dithiothreitol (DTT), ו -5 מ"מ חומצה ethylenediaminetetraacetic (EDTA) לריכוז סופי של 30 מיקרומטר. מחלק את הפתרון הזה לתוך aliquots וחנות קטן ב -80 C. לדלל טרי, לפי סעיף 2.1.5.1, למאגר Assay ולשמור על הקרח.
הערה: הפתרון יהיה יציב למשך כ -5 שעות, או עד יש ירידה בפעילות האנזים. - מכין את המצע על פי ההוראות הבאות:
- ממיסים 10 מ"ג של גלוטתיון מופחת (GSH) ב 325 μl של מים ultrapure לריכוז סופי של פתרון המניות 100 מ"מ. לדלל 21 μl מפתרון המניה הזו ב 979 μl של חיץ Assay עבור ריכוז סופי של הפתרון עובד 2.1 מ"מ.
- ממיסים 10 מ"ג של 2,4-dinitrochlorobenzene (CDNB) ב 492 μl של דוארthanol לריכוז סופי של פתרון המניות 100 מ"מ. לדלל 43.2 μl מפתרון המניות ב 956.8 μl של חיץ Assay עבור ריכוז סופי של הפתרון עובד 4.32 מ"מ.
- צלחת 96-היטב, לשים את כל מצע בשורה נפרדת (12 בארות). הכנס לפחות 60 μl היטב לתוך כל אחד כדי לאפשר נסיגה מהירה וקלה של הפתרון. מכסים את הצלחת עם גיליון אלומיניום להגנה אור.
- הכן את פתרונות המניות הבאות למאגר Assay:
- לדלל GST M1-1 ב -50 לריכוז סופי של 0.6 מיקרומטר של דימר.
- לדלל את 'מתמר כימי "כדי פתרון מניות 30 מיקרומטר.
- לדלל PDGF לריכוז סופי של 40 מיקרומטר.
- לדלל aptamer PDGF לריכוז סופי של 250 מיקרומטר.
- מדדו את פעילות GST בנוכחות של 'מתמר כימי' ו PDGF.
- הגדרת i הליך הניסויn קורא הצלחת למדידת קינטית.
- צור ניסוי חדש כמו 'פרוטוקול סטנדרטי ".
- לחץ על "נוהל" כדי לפתוח את חלון הגדרות הליך.
- ברשימת הקופצות בצד העליון של החלון, בחר את סוג '384 צלחת' לפי יצרן הצלחת.
- "לקרוא" לחצו בתפריט השמאלי.
- לגבי שיטת זיהוי לבחור "ספיגה".
- באשר לסוג הקריאה לבחור "נקודת סיום".
- כתוב 340 ננומטר על החלון הגל.
- לחץ על החלק התחתון "צלחת מלאה" בצד הימני העליון ולבחור הבאר כדי להימדד.
- 'בסדר' כדי לסגור את החלון 'קרא'.
- בחר "להתחיל התנועתיות" בתפריט השמאלי.
- הפוך את 10 דקות לרוץ זמן.
- בחר באפשרות המרווחת מינימום.
- לחץ על 'אישור' כדי לסגור את החלון קינטית.
- גרור את i קו 'קרא'n כדי המדידה קינטית.
- לחצו על כפתור "לאמת" ולאחר מכן על הלחצן 'אישור'.
- שמור את הניסוי.
- לחצו על הלחצן 'הפעל'. תיבת דו-שיח תופיע - ללחוץ על כפתור 'אישור' רק כאשר המדידה יש להתחיל.
- על מנת לבצע את הניסוי triplicates, להכין ארבעה דוגמאות שכל אחת מהן מכילה 3.25 μl של 'מתמר כימי' ו 3.25 μl של GST M1-1. הוסף מדגם 0, 1.2, 2.4, או 4.9 μl של PDGF ו- 123.5, 122.3, 121.1, 118.6 או μl של חיץ assay, בהתאמה.
- דגירה הפתרון בטמפרטורת החדר למשך 10 דקות.
- בצלחת גם 384-שקוף, להוסיף 40 μl של מדגם זה טוב. הכנס את הדגימות רק בארות המוזרות או רק הבארות אפילו באותה השורה כדי לאפשר את השימוש של פיפטור רב עבור בנוסף מצע.
- באמצעות 12 ערוצים רב פיפטור, להוסיף במהירות 10 μl מכל אחת tהוא מצעים שהיו מוכנות מראש בצלחת 96-היטב (סעיף 2.1.4). מערבבים בעדינות ובמהירות, כדי למנוע בועות. הכנס את הצלחת לתוך הקורא ולהתחיל המדידה קינטית. מאז קינטיקה GST היא מהירה למדי, מנסה לצמצם את הזמן בין בנוסף המצע לבין תחילת המדידה קינטית.
- הגדרת i הליך הניסויn קורא הצלחת למדידת קינטית.
- מחזורי GST הפעלה / עיכוב מתווך על ידי 'מתמר הכימי ".
- על מנת לבצע את הניסוי triplicates, להכין 5 דגימות שכל אחת מהן מכילה 84.5 μl של חיץ assay, 3.25 μl של 'מתמר כימי', ו 3.25 μl של GST M1-1. דגירה בטמפרטורת החדר למשך 3 דקות.
- להוסיף 3.65 μl של חיץ Assay לדגום 1 ו 3.65 μl של PDGF קטעים 2-5. דגירה בטמפרטורת החדר למשך 3 דקות.
- להוסיף 3.12 μl של חיץ Assay קטעים 1-2 ו 3.12 μl של aptamer PDGF קטעים 3-5. דגירה בטמפרטורת החדר למשך 3 דקות.
- להוסיף 24.4 μl של חיץ Assay כדי דגימות1-3 ו 24.4 μl של PDGF קטעים 4-5. דגירה בטמפרטורת החדר למשך 3 דקות.
- להוסיף 7.8 μl של חיץ Assay קטעים 1-4 ו -7.8 μl של aptamer PDGF לדגום 5. דגירה בטמפרטורת החדר למשך 5 דקות.
- בצלחת גם 384-שקוף, להוסיף 40 μl של מדגם לבאר כל אחד. דגימות הכניסו רק לתוך מוזר או רק לתוך הבארות אפילו באותה השורה.
- באמצעות 12 ערוצים רב פיפטור, להוסיף במהירות 10 μl מכל מצע (מוכן מראש בצלחת 96-היטב). מערבבים בעדינות ובמהירות, כדי למנוע בועות. הכנס את הצלחת לתוך הקורא ולהתחיל המדידה קינטית.
- חשב את V 0 [MOD / min] תחת כל תנאי על ידי הפחתת OD הנמדדים 340 ננומטר בזמן t = 0.5 דקות מן OD הנמדדים 340 ננומטר בזמן t = 1.5 דקות כדי להעריך את המחזור הפעלה / עיכוב. 25
- להעריך את התגובה בזמן אמת של 'מתמר כימי "כדי השינויים בסביבה.
- אפקט בזמן אמת של בנוסף PDGF
- הגדרת הליך ניסיוני בקורא הצלחת למדידת קינטית.
- חזור על שלבי 2.2.1.1-2.2.1.10.
- הפוך את זמן הריצה 3.5 דקות.
- בחר באפשרות המרווחת מינימום.
- לחץ על 'אישור' כדי לסגור את החלון קינטית.
- גרור את הקו 'קרא' לתוך המדידה קינטית.
- בחר פלייט מתוך / ב בתפריט השמאלי.
- בחר באפשרות 'צלחת החוצה (לא הדו-שיח)'.
- בחר באפשרות 'העיכוב' בתפריט השמאלי וזן 30 שניות.
- בחר פלייט מתוך / ב בתפריט השמאלי.
- בחר באפשרות 'הצלחת (לא הדו-שיח)'.
- צור מדידת הקינטית שנייה על ידי חזרה על שלבי 2.2.1.4 - 2.2.1.14 אבל בסעיף 2.2.1.11 להגדיר את הקינטית להיות 25 דקות במקום 10 דקות.
- לחצו על כפתור "לאמת" ולאחר מכן על הלחצן 'אישור'.
- שמור את הניסוי.
- לחצו 'צבא השחרור העממילחצן 'y. תיבת דו-שיח תופיע - ללחוץ על כפתור 'אישור' רק כאשר המדידה יש להתחיל.
- הכינו שתי דגימות ידי ערבוב 1 μl של GST M1-1 ו 1 μl של 'מתמר כימי' ב 38 μl של חיץ assay. הכנס את הדגימות לשתי בארות של צלחת גם 384-שקופה, עוזב באר מים ריק בין שתי בארות אלה.
- באמצעות 12 ערוצים רב פיפטור, להוסיף במהירות 10 μl מכל המצע, מערבבים בעדינות ובמהירות, כדי למנוע בועות, הכנס את הצלחת לתוך הקורא ולהתחיל המדידה קינטית.
- כשהצלחת פותחת (לאחר 3.5 דקות), להוסיף במהירות 1.125 μl של PDGF לאחד הבארות, ומערבבים בעדינות, ולאפשר את הצלחת לסגור למדידות הקינטית הנותרים.
- אפקט בזמן אמת של הוספת aptamer PDGF
- חזור על שלבי 2.4.1.1-2.4.1.15.
- הכינו שתי דגימות ידי ערבוב 1 μl של GST M1-1, 1 μl של 'מתמר כימי ', ו 1.125 μl של PDGF ב 36.9 μl של חיץ assay. הכנס את הדגימות לשתי בארות של צלחת גם 384-שקופה, עוזב באר מים ריק בין שתי בארות אלה.
- באמצעות 12 ערוצים רב פיפטור, להוסיף במהירות 10 μl מכל המצע, מערבבים בעדינות ובמהירות, כדי למנוע בועות, הכנס את הצלחת לתוך הקורא, ולהתחיל המדידה קינטית.
- כשהצלחת פותחת (לאחר 1.5 דקות), להוסיף במהירות 1.2 μl של aptamer PDGF לאחד הבארות, ומערבבים בעדינות ולאפשר את הצלחת לסגור למדידות הקינטית הנותרים.
- אפקט בזמן אמת של בנוסף PDGF
- מדוד JS-K prodrug הפעלה באמצעות GST בנוכחות של 'מתמר כימי' ו PDGF.
- הגדרת הליך ניסיוני בקורא הצלחת למדידת קינטית.
- צור ניסוי חדש כמו 'פרוטוקול סטנדרטי ".
- לחץ על "נוהל" כדי לפתוח את חלון הגדרות הליך.
- ברשימת הקופצות בצד העליון של החלון לבחור סוג '384 צלחת' לפי יצרן הצלחת.
- "לקרוא" לחצו בתפריט השמאלי.
- לגבי שיטת זיהוי בוחרת "ספיגה".
- באשר לסוג הקריאה לבחור "נקודת סיום".
- כתוב 305 ננומטר על החלון הגל.
- לחצו על הכפתור "צלחת מלאה" בצד הימני העליון ולבחור הבאר כדי להימדד.
- 'בסדר' כדי לסגור את החלון 'קרא'.
- בחר "להתחיל התנועתיות" בתפריט השמאלי.
- הפוך את 10 דקות לרוץ זמן.
- בחר באפשרות המרווחת מינימום.
- לחץ על 'אישור' כדי לסגור את החלון קינטית.
- גרור את הקו 'קרא' לתוך המדידה קינטית.
- לחצו על כפתור "לאמת" ולאחר מכן על הלחצן 'אישור'.
- שמור את הניסוי.
- לחצו על הלחצן 'הפעל'. Bo-שיחx יופיעו - לחץ על הלחצן 'אישור' רק כאשר יש להתחיל את המדידה.
- לייצור NO מדידות להשתמש בערכת קלוריות ניטריט / ניטרט. צלחת 96-היטב להכניס 50 μl של חיץ assay לתוך שורה אחת, 70 μl של Griess שאני מגיב לתוך בשורה שנייה, ו -70 μl של מגיב Griess השני לתוך בשורה שלישית.
- על מנת לבצע את ניסוי triplicates, להכין ארבע דוגמאות שכל אחת מהן מכיל 4.8 μl של 'מתמר הכימי ". כדי לדגום 1, להוסיף 155.2 μl של חיץ Assay; לדגום 2, להוסיף 3.2 μl של GST-M1-1 ו -152 μl של חיץ Assay; לדגום 3, להוסיף 9.6 μl של PDGF ו- 145.6 μl של חיץ Assay; וכדי לטעום 4, להוסיף 3.2 μl של GST-M1-1, 9.6 μl של PDGF, ו 142.4 μl של חיץ assay.
- דגירה הפתרון בטמפרטורת החדר למשך 10 דקות.
- בצלחת גם 384-שקוף, להוסיף 50 μl של מדגם לבאר כל אחד. דגימות הכנס רק מוזר או רקאפילו בארות באותה השורה כדי לאפשר את השימוש של פיפטור רב עבור בנוסף מצע.
- להוסיף 0.54 μl של JS-K (5 מ"מ DMSO) זה טוב.
- באמצעות 12 ערוצים רב פיפטור, להוסיף במהירות 10 μl מפתרון GSH (מוכנה מראש בצלחת 96-היטב), לערבב בעדינות ובמהירות כדי למנוע בועות. הכנס את הצלחת לתוך הקורא ולהתחיל המדידה קינטית.
- מיד לאחר המדידה קינטית, באמצעות רב פיפטור 12 ערוצים, לקחת 50 μl מכל מדגם לתוך השורה חיץ assay בצלחת 96-גם מוכנה מראש ובמהירות ולהוסיף לו 50 μl של מגיב Griess I ו- 50 μl של מגיב Griess השנייה. דגירה, תוך הגנה מפני אור במשך 10 דקות ב RT ולמדוד את הספיגה ב 550 ננומטר.
הערה: חיץ assay והנפחים ריאגנטים תלויים בפרוטוקול 'הערכות.
- הגדרת הליך ניסיוני בקורא הצלחת למדידת קינטית.
Access restricted. Please log in or start a trial to view this content.
תוצאות
העיצוב, הסינתזה, מנגנון הפעולה של 'מתמר כימי' שיכול לגרום תקשורת מלאכותית בין PDGF ו- GST מוצג באיור 2. המבנה של "מתמר" משלב aptamer PDGF DNA וכן אמיד bis-ethacrynic (BEA ), אשר הינו מעכב GST ידוע (איור 2 א). 19 קלסרים אלה מאפשרות 'מתמר' להיק?...
Access restricted. Please log in or start a trial to view this content.
Discussion
We presented a method for designing and testing of a 'chemical transducer' that can induce artificial communication between two naturally unrelated proteins, GST and PDGF, without modifying the native proteins. The unnatural GST-PDGF communications could be detected in real time by using enzymatic assays that follow the changes in the activity of GST in the presence of the 'chemical transducer' and increasing the concentrations of PDGF. In addition to detecting the activation of GST by PDGF, these assays were used to fol...
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors have nothing to disclose.
Acknowledgements
מחקר זה מומן על ידי קרן מינרווה, ארגון HFSP, ומענק המועצה האירופית למחקר (החל גרנט 338,265).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1-chloro-2,4-dinitrobenzene | Sigma-Aldrich | 237329 | |
| Acetic acid | Bio Lab | 01070521 | |
| Acetnitrile | J.T.Baker | 9017-03 | |
| Ascorbic acid | Sigma-Aldrich | A4544 | |
| Copper(II) Sulfate pentahydrate | Merck-Millipore | 102790 | |
| Dimethyl sulfoxide | Merck-Millipore | 802912 | |
| Dulbecco's Phosphate Buffered Saline | Biological Industries | 02-023-5A | |
| Ethacrynic acid | Tokyo Chemical Industry Co. Ltd | E0526 | |
| Glutathione-s-transferase M1-1 | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| JS-K | Sigma-Aldrich | J4137 | |
| L-glutathione reduced | Sigma-Aldrich | G4251 | |
| Magnesium Chloride | J.T.Baker | 0162 | |
| nitrate/nitrite colorimetric assay kit | Cayman Chemical | 780001 | |
| Oligonucleotides | W. M. Keck Foundation Biotechnology at Yale University | custom order | |
| PDGF-BB | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| TBTA | Sigma-Aldrich | 678937 | |
| Triethylamine | Sigma-Aldrich | T0886 | |
| Desalting column | GE Healthcare | illustra MicroSpin G-25 Columns | |
| HPLC | Waters | 2695 separation module | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 4.6 mm × 50 mm) | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 10 mm × 50 mm) | |
| Plate reader | BioTek | synergy H4 hybrid |
References
- Hunter, T. Signaling—2000 and Beyond. Cell. 100, 113-127 (2000).
- Levitzki, A., Klein, S. Signal transduction therapy of cancer. Mol Aspects Med. 31, 287-329 (2010).
- Peri-Naor, R., Motiei, L., Margulies, D. Artificial signal transduction therapy: a futuristic approach to disease treatment. Future Med. Chem. 7, 2091-2093 (2015).
- Peri-Naor, R., Ilani, T., Motiei, L., Margulies, D. Protein-Protein Communication and Enzyme Activation Mediated by a Synthetic Chemical Transducer. J. Am. Chem. Soc. 137, 9507-9510 (2015).
- Corson, T. W., Aberle, N., Crews, C. M. Design and Applications of Bifunctional Small Molecules: Why Two Heads Are Better Than One. ACS Chem. Biol. 3, 677-692 (2008).
- Rutkowska, A., Schultz, C. Protein Tango: The Toolbox to Capture Interacting Partners. Angew. Chem. Int. Ed. 51, 8166-8176 (2012).
- Meyer, C., Köhn, M. A Molecular Tête-à-Tête Arranged by a Designed Adaptor Protein. Angew. Chem. Int. Ed. 51, 8160-8162 (2012).
- Klemm, J. D., Schreiber, S. L., Crabtree, G. R. Dimerization as a Regulatory Mechanism in Signal Transduction. Annu. Rev. Immunol. 16, 569-592 (1998).
- DeRose, R., Miyamoto, T., Inoue, T. Manipulating signaling at will: chemically-inducible dimerization (CID) techniques resolve problems in cell biology. Pflugers Arch. 465, 409-417 (2013).
- Gestwicki, J. E., Marinec, P. S. Chemical control over protein-protein interactions: beyond inhibitors. Comb. Chem. High Throughput. Screen. 10, 667-675 (2007).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. 25, 848-862 (2013).
- Diezmann, F., Seitz, O. DNA-guided display of proteins and protein ligands for the interrogation of biology. Chem. Soc. Rev. 40, 5789-5801 (2011).
- Röglin, L., Ahmadian, M. R., Seitz, O. DNA-Controlled Reversible Switching of Peptide Conformation and Bioactivity. Angew. Chem. Int. Ed. 46, 2704-2707 (2007).
- Röglin, L., Altenbrunn, F., Seitz, O. DNA and RNA-Controlled Switching of Protein Kinase Activity. ChemBioChem. 10, 758-765 (2009).
- Harris, D. C., Chu, X., Jayawickramarajah, J. DNA-Small Molecule Chimera with Responsive Protein-Binding Ability. J. Am. Chem. Soc. 130, 14950-14951 (2008).
- Harris, D. C., Saks, B. R., Jayawickramarajah, J. Protein-Binding Molecular Switches via Host-Guest Stabilized DNA Hairpins. J. Am. Chem. Soc. 133, 7676-7679 (2011).
- Kim, Y., Cao, Z., Tan, W. Molecular assembly for high-performance bivalent nucleic acid inhibitor. Proc. Nat. Acad. Sci. U.S.A. 105, 5664-5669 (2008).
- Han, D., et al. A Logical Molecular Circuit for Programmable and Autonomous Regulation of Protein Activity Using DNA Aptamer-Protein Interactions. J. Am. Chem. Soc. 134, 20797-20804 (2012).
- Motiei, L., Pode, Z., Koganitsky, A., Margulies, D. Targeted Protein Surface Sensors as a Tool for Analyzing Small Populations of Proteins in Biological Mixtures. Angew. Chem. Int. Ed. 53, 9289-9293 (2014).
- Ranallo, S., Rossetti, M., Plaxco, K. W., Vallée-Bélisle, A., Ricci, F. A Modular, DNA-Based Beacon for Single-Step Fluorescence Detection of Antibodies and Other Proteins. Angew. Chem. Int. Ed. 54, 13214-13218 (2015).
- Franzini, R. M., et al. Identification of Structure-Activity Relationships from Screening a Structurally Compact DNA-Encoded Chemical Library. Angew. Chem. Int. Ed. 54, 3927-3931 (2015).
- Unger-Angel, L., et al. Protein recognition by bivalent, 'turn-on' fluorescent molecular probes. Chem. Sci. 6, 5419-5425 (2015).
- Nissinkorn, Y., et al. Sensing Protein Surfaces with Targeted Fluorescent Receptors. Chem. Eur. J. 21, 15981-15987 (2015).
- Huber, C. G., Oefner, P. J., Bonn, G. K. High-Resolution Liquid Chromatography of Oligonucleotides on Nonporous Alkylated Styrene-Divinylbenzene Copolymers. Anal. Biochem. 212, 351-358 (1993).
- Lyon, R. P., Hill, J. J., Atkins, W. M. Novel class of bivalent glutathione S-transferase inhibitors. Biochemistry. 42, 10418-10428 (2003).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. , 1-16 (2013).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved