È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Imitando la funzione di proteine di segnalazione: Verso artificiale trasduzione del segnale Therapy
In questo articolo
Riepilogo
We present guidelines for developing synthetic 'chemical transducers' that can induce communication between naturally unrelated proteins. In addition, detailed protocols are presented for synthesizing and testing a specific 'transducer' that enables a growth factor to activate a detoxifying enzyme and consequently, to regulate the cleavage of an anticancer prodrug.
Abstract
Signal transduction pathways, which control the response of cells to various environmental signals, are mediated by the function of signaling proteins that interact with each other and activate one other with high specificity. Synthetic agents that mimic the function of these proteins might therefore be used to generate unnatural signal transduction steps and consequently, alter the cell's function. We present guidelines for designing 'chemical transducers' that can induce artificial communication between native proteins. In addition, we present detailed protocols for synthesizing and testing a specific 'transducer', which can induce communication between two unrelated proteins: platelet-derived growth-factor (PDGF) and glutathione-S-transferase (GST). The way by which this unnatural PDGF-GST communication could be used to control the cleavage of an anticancer prodrug is also presented, indicating the potential for using such systems in 'artificial signal transduction therapy'. This work is intended to facilitate developing additional 'transducers' of this class, which may be used to mediate intracellular protein-protein communication and consequently, to induce artificial cell signaling pathways.
Introduzione
Vie di trasduzione del segnale giocano un ruolo significativo praticamente in ogni processo cellulare e permettono alla cellula di rispondere rapidamente a segnali ambientali. 1 Questi percorsi sono spesso innescati dal legame di una molecola di segnalazione ad un recettore extracellulare, che si traduce in attivazione di enzimi intracellulari. Amplificazione e propagazione di questo segnale all'interno della cellula è mediata dalla funzione di segnalazione proteine che formano una rete di interazioni proteina-proteina in cui gli enzimi sono reversibilmente attivati con elevata specificità. A causa disregolazione di queste reti porta spesso allo sviluppo del cancro, c'è stato molto interesse a stabilire 'trasduzione del segnale terapia del cancro', 2 in cui i farmaci sono progettati per distruggere vie di segnalazione maligni. Abbiamo recentemente proposto un approccio alternativo per segnalare terapia trasduzione che si basa sulla capacità dei farmaci di generare trasduzione del segnale innaturali. 3 In particolare, riteniamo che progettando agenti sintetici che mimano la funzione di proteine di segnalazione, sarebbe possibile modulare la funzione della cellula indirettamente. Ad esempio, queste reti artificiali possono consentire proteine biomarcatori per attivare gli enzimi che solcano profarmaci. In alternativa, questi mimetici proteina di segnalazione potrebbero essere in grado di attivare vie di segnalazione cellulare innaturali, con conseguente effetti terapeutici.
Per dimostrare la fattibilità di questo approccio, abbiamo recentemente creato una sintetica 'trasduttore chimico' 4, che consente il fattore di crescita derivato dalle piastrine (PDGF) per attivare la scissione di un profarmaco antitumorale attivando glutatione-s-transferasi (GST), che è non il suo partner naturale vincolante. La struttura di questo 'trasduttore' costituito da un anti-PDGF aptamer DNA che viene modificato con un inibitore bivalente per GST. Quindi, questo agente sintetico appartiene ad una famiglia di molecole con i siti di legame perdiverse proteine, 5-7 come induttori chimici di dimerizzazione (CID) 8-10 e anche al gruppo di proteine-leganti basato su coniugati molecola oligonucleotidi sintetici. 11-21
I principi generali alla base della progettazione di tali sistemi sono descritti nel presente documento e protocolli dettagliati per sintetizzare e testare la funzione di questo 'trasduttore' con saggi enzimatici convenzionali sono forniti. Questo lavoro è destinato a facilitare lo sviluppo di "trasduttori" aggiuntivi di questa classe, che può essere usato per mediare comunicazione proteina-proteina intracellulare e conseguentemente, per indurre vie di segnalazione delle cellule artificiali.
La figura 1 descrive schematicamente i principi di funzionamento di sintesi 'trasduttori chimici' che possono mediare la comunicazione proteina-proteina innaturali. In questa illustrazione, un 'trasduttore chimica', che integra leganti sintetici per proteins I e II (leganti I e II), consente proteina II per innescare l'attività catalitica della proteina I, che non è il suo partner naturale vincolante. In assenza di proteine II, il trasduttore lega il sito catalitico dell'enzima (proteina I) e inibisce la sua attività (Figura 1, stato ii). Il legame del 'trasduttore' alle proteine II, tuttavia, promuove interazioni tra legante I e la superficie della proteina II (Figura 1, stato iii), che riduce l'affinità verso proteine I. Di conseguenza, la concentrazione efficace del ' libera trasduttore 'nella soluzione viene ridotta, il che porta alla dissociazione del trasduttore-proteina complesso I e riattivazione della proteina I (Figura 1, stato iv). Nel loro insieme, questi passi in evidenza tre principi fondamentali alla base della progettazione di "trasduttori 'efficienti: (1) un' sensore 'dovrebbe avere un legante specifico per ciascuno dei bersagli proteici, (2) l'interazione between legante II e proteine II dovrebbe essere più forte l'interazione tra binder I e proteine I, e (3) binder devo essere in grado di interagire con la superficie della proteina II. Quest'ultimo principio non richiede necessariamente che legante io solo avrebbe un alta affinità e selettività verso proteine II. Invece, si basa su nostri recenti studi che hanno dimostrato che portare una molecola sintetica in prossimità di una proteina è in grado di favorire interazioni tra questa molecola e la superficie della proteina. 19,22,23
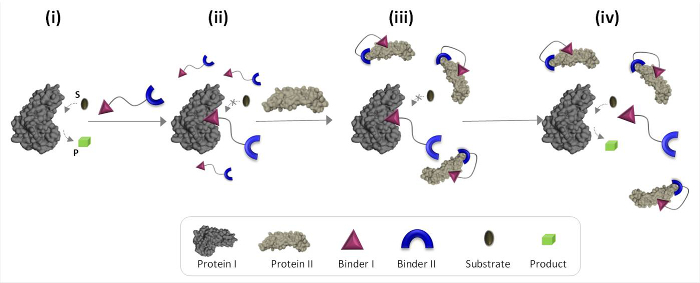
Figura 1:. Funzionamento principi di 'trasduttori chimici "Quando si aggiunge il' trasduttore chimica 'per una proteina attiva I (stato i), che si lega al suo sito attivo attraverso legante I e inibisce la sua attività (stato ii). In presenza di proteine II, tuttavia, la non legato 't chimicaransducer 'interagisce con proteine II tramite legante II, che promuove le interazioni tra legante I e la superficie della proteina II. Questo legante indotta I-II proteina interazione riduce la concentrazione effettiva di legante io, che porta alla dissociazione del 'transducer'-proteina complesso I e alle proteine I riattivazione (stato iv). Clicca qui per vedere una versione più grande di questa figura .
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Sintesi della 'chimica trasduttore'
- I preparativi preliminari
- Preparare 2 M trietilammonio acetato (TEAA) tampone mescolando 278 ml di trietilammina con 114 ml di acido acetico e 400 ml di acqua ultrapura. Regolare il pH a 7 e aggiungere acqua ad un volume finale di 1 L. Conservare in una bottiglia scura.
Nota: Questa soluzione è stabile per anni. - Preparare una soluzione di acido ascorbico 5 mM sciogliendo 18 mg di acido ascorbico in 20 ml di acqua ultrapura. Utilizzare una soluzione fresca; la soluzione è stabile per un giorno.
- Preparare una (II) soluzione 10 mM Cu / Tris (benzyltriazolylmethyl) ammina (TBTA) sciogliendo 25 mg di rame (II) pentaidrato solfato in 10 ml di acqua ultrapura e 58 mg di TBTA in 11 ml dimetilsolfossido (DMSO). Mescolare le due soluzioni. Mantenere a temperatura ambiente e proteggerla dalla luce.
- Preparare 2 M trietilammonio acetato (TEAA) tampone mescolando 278 ml di trietilammina con 114 ml di acido acetico e 400 ml di acqua ultrapura. Regolare il pH a 7 e aggiungere acqua ad un volume finale di 1 L. Conservare in una bottiglia scura.
- procedura Coniugazione
- Sciogliere 100 nmol del oligonucleotide modificato (ODN-1) in 80 microlitridi acqua ultrapura fresca. Aggiungere 20 ml di 2 M TEAA, pH = 7. Aggiungere 80 ml di una soluzione preparata di acido ascorbico (5 mM in acqua).
- Sciogliere 1,5 mmol (574,5 mg) di acido etacrinico azido-modificato in 180 ml di DMSO e aggiungerlo alla soluzione. Degassare la soluzione con Argon per 60 sec e rapidamente aggiungere 40 microlitri da (II) soluzione Cu / TBTA (10 mM in 55% (v / v) DMSO / acqua).
- Spurgare di nuovo con Argon e chiudere, e mescolare durante la notte.
- Monitorare l'avanzamento della reazione e purificare il coniugato mediante RP-HPLC (fase mobile: A) 5% acetonitrile, 5% TEAA, 90% di acqua ultrapura; B) 65% acetonitrile, 5% TEAA, il 30% di acqua ultrapura). 24
2. Controllo GST attività da PDGF
- I preparativi preliminari
- Preparare 50 ml del tampone Assay mescolando 33,9 ml di tampone fosfato (PBSx1) con 16,1 ml di acqua ultrapura per ottenere una concentrazione finale di fosfato 8 mM e annuncid 23,8 mg di MgCl 2 per ottenere un 5 mm di concentrazione finale.
- Preparare una soluzione stock di GST M1-1 sciogliendo la proteina in un tampone contenente 50 mM Tris pH 7,5, 50 mM NaCl, 1 mM ditiotreitolo (DTT), e 5 mM di acido etilendiamminotetraacetico (EDTA) ad una concentrazione finale di 30 pM. Dividere questa soluzione in piccole aliquote e conservare a -80 ° C. Diluire fresco, secondo la sezione 2.1.5.1, nel tampone e tenere in ghiaccio.
Nota: la soluzione sarà stabile per circa 5 ore, o fino a quando vi è una riduzione dell'attività enzimatica. - Preparare il supporto secondo le seguenti istruzioni:
- Disciogliere 10 mg di glutatione ridotto (GSH) in 325 ml di acqua ultrapura per una concentrazione finale di 100 mM soluzione madre. Diluire 21 ml di questa soluzione madre in 979 ml di tampone per una concentrazione finale di 2,1 soluzione di lavoro mm.
- Sciogliere 10 mg di 2,4-dinitroclorobenzene (CDNB) in 492 ml di postathanol ad una concentrazione finale di 100 soluzione madre mm. Diluire 43,2 ml di soluzione madre in 956,8 ml di un tampone per una concentrazione finale di 4.32 soluzione di lavoro mm.
- In una piastra da 96 pozzetti, mettere ogni substrato in una riga separata (12 pozzetti). Inserire almeno 60 microlitri in ciascun pozzetto per permettere semplice e veloce prelievo della soluzione. Coprire la piastra con un foglio di alluminio per la protezione dalla luce.
- Preparare le seguenti soluzioni madre nel buffer Assay:
- Diluire GST M1-1 da 50 ad una concentrazione finale di 0,6 mM del dimero.
- Diluire il 'trasduttore chimica' per un 30 micron soluzione madre.
- Diluire PDGF ad una concentrazione finale di 40 pM.
- Diluire PDGF aptamero ad una concentrazione finale di 250 mM.
- Misurare la GST attività nel presenza della 'trasduttore chimica' e PDGF.
- Impostare una procedura sperimentale in per il lettore di piastre per la misurazione cinetica.
- Creare un nuovo esperimento come un 'protocollo standard'.
- Premere 'procedura' per aprire la finestra delle impostazioni della procedura.
- Nell'elenco comparsa sul lato superiore della finestra, scegliere il tipo '384 piastra' secondo il produttore piatto.
- Premere 'Leggi' nel menu a sinistra.
- Per quanto riguarda il metodo di rilevamento scegliere 'assorbanza'.
- Per quanto riguarda il tipo di lettura scegliere 'Punto finale'.
- Valuta 340 nm sulla finestra di lunghezza d'onda.
- Premete sul fondo 'Piatto pieno' sul lato superiore destro e scegliere il bene da misurare.
- Premere 'OK' per chiudere la finestra 'Leggi'.
- Scegliere 'iniziare cinetica' nel menu a sinistra.
- Effettuare il tempo di esecuzione 10 min.
- Selezionare l'opzione intervalli minimi.
- Premere 'OK' per chiudere la finestra cinetica.
- Trascinare il 'Leggi' i lineanto la misurazione cinetica.
- Premere il pulsante 'convalidare' e poi il pulsante 'OK'.
- Salvare l'esperimento.
- Premere il tasto 'play'. Apparirà una finestra di dialogo - solo premere il pulsante 'OK' quando deve essere avviato la misurazione.
- Per eseguire l'esperimento triplicato, preparare quattro campioni contenenti ciascuna 3,25 microlitri del 'trasduttore chimica' e 3.25 ml di GST M1-1. Aggiungere ad ogni campione 0, 1.2, 2.4 o 4.9 ml di PDGF e 123.5, 122.3, 121.1, o 118,6 ml di tampone di dosaggio, rispettivamente.
- Incubare la soluzione a temperatura ambiente per 10 min.
- In un piatto ben 384-trasparente, inserire 40 ml di campione a ciascun pozzetto. Inserire i campioni soltanto nei pozzetti dispari o solo nei pozzetti anche nella stessa linea per consentire l'uso di un multi-pipetta per l'aggiunta del substrato.
- Utilizzando un 12-channel multi-pipetta, aggiungere rapidamente 10 ml di ciascuno dei tegli substrati che sono stati pre-preparati nella piastra a 96 pozzetti (sezione 2.1.4). Mescolare delicatamente e rapidamente per evitare le bolle. Inserire la piastra nel lettore e avviare la misurazione cinetica. Poiché la cinetica GST è abbastanza veloce, cercare di minimizzare il tempo tra substrato aggiunta e l'inizio della misurazione cinetica.
- Impostare una procedura sperimentale in per il lettore di piastre per la misurazione cinetica.
- GST attivazione / inibizione Cicli mediato dal 'trasduttore chimica'.
- Per eseguire l'esperimento triplicato, preparare 5 campioni contenenti ciascuno 84,5 ml di tampone, 3,25 ml di 'trasduttore chimico', e 3,25 ml di GST M1-1. Incubare a temperatura ambiente per 3 min.
- Aggiungere 3,65 ml di tampone per il campione 1 e 3,65 ml di PDGF ai campioni 2-5. Incubare a temperatura ambiente per 3 min.
- Aggiungere 3.12 ml di tampone per campioni 1-2 e 3.12 ml di PDGF aptameri ai campioni 3-5. Incubare a temperatura ambiente per 3 min.
- Aggiungere 24,4 ml di tampone per campioni1-3 e 24,4 ml di PDGF ai campioni 4-5. Incubare a temperatura ambiente per 3 min.
- Aggiungere 7,8 microlitri di tampone del saggio di campioni 1-4 e 7,8 ml di PDGF aptameri a campione 5. Incubare a temperatura ambiente per 5 min.
- In un piatto ben 384-trasparente, inserire 40 ml di campione in ciascun pozzetto. campioni Inserire solo nel dispari o solo nelle addirittura pozzi nella stessa linea.
- Utilizzando un 12-channel multi-pipetta, aggiungere rapidamente 10 microlitri di ciascun substrato (pre-preparata nella piastra a 96 pozzetti). Mescolare delicatamente e rapidamente per evitare le bolle. Inserire la piastra nel lettore e avviare la misurazione cinetica.
- Calcolare il V 0 [Mod / min] in ciascuna condizione sottraendo il OD misurata a 340 nm at = 0.5 min dalla OD misurata a 340 nm at = 1.5 min per valutare l'attivazione / inibizione della riciclabilità. 25
- Valutare la risposta in tempo reale del 'trasduttore chimica' per cambiamenti nell'ambiente.
- effetto in tempo reale di PDGF aggiunta
- Impostare una procedura sperimentale nel lettore di piastre per la misurazione cinetica.
- Ripetere i passaggi 2.2.1.1-2.2.1.10.
- Effettuare il tempo di funzionamento 3.5 min.
- Selezionare l'opzione intervalli minimi.
- Premere 'OK' per chiudere la finestra cinetica.
- Trascinare la linea di 'Leggere' nella misurazione cinetica.
- Scegli Piastra Out / In nel menu a sinistra.
- Scegliere l'opzione 'piatto fuori (senza finestra)'.
- Scegliere l'opzione 'Gara' nel menu a sinistra ed entrate 30 sec.
- Scegli Piastra Out / In nel menu a sinistra.
- Scegliere il 'piatto in (senza finestra)' opzione.
- Creare una seconda misura cinetica ripetendo i passi 2.2.1.4 - 2.2.1.14 ma nella sezione 2.2.1.11 impostare la cinetica di essere 25 min invece di 10 min.
- Premere il pulsante 'convalidare' e poi il pulsante 'OK'.
- Salvare l'esperimento.
- Premere il tasto 'PLApulsante Y '. Apparirà una finestra di dialogo - solo premere il pulsante 'OK' quando deve essere avviato la misurazione.
- Preparare due campioni mescolando 1 ml di GST M1-1 e 1 ml di 'trasduttore chimica' in 38 ml di tampone. Inserire i campioni in due pozzetti di una piastra ben 384-trasparente, lasciando un pozzo vuoto tra questi due pozzetti.
- Utilizzando un 12 canali multi-pipetta, aggiungere rapidamente 10 ml di ogni substrato, mescolare delicatamente e rapidamente per evitare le bolle, inserire la piastra nel lettore e avviare la misurazione cinetica.
- Quando la piastra si apre (dopo 3,5 min), aggiungere rapidamente 1.125 ml di PDGF ad uno dei pozzi, mescolare delicatamente, e lasciare che la piastra di chiusura per le misurazioni cinetiche rimanenti.
- effetto reale tempo di aggiunta del aptamer PDGF
- Ripetere i passaggi 2.4.1.1-2.4.1.15.
- Preparare due campioni mescolando 1 ml di GST M1-1, 1 ml di 'trasduttore chimica ', e 1.125 ml di PDGF a 36,9 ml di tampone. Inserire i campioni in due pozzetti di una piastra ben 384-trasparente, lasciando un pozzo vuoto tra questi due pozzetti.
- Utilizzando un 12 canali multi-pipetta, aggiungere rapidamente 10 ml di ogni substrato, mescolare delicatamente e rapidamente per evitare le bolle, inserire la piastra nel lettore, e avviare la misurazione cinetica.
- Quando la piastra si apre (dopo 1,5 min), aggiungere rapidamente 1,2 ml di PDGF aptameri ad uno dei pozzi, mescolare delicatamente e lasciare che la piastra di chiusura per le misurazioni cinetiche rimanenti.
- effetto in tempo reale di PDGF aggiunta
- Misurare JS-K Prodrug attivazione da GST in presenza della 'trasduttore chimica' e PDGF.
- Impostare una procedura sperimentale nel lettore di piastre per la misurazione cinetica.
- Creare un nuovo esperimento come un 'protocollo standard'.
- Premere 'procedura' per aprire la finestra delle impostazioni della procedura.
- Nella lista pop-up sulla parte superiore della finestra di scegliere il tipo '384 piastra' secondo il produttore piatto.
- Premere 'Leggi' nel menu a sinistra.
- Per quanto riguarda il metodo di rilevazione scelto 'assorbanza'.
- Per quanto riguarda il tipo di lettura scegliere 'Punto finale'.
- Valuta 305 nm sulla finestra di lunghezza d'onda.
- Premere il pulsante 'Piatto pieno' sul lato superiore destro e scegliere il bene da misurare.
- Premere 'OK' per chiudere la finestra 'Leggi'.
- Scegliere 'iniziare cinetica' nel menu a sinistra.
- Effettuare il tempo di esecuzione 10 min.
- Selezionare l'opzione intervalli minimi.
- Premere 'OK' per chiudere la finestra cinetica.
- Trascinare la linea di 'Leggere' nella misurazione cinetica.
- Premere il pulsante 'convalidare' e poi il pulsante 'OK'.
- Salvare l'esperimento.
- Premere il tasto 'play'. Una finestra di dialogo box apparirà - solo premere il pulsante 'OK' quando deve essere avviato la misurazione.
- Per la produzione di NO misurazioni utilizzare un kit calorimetrica nitriti / nitrati. In una piastra da 96 pozzetti inserire 50 ml di tampone in una riga, 70 ml di Griess I reattivo nella seconda fila, e 70 ml di Griess II reattivo nella terza fila.
- Per eseguire l'esperimento triplicato, preparare quattro campioni contenenti ciascuna 4,8 microlitri del 'trasduttore chimica'. Per campionare 1, aggiungere 155,2 ml di tampone; per assaggiare 2, aggiungere 3,2 ml di GST-M1-1 e 152 ml di tampone; per assaggiare 3, aggiungere 9,6 ml di PDGF e 145,6 ml di tampone; e per assaggiare 4, aggiungere 3,2 ml di GST-M1-1, 9,6 ml di PDGF, e 142,4 ml di tampone.
- Incubare la soluzione a temperatura ambiente per 10 min.
- In una piastra ben 384-trasparente, inserire 50 ml di campione in ciascun pozzetto. campioni Inserire solo nel dispari o solo nelanche pozzetti di una stessa linea per consentire l'uso di un multi-pipetta per l'aggiunta del substrato.
- Aggiungere 0,54 ml di JS-K (5 mm in DMSO) in ciascun pozzetto.
- Utilizzando un 12 canali multi-pipetta, aggiungere rapidamente 10 ml di soluzione di GSH (pre-preparati nella piastra a 96 pozzetti), mescolare delicatamente e rapidamente per evitare le bolle. Inserire la piastra nel lettore e avviare la misurazione cinetica.
- Immediatamente dopo la misurazione cinetica, con un 12 canali multi-pipetta, prendere 50 ml di ogni campione nella fila tampone nella piastra a 96 pozzetti pre-preparati e aggiungere rapidamente ad esso 50 ml di Griess I reagenti e 50 ml di Griess II reagente. Incubare proteggendo dalla luce per 10 minuti a RT e misurare l'assorbanza a 550 nm.
Nota: Il tampone e volumi reagenti dipendono protocollo dei kit.
- Impostare una procedura sperimentale nel lettore di piastre per la misurazione cinetica.
Access restricted. Please log in or start a trial to view this content.
Risultati
La progettazione, la sintesi, e il meccanismo di azione di un 'trasduttore chimica' che può indurre comunicazione artificiale tra PDGF e GST sono rappresentati in Figura 2. La struttura del 'trasduttore' integra un aptamero PDGF DNA ed un ammide bis-ethacrynic (BEA ), che è, rispettivamente, un inibitore noto GST (Figura 2a). 19 Questi leganti consentono 'trasduttore' di impegnare sia PDGF e GST con differenti affinit...
Access restricted. Please log in or start a trial to view this content.
Discussione
We presented a method for designing and testing of a 'chemical transducer' that can induce artificial communication between two naturally unrelated proteins, GST and PDGF, without modifying the native proteins. The unnatural GST-PDGF communications could be detected in real time by using enzymatic assays that follow the changes in the activity of GST in the presence of the 'chemical transducer' and increasing the concentrations of PDGF. In addition to detecting the activation of GST by PDGF, these assays were used to fol...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
Questa ricerca è stata sostenuta dalla Fondazione Minerva, l'Organizzazione HFSP, e un Consiglio di Grant europeo della ricerca (Starting Grant 338.265).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 1-chloro-2,4-dinitrobenzene | Sigma-Aldrich | 237329 | |
| Acetic acid | Bio Lab | 01070521 | |
| Acetnitrile | J.T.Baker | 9017-03 | |
| Ascorbic acid | Sigma-Aldrich | A4544 | |
| Copper(II) Sulfate pentahydrate | Merck-Millipore | 102790 | |
| Dimethyl sulfoxide | Merck-Millipore | 802912 | |
| Dulbecco's Phosphate Buffered Saline | Biological Industries | 02-023-5A | |
| Ethacrynic acid | Tokyo Chemical Industry Co. Ltd | E0526 | |
| Glutathione-s-transferase M1-1 | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| JS-K | Sigma-Aldrich | J4137 | |
| L-glutathione reduced | Sigma-Aldrich | G4251 | |
| Magnesium Chloride | J.T.Baker | 0162 | |
| nitrate/nitrite colorimetric assay kit | Cayman Chemical | 780001 | |
| Oligonucleotides | W. M. Keck Foundation Biotechnology at Yale University | custom order | |
| PDGF-BB | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| TBTA | Sigma-Aldrich | 678937 | |
| Triethylamine | Sigma-Aldrich | T0886 | |
| Desalting column | GE Healthcare | illustra MicroSpin G-25 Columns | |
| HPLC | Waters | 2695 separation module | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 4.6 mm × 50 mm) | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 10 mm × 50 mm) | |
| Plate reader | BioTek | synergy H4 hybrid |
Riferimenti
- Hunter, T. Signaling—2000 and Beyond. Cell. 100, 113-127 (2000).
- Levitzki, A., Klein, S. Signal transduction therapy of cancer. Mol Aspects Med. 31, 287-329 (2010).
- Peri-Naor, R., Motiei, L., Margulies, D. Artificial signal transduction therapy: a futuristic approach to disease treatment. Future Med. Chem. 7, 2091-2093 (2015).
- Peri-Naor, R., Ilani, T., Motiei, L., Margulies, D. Protein-Protein Communication and Enzyme Activation Mediated by a Synthetic Chemical Transducer. J. Am. Chem. Soc. 137, 9507-9510 (2015).
- Corson, T. W., Aberle, N., Crews, C. M. Design and Applications of Bifunctional Small Molecules: Why Two Heads Are Better Than One. ACS Chem. Biol. 3, 677-692 (2008).
- Rutkowska, A., Schultz, C. Protein Tango: The Toolbox to Capture Interacting Partners. Angew. Chem. Int. Ed. 51, 8166-8176 (2012).
- Meyer, C., Köhn, M. A Molecular Tête-à-Tête Arranged by a Designed Adaptor Protein. Angew. Chem. Int. Ed. 51, 8160-8162 (2012).
- Klemm, J. D., Schreiber, S. L., Crabtree, G. R. Dimerization as a Regulatory Mechanism in Signal Transduction. Annu. Rev. Immunol. 16, 569-592 (1998).
- DeRose, R., Miyamoto, T., Inoue, T. Manipulating signaling at will: chemically-inducible dimerization (CID) techniques resolve problems in cell biology. Pflugers Arch. 465, 409-417 (2013).
- Gestwicki, J. E., Marinec, P. S. Chemical control over protein-protein interactions: beyond inhibitors. Comb. Chem. High Throughput. Screen. 10, 667-675 (2007).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. 25, 848-862 (2013).
- Diezmann, F., Seitz, O. DNA-guided display of proteins and protein ligands for the interrogation of biology. Chem. Soc. Rev. 40, 5789-5801 (2011).
- Röglin, L., Ahmadian, M. R., Seitz, O. DNA-Controlled Reversible Switching of Peptide Conformation and Bioactivity. Angew. Chem. Int. Ed. 46, 2704-2707 (2007).
- Röglin, L., Altenbrunn, F., Seitz, O. DNA and RNA-Controlled Switching of Protein Kinase Activity. ChemBioChem. 10, 758-765 (2009).
- Harris, D. C., Chu, X., Jayawickramarajah, J. DNA-Small Molecule Chimera with Responsive Protein-Binding Ability. J. Am. Chem. Soc. 130, 14950-14951 (2008).
- Harris, D. C., Saks, B. R., Jayawickramarajah, J. Protein-Binding Molecular Switches via Host-Guest Stabilized DNA Hairpins. J. Am. Chem. Soc. 133, 7676-7679 (2011).
- Kim, Y., Cao, Z., Tan, W. Molecular assembly for high-performance bivalent nucleic acid inhibitor. Proc. Nat. Acad. Sci. U.S.A. 105, 5664-5669 (2008).
- Han, D., et al. A Logical Molecular Circuit for Programmable and Autonomous Regulation of Protein Activity Using DNA Aptamer-Protein Interactions. J. Am. Chem. Soc. 134, 20797-20804 (2012).
- Motiei, L., Pode, Z., Koganitsky, A., Margulies, D. Targeted Protein Surface Sensors as a Tool for Analyzing Small Populations of Proteins in Biological Mixtures. Angew. Chem. Int. Ed. 53, 9289-9293 (2014).
- Ranallo, S., Rossetti, M., Plaxco, K. W., Vallée-Bélisle, A., Ricci, F. A Modular, DNA-Based Beacon for Single-Step Fluorescence Detection of Antibodies and Other Proteins. Angew. Chem. Int. Ed. 54, 13214-13218 (2015).
- Franzini, R. M., et al. Identification of Structure-Activity Relationships from Screening a Structurally Compact DNA-Encoded Chemical Library. Angew. Chem. Int. Ed. 54, 3927-3931 (2015).
- Unger-Angel, L., et al. Protein recognition by bivalent, 'turn-on' fluorescent molecular probes. Chem. Sci. 6, 5419-5425 (2015).
- Nissinkorn, Y., et al. Sensing Protein Surfaces with Targeted Fluorescent Receptors. Chem. Eur. J. 21, 15981-15987 (2015).
- Huber, C. G., Oefner, P. J., Bonn, G. K. High-Resolution Liquid Chromatography of Oligonucleotides on Nonporous Alkylated Styrene-Divinylbenzene Copolymers. Anal. Biochem. 212, 351-358 (1993).
- Lyon, R. P., Hill, J. J., Atkins, W. M. Novel class of bivalent glutathione S-transferase inhibitors. Biochemistry. 42, 10418-10428 (2003).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. , 1-16 (2013).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon