Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Imitando la función de las proteínas de señalización: hacia artificial de la señal de transducción Terapia
En este artículo
Resumen
We present guidelines for developing synthetic 'chemical transducers' that can induce communication between naturally unrelated proteins. In addition, detailed protocols are presented for synthesizing and testing a specific 'transducer' that enables a growth factor to activate a detoxifying enzyme and consequently, to regulate the cleavage of an anticancer prodrug.
Resumen
Signal transduction pathways, which control the response of cells to various environmental signals, are mediated by the function of signaling proteins that interact with each other and activate one other with high specificity. Synthetic agents that mimic the function of these proteins might therefore be used to generate unnatural signal transduction steps and consequently, alter the cell's function. We present guidelines for designing 'chemical transducers' that can induce artificial communication between native proteins. In addition, we present detailed protocols for synthesizing and testing a specific 'transducer', which can induce communication between two unrelated proteins: platelet-derived growth-factor (PDGF) and glutathione-S-transferase (GST). The way by which this unnatural PDGF-GST communication could be used to control the cleavage of an anticancer prodrug is also presented, indicating the potential for using such systems in 'artificial signal transduction therapy'. This work is intended to facilitate developing additional 'transducers' of this class, which may be used to mediate intracellular protein-protein communication and consequently, to induce artificial cell signaling pathways.
Introducción
Las vías de transducción de señal desempeñan un papel importante en prácticamente todos los procesos celular y permiten a la célula responder rápidamente a las señales ambientales. 1 Estas vías son a menudo desencadenan por la unión de una molécula de señalización a un receptor extracelular, lo que resulta en la activación de enzimas intracelulares. La amplificación y la propagación de esta señal dentro de la célula está mediada por la función de las proteínas que forman una red de interacciones proteína-proteína en el que las enzimas se activan de forma reversible con una alta especificidad de señalización. Debido a la desregulación de estas redes con frecuencia conduce al desarrollo del cáncer, no ha habido mucho interés en el establecimiento de "terapia de transducción de señales de cáncer ', 2 por el que los medicamentos están diseñados para interrumpir las rutas de señalización malignas. Recientemente hemos propuesto un enfoque alternativo a la señal de transducción de la terapia que se basa en la capacidad de los fármacos para generar vías de transducción de señales no naturales. 3 En particular, creemos que mediante el diseño de agentes sintéticos que imitan la función de las proteínas de señalización, sería posible para modular la función de la célula indirectamente. Por ejemplo, estas redes artificiales pueden permitir biomarcadores de proteínas para activar las enzimas que escinden profármacos. Alternativamente, estos miméticos de proteína de señalización podrían ser capaces de activar las vías de señalización celular no naturales, dando como resultado efectos terapéuticos.
Para demostrar la viabilidad de este enfoque, hemos creado recientemente un "transductor química 'sintética 4 que permite el factor de crecimiento derivado de plaquetas (PDGF) para activar la escisión de un profármaco anticáncer mediante la activación de la glutatión-s-transferasa (GST), que es no su pareja de unión natural. La estructura de este "transductor" consiste en un anti-PDGF aptámero de ADN que se ha modificado con un inhibidor bivalente para GST. Por lo tanto, este agente sintético pertenece a una familia de moléculas con sitios de unión adiferentes proteínas, 5-7, tales como inductores químicos de dimerización (CID) 8-10 y también para el grupo de proteínas aglutinantes sobre la base de los conjugados de molécula de oligonucleótido sintético. 11-21
Los principios generales que subyacen en el diseño de tales sistemas se describe en este documento y se proporcionan protocolos detallados para sintetizar y probar la función de este "transductor" con ensayos enzimáticos convencionales. Este trabajo tiene por objeto facilitar el desarrollo de transductores '' adicionales de esta clase, que se puede utilizar para mediar en la comunicación proteína-proteína intracelular y, por consiguiente, para inducir la vías de señalización celular artificiales.
La Figura 1 describe esquemáticamente los principios de funcionamiento de los transductores '' químicos sintéticos que pueden mediar comunicaciones proteína-proteína no naturales. En esta ilustración, un "transductor química ', que integra aglutinantes sintéticos para proteins I y II (aglutinantes I y II), permite a la proteína II para desencadenar la actividad catalítica de la proteína I, que no es su pareja de unión natural. En la ausencia de la proteína II, el transductor se une al sitio catalítico de la enzima (proteína I) e inhibe su actividad (Figura 1, el estado ii). La unión de la "transductor" a la proteína II, sin embargo, promueve interacciones entre aglutinante I y la superficie de la proteína II (Figura 1, el estado iii), lo que reduce su afinidad hacia la proteína I. Como resultado, la concentración eficaz de la " transductor libre 'en la solución se reduce, lo que conduce a la disociación del transductor-proteína complejo I y para la reactivación de la proteína I (Figura 1, el estado iv). Tomados en conjunto, estos pasos destacar tres principios fundamentales que subyacen en el diseño de transductores '' eficientes: (1) un "transductor" debe tener una carpeta específica para cada una de las proteínas diana, (2) la interacción between ligante II y II de la proteína debe ser más fuerte que la interacción entre la proteína ligante I y I, y (3) ligante debo ser capaz de interactuar con la superficie de la proteína II. Este último principio no requiere necesariamente que ligante yo solo tendría una alta afinidad y selectividad para la proteína II. En su lugar, se basa en nuestros estudios recientes que mostraron que traer una molécula sintética en la proximidad de una proteína puede promover interacciones entre esta molécula y la superficie de la proteína. 19,22,23
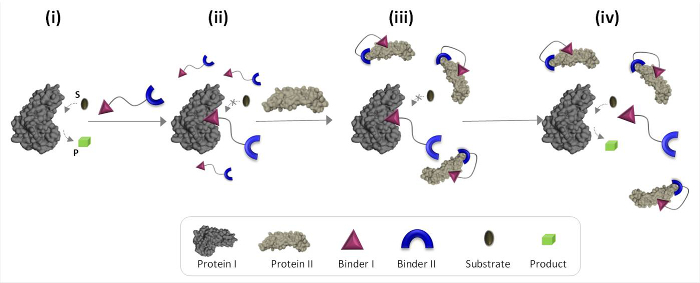
Figura 1:. Operando principios de transductores químicos '' Cuando se añade el 'transductor química' a una proteína activa I (estado i), se une a su sitio activo a través de aglutinante que e inhibe su actividad (estado II). En presencia de la proteína II, sin embargo, el no unido 'química transducer 'interactúa con la proteína II a través de aglutinante II, que promueve las interacciones entre aglutinante I y la superficie de la proteína II. Esta carpeta inducida I-II de la proteína de interacción reduce la concentración efectiva de aglutinante I, que conduce a la disociación de la 'transducer'-proteína complejo I y para la proteína I reactivación (estado IV). Haga clic aquí para ver una versión más grande de esta figura .
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Síntesis de la 'química del transductor'
- Los preparativos preliminares
- Preparar tampón de acetato de 2 M de trietilamonio (TEAA) mediante la mezcla de 278 ml de trietilamina con 114 ml de ácido acético y 400 ml de agua ultrapura. Se ajusta el pH a 7 y se añade agua hasta un volumen final de 1 L. Guárdelo en un frasco oscuro.
Nota: Esta solución es estable durante años. - Preparar una solución de ácido ascórbico 5 mM por disolución de 18 mg de ácido ascórbico en 20 ml de agua ultrapura. Use una solución fresca; la solución es estable durante un día.
- Preparar una solución de Cu 10 mM (II) / Tris (benzyltriazolylmethyl) amina (TBTA) mediante la disolución de 25 mg de cobre (II) pentahidratado sulfato en 10 ml de agua ultrapura y 58 mg de TBTA en 11 ml de sulfóxido de dimetilo (DMSO). Mezclar las dos soluciones. Mantenerlo a temperatura ambiente y protegerlo de la luz.
- Preparar tampón de acetato de 2 M de trietilamonio (TEAA) mediante la mezcla de 278 ml de trietilamina con 114 ml de ácido acético y 400 ml de agua ultrapura. Se ajusta el pH a 7 y se añade agua hasta un volumen final de 1 L. Guárdelo en un frasco oscuro.
- procedimiento de conjugación
- Disolver 100 nmol del oligonucleótido modificado (ODN-1) en 80 lde agua ultra pura fresca. Añadir 20 l de M TEAA 2, pH = 7. Añadir 80 l de una solución recién hecha de ácido ascórbico (5 mM en agua).
- Disolver 1,5 mol (574,5 g) de ácido etacrínico azido-modificado en 180 l de DMSO y añadirlo a la solución. Desgasificar la solución con argón durante 60 segundos y añadir rápidamente 40 l de la solución de TBTA Cu (II) / (10 mM en 55% (v / v) de DMSO / agua).
- Se purga de nuevo con argón, cerrándola, y se agita durante la noche.
- Monitorear el progreso de la reacción y purificar el conjugado por RP-HPLC (fase móvil: A) 5% de acetonitrilo, 5% TEAA, 90% de agua ultrapura; B) 65% de acetonitrilo, 5% TEAA, 30% de agua ultrapura). 24
2. El control de la actividad de GST por PDGF
- Los preparativos preliminares
- Preparar 50 ml de tampón de ensayo mediante la mezcla de 33,9 ml de solución salina tamponada con fosfato (PBSx1) con 16,1 ml de agua ultrapura para lograr una concentración de fosfato final de 8 mM y add 23,8 mg de MgCl2 para lograr un 5 mM de concentración final.
- Preparar una solución madre de GST M1-1 disolviendo la proteína en un tampón que contiene 50 mM Tris pH 7,5, NaCl 50 mM, ditiotreitol 1 mM (DTT), y 5 mM de ácido etilendiaminotetraacético (EDTA) a una concentración final de 30 mM. Divida esta solución en pequeñas alícuotas y se almacena a -80 ° C. Diluir recientemente, de acuerdo con la sección 2.1.5.1, en el tampón de ensayo y mantener en hielo.
Nota: La solución será estable durante aproximadamente 5 h, o hasta que hay una reducción en la actividad enzimática. - Preparar el sustrato de acuerdo con las siguientes instrucciones:
- Disolver 10 mg de glutatión reducido (GSH) en 325 l de agua ultrapura hasta una concentración final de solución madre 100 mM. Diluir 21 l de esta solución madre en 979 l de tampón de ensayo para una concentración final de solución de trabajo de 2,1 mM.
- Disolver 10 mg de 2,4-dinitroclorobenceno (CDNB) en 492 l de correoTHANOL a una concentración final de solución madre 100 mM. Diluir 43,2 l de la solución madre en 956.8 l de un tampón de ensayo para una concentración final de solución de trabajo de 4,32 mM.
- En una placa de 96 pocillos, poner cada sustrato en una línea separada (12 pozos). Inserte al menos 60 l en cada pocillo para permitir la retirada fácil y rápida de la solución. Cubrir la placa con una lámina de aluminio para la protección contra la luz.
- Preparar las siguientes soluciones madre en el tampón de ensayo:
- Diluir GST M1-1 por 50 a una concentración final de 0,6 M de dímero.
- Se diluye la 'transductor química' de una solución madre 30 mM.
- Diluir PDGF a una concentración final de 40 mM.
- Diluir PDGF aptámero a una concentración final de 250 mM.
- Medir la actividad GST en la Presencia del 'transductor química' y PDGF.
- Establecer un procedimiento experimental in el lector de placas para la medición cinética.
- Crear un nuevo experimento como un "protocolo estándar '.
- Pulse en "procedimiento" para abrir la ventana de parámetros del procedimiento.
- En la lista que aparece en el lado superior de la ventana, seleccione el tipo '384 placa' de acuerdo con el fabricante de la placa.
- Pulse 'Leer' en el menú de la izquierda.
- En cuanto al método de detección elija 'Absorbancia'.
- En cuanto al tipo de lectura seleccione 'punto final'.
- Escribe 340 nm en la ventana de longitud de onda.
- Pulse en la parte inferior 'Placa completa' en la parte superior derecha y elegir el bien como para ser medidos.
- Pulse 'OK' para cerrar la 'Leer' ventana.
- Elija 'iniciar cinética' en el menú de la izquierda.
- Hacer que el tiempo de funcionamiento 10 min.
- Seleccionar la opción intervalos mínimos.
- Pulse 'Aceptar' para cerrar la ventana cinética.
- Arrastre el "leídas" línea dento la medición cinética.
- Presione el botón "validar" y luego el botón "OK".
- Guarde el experimento.
- Presione el botón de 'play'. Un cuadro de diálogo aparecerá - pulse el botón "OK" sólo cuando la medición se debe iniciar.
- Con el fin de realizar el experimento por triplicado, preparar cuatro muestras que contienen cada uno 3,25 l de la 'transductor química' y 3,25 l de GST M1-1. Añadir a cada muestra 0, 1,2, 2,4, o 4,9 l de PDGF y 123,5, 122,3, 121,1, 118,6 o l del tampón de ensayo, respectivamente.
- Incubar la solución a temperatura ambiente durante 10 min.
- En una placa de 384-transparente, inserte 40 l de muestra a cada pocillo. Inserte las muestras solamente en los pocillos impares, o sólo en los pocillos, incluso en la misma línea para permitir el uso de un multi-pipeta para la adición de sustrato.
- El uso de un 12 canales multi-pipeta, añadir rápidamente 10 l de cada una de tél sustratos que fueron preparadas de antemano en la placa de 96 pocillos (sección 2.1.4). Mezclar suavemente y rápidamente para evitar burbujas. Inserte la placa en el lector e inicie la medición cinética. Desde la cinética de GST es bastante rápido, tratar de minimizar el tiempo entre la adición del sustrato y el comienzo de la medición cinética.
- Establecer un procedimiento experimental in el lector de placas para la medición cinética.
- La activación de GST Ciclos / inhibición mediada por el 'transductor química'.
- Con el fin de realizar el experimento por triplicado, preparar 5 muestras, conteniendo cada uno 84,5 l de tampón de ensayo, 3,25 l de 'transductor química', y 3,25 l de GST M1-1. Incubar a temperatura ambiente durante 3 min.
- Añadir 3,65 l de tampón de ensayo a la muestra 1 y de 3,65 l de PDGF a las muestras 2-5. Incubar a temperatura ambiente durante 3 min.
- Añadir 3,12 l de tampón de ensayo para las muestras 1-2 y 3,12 l de PDGF aptámero a las muestras 3-5. Incubar a temperatura ambiente durante 3 min.
- Añadir 24,4 l de tampón de ensayo a muestras1-3 y 24,4 l de PDGF a las muestras 4-5. Incubar a temperatura ambiente durante 3 min.
- Añadir 7,8 l de tampón de ensayo hasta las muestras 1-4 y 7,8 l de PDGF aptámero a la muestra 5. Incubar a temperatura ambiente durante 5 min.
- En una placa de 384-transparente, inserte 40 l de muestra en cada pocillo. Las muestras sólo se puede enchufar a la par o solamente en los pocillos, incluso en la misma línea.
- El uso de un 12-canal multi-pipeta, añadir rápidamente 10 l de cada sustrato (pre-preparada en la placa de 96 pocillos). Mezclar suavemente y rápidamente para evitar burbujas. Inserte la placa en el lector e inicie la medición cinética.
- Calcular la V 0 [mod / min] en cada condición restando la DO a 340 nm medido en t = 0,5 min del OD se mide a 340 nm en t = 1,5 min para evaluar la activación / inhibición reciclabilidad. 25
- Evaluar la respuesta en tiempo real de la 'transductor química' a cambios en el medio ambiente.
- efecto en tiempo real de la adición de PDGF
- Establecer un procedimiento experimental en el lector de placas para la medición cinética.
- Repita los pasos 2.2.1.1-2.2.1.10.
- Hacer que el tiempo de ejecución de 3,5 min.
- Seleccionar la opción intervalos mínimos.
- Pulse 'Aceptar' para cerrar la ventana cinética.
- Arrastre la línea 'Leer' en la medición cinética.
- Elija Placa de salida / entrada en el menú de la izquierda.
- Elija la opción 'se resiembra (sin diálogo)'.
- Elige la opción "Delay" en el menú de la izquierda y entrar en 30 seg.
- Elija Placa de salida / entrada en el menú de la izquierda.
- Elija el 'plato en (sin diálogo) "opción.
- Crear una segunda medición cinética repitiendo los pasos 2.2.1.4 - 2.2.1.14 pero en la sección 2.2.1.11 establecer la cinética de ser de 25 minutos en lugar de 10 min.
- Presione el botón "validar" y luego el botón "OK".
- Guarde el experimento.
- Pulse el 'play Botón '. Un cuadro de diálogo aparecerá - pulse el botón "OK" sólo cuando la medición se debe iniciar.
- Se preparan dos muestras mediante la mezcla de 1 l de GST M1-1 y 1 l de la 'transductor química' en 38 l de tampón de ensayo. Insertar las muestras en dos pocillos de una placa de 384-transparente, dejando un pozo vacío entre estos dos pozos.
- El uso de un 12 canales multi-pipeta, añadir rápidamente 10 l de cada sustrato, mezclar suavemente y rápidamente para evitar burbujas, insertar la placa en el lector e iniciar la medición cinética.
- Cuando la placa se abre (después de 3,5 minutos), añadir rápidamente 1.125 l de PDGF a uno de los pozos, mezclar suavemente y dejar que la placa de cierre para las mediciones cinéticas restantes.
- efecto en tiempo real de la adición de aptámero de PDGF
- Repita los pasos 2.4.1.1-2.4.1.15.
- Se preparan dos muestras mediante la mezcla de 1 l de GST M1-1, 1 l de la 'transductor química ', y 1.125 l de PDGF en 36,9 l de tampón de ensayo. Insertar las muestras en dos pocillos de una placa de 384-transparente, dejando un pozo vacío entre estos dos pozos.
- El uso de un 12 canales multi-pipeta, añadir rápidamente 10 l de cada sustrato, mezclar suavemente y rápidamente para evitar burbujas, insertar la placa en el lector, e inicie la medición cinética.
- Cuando la placa se abre (después de 1,5 min), añadir rápidamente 1,2 l de PDGF aptámero a uno de los pozos, mezclar suavemente y dejar que la placa para cerrar para las mediciones cinéticas restantes.
- efecto en tiempo real de la adición de PDGF
- Medir JS-K profármaco de activación por GST en la Presencia del 'transductor química' y PDGF.
- Establecer un procedimiento experimental en el lector de placas para la medición cinética.
- Crear un nuevo experimento como un "protocolo estándar '.
- Pulse en "procedimiento" para abrir la ventana de parámetros del procedimiento.
- En la lista que aparece en el lado superior de la ventana, seleccione el tipo '384 placa' de acuerdo con el fabricante de la placa.
- Pulse 'Leer' en el menú de la izquierda.
- En cuanto al método de detección eligió 'Absorbancia'.
- En cuanto al tipo de lectura seleccione 'punto final'.
- Escribe 305 nm en la ventana de longitud de onda.
- Pulse en el botón 'Placa completa' en la parte superior derecha y elegir el bien como para ser medidos.
- Pulse 'OK' para cerrar la 'Leer' ventana.
- Elija 'iniciar cinética' en el menú de la izquierda.
- Hacer que el tiempo de funcionamiento 10 min.
- Seleccionar la opción intervalos mínimos.
- Pulse 'Aceptar' para cerrar la ventana cinética.
- Arrastre la línea 'Leer' en la medición cinética.
- Presione el botón "validar" y luego el botón "OK".
- Guarde el experimento.
- Presione el botón de 'play'. Un bo de diálogox aparecerá - pulse el botón "OK" sólo cuando la medición se debe iniciar.
- Para la producción de NO mediciones utilizan un kit colorimétrico nitrito / nitrato. En una placa de 96 pocillos insertar 50 l de tampón de ensayo en una fila, 70 l de Griess I reactivo en una segunda fila, y 70 l de reactivo de Griess II en una tercera fila.
- Con el fin de realizar el experimento por triplicado, preparar cuatro muestras que contienen cada uno 4,8 l de la 'transductor química'. Para muestra 1, añadir 155,2 l de tampón de ensayo; a la muestra 2, añadir 3,2 l de GST-M1-1 y 152 l de tampón de ensayo; a la muestra 3, añadir 9,6 l de PDGF y 145,6 l de tampón de ensayo; y para la muestra 4, añadir 3,2 l de GST-M1-1, 9,6 l de PDGF, y 142,4 l de tampón de ensayo.
- Incubar la solución a temperatura ambiente durante 10 min.
- En una placa de 384-transparente, inserte 50 l de muestra en cada pocillo. Las muestras sólo se puede enchufar en el par o sólo en elincluso pozos en la misma línea para permitir el uso de una multi-pipeta para la adición de sustrato.
- Añadir 0,54 l de JS-K (5 mM en DMSO) a cada pocillo.
- El uso de un 12-canal multi-pipeta, añadir rápidamente 10 l de la solución de GSH (pre-preparada en la placa de 96 pocillos), se mezcla suavemente y rápidamente para evitar burbujas. Inserte la placa en el lector e inicie la medición cinética.
- Inmediatamente después de la medición cinética, el uso de un 12-canal multi-pipeta, tomar 50 l de cada muestra en la fila de tampón de ensayo en la placa de 96 pocillos pre-preparado y añadir rápidamente a la misma 50 l de reactivo de Griess I y 50 l de reactivo de Griess II. Incubar la vez que protege de la luz durante 10 minutos a temperatura ambiente y se mide la absorbancia a 550 nm.
Nota: El tampón de ensayo y volúmenes de reactivos dependen de protocolo de los kits.
- Establecer un procedimiento experimental en el lector de placas para la medición cinética.
Access restricted. Please log in or start a trial to view this content.
Resultados
El diseño, la síntesis y mecanismo de acción de un "transductor química 'que puede inducir la comunicación artificial entre PDGF y GST se presentan en la Figura 2. La estructura del" transductor "integra un aptámero de ADN PDGF y una amida-bis etacrínico (BEA ), que es un conocido inhibidor de GST (figura 2a). 19 Estos aglutinantes permiten la "transductor" para unirse tanto a PDGF y GST con diferentes afini...
Access restricted. Please log in or start a trial to view this content.
Discusión
We presented a method for designing and testing of a 'chemical transducer' that can induce artificial communication between two naturally unrelated proteins, GST and PDGF, without modifying the native proteins. The unnatural GST-PDGF communications could be detected in real time by using enzymatic assays that follow the changes in the activity of GST in the presence of the 'chemical transducer' and increasing the concentrations of PDGF. In addition to detecting the activation of GST by PDGF, these assays were used to fol...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Esta investigación fue apoyada por la Fundación Minerva, la Organización HFSP, y un Consejo de Investigación Europeo de Grant (Starting Grant 338265).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 1-chloro-2,4-dinitrobenzene | Sigma-Aldrich | 237329 | |
| Acetic acid | Bio Lab | 01070521 | |
| Acetnitrile | J.T.Baker | 9017-03 | |
| Ascorbic acid | Sigma-Aldrich | A4544 | |
| Copper(II) Sulfate pentahydrate | Merck-Millipore | 102790 | |
| Dimethyl sulfoxide | Merck-Millipore | 802912 | |
| Dulbecco's Phosphate Buffered Saline | Biological Industries | 02-023-5A | |
| Ethacrynic acid | Tokyo Chemical Industry Co. Ltd | E0526 | |
| Glutathione-s-transferase M1-1 | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| JS-K | Sigma-Aldrich | J4137 | |
| L-glutathione reduced | Sigma-Aldrich | G4251 | |
| Magnesium Chloride | J.T.Baker | 0162 | |
| nitrate/nitrite colorimetric assay kit | Cayman Chemical | 780001 | |
| Oligonucleotides | W. M. Keck Foundation Biotechnology at Yale University | custom order | |
| PDGF-BB | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| TBTA | Sigma-Aldrich | 678937 | |
| Triethylamine | Sigma-Aldrich | T0886 | |
| Desalting column | GE Healthcare | illustra MicroSpin G-25 Columns | |
| HPLC | Waters | 2695 separation module | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 4.6 mm × 50 mm) | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 10 mm × 50 mm) | |
| Plate reader | BioTek | synergy H4 hybrid |
Referencias
- Hunter, T. Signaling—2000 and Beyond. Cell. 100, 113-127 (2000).
- Levitzki, A., Klein, S. Signal transduction therapy of cancer. Mol Aspects Med. 31, 287-329 (2010).
- Peri-Naor, R., Motiei, L., Margulies, D. Artificial signal transduction therapy: a futuristic approach to disease treatment. Future Med. Chem. 7, 2091-2093 (2015).
- Peri-Naor, R., Ilani, T., Motiei, L., Margulies, D. Protein-Protein Communication and Enzyme Activation Mediated by a Synthetic Chemical Transducer. J. Am. Chem. Soc. 137, 9507-9510 (2015).
- Corson, T. W., Aberle, N., Crews, C. M. Design and Applications of Bifunctional Small Molecules: Why Two Heads Are Better Than One. ACS Chem. Biol. 3, 677-692 (2008).
- Rutkowska, A., Schultz, C. Protein Tango: The Toolbox to Capture Interacting Partners. Angew. Chem. Int. Ed. 51, 8166-8176 (2012).
- Meyer, C., Köhn, M. A Molecular Tête-à-Tête Arranged by a Designed Adaptor Protein. Angew. Chem. Int. Ed. 51, 8160-8162 (2012).
- Klemm, J. D., Schreiber, S. L., Crabtree, G. R. Dimerization as a Regulatory Mechanism in Signal Transduction. Annu. Rev. Immunol. 16, 569-592 (1998).
- DeRose, R., Miyamoto, T., Inoue, T. Manipulating signaling at will: chemically-inducible dimerization (CID) techniques resolve problems in cell biology. Pflugers Arch. 465, 409-417 (2013).
- Gestwicki, J. E., Marinec, P. S. Chemical control over protein-protein interactions: beyond inhibitors. Comb. Chem. High Throughput. Screen. 10, 667-675 (2007).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. 25, 848-862 (2013).
- Diezmann, F., Seitz, O. DNA-guided display of proteins and protein ligands for the interrogation of biology. Chem. Soc. Rev. 40, 5789-5801 (2011).
- Röglin, L., Ahmadian, M. R., Seitz, O. DNA-Controlled Reversible Switching of Peptide Conformation and Bioactivity. Angew. Chem. Int. Ed. 46, 2704-2707 (2007).
- Röglin, L., Altenbrunn, F., Seitz, O. DNA and RNA-Controlled Switching of Protein Kinase Activity. ChemBioChem. 10, 758-765 (2009).
- Harris, D. C., Chu, X., Jayawickramarajah, J. DNA-Small Molecule Chimera with Responsive Protein-Binding Ability. J. Am. Chem. Soc. 130, 14950-14951 (2008).
- Harris, D. C., Saks, B. R., Jayawickramarajah, J. Protein-Binding Molecular Switches via Host-Guest Stabilized DNA Hairpins. J. Am. Chem. Soc. 133, 7676-7679 (2011).
- Kim, Y., Cao, Z., Tan, W. Molecular assembly for high-performance bivalent nucleic acid inhibitor. Proc. Nat. Acad. Sci. U.S.A. 105, 5664-5669 (2008).
- Han, D., et al. A Logical Molecular Circuit for Programmable and Autonomous Regulation of Protein Activity Using DNA Aptamer-Protein Interactions. J. Am. Chem. Soc. 134, 20797-20804 (2012).
- Motiei, L., Pode, Z., Koganitsky, A., Margulies, D. Targeted Protein Surface Sensors as a Tool for Analyzing Small Populations of Proteins in Biological Mixtures. Angew. Chem. Int. Ed. 53, 9289-9293 (2014).
- Ranallo, S., Rossetti, M., Plaxco, K. W., Vallée-Bélisle, A., Ricci, F. A Modular, DNA-Based Beacon for Single-Step Fluorescence Detection of Antibodies and Other Proteins. Angew. Chem. Int. Ed. 54, 13214-13218 (2015).
- Franzini, R. M., et al. Identification of Structure-Activity Relationships from Screening a Structurally Compact DNA-Encoded Chemical Library. Angew. Chem. Int. Ed. 54, 3927-3931 (2015).
- Unger-Angel, L., et al. Protein recognition by bivalent, 'turn-on' fluorescent molecular probes. Chem. Sci. 6, 5419-5425 (2015).
- Nissinkorn, Y., et al. Sensing Protein Surfaces with Targeted Fluorescent Receptors. Chem. Eur. J. 21, 15981-15987 (2015).
- Huber, C. G., Oefner, P. J., Bonn, G. K. High-Resolution Liquid Chromatography of Oligonucleotides on Nonporous Alkylated Styrene-Divinylbenzene Copolymers. Anal. Biochem. 212, 351-358 (1993).
- Lyon, R. P., Hill, J. J., Atkins, W. M. Novel class of bivalent glutathione S-transferase inhibitors. Biochemistry. 42, 10418-10428 (2003).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. , 1-16 (2013).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados