A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الشعرية الكهربائي فصل حيدة النسيلة الأجسام المضادة الإسوية باستخدام الشعرية محايد
In This Article
Summary
Here, we present a comprehensive capillary zone electrophoresis protocol for the assessment of intrinsic physicochemical heterogeneity of monoclonal antibodies as a quality attribute.
Abstract
Biotherapeutic proteins, such as monoclonal antibodies (mAbs), are feasible alternatives for the treatment of chronic-degenerative diseases. The biological activity of these proteins depends on their physicochemical properties. The use of high-performance techniques like chromatography and capillary electrophoresis has been described for the analysis of physicochemical heterogeneity of mAbs. Nowadays, capillary zone electrophoresis (CZE) technique constitutes one of the most resolutive and sensitive assays for the analysis of biomolecules. Besides, the electro-driven separation in CZE is governed by extensive properties of matter and offers the advantage of analyzing proteins close to their native state. However, the successful implementation of this technique for routine analysis depends on the skills of the analyst at the critical steps during sample and system preparation. The purpose of this tutorial is to detail the steps to succeed in the CZE analysis of mAbs. Further, this protocol can be used for the development and improvement of skills of the personnel involved in protein analytical chemistry laboratories.
Introduction
الاجسام المضادة (MABS) هي بروتينات biotherapeutic مع تزايد الاهتمام نظرا لقدرتها على التحرك ضد العديد من الأمراض المزمنة والتنكسية 1. مثل الجزيئات الحيوية الأخرى، MABS عرضة للخضوع العديد من التعديلات الفيزيائية في جميع مراحل دورة حياتها (أي، من الحيوي إلى المنتج النهائي). وتشمل هذه التعديلات، ولكن لا تقتصر على: نزع الأميد، بالغليكوزيل، والأكسدة، cyclization، المماكبة، وتجميع والانقسام بروتين 2. وبالتالي، هناك حاجة إلى تقنيات تحليلية قادرة على حل الإسوية الجوهرية لمراقبة MABS عدم التجانس والاستقرار من أجل وضع مواصفات الجودة.
الشعرية الكهربائي (م) هو تقنية فصل عالية الأداء التي تقوم outinside من أنبوب تنصهر السيليكا الضيق (مجموعة ميكرون) مليئة بالكهرباء الخلفية (BGE). بناء على طلب من مجال كهربائي (تصل إلى 30،000 V)، جزيء مشحونةالصورة الهجرة نحو القطب مع المسؤول المعاكس (أي مدفوعة الكهربائية الفصل). استخدام الفولتية العالية في CE يسمح التحاليل السريعة وزيادة الكفاءة، والتي تعلو على الكهربائي للهلام الكلاسيكية. الكهربائي منطقة الشعرية (تشيكيا) هو أسلوب قائم على CE تستخدم بشكل روتيني في صناعة الأدوية الحيوية لتقييم جودة المنتج 3-9. وخلافا لغيرها من وسائط CE (على سبيل المثال، هلام الشعرية الكهربائي، الشعرية ISOELECTRIC التركيز) أو أساليب تعتمد على اللوني، ويمكن إجراء تشيكيا دون استخدام denaturants أو واجهات الحالة الصلبة، والسماح للتحليل التباين المتأصل في MABS قريبة من الدولة الأصلية الخاصة بهم 10 . الفصل تشيكيا من الأشكال الإسوية ماب يحدث داخل الشعرية تنصهر السيليكا مغطاة ماء البوليمر (الشعرية محايد) ويقوم على التنقل الكهربي مختلفة، والتي يحكمها تهمة والكتلة والحجم والشكل (أو حجم الهيدروديناميكية) 11. تم الكشف عن الأنصاف ماب عندمافهي تتحرك وتمر عبر نافذة الكشف، التي لمست من قبل كاشف الأشعة فوق البنفسجية (UV) الامتصاصية في 214 نانومتر (4).
والتنفيذ الناجح لهذه التقنية التحليلية يعتمد على الاهتمام المناسب لتفاصيل قبل وأثناء التجربة. يتصرف خلاف ذلك سيزيد من التكلفة والوقت لإجراء التحليل، مما يؤدي في نهاية المطاف إلى الفشل المستمر والإحباط.
هنا، نقدم دليل خطوة بخطوة لإجراء تحليل الناجح لماب عدم التجانس التي كتبها تشيكيا من خلال شرح مفصل لتحضير محاليل والعينات، وإعداد نظام CE، أساليب أداة إعداد، والحصول على البيانات، و تجهيز. لغرض هذا البرنامج التعليمي، المؤتلف الإنسان بالكامل ألفا المضادة للعامل نخر الورم يستخدم (مكافحة TNFα) ماب كنموذج البروتين. ومع ذلك، هذا البروتوكول يمكن تخصيصها بسهولة لتحليل البروتينات الأخرى التي تفكر في التعديلات وجيزة. اdditionally، يقترح المشاكل المحتملة عدة توصيات للتخفيف. ومما يشجع القارئ على تتبع بدقة البروتوكول المقترح، واحتمال أن تنجح سوف تزيد.
Protocol
1. إعداد حلول
- إعداد الحل BGE.
- إعداد 100 مل من محلول مكون من 0.05٪ (م / ت) السليلوز بروبيل هيدروكسي ميثيل (HPMC)، 200 مم ε الأمينية ن الكابرويك حمض (EACA) و 30 ملي خلات ليثيوم.
ملاحظة: كما HPMC هو بوليمر اللزجة، صب مسحوق في كوب من الزجاج، إضافة 80 مل من الماء، وأخيرا إضافة شريط التحريك. متابعة إضافة الكواشف المتبقية بشكل طبيعي. ارتداء النظارات الواقية عند التعامل مع خلات الليثيوم لأنها يمكن أن تسبب تهيج العين. - ضبط لقيمة الرقم الهيدروجيني 4.8 ± 0.1 مع 50٪ (ت / ت) وحامض الخليك. يسمح الحل لتحقيق الاستقرار لمدة 5 دقائق وضبط حسب الضرورة.
- يضاف الماء إلى أن تصل إلى الحجم النهائي من 100 مل في القارورة الحجمية.
- تصفية من خلال غشاء ماء مع حجم 0.2 ميكرون المسام.
- متجر في 2-8 درجة مئوية لمدة تصل إلى 7 أيام.
- إعداد 100 مل من محلول مكون من 0.05٪ (م / ت) السليلوز بروبيل هيدروكسي ميثيل (HPMC)، 200 مم ε الأمينية ن الكابرويك حمض (EACA) و 30 ملي خلات ليثيوم.
- إعداد معيار الداخلية.
- إعداد 1 ملحل تتكون من 1٪ (م / ت) الهستامين.
- تصفية من خلال غشاء ماء مع حجم 0.2 ميكرون المسام.
- متجر في 2-8 درجة مئوية لمدة تصل إلى 1 يوم.
إعداد 2. عينة
- إعداد 180 ميكرولتر من عينة ماب المخفف مع العازلة تريس (50 ملي تريس (hydroxymethyl) aminomethane، ودرجة الحموضة 8.0) إلى تركيز النهائي من 1 ملغ / مل.
- إضافة 20 ميكرولتر من 1٪ (م / ت) الهستامين.
- خلط وأجهزة الطرد المركزي في 1000 x ج لمدة 5 ثوان.
- ضع قارورة صغيرة داخل قارورة العالمية.
- نقل العينة إلى القارورة الصغيرة وسقف القارورة العالمية. الاستغناء العينة صعودا من أجل تجنب إدخال أي فقاعات.
- متجر في 2-8 درجة مئوية لمدة تصل إلى 1 يوم.
- ضع قارورة العالمي (مع قارورة صغيرة تحتوي على محلول العينة) في علبة عينة مدخل.
3. إعداد نظام CE.
- تنظيف نظام CE.
ملاحظة: عشر السلوكهو الإجراء مرة واحدة في الأسبوع على الأقل لتجنب تسرب التيار الكهربائي المستمدة من تراكم الغبار والحطام. ومع ذلك، اعتمادا على التطبيق (على سبيل المثال، استخدام BGE مع زيادة اللزوجة أو مع تركيز الملح العالية، والعينات مع زيادة اللزوجة) الأقطاب والعتلات فتح قد يحتاج إلى تنظيفها بشكل متكرر أكثر لمنع التلوث وعينة المرحلة.- إيقاف تشغيل مفتاح الطاقة الصك م، وفتح الباب الأمامي.
- تنظيف سطح غطاء عينة عينة، عقد نظام (عينة وعازلة صواني)، غطاء خرطوشة، بار المشبك، كتلة واجهة والأقطاب مع محبوكة مبللة بالماء مسح. كرر الإجراء مع مسح وجاف قبل استخدام مبللة الايثانول.
- شطف العتلات فتح جيدا بالماء. تنظيف سطحها مع محبوكة مسح. كرر الإجراء مع مسح وجافة قبل التثبيت مبللة الايثانول.
- تنظيف طرفي كابل الألياف البصرية دقيقلاي بقطعة قماش ستوكات مبللة بالماء. كرر الإجراء مع قطعة قماش مبللة الايثانول.
- خرطوشة.
- إزالة الشعرية محايد جديد (50 ميكرون القطر الداخلي) من عبوتها.
- الشريط أسفل واحدة من نهاية الأنابيب الشعرية وقائية لطاولة العمل. حل، وتصويب وسحب شعري خارج الأنبوب.
- عصا قطعة من الشريط أو ورقة لطاولة العمل وإضافة علامات القياس على النحو التالي: طول للكشف عن (30 سم)، نافذة الشعرية (0.2 سم) وطول إلى نهاية مخرج (10 سم) (أي 40.2 سم الطول الكلي، 30.0 سم طول فعالة).
- محاذاة النافذة الشعرية إلى علامة قياس 0.2 سم في ورقة مرجعية. إصلاح الشعرية مع الشريط ووضع علامة الشعرية ينتهي 2 مم خارج علامات القياس.
- قطع الغطاء الواقي في نهاية مدخل الشعرية (ابعد حد من نافذة) في حركة واحدة على التوالي باستخدام حافة دافق من الحجر الانفطار.
- تزج نهاية الشعرية في قارورة عالمية توج مملوءة بالماء لتجنب تلف دائم في طلاء الداخلي الشعرية. كرر هذا الإجراء في كل مرة يتعرض نهاية الشعرية إلى المحيط لأكثر من 1 دقيقة.
- إدراج نهاية الشعرية مدخل إلى الجانب منفذ للخرطوشة.
- الشد والجذب الشعرية من خلال خرطوشة حسب الضرورة حتى يتم توسيط نافذة الشعرية إلى إطار خرطوشة.
- تضاف المكونات الفتحة (100 ميكرون × 200 ميكرون) في إطار خرطوشة.
ملاحظة: تأكد من أن الضوء الأبيض يمر من خلال النافذة عندما تتعرض لمصدر الأبيض من ضوء. إذا كان الضوء الذي يمر عبر لديه مظهر اللون البني، وضبط حسب الضرورة. - تضاف الشعرية في أنابيب التبريد شكلت قبل لمجموع طول شعري من 40.2 سم (مع الجوز المثبتة مسبقا الأنابيب، الطويق ويا الدائري عند كلا الطرفين في هذا النظام).
- دفع الشعرية من خلال coolanر أنابيب الضرورة حتى يظهر الشعرية في الجانب الآخر من الأنبوب.
- إدراج نهاية الأنبوب المبرد إلى جانب منفذ للخرطوشة وتشديد الجوز الأنابيب.
- إدراج نهاية الشعرية مدخل إلى الجانب مدخل من الخرطوشة.
- الشد والجذب الشعرية من خلال خرطوشة حسب الضرورة حتى يظهر الشعرية في الجانب مدخل من الخرطوشة.
- إدراج نهاية الأنبوب المبرد إلى جانب مدخل خرطوشة وتشديد الجوز الأنابيب.
- قطع الغطاء الواقي في نهاية الشعرية منفذ (النهاية أقرب من الإطار) في حركة واحدة على التوالي باستخدام حافة دافق من الحجر الانفطار.
- إدراج مقاطع ختم التوكيل على نهايات الشعيرات الدموية والضغط على لتستقر في الموقف. بصريا تفقد الشعرية ينتهي. إذا لم تكن حتى، كرر الإجراء.
- وضع قالب شعري طول على حافة طاولة العمل.
- وضع خرطوشة أسفل AGainst قالب شعري طول ومحاذاة الشعرية ينتهي مع خطوط إشارة على القالب. إذا كانت علامات قياس الشعرية (انظر 3.2.4) لا تتماشى مع خطوط إشارة، وضبط حسب الضرورة.
- عقد الشعرية ضد قالب شعري طول وقطع طرفي الشعرية باستخدام حافة دافق من الشق حجر 2 ملم تحت خطوط إشارة على القالب.
- بصريا تفقد الشعرية ينتهي مع عدسة مكبرة. إذا نهايات الشعيرات الدموية غير متجانسة، تلميع لهم باستخدام وجه ناعم من الحجر الانفطار.
- إدراج فتحة يا الدائري في حفرة فتحة المكونات باستخدام أداة الإدراج يا الدائري.
- تثبيت قارورة عالمية توج مملوءة بالماء في حالة خرطوشة وخرطوشة المكان إلى حالة مباشرة مع نهايات الشعيرات الدموية إدراجها في قارورة. لتخزين قصيرة وطويلة المدى حفاظ على 2-8 درجة مئوية.
- إعداد صواني العازلة.
- وتملأ المكان الكون توجقارورة القاعدة في مدخل العازلة وصواني منفذ (الشكل 1). مواقف قنينة كرر في الممرات 2 و 3 و 4 و 5 وفقا لعدد من العينات لتحليلها، ووضع مسار واحد لكل ستة حقن العينة.
ملاحظة: تجنب ترطيب قبعات قارورة لمنع تسرب الحالي.
- وتملأ المكان الكون توجقارورة القاعدة في مدخل العازلة وصواني منفذ (الشكل 1). مواقف قنينة كرر في الممرات 2 و 3 و 4 و 5 وفقا لعدد من العينات لتحليلها، ووضع مسار واحد لكل ستة حقن العينة.
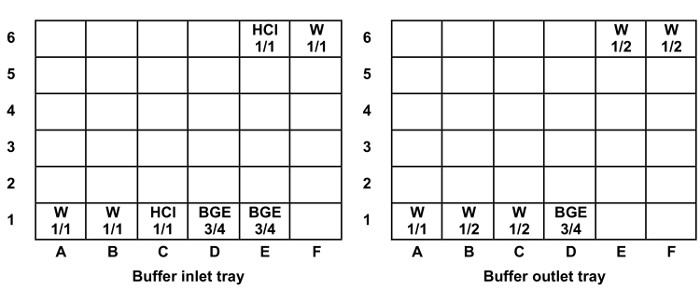
الشكل 1: المركز وملء مستوى قارورة العالمية في مدخل العازلة ومنفذ علب. ملء مستويات: 1/1 = 1400 ميكرولتر، 3/4 = 1300 ميكرولتر و1/2 = 1000 ميكرولتر. الاختصارات: W = الماء، حمض الهيدروكلوريك = 0.1 M حمض الهيدروكلوريك. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- نظام CE مكونات التجمع.
- تثبيت كاشف للأشعة فوق البنفسجية.
- تثبيت الروافع فتحعن طريق الضغط على ما يصل إلى كتلة واجهة.
- تثبيت كابل الألياف البصرية. أدخل الطرف المقابل للشريط المشبك و، في حين عقد كلا الطرفين، وتدوير في اتجاه عقارب الساعة. قم بتوصيل الطرف الآخر للكشف عن الأشعة فوق البنفسجية.
ملاحظة: التعامل مع كابل الألياف البصرية مع الرعاية أثناء هذا الإجراء منذ الانحناء يمكن أن تسبب كسر لها. - مكان العينة وصواني عازلة في النظام عينة عقد والمفاجئة في الموقف.
- وضع خرطوشة الشعرية في كتلة واجهة و، في حين الضغط على شريط المشبك عند كلا الطرفين، وتشديد الرقابة على المقابض.
4. طرق صك مجموعة المتابعة
- إنشاء تكييف والجري وطرق اغلاق الصك وفقا للمعايير التالية والجدول 1: الجهد، الحد الأقصى: 30.0 كيلو فولت. الحالي، الحد الأقصى: 300.0 أمبير. درجة الحرارة خرطوشة: 20.0 درجة مئوية. درجة حرارة تخزين العينات: 10.0 درجة مئوية. الأشعة فوق البنفسجية للكشف عن الظروف الأولية: الطول الموجي: 214 نانومتر. معدل البيانات: 4 هرتز؛ مرشح: عادي؛ عرض ذروة (يشير): 16-25. إشارة الامتصاصية: مباشرة.
ملاحظة: معدل الحصول على البيانات ويمكن زيادة تصل إلى 25 هرتز من أجل تحسين تغطية مناطق الفصل الضيقة.
| برنامج الوقت طريقة تكييف | |||||||
| الوقت (دقيقة) | حدث | القيمة | مدة | قارورة مدخل | قارورة المخرج | ملخص | تعليقات |
| - | شطف - الضغط | 2068 مليبار | 1.0 دقيقة | BI: C1 | BO: C1 | إلى الأمام | حمض الهيدروكلوريك 0.1 M |
| - | شطف - الضغط | 2068 مليبار | 2.0 دقيقة | BI: B1 | BO: C1 | إلى الأمام | الماء |
| - | شطف - الضغط | 2068 مليبار | 10.0 دقيقة | BI: E1 | BO: C1 | إلى الأمام | BGE |
| 0.00 | مستقل - الجهد | 15.0 KV | 10.0 دقيقة | BI: D1 | BO: D1 | 0.17 الحد الأدنى منحدر، والاستقطاب الطبيعي | فصل |
| 10.00 | شطف - الضغط | 2758 مليبار | 10.0 دقيقة | BI: E1 | BO: C1 | إلى الأمام | BGE |
| 20.01 | انتظر | - | 0.0 دقيقة | BI: A1 | BO: A1 | - | نصائح شطف |
| تشغيل البرنامج مرة طريقة | |||||||
| الوقت (دقيقة) | حدث | القيمة | مدة | قارورة مدخل | ملخص | تعليقات | |
| - | شطف - الضغط | 2068 مليبار | 1.0 دقيقة | BI: C1 | BO: C1 | إلى الأمام، في / خارج المؤتمر الوطني العراقي قارورة 6 | حمض الهيدروكلوريك 0.1 M |
| - | شطف - الضغط | 2068 مليبار | 2.0 دقيقة | BI: B1 | BO: C1 | إلى الأمام، في / خارج المؤتمر الوطني العراقي قارورة 6 | ماء |
| - | شطف - الضغط | 2068 مليبار | 4.0 دقيقة | BI: E1 | BO: C1 | إلى الأمام، في / خارج المؤتمر الوطني العراقي قارورة 6 | BGE |
| - | حقن - الضغط | 34 مليبار | 20.0 ثانية | SI: A1 | BO: B1 | تجاوز، الى الامام | حقن عينة |
| - | انتظر | - | 0.4 دقيقة | BI: A1 | BO: A1 | في / خارج المؤتمر الوطني العراقي قارورة 6 | غسل نصائح |
| 0 | مستقل - الجهد | 15.0 KV | 30.0 دقيقة | BI: D1 | BO: D1 | 0.17 الحد الأدنى منحدر، والاستقطاب العادي، في / خارج المؤتمر الوطني العراقي قارورة 6 | فصل عينة |
| 0.5 | Autozero | - | - | - | - | - | - |
| 30.01 | وقف البيانات | - | - | - | - | - | - |
| 30.02 | شطف - الضغط | 2068 مليبار | 2.0 دقيقة | BI: B1 | BO: C1 | إلى الأمام، في / خارج المؤتمر الوطني العراقي قارورة 6 | ماء |
| 32.03 | انتظر | - | 0.0 دقيقة | BI: A1 | BO: A1 | في / خارج المؤتمر الوطني العراقي قارورة 6 | نصائح شطف |
| 32.04 | النهاية | - | - | - | - | - | النهاية |
| برنامج الوقت طريقة الاغلاق | |||||||
| الوقت (دقيقة) | حدث | القيمة | مدة | قارورة مدخل | قارورة المخرج | ملخص | تعليقات |
| - | شطف - الضغط | 2068 مليبار | 1.0 دقيقة | BI: E6 | BO: E6 | إلى الأمام | حمض الهيدروكلوريك 0.1 M |
| - | شطف - الضغط | 2068 مليبار | 6.0 دقيقة | BI: F6 | BO: F6 | إلى الأمام | ماء |
| - | مصباح - إيقاف | - | - | - | - | - | - |
| - | انتظر | - | 0.0 دقيقة | BI: A1 | BO: A1 | - | نصائح شطف |
الجدول 1: تكييف، تشغيل وبرامج وقت الاغلاق.
5. الحصول على البيانات ومعالجة
- برمجة مجموعة عينة.
- برمجة الشعرية لتكييف باستخدام طريقة تكييف الصك. عند استخدام الشعرية لأول مرة، برنامج أربعة التكرار. خلاف ذلك البرنامج اثنين فقط من تكرار طريقة تكييف.
- برمجة عينات لتحليلها باستخدام طريقة أداة تشغيل.
- برمجة الشعرية لتخزين باستخدام طريقة أداة الاغلاق وكرر الإجراء المشار إليها في القسم 3.2.22.
- تشغيل التجربة.
- تصدير electropherograms.
- حساب الوقت الهجرة والمحتوى نسبة، وهو الرئيسي الأساسيالإسوية الحمضية الثانية باستخدام العمودي التكامل انخفاض خط الشخصي رحلاني.
النتائج
ويبين الشكل 2 الملف الشخصي التيار الكهربائي نموذجي من 200 ملي EACA، 30 ملي خلات الليثيوم، ودرجة الحموضة 4.8 BGE مع عينة مكافحة TNFα ماب المخفف مع العازلة تريس (50 ملي، ودرجة الحموضة 8.0). كما يمكن ملاحظتها، والحالي هو مستقر في جميع مراحل التحليل ويمكن أ?...
Discussion
في هذا البرنامج التعليمي، وتسليط الضوء على أهمية الممارسات السليمة عندما يحلل إجراء تشيكيا من MABS من أجل زيادة احتمال أن تنجح. ومع ذلك، عند استخدام تشيكيا على أساس روتيني، تنشأ قضايا لا محالة 12.
للحصول على أفضل النتائج، من ا?...
Disclosures
The authors Carlos E. Espinosa-de la Garza, Rodolfo D. Salazar-Flores, Néstor O. Pérez, Luis F. Flores-Ortiz and Emilio Medina-Rivero are employees of Probiomed S.A. de C.V., which is developing, manufacturing and marketing biosimilar products. All authors are involved in the development of biosimilar products for Probiomed.
Acknowledgements
The authors thank Wiley for the granted permission to use the concepts of the following publication for this tutorial. Carlos E. Espinosa-de la Garza, Francisco C. Perdomo-Abúndez, Jesús Padilla-Calderón, Jaime M. Uribe-Wiechers, Néstor O. Pérez, Luis F. Flores-Ortiz, Emilio Medina-Rivero: Analysis of recombinant monoclonal antibodies by capillary zone electrophoresis. Electrophoresis. 2013. 34. 1133-1140. Copyright Wiley-VCH Verlag GmbH & Co. KGaA. This work was supported by CONACyT, Mexico, grant 230551.
Materials
| Name | Company | Catalog Number | Comments |
| Glacial acetic acid | Tecsiquim | AT0035-7 | |
| ACS grade hydrochloric acid | J.T. Baker | 9535-05 | |
| Histamine dihydrochloride | Fluka | 53300 | |
| (Hydroxypropyl) methyl cellulose | Fluka | 09963 | |
| Lithium acetate | Sigma-Aldrich | 517992 | |
| 6-Aminocaproic acid | Sigma-Aldrich | A2504 | |
| eCAP Tris Buffer, 50.0 mM, pH 8 | Beckman Coulter | 477427 | |
| PA 800 Plus Pharmaceutical Analysis System | Beckman Coulter | A66528 | |
| eCAP Neutral capillary | Beckman Coulter | 477441 | |
| Vial, Micro, 200 µl | Beckman Coulter | 144709 | |
| Universal Vial Caps | Beckman Coulter | A62250 | |
| Universal Vials | Beckman Coulter | A62251 | |
| Cable, Optics, UV/Vis | Beckman Coulter | 144093 | |
| UV/Vis Detector Module | Beckman Coulter | 144733 | |
| Cartridge Assembly Kit, Blank | Beckman Coulter | 144738 |
References
- Bruno, V., Battaglia, G., Nicoletti, F. The advent of monoclonal antibodies in the treatment of chronic autoimmune diseases. Neurol. Sci. 31, 283-288 (2011).
- Liu, H., Gaza-Bulseco, G., Faldu, D., Chumsae, C., Sun, J. Heterogeneity of monoclonal antibodies. J. Pharm. Sci. 97 (7), 2426-2447 (2008).
- Creamer, J. S., Oborny, N. J., Lunte, S. M. Recent advances in the analysis of therapeutic proteins by capillary and microchip electrophoresis. Anal. Methods. 6 (15), 5427-5449 (2014).
- Fekete, S., Guillarme, D., Sandra, P., Sandra, K. Chromatographic, Electrophoretic, and Mass Spectrometric Methods for the Analytical Characterization of Protein Biopharmaceuticals. Anal. Chem. 88 (1), 480-507 (2016).
- He, Y., et al. Analysis of identity, charge variants, and disulfide isomers of monoclonal antibodies with capillary zone electrophoresis in an uncoated capillary column. Anal. Chem. 82 (8), 3222-3230 (2010).
- He, Y., Isele, C., Hu, W., Ruesch, M. Rapid analysis of charge variants of monoclonal antibodies with capillary zone electrophoresis in dynamically coated fused-silica capillary. J. Sep. Sci. 34 (5), 548-555 (2011).
- Zhao, S. S., Chen, D. D. Y. Applications of capillary electrophoresis in characterizing recombinant protein therapeutics. Electrophoresis. 35 (1), 96-108 (2014).
- Štěpánová, S., Kašička, V. Determination of impurities and counterions of pharmaceuticals by capillary electromigration methods. J. Sep. Sci. 37 (15), 2039-2055 (2014).
- Štěpánová, S., Kašička, V. Recent applications of capillary electromigration methods to separation and analysis of proteins. Anal. Chim. Acta. 933, 23-42 (2016).
- Espinosa-de la Garza, C. E., et al. Analysis of recombinant monoclonal antibodies by capillary zone electrophoresis. Electrophoresis. 34 (8), 1133-1140 (2013).
- Staub, A., Guillarme, D., Schappler, J., Veuthey, J. L., Rudaz, S. Intact protein analysis in the biopharmaceutical field. J. Pharm. Biomed. Anal. 55 (4), 810-822 (2011).
- Altria, K. D., Altria, K. D. Troubleshooting. Methods in Molecular Biology, Vol 52. Capillary Electrophoresis Guidebook: Principles, Operation and Applications. , (1996).
- Ma, S., Nashabeh, W. Analysis of protein therapeutics by capillary electrophoresis. Chromatographia. 53 (5), 75-89 (2001).
- Jaccoulet, E., Smadja, C., Prognon, P., Taverna, M. Capillary electrophoresis for rapid identification of monoclonal antibodies for routine application in hospital. Electrophoresis. 36 (17), 2050-2056 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved