A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הפרדת אלקטרופורזה הנימים של חד השבטי הנוגדן isoforms באמצעות נימי Neutral
In This Article
Summary
Here, we present a comprehensive capillary zone electrophoresis protocol for the assessment of intrinsic physicochemical heterogeneity of monoclonal antibodies as a quality attribute.
Abstract
Biotherapeutic proteins, such as monoclonal antibodies (mAbs), are feasible alternatives for the treatment of chronic-degenerative diseases. The biological activity of these proteins depends on their physicochemical properties. The use of high-performance techniques like chromatography and capillary electrophoresis has been described for the analysis of physicochemical heterogeneity of mAbs. Nowadays, capillary zone electrophoresis (CZE) technique constitutes one of the most resolutive and sensitive assays for the analysis of biomolecules. Besides, the electro-driven separation in CZE is governed by extensive properties of matter and offers the advantage of analyzing proteins close to their native state. However, the successful implementation of this technique for routine analysis depends on the skills of the analyst at the critical steps during sample and system preparation. The purpose of this tutorial is to detail the steps to succeed in the CZE analysis of mAbs. Further, this protocol can be used for the development and improvement of skills of the personnel involved in protein analytical chemistry laboratories.
Introduction
נוגדנים חד-שבטיים (מבז) הם חלבונים biotherapeutic עם הגדלת הריבית בשל יכולתם לפעול נגד מספר 1 כרונית ניוונית מחלות. כמו ביומולקולות אחרות, מהבז נוטה לעבור שינויי physicochemical כמה בכל שלבי מחזור החיים שלהם (כלומר, מן ביוסינתזה למוצר הסופי). כזה שינויים כוללים, אך אינם מוגבלים ל: deamidation, glycosylation, חמצון, cyclization, isomerization, צבירה פרוטאוליטים מחשוף 2. לפיכך, שיטות אנליטיות מסוגלת לפתור isoforms המהותי יש צורך לפקח ההטרוגניות מבז ויציבות כדי להקים מפרט איכות.
אלקטרופורזה נימים (CE) היא טכנולוגית הפרדה גבוהה ביצועים נשאה outinside של צינור התמזג-סיליקה צר (טווח מיקרומטר) מלא עם אלקטרוליט רקע (BGE). במועד היישום של שדה חשמלי (עד 30,000 V), טעונה מולקולההים נודד לעבר אלקטרודה עם מטען נגדי (כלומר, פרדה מונחה אלקטרו). השימוש במתח גבוה ב CE מאפשר ניתוחים מהירים התייעלות, אשר עדיפים על ג'ל אלקטרופורזה קלסית. אלקטרופורזה אזור נימים (CZE) היא טכניקה מבוססת לספירה בשימוש השיגרתי בתעשיית הביו-פרמצבטיקה להערכת איכות מוצר 3-9. בניגוד מצבים אחרים של לסה"נ (למשל, ג'ל אלקטרופורזה נימי, איזואלקטרית נימי התמקדות) או בשיטות מבוססות כרומטוגרפיה, CZE יכול להתנהל ללא שימוש denaturants או ממשקי-שלב מוצק, המאפשר ניתוח של בהטרוגניות הטבועה מבז קרוב למצב הטבעי שלהם 10 . הפרדת CZE של isoforms מב מתרחשת בתוך נימים התמזג-סיליקה מכוסות פולימר הידרופילי (נימים ניטראליות), והיא מבוססת על ניידות electrophoretic השונה שלהם, אשר נשלטת על ידי תשלום, המוני, גודל וצורה (או נפח הידרודינמית) 11. moieties מב מזוהה כאשרהם מגויסים ועוברים דרך חלון איתור, אשר חשו על ידי גלאי אולטרה סגול (UV) ספיגת ב 214 ננומטר 4.
היישום המוצלח של שיטה אנליטית זה יהיה תלוי תשומת לב ראויה פרטים לפני ובמהלך הניסוי. ממלא מקום אחר יגדיל את העלות והזמן לבצע את הניתוח, ובסופו של דבר מוביל כישלון ותסכול מתמידים.
כאן, אנו מציגים צעד-אחר-צעד מדריך כדי לבצע ניתוח מוצלח של ההטרוגניות מב ידי CZE דרך ההסבר המפורט של הכנת פתרונות ודוגמאות, הכנת מערכת לספירה, שיטות המכשירות להגדיר, רכישת הנתונים, עיבוד נתונים. לצורך הדרכה זו, אלפא גורם נמק אנטי סרטניים רקומביננטי אנושי מלא (אנטי-TNFα) מב משמש כמודל חלבון; עם זאת, פרוטוקול זה יכול להיות מותאם אישית בקלות על הניתוח של חלבונים אחרים בהתחשב שינויים קצרים. אdditionally, כמה המלצות כדי להקטין בעיות פוטנציאליות מוצעות. הקורא מוזמן לעקוב אחר הפרוטוקול המוצע בקפדנות, בהסתברות להצליח יגדל.
Protocol
1. הכנת פתרונות
- הכן את הפתרון BGE.
- כן 100 מיליליטר של פתרון מורכב 0.05% (m / v) תאי מתיל propyl הידרוקסי (HPMC), 200 מ"מ ε-אמינו n-caproic חומצה (EACA) ו -30 יצטטו ליתיום מ"מ.
הערה: ככל HPMC הוא פולימר viscoelastic, לשפוך את האבקה לתוך כוס זכוכית, להוסיף 80 מ"ל של מים ולבסוף להוסיף את סרגל בחישה. ממשיכים להוסיף ריאגנטים הנותרים כמו בדרך כלל. יש להרכיב משקפי בטיחות בעת הטיפול יצטט ליתיום כפי שהוא יכול לגרום לגירוי בעיניים. - התאם לשווי pH 4.8 ± 0.1 עם 50% (v / v) חומצה אצטית. אפשר פתרון לייצוב במשך 5 דקות ולהתאים לפי הצורך.
- מוסיפים מים כדי לפצות לנפח סופי של 100 מ"ל בקבוק מדידה.
- סינון דרך קרום הידרופילי עם גודל 0.2 מיקרומטר נקבוביים.
- חנות ב 2-8 מעלות צלזיוס למשך עד 7 ימים.
- כן 100 מיליליטר של פתרון מורכב 0.05% (m / v) תאי מתיל propyl הידרוקסי (HPMC), 200 מ"מ ε-אמינו n-caproic חומצה (EACA) ו -30 יצטטו ליתיום מ"מ.
- הכן את התקן הפנימי.
- כן 1 מיליליטרשל פתרון מורכב 1% (מ / נ) היסטמין.
- סינון דרך קרום הידרופילי עם גודל 0.2 מיקרומטר נקבוביים.
- חנות ב 2-8 מעלות צלזיוס למשך עד 1 יום.
לדוגמא כנה 2.
- הכן 180 μl של מדגם מב מדולל טריס חיץ (50 מ"מ טריס (hydroxymethyl) aminomethane, pH 8.0) לריכוז סופי של 1 מ"ג / מ"ל.
- הוסף 20 μl של 1% (מ / נ) היסטמין.
- מערבבים צנטריפוגות XG ב 1000 למשך 5 שניות.
- מניחים בקבוקון מיקרו בתוך בקבוקון אוניברסלי.
- מעבירים את המדגם לתוך בקבוקון מיקרו מכסה את הבקבוקון אוניברסלי. מחלקים את המדגם כלפי מעלה כדי למנוע החדרת כל הבועות.
- חנות ב 2-8 מעלות צלזיוס למשך עד 1 יום.
- מניח את הצנצנת האוניברסלית (עם בקבוקון מייקרו המכיל את הפתרון המדגם) במגש כניסת מדגם.
3. הכנת מערכת CE.
- ניקוי מערכת CE.
הערה: ה התנהגותהליך הוא לפחות פעם בשבוע על מנת למנוע דליפת זרם חשמלית נגזרת הצטברות של אבק ופסולת. עם זאת, בהתאם ליישום (למשל, שימוש BGE עם צמיגות מוגברת או עם ריכוז מלח גבוה, דגימות עם צמיגות מוגברת) אלקטרודות וידיות פתיחה ייתכן שיש צורך לנקות בתדירות גבוהה יותר על מנת למנוע זיהום צולב שריד מדגם.- כבו את מתג ההפעלה של המכשיר CE ופתח את דלת הכניסה.
- נקה את פני השטח של הכיסוי המדגם, מערכת החזיק מדגם (מגשים מדגם חיץ), מכסה מחסניות, מהדק בר, בלוק ממשק ואלקטרודות עם ארוגי לחת מים לנגב. חזור על התהליך עם אתנול לחה לנגב יבש לפני השימוש.
- שוטפים את המנופים פתיחת היטב במים. נקה פני השטח שלהם עם ארוגים לנגב. חזור על התהליך עם אתנול לחה לנגב ולייבש לפני ההתקנה.
- נקה את שני קצוות של כבל הסיב האופטי הזהירly עם מטלית מיקרופייבר לחה במים. חזור על התהליך עם מטלית לחה-אתנול.
- מכלול מחסנית.
- הסרת נימים ניטראליות חדשות (50 מיקרומטר קוטר פנימי) מהאריזה.
- סרט למטה קצה אחד של צינור נימי מגן על שולחן העבודה. Uncoil, ליישר ולמשוך את הנימים את הצינורות.
- היצמד חתיכת סרט או נייר אל שולחן העבודה ולהוסיף סימוני מדידה כדלקמן: אורך אל הגלאי (30 ס"מ), חלון נימי (0.2 ס"מ) ואורך עד הסוף לשקע (10 ס"מ) (כלומר, 40.2 ס"מ באורך כולל, 30.0 ס"מ אורך יעיל).
- יישר את חלון נימים על גובת מדידת 0.2 סנטימטרים בעיתון ההתייחסות. תקן את הנימים עם קלטת ולסמן את הנימים בתוצאת 2 מ"מ מחוץ סימני המדידה.
- חותך את המכסה המגן בסוף כניסת הנימים (הכי רחוק סוף מהחלון) בתנועה ישרה יחידה באמצעות הקצה הסומק של אבן הביקוע.
- לטבול את הקצה נימי לתוך בקבוקון אוניברסלי כתרים מלאים מים על מנת למנוע נזק בלתי הפיך לציפוי נימי הפנימי. חזור על הליך זה בכל פעם סוף נימי חשופת הסביבה במשך יותר מ 1 דקות.
- הכנס את קצה נימי הכניסה לתוך בצד היציאה של המחסנית.
- דחוף ומשוכים נימי דרך המחסנית לפי צורך עד לחלון הנימים מרוכז אל חלון המחסנית.
- הכניסו את תקע הצמצם (100 מיקרומטר x 200 מיקרומטר) לתוך חלון מחסנית.
הערה: ודא כי אור לבן עובר דרך החלון כאשר הם נחשפים למקור האור לבן. אם האור שעובר דרך בעל חזות חומה, להתאים לפי צורך. - הכנס את הנימים לתוך הצינורות מראש יצר קירור עבור באורך נימי סך של 40.2 סנטימטר (עם אגוז צינורות מותקנים מראש, טבעת חזוק ו O- טבעת בשני קצותיו בסדר הזה).
- דחוף את נימי דרך coolant צינורות לפי צורך עד הנימים מופיעות בצד השני של הצינור.
- הכנס את הקצה של הצינור נוזל קירור לתוך הצד לשקע המחסנית להדק את אום הצינורות.
- הכנס את קצה נימי הכניסה לתוך בצד המפרצון של המחסנית.
- דחוף ומשוך נימי דרך המחסנית לפי צורך עד הנימים מופיעות בצד המפרצון של המחסנית.
- הכנס את הקצה של הצינור נוזל קירור לתוך צד כניסת המחסנית להדק את אום הצינורות.
- חותך את המכסה המגן בסוף לשקע נימים (בקצה הקרוב מהחלון) בתנועה ישרה יחידה באמצעות הקצה הסומק של אבן הביקוע.
- הכנס את הקטעים-שכר חותמים על הקצוות נימי ולחץ לצלם למקומו. ראייה לבדוק את הנימים מסתיימות. אם הם אפילו לא, לחזור על התהליך.
- מניחים את התבנית נימי באורך על קצה שולחן העבודה.
- הנח את המחסנית כלפי מטה AGainst תבנית נימי באורך וליישר את הנימים ונגמרו קווי ההפניה על התבנית. אם סימני המדידה נימי (ראה 3.2.4) שאינם תואמים את קווי הפניה, להתאים לפי הצורך.
- החזק את הנימים נגד תבנית נימי באורך והעברת את שני הקצוות של הנימים באמצעות הקצה הסומק של מ"מ ביקוע אבן 2 מתחת לקווי ההפניה על התבנית.
- ראייה לבדוק את הנימים מסתיימות עם זכוכית מגדלת. אם קצוות נימי אינם חלקים, להבריק אותם באמצעות פן הרכות של אבן הביקוע.
- הכנס את אטם הצמצם לתוך חור תקע הצמצם אתה משתמש בכלי הזנת O-Ring.
- התקן בקבוקונים אוניברסליים כתרים מלאי מים לתוך תיק המחסנית ומחסנית מקום לתוך תיק מייד עם קצות נימים מוכנס לתוך צלוחיות. עבור אחסון לטווח קצר וארוך לשמור ב 2-8 מעלות צלזיוס.
- הכנת מגשי חיץ.
- מלאו והניח יקום כתראל צלוחיות כניסת החיץ ומגשים לשקע (איור 1). עמדות בקבוקון חזרו במסלולי 2, 3, 4 ו -5 פי עם מספר הדגימות להיות מנותחות, הצבת נתיב אחד לכל שש זריקות מדגמות.
הערה: הימנע הרטבת כמוסות הבקבוקון כדי למנוע דליפה נוכחית.
- מלאו והניח יקום כתראל צלוחיות כניסת החיץ ומגשים לשקע (איור 1). עמדות בקבוקון חזרו במסלולי 2, 3, 4 ו -5 פי עם מספר הדגימות להיות מנותחות, הצבת נתיב אחד לכל שש זריקות מדגמות.
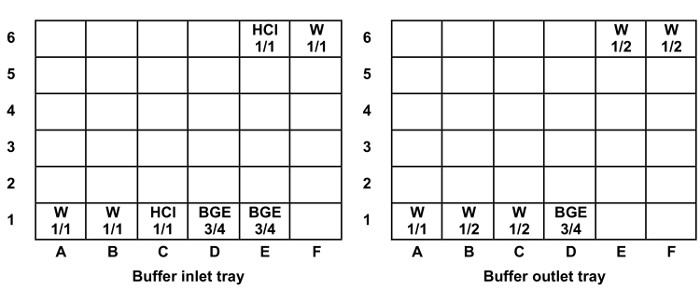
איור 1: מיקום ולמלא רמת בקבוקונים אוניברסלי במגשים הכניסה והיציאה חיץ. מלאו רמות: 1/1 = 1400 μL, 3/4 = 1300 μL ו 1/2 = 1000 μL. קיצורים: W = מים, HCl = 0.1 חומצה הידרוכלורית M. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- מערכת CE הרכבת רכיבים.
- התקן את גלאי UV.
- התקן את הידיות לפתיחתעל ידי לחיצה עד לבלוק הממשק.
- התקן את כבל סיב אופטי. הכנס את הקצה המתאים בסרגל מהדק ותוך כדי לחיצה בשני הקצוות, לסובב עם כיוון השעון. חבר את הקצה השני אל גלאי UV.
הערה: טפלו כבל סיב אופטי עם טיפול במהלך הליך זה מאז כיפוף עלול לגרום שבר שלה. - מדגם מקום ומגשים חיץ למערכת החזקה מדגם ולהצמיד למקומו.
- הנח את מחסנית הנימים לבלוק הממשק, תוך כדי לחיצה על סרגל המהדק בשני קצותיו, להדק את הכפתורים.
4. כלי שיטות קמות
- צור את המיזוג, ריצה ושיטות מכשיר כיבוי על פי הפרמטרים הבאים ולוח 1: המתח, מקסימום: 30.0 קילו וולט; נוכחי, מקסימום: 300.0 מיקרו-אמפר; טמפרטורת מחסנית: 20.0 מעלות צלזיוס; טמפרטורת אחסון מדגם: 10.0 מעלות צלזיוס; תנאי ההתחלה גלאי UV: אורך גל: 214 ננומטר; שיעור נתונים: 4 רץ; מסנן: רגיל; רוחב שיא (נקודות): 16-25; אות ספיגה: ישיר.
הערה: נתוני רכישה בשיעור ניתן להגדיל עד 25 רץ כדי לשפר את הסיקור של שטחי הפרדה צרים.
| תכנית זמן שיטה אויר | |||||||
| זמן (דקות) | מִקרֶה | ערך | מֶשֶׁך | בקבוקון מפרצון | בקבוקון Outlet | סיכום | תגובות |
| - | לשטוף - לחץ | 2068 mbar | 1.0 דקות | BI: C1 | BO: C1 | קָדִימָה | HCl 0.1 M |
| - | לשטוף - לחץ | 2068 mbar | 2.0 דקות | BI: B1 | BO: C1 | קָדִימָה | מים |
| - | לשטוף - לחץ | 2068 mbar | 10.0 דקות | BI: E1 | BO: C1 | קָדִימָה | BGE |
| 0.00 | נפרד - מתח | 15.0 KV | 10.0 דקות | BI: D1 | BO: D1 | 0.17 Min רמפה, קוטביות נורמלית | נפרד |
| 10.00 | לשטוף - לחץ | 2758 mbar | 10.0 דקות | BI: E1 | BO: C1 | קָדִימָה | BGE |
| 20.01 | לַחֲכוֹת | - | 0.0 דקות | BI: A1 | BO: A1 | - | טיפים לשטוף |
| הפעלת תוכנית זמן השיטה | |||||||
| זמן (דקות) | מִקרֶה | ערך | מֶשֶׁך | בקבוקון מפרצון | סיכום | תגובות | |
| - | לשטוף - לחץ | 2068 mbar | 1.0 דקות | BI: C1 | BO: C1 | קדימה, כניסה / יציאה inc בקבוקון 6 | HCl 0.1 M |
| - | לשטוף - לחץ | 2068 mbar | 2.0 דקות | BI: B1 | BO: C1 | קדימה, כניסה / יציאה inc בקבוקון 6 | מַיִם |
| - | לשטוף - לחץ | 2068 mbar | 4.0 דקות | BI: E1 | BO: C1 | קדימה, כניסה / יציאה inc בקבוקון 6 | BGE |
| - | להזריק - לחץ | 34 mbar | 20.0 שניות | SI: A1 | BO: B1 | דרוס, קדימה | הזרקה לדוגמא |
| - | לַחֲכוֹת | - | 0.4 דקות | BI: A1 | BO: A1 | In / Out בקבוקון inc 6 | טיפים Wash |
| 0 | נפרד - מתח | 15.0 KV | 30.0 דקות | BI: D1 | BO: D1 | 0.17 Min הרמפה, קוטביות נורמלית, כניסה / יציאה בקבוקון inc 6 | הפרדה לדוגמא |
| 0.5 | Autozero | - | - | - | - | - | - |
| 30.01 | עצור נתונים | - | - | - | - | - | - |
| 30.02 | לשטוף - לחץ | 2068 mbar | 2.0 דקות | BI: B1 | BO: C1 | קדימה, כניסה / יציאה inc בקבוקון 6 | מַיִם |
| 32.03 | לַחֲכוֹת | - | 0.0 דקות | BI: A1 | BO: A1 | In / Out בקבוקון inc 6 | טיפים לשטוף |
| 32.04 | סוֹף | - | - | - | - | - | סוֹף |
| תכנית זמן שיטת כיבוי | |||||||
| זמן (דקות) | מִקרֶה | ערך | מֶשֶׁך | בקבוקון מפרצון | בקבוקון Outlet | סיכום | תגובות |
| - | לשטוף - לחץ | 2068 mbar | 1.0 דקות | BI: E6 | BO: E6 | קָדִימָה | HCl 0.1 M |
| - | לשטוף - לחץ | 2068 mbar | 6.0 דקות | BI: F6 | BO: F6 | קָדִימָה | מַיִם |
| - | מנורה - כבוי | - | - | - | - | - | - |
| - | לַחֲכוֹת | - | 0.0 דקות | BI: A1 | BO: A1 | - | טיפים לשטוף |
טבלה 1: אויר, פועל ותוכניות זמן הכיבוי.
5. קליטת נתונים ועיבוד
- לתכנת את המדגם.
- לתכנת את הנימים עבור מיזוג בשיטת מכשיר מיזוג. כאשר הנימים משמשות בפעם הראשונה, תכנית ארבע חזרות; לתכנת אחרת רק שתי חזרות של שיטת המיזוג.
- לתכנת את הדגימות להיות מנותחים בשיטת מכשיר הריצה.
- לתכנת את הנימים לאחסון בשיטת מכשיר הכיבוי לחזור על התהליך מפורט בסעיף 3.2.22.
- הפעל את הניסוי.
- יצא את electropherograms.
- חשב את זמן ההעברה ואת תוכן אחוז בסיסי, העיקריisoforms חומצי nd באמצעות שילוב קו ירידה אנכית של הפרופיל electropherogram.
תוצאות
איור 2 מציג את פרופיל זרם חשמלי טיפוסי של אצטט ליתיום 200 מ"מ EACA, 30 מ"מ, BGE pH 4.8 עם מדגם אנטי TNFα מב מדולל טריס חיץ (50 מ"מ, ה- pH 8.0). כפי שניתן לשים לב, הזרם הוא יציב לאורך כל ניתוח יכול להתנדנד בין ערכים של 30 עד 35 מיקרו-אמפר. איור 3 מציג ?...
Discussion
במדריך זה, אנו מדגישים את החשיבות של שיטות נכונות בעת ביצוע CZE מנתח של מבז כדי להגדיל את ההסתברות להצליח. עם זאת, כאשר CZE משמש על בסיס שגרתי, מתעוררות בעיות בלתי נמנע 12.
לקבלת התוצאות הטובות ביותר, חשוב לעקוב אחר ההערות שנכללו ?...
Disclosures
The authors Carlos E. Espinosa-de la Garza, Rodolfo D. Salazar-Flores, Néstor O. Pérez, Luis F. Flores-Ortiz and Emilio Medina-Rivero are employees of Probiomed S.A. de C.V., which is developing, manufacturing and marketing biosimilar products. All authors are involved in the development of biosimilar products for Probiomed.
Acknowledgements
The authors thank Wiley for the granted permission to use the concepts of the following publication for this tutorial. Carlos E. Espinosa-de la Garza, Francisco C. Perdomo-Abúndez, Jesús Padilla-Calderón, Jaime M. Uribe-Wiechers, Néstor O. Pérez, Luis F. Flores-Ortiz, Emilio Medina-Rivero: Analysis of recombinant monoclonal antibodies by capillary zone electrophoresis. Electrophoresis. 2013. 34. 1133-1140. Copyright Wiley-VCH Verlag GmbH & Co. KGaA. This work was supported by CONACyT, Mexico, grant 230551.
Materials
| Name | Company | Catalog Number | Comments |
| Glacial acetic acid | Tecsiquim | AT0035-7 | |
| ACS grade hydrochloric acid | J.T. Baker | 9535-05 | |
| Histamine dihydrochloride | Fluka | 53300 | |
| (Hydroxypropyl) methyl cellulose | Fluka | 09963 | |
| Lithium acetate | Sigma-Aldrich | 517992 | |
| 6-Aminocaproic acid | Sigma-Aldrich | A2504 | |
| eCAP Tris Buffer, 50.0 mM, pH 8 | Beckman Coulter | 477427 | |
| PA 800 Plus Pharmaceutical Analysis System | Beckman Coulter | A66528 | |
| eCAP Neutral capillary | Beckman Coulter | 477441 | |
| Vial, Micro, 200 µl | Beckman Coulter | 144709 | |
| Universal Vial Caps | Beckman Coulter | A62250 | |
| Universal Vials | Beckman Coulter | A62251 | |
| Cable, Optics, UV/Vis | Beckman Coulter | 144093 | |
| UV/Vis Detector Module | Beckman Coulter | 144733 | |
| Cartridge Assembly Kit, Blank | Beckman Coulter | 144738 |
References
- Bruno, V., Battaglia, G., Nicoletti, F. The advent of monoclonal antibodies in the treatment of chronic autoimmune diseases. Neurol. Sci. 31, 283-288 (2011).
- Liu, H., Gaza-Bulseco, G., Faldu, D., Chumsae, C., Sun, J. Heterogeneity of monoclonal antibodies. J. Pharm. Sci. 97 (7), 2426-2447 (2008).
- Creamer, J. S., Oborny, N. J., Lunte, S. M. Recent advances in the analysis of therapeutic proteins by capillary and microchip electrophoresis. Anal. Methods. 6 (15), 5427-5449 (2014).
- Fekete, S., Guillarme, D., Sandra, P., Sandra, K. Chromatographic, Electrophoretic, and Mass Spectrometric Methods for the Analytical Characterization of Protein Biopharmaceuticals. Anal. Chem. 88 (1), 480-507 (2016).
- He, Y., et al. Analysis of identity, charge variants, and disulfide isomers of monoclonal antibodies with capillary zone electrophoresis in an uncoated capillary column. Anal. Chem. 82 (8), 3222-3230 (2010).
- He, Y., Isele, C., Hu, W., Ruesch, M. Rapid analysis of charge variants of monoclonal antibodies with capillary zone electrophoresis in dynamically coated fused-silica capillary. J. Sep. Sci. 34 (5), 548-555 (2011).
- Zhao, S. S., Chen, D. D. Y. Applications of capillary electrophoresis in characterizing recombinant protein therapeutics. Electrophoresis. 35 (1), 96-108 (2014).
- Štěpánová, S., Kašička, V. Determination of impurities and counterions of pharmaceuticals by capillary electromigration methods. J. Sep. Sci. 37 (15), 2039-2055 (2014).
- Štěpánová, S., Kašička, V. Recent applications of capillary electromigration methods to separation and analysis of proteins. Anal. Chim. Acta. 933, 23-42 (2016).
- Espinosa-de la Garza, C. E., et al. Analysis of recombinant monoclonal antibodies by capillary zone electrophoresis. Electrophoresis. 34 (8), 1133-1140 (2013).
- Staub, A., Guillarme, D., Schappler, J., Veuthey, J. L., Rudaz, S. Intact protein analysis in the biopharmaceutical field. J. Pharm. Biomed. Anal. 55 (4), 810-822 (2011).
- Altria, K. D., Altria, K. D. Troubleshooting. Methods in Molecular Biology, Vol 52. Capillary Electrophoresis Guidebook: Principles, Operation and Applications. , (1996).
- Ma, S., Nashabeh, W. Analysis of protein therapeutics by capillary electrophoresis. Chromatographia. 53 (5), 75-89 (2001).
- Jaccoulet, E., Smadja, C., Prognon, P., Taverna, M. Capillary electrophoresis for rapid identification of monoclonal antibodies for routine application in hospital. Electrophoresis. 36 (17), 2050-2056 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved