Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Капиллярный электрофорез Разделение моноклональных антител изоформ с нейтральным капилляра
В этой статье
Резюме
Here, we present a comprehensive capillary zone electrophoresis protocol for the assessment of intrinsic physicochemical heterogeneity of monoclonal antibodies as a quality attribute.
Аннотация
Biotherapeutic proteins, such as monoclonal antibodies (mAbs), are feasible alternatives for the treatment of chronic-degenerative diseases. The biological activity of these proteins depends on their physicochemical properties. The use of high-performance techniques like chromatography and capillary electrophoresis has been described for the analysis of physicochemical heterogeneity of mAbs. Nowadays, capillary zone electrophoresis (CZE) technique constitutes one of the most resolutive and sensitive assays for the analysis of biomolecules. Besides, the electro-driven separation in CZE is governed by extensive properties of matter and offers the advantage of analyzing proteins close to their native state. However, the successful implementation of this technique for routine analysis depends on the skills of the analyst at the critical steps during sample and system preparation. The purpose of this tutorial is to detail the steps to succeed in the CZE analysis of mAbs. Further, this protocol can be used for the development and improvement of skills of the personnel involved in protein analytical chemistry laboratories.
Введение
Моноклональные антитела (мАт) являются биотерапевтический белки с ростом интереса из - за их способности действовать против нескольких хронических и дегенеративных заболеваний 1. Как и другие биомолекулы, мАт склонны пройти несколько физико - химических модификаций на всех этапах их жизненного цикла (т.е. от биосинтеза до конечного продукта). Такие модификации включают, но не ограничиваются ими: деамидированием, гликозилирование, окисление, циклизации, изомеризации, агрегации и протеолитическим расщеплением 2. Следовательно, аналитические методы, способные решить внутренние изоформы необходимы для мониторинга MAT, гетерогенность и стабильности с целью установления требований к качеству.
Капиллярного электрофореза (CE) представляет собой технологию, высокопроизводительное разделение, осуществляемое outinside узкой плавленого кварца трубки (диапазон мкм), наполненную фонового электролита (BGE). При приложении электрического поля (до 30000 В), заряженной молекулыs мигрируют к электроду с противоположным зарядом (то есть, электро-приводом разделения). Использование высоких напряжений в CE позволяет быстро анализа и повышения эффективности, которые превосходят электрофореза классического геля. Капиллярного зонного электрофореза (CZE) представляет собой метод CE на основе обычно используются в биофармацевтической промышленности для оценки качества продукта 3-9. В отличие от других режимов CE (например, электрофорез капиллярный гель, капиллярная изоэлектрической фокусирующей) или методов хроматографии на основе, CZE может проводиться без использования денатурирующих или твердофазных интерфейсов, что позволяет анализ присущей неоднородности мАт , близких к их нативном состоянии 10 , CZE разделение MAB изоформ происходит внутри плавленого кварца капилляра , покрытого гидрофильным полимером (нейтральным капилляра) и основан на их различной электрофоретической подвижности, которое управляется с помощью заряда, массы, размера и формы (или гидродинамического объема) 11. монАТ фрагменты обнаружены приони мобилизовали и проходят через окна обнаружения, которая измеряется с помощью детектора ультрафиолетового (УФ) оптической плотности при 214 нм 4.
Успешная реализация этой аналитической методики будет зависеть от надлежащего внимания к деталям до и во время эксперимента. Действуя в противном случае приведет к увеличению затрат и времени, чтобы провести анализ, в конечном счете, приводит к постоянной неудачи и разочарования.
Здесь мы представляем руководство шаг за шагом провести успешный анализ МАВ неоднородности по CZE через подробное объяснение приготовления растворов и образцов, подготовки системы CE, методов инструментов, созданных, сбора данных, и обработка. Для целей данного руководства, полностью рекомбинантный человеческий анти-фактора некроза опухоли альфа (анти-TNF-alpha) моноклональное антитело используется в качестве модели белка; Тем не менее, этот протокол можно легко настроить для анализа других белков с учетом кратких модификаций.dditionally несколько рекомендаций по смягчению предложены возможные проблемы. Читателю предлагается строго соблюдать предложенный протокол, поскольку вероятность достижения успеха будет возрастать.
протокол
1. Приготовление растворов
- Приготовьте раствор BGE.
- Приготовьте 100 мл раствора, состоящего из 0,05% (м / об) гидроксипропилметилцеллюлозы (ГПМЦ), 200 мМ ε-амино- N-капроновой кислоты (ЭАК) и 30 мМ ацетат лития.
Примечание: В качестве НРМС вязкоупругого полимера, залить порошок в стеклянном стакане, добавляют 80 мл воды и, наконец, добавить стержню мешалки. Продолжайте добавлять оставшиеся реагенты, как обычно. Носите защитные очки при работе с ацетат лития, как это может вызвать раздражение глаз. - Отрегулировать до величины рН 4,8 ± 0,1 с помощью 50% (об / об) уксусной кислоты. Дайте раствору стабилизироваться в течение 5 мин и при необходимости отрегулировать.
- Добавьте воду, чтобы до конечного объема 100 мл в мерной колбе.
- Смесь фильтруют через гидрофильную мембрану с размером 0,2 мкм порами.
- Хранить при температуре 2-8 ° С в течение до 7 дней.
- Приготовьте 100 мл раствора, состоящего из 0,05% (м / об) гидроксипропилметилцеллюлозы (ГПМЦ), 200 мМ ε-амино- N-капроновой кислоты (ЭАК) и 30 мМ ацетат лития.
- Подготовьте внутренний стандарт.
- Подготовить 1 млраствора, состоящего из 1% (м / об) гистамина.
- Смесь фильтруют через гидрофильную мембрану с размером 0,2 мкм порами.
- Хранить при температуре 2-8 ° С в течение до 1 дня.
2. Подготовка проб
- Подготовьте 180 мкл образца, разбавленного мАт трис-буфером (50 мМ трис (гидроксиметил), рН 8,0) до конечной концентрации 1 мг / мл.
- Добавьте 20 мкл 1% (м / об) гистамина.
- Смешайте и центрифуге при 1000 мкг в течение 5 сек.
- Поместите микро флакон внутри универсального флакона.
- Перенести пробу в микро флакон и колпачок универсальный флакон. Разливают образец вверх, чтобы избежать введения каких-либо пузырьков.
- Хранить при температуре 2-8 ° С в течение до 1 дня.
- Поместите универсальный флакон (с микро флакон, содержащий раствор образца) во входном лотке образца.
3. Подготовка системы CE.
- Система очистки CE.
Примечание: Проведение йэто процедура, по крайней мере один раз в неделю, чтобы избежать электрического тока утечки, производный от накопления пыли и мусора. Тем не менее, в зависимости от применения (например, использование BGE с повышенной вязкостью или с высокой концентрацией соли, образцы с повышенной вязкостью) электродов и рычажки могут потребовать , чтобы очищать чаще , чтобы предотвратить перекрестное загрязнение и образец уноса.- Выключите выключатель питания прибора CE и откройте переднюю дверцу.
- Очистите поверхность крышки образца, образца, проведение системы (образец и буферные лотки), крышку картриджа, струбцину, блок интерфейса и электроды с водой смоченную нетканый салфеткой. Повторите эту процедуру с этанолом, смоченную протирать и сухой перед использованием.
- Промыть рычажки тщательно промыть водой. Очистите их поверхность с нетканым салфеткой. Повторите эту процедуру с этанолом, смоченную протирать и сухой перед установкой.
- Очистите два конца волоконно-оптического кабеля тщательногоLY с водой смоченную ткань из микроволокна. Повторите эту процедуру с этанолом смоченной тканью.
- Картриджем.
- Удалите новый нейтральный капилляра (внутренний диаметр 50 мкм) из упаковки.
- Лента вниз один конец капиллярной защитной трубки к верстаке. Размотать, выпрямите и вытяните капиллярную трубку из трубки.
- Придерживайтесь кусок ленты или бумаги на верстаке и добавить метки измерений следующим образом : отношение длины к детектору (30 см), капиллярный окна (0,2 см) и длиной до выпускного конца (10 см) (то есть, общая 40,2 см длины, 30.0 см эффективная длина).
- Совместите окно капиллярную до отметки измерения 0,2 см в справочном документе. Закрепите капилляр с лентой и отметьте капиллярная Счет 2 мм за пределами отметок измерения.
- Вырезать защитный колпачок на капиллярную входном конце (конец самый дальний от окна) в одном прямом движении, используя флеш край раскалывания камня.
- Погрузить конец капилляра с колпачком универсальном флакон, наполненный водой, чтобы избежать постоянного повреждения капиллярной внутреннего покрытия. Повторите эту процедуру каждый раз, когда капиллярная конец подвергается воздействию окружающей среды в течение более 1 мин.
- Вставьте капиллярную впускной конец в выпускной стороне картриджа.
- Тяговое и толкающее капилляр через картридж по мере необходимости, пока окно капиллярного не по центру к окну картриджа.
- Вставьте штекер диафрагмы (100 мкм × 200 мкм) в окно картриджа.
Примечание: Убедитесь, что белый свет проходит через окно, когда подвергается воздействию источника белого света. Если свет, который проходит через имеет коричневатый внешний вид, при необходимости отрегулировать. - Вставьте капилляр в предварительно сформированной трубки охлаждающей жидкости для общей длины капилляра 40,2 см (с предварительно установленной трубной гайкой, зачищены и уплотнительное кольцо на обоих концах в таком порядке).
- Вставьте капилляр через coolanт трубы по мере необходимости, до тех пор, пока не появится капиллярная на другой стороне трубки.
- Вставьте конец трубки охлаждающей жидкости в выпускной стороне картриджа и затяните гайку трубки.
- Вставьте капиллярную впускной конец в впускной стороне картриджа.
- Тяговое и толкающее капилляр через картридж по мере необходимости до тех пор, пока не появится капиллярная на впускной стороне картриджа.
- Вставьте конец трубки охлаждающей жидкости во впускной стороне картриджа и затянуть гайку трубки.
- Обрежьте защитный колпачок на выходном конце капиллярного (конец, ближайший из окна) в одном прямом движении с использованием промывочного край раскалывания камня.
- Вставьте SEAL-фиксатор закрепляет над концами капилляра и нажмите огрызаться в нужное положение. Осмотреть капиллярная заканчивается. Если они не являются даже, повторите процедуру.
- Поместите шаблон капиллярная длины на краю верстака.
- Поместите картридж направлен вниз AGainst шаблон капиллярная длины и выровнять капиллярная концы с опорными линиями на шаблоне. Если метки измерения капиллярного (см 3.2.4) не совпадают с эталонными линиями, при необходимости отрегулировать.
- Держа капилляр против шаблона капиллярная длины и отрежьте оба конца капилляра с помощью промывочного края отщеплением камень 2 мм ниже опорных линий на шаблоне.
- Осмотреть концами капилляра с увеличительным стеклом. Если капиллярные концы не являются гладкими, полировать их с помощью мягкого лица раскалывания камня.
- Вставьте диафрагму уплотнительное кольцо в отверстие сливное отверстие с помощью инструмента вставки уплотнительного кольца.
- Установить блокированы универсальные флаконы, наполненные водой в корпусе картриджа и поместите картридж в корпус сразу с концами капилляра, вставленных во флаконы. Для краткосрочного и долгосрочного хранения хранить при температуре 2-8 ° C.
- Приготовление буферных лотков.
- Заполнить и разместить блокированы UniversAl ампул в входе буфера и лотки на выходе (рисунок 1). Повторите ампула позиции на дорожках 2, 3, 4 и 5 в соответствии с количеством анализируемых образцов, помещая одну полосу на каждые шесть инъекций образцов.
Примечание: Во избежание смачивания флакона колпачки, чтобы предотвратить утечку тока.
- Заполнить и разместить блокированы UniversAl ампул в входе буфера и лотки на выходе (рисунок 1). Повторите ампула позиции на дорожках 2, 3, 4 и 5 в соответствии с количеством анализируемых образцов, помещая одну полосу на каждые шесть инъекций образцов.
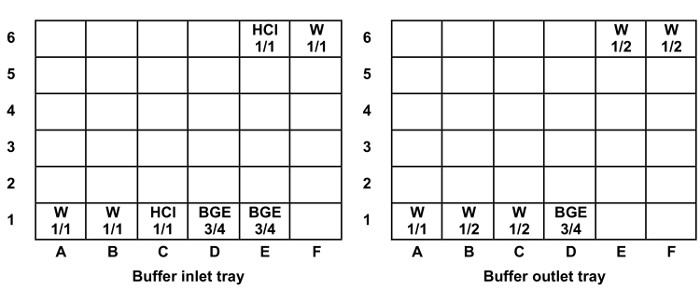
Рисунок 1: Положение и уровень заполнения универсальных флаконов во впускной и выпускной буфер лотков. Заполните уровни: 1/1 = 1400 мкл, 3/4 = 1300 мкл и 1/2 = 1000 мкл. Сокращения: W = вода, HCl = 0,1 М соляной кислоты. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Система CE сборки компонентов.
- Установите УФ-детектора.
- Установите рычажкинажатием вверх в блок интерфейса.
- Установите волоконно-оптический кабель. Вставьте соответствующий конец панели зажима и, удерживая оба конца, вращаются по часовой стрелке. Подключите другой конец к УФ-детектора.
ПРИМЕЧАНИЕ: Обращайтесь с волоконно-оптический кабель с осторожностью во время этой процедуры, поскольку изгиб может привести к ее поломке. - Поместите образец и буферные лотки в систему фиксации образцов и оснастки в рабочее положение.
- Поместите капиллярную картридж в блок интерфейса и, одновременно нажимая планку фиксатора на обоих концах, затяните ручки.
4. Методы набора инструментов вверх
- Создайте систему кондиционирования, бег и методы выключения прибора в соответствии со следующими параметрами и в таблице 1: Напряжение, макс: 30,0 кВ; Ток, макс: 300,0 мкА; Температура картриджа: 20,0 ° C; Температура хранения образца: 10,0 ° C; УФ-детектор начальных условий: Длина волны: 214 нм; Скорость передачи данных: 4 Гц; Фильтр: Нормальный; Пиковая ширина (точек): 16-25; Абсорбция сигнала: Прямая.
Примечание: скорость сбора данных может быть увеличена до 25 Гц, с тем чтобы улучшить охват узких зон отрыва.
| Кондиционер Программа временной метод | |||||||
| Время (мин) | Мероприятие | Стоимость | продолжительность | Впускной флакон | Выход флакон | Резюме | Комментарии |
| - | Полоскание - Давление | 2068 мбар | 1,0 мин | BI: C1 | BO: C1 | Вперед | HCl 0,1 М |
| - | Полоскание - Давление | 2068 мбар | 2,0 мин | BI: B1 | BO: C1 | Вперед | Вода |
| - | Полоскание - Давление | 2068 мбар | 10,0 мин | BI: E1 | BO: C1 | Вперед | BGE |
| 0.00 | Отдельный - Напряжение | 15,0 кВ | 10,0 мин | BI: D1 | BO: D1 | 0.17 Мин пандус, нормальная полярность | отдельный |
| 10.00 | Полоскание - Давление | 2758 мбар | 10,0 мин | BI: E1 | BO: C1 | Вперед | BGE |
| 20,01 | Подождите | - | 0.0 мин | BI: A1 | BO: A1 | - | Полоскание советы |
| Запуск программы времени метод | |||||||
| Время (мин) | Мероприятие | Стоимость | продолжительность | Впускной флакон | Выход флакон | Резюме | Комментарии |
| - | Полоскание - Давление | 2068 мбар | 1,0 мин | BI: C1 | BO: C1 | Вперед, In / Out Флакон вкл 6 | HCl 0,1 М |
| - | Полоскание - Давление | 2068 мбар | 2,0 мин | BI: B1 | BO: C1 | Вперед, In / Out Флакон вкл 6 | вода |
| - | Полоскание - Давление | 2068 мбар | 4.0 мин | BI: E1 | BO: C1 | Вперед, In / Out Флакон вкл 6 | BGE |
| - | Вводят - Давление | 34 мбар | 20,0 сек | SI: A1 | BO: B1 | Override, вперед | образец для инъекций |
| - | Подождите | - | 0,4 мин | BI: A1 | BO: A1 | In / Out флакона вкл 6 | советы Wash |
| 0 | Отдельный - Напряжение | 15,0 кВ | 30.0 мин | BI: D1 | BO: D1 | 0.17 Мин пандус, нормальная полярность, In / Out Флакон вкл 6 | Пример Разделение |
| 0,5 | Автонуль | - | - | - | - | - | - |
| 30,01 | Прекратить данные | - | - | - | - | - | - |
| 30.02 | Полоскание - Давление | 2068 мбар | 2,0 мин | BI: B1 | BO: C1 | Вперед, In / Out Флакон вкл 6 | вода |
| 32.03 | Подождите | - | 0.0 мин | BI: A1 | BO: A1 | In / Out флакона вкл 6 | Полоскание советы |
| 32.04 | Конец | - | - | - | - | - | Конец |
| Завершение работы программы временной метод | |||||||
| Время (мин) | Мероприятие | Стоимость | продолжительность | Впускной флакон | Выход флакон | Резюме | Комментарии |
| - | Полоскание - Давление | 2068 мбар | 1,0 мин | BI: E6 | BO: E6 | Вперед | HCl 0,1 М |
| - | Полоскание - Давление | 2068 мбар | 6,0 мин | BI: F6 | BO: F6 | Вперед | вода |
| - | Лампа - Выкл | - | - | - | - | - | - |
| - | Подождите | - | 0.0 мин | BI: A1 | BO: A1 | - | Полоскание советы |
Таблица 1: Кондиционирование, бег и программы времени выключения.
5. Получение и обработка данных
- Программирование установленного образца.
- Программирование капилляр для кондиционирования с использованием метода кондиционирования прибора. Когда капиллярный используется в первый раз, программа повторили четыре раза; в противном случае запрограммировать только два повторения метода кондиционирования.
- Запрограммируйте образцы должны быть проанализированы с помощью бегущего метода прибора.
- Программирование капилляр для хранения с использованием метода инструмента выключения и повторите процедуру, указанную в разделе 3.2.22.
- Запустите эксперимент.
- Экспорт электрофореграммы.
- Рассчитайте время миграции и процентное содержание основного, главного ай кислые изоформы с использованием вертикальной интеграции капли линии профиля electropherogram.
Результаты
На рисунке 2 представлен типичный электрический ток профиль 200 мМ EACA, 30 мМ ацетата лития, рН 4,8 BGE с анти-TNF - alpha мАт образца , разбавленного раствора трис - буфера (50 мМ, рН 8,0). Как можно заметить, ток стабилен в течение всего анализа и может колебаться между значени...
Обсуждение
В этом уроке, мы подчеркиваем важность надлежащей практики при проведении CZE анализа моноклональных антител, с тем чтобы повысить вероятность добиться успеха. Однако, когда CZE используется на регулярной основе, вопросы неизбежно возникают 12.
Для достижения наилуч?...
Раскрытие информации
The authors Carlos E. Espinosa-de la Garza, Rodolfo D. Salazar-Flores, Néstor O. Pérez, Luis F. Flores-Ortiz and Emilio Medina-Rivero are employees of Probiomed S.A. de C.V., which is developing, manufacturing and marketing biosimilar products. All authors are involved in the development of biosimilar products for Probiomed.
Благодарности
The authors thank Wiley for the granted permission to use the concepts of the following publication for this tutorial. Carlos E. Espinosa-de la Garza, Francisco C. Perdomo-Abúndez, Jesús Padilla-Calderón, Jaime M. Uribe-Wiechers, Néstor O. Pérez, Luis F. Flores-Ortiz, Emilio Medina-Rivero: Analysis of recombinant monoclonal antibodies by capillary zone electrophoresis. Electrophoresis. 2013. 34. 1133-1140. Copyright Wiley-VCH Verlag GmbH & Co. KGaA. This work was supported by CONACyT, Mexico, grant 230551.
Материалы
| Name | Company | Catalog Number | Comments |
| Glacial acetic acid | Tecsiquim | AT0035-7 | |
| ACS grade hydrochloric acid | J.T. Baker | 9535-05 | |
| Histamine dihydrochloride | Fluka | 53300 | |
| (Hydroxypropyl) methyl cellulose | Fluka | 09963 | |
| Lithium acetate | Sigma-Aldrich | 517992 | |
| 6-Aminocaproic acid | Sigma-Aldrich | A2504 | |
| eCAP Tris Buffer, 50.0 mM, pH 8 | Beckman Coulter | 477427 | |
| PA 800 Plus Pharmaceutical Analysis System | Beckman Coulter | A66528 | |
| eCAP Neutral capillary | Beckman Coulter | 477441 | |
| Vial, Micro, 200 µl | Beckman Coulter | 144709 | |
| Universal Vial Caps | Beckman Coulter | A62250 | |
| Universal Vials | Beckman Coulter | A62251 | |
| Cable, Optics, UV/Vis | Beckman Coulter | 144093 | |
| UV/Vis Detector Module | Beckman Coulter | 144733 | |
| Cartridge Assembly Kit, Blank | Beckman Coulter | 144738 |
Ссылки
- Bruno, V., Battaglia, G., Nicoletti, F. The advent of monoclonal antibodies in the treatment of chronic autoimmune diseases. Neurol. Sci. 31, 283-288 (2011).
- Liu, H., Gaza-Bulseco, G., Faldu, D., Chumsae, C., Sun, J. Heterogeneity of monoclonal antibodies. J. Pharm. Sci. 97 (7), 2426-2447 (2008).
- Creamer, J. S., Oborny, N. J., Lunte, S. M. Recent advances in the analysis of therapeutic proteins by capillary and microchip electrophoresis. Anal. Methods. 6 (15), 5427-5449 (2014).
- Fekete, S., Guillarme, D., Sandra, P., Sandra, K. Chromatographic, Electrophoretic, and Mass Spectrometric Methods for the Analytical Characterization of Protein Biopharmaceuticals. Anal. Chem. 88 (1), 480-507 (2016).
- He, Y., et al. Analysis of identity, charge variants, and disulfide isomers of monoclonal antibodies with capillary zone electrophoresis in an uncoated capillary column. Anal. Chem. 82 (8), 3222-3230 (2010).
- He, Y., Isele, C., Hu, W., Ruesch, M. Rapid analysis of charge variants of monoclonal antibodies with capillary zone electrophoresis in dynamically coated fused-silica capillary. J. Sep. Sci. 34 (5), 548-555 (2011).
- Zhao, S. S., Chen, D. D. Y. Applications of capillary electrophoresis in characterizing recombinant protein therapeutics. Electrophoresis. 35 (1), 96-108 (2014).
- Štěpánová, S., Kašička, V. Determination of impurities and counterions of pharmaceuticals by capillary electromigration methods. J. Sep. Sci. 37 (15), 2039-2055 (2014).
- Štěpánová, S., Kašička, V. Recent applications of capillary electromigration methods to separation and analysis of proteins. Anal. Chim. Acta. 933, 23-42 (2016).
- Espinosa-de la Garza, C. E., et al. Analysis of recombinant monoclonal antibodies by capillary zone electrophoresis. Electrophoresis. 34 (8), 1133-1140 (2013).
- Staub, A., Guillarme, D., Schappler, J., Veuthey, J. L., Rudaz, S. Intact protein analysis in the biopharmaceutical field. J. Pharm. Biomed. Anal. 55 (4), 810-822 (2011).
- Altria, K. D., Altria, K. D. Troubleshooting. Methods in Molecular Biology, Vol 52. Capillary Electrophoresis Guidebook: Principles, Operation and Applications. , (1996).
- Ma, S., Nashabeh, W. Analysis of protein therapeutics by capillary electrophoresis. Chromatographia. 53 (5), 75-89 (2001).
- Jaccoulet, E., Smadja, C., Prognon, P., Taverna, M. Capillary electrophoresis for rapid identification of monoclonal antibodies for routine application in hospital. Electrophoresis. 36 (17), 2050-2056 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены