Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Nötr Kılcal kullanılarak monoklonal antikor izoformlannın Kapiler Elektroforez Ayırma
Bu Makalede
Özet
Here, we present a comprehensive capillary zone electrophoresis protocol for the assessment of intrinsic physicochemical heterogeneity of monoclonal antibodies as a quality attribute.
Özet
Biotherapeutic proteins, such as monoclonal antibodies (mAbs), are feasible alternatives for the treatment of chronic-degenerative diseases. The biological activity of these proteins depends on their physicochemical properties. The use of high-performance techniques like chromatography and capillary electrophoresis has been described for the analysis of physicochemical heterogeneity of mAbs. Nowadays, capillary zone electrophoresis (CZE) technique constitutes one of the most resolutive and sensitive assays for the analysis of biomolecules. Besides, the electro-driven separation in CZE is governed by extensive properties of matter and offers the advantage of analyzing proteins close to their native state. However, the successful implementation of this technique for routine analysis depends on the skills of the analyst at the critical steps during sample and system preparation. The purpose of this tutorial is to detail the steps to succeed in the CZE analysis of mAbs. Further, this protocol can be used for the development and improvement of skills of the personnel involved in protein analytical chemistry laboratories.
Giriş
Monoklonal antikorlar (mAbs) nedeniyle pek çok kronik ve dejeneratif hastalıklar 1'e karşı hareket etme kapasitesine artan ilgi ile biyoterapötik proteinlerdir. Diğer biyomoleküllerin gibi, mAb'ler (nihai ürüne biyosentezi dan yani) kendi yaşam döngüsünün tüm aşamalarında çeşitli fizikokimyasal değişiklikler geçmesi yatkındır. Bu modifikasyonlar arasında, ancak bunlarla sınırlı değildir: deamidasyon, glikosilasyon, oksidasyon, siklizasyon, izomerizasyon, agregasyon ve proteolitik bölünme 2. Bu nedenle, içsel izoformları çözmek için yetenekli analitik teknikler kalite spesifikasyonları kurmak için mAb'ler heterojenliği ve istikrarı izlemek için ihtiyaç vardır.
Kapiller elektroforez (CE), bir arka plan elektrolit (BGE) ile doldurulmuş dar kaynaşık silika borusu (um aralığında) outinside taşınan yüksek performanslı ayırma teknolojisidir. Bir elektrik alanının uygulanmasıyla, yüklü molekülün (30,000 V kadar)s ters ücret (yani, elektro-odaklı ayırma) ile elektroda doğru göç ederler. CE yüksek gerilim kullanılması klasik jel elektroforezi üstündür hızlı analiz ve verimlilik artışı, izin verir. Kılcal bölge elektroforezi (CZE), rutin olarak, ürün kalitesi değerlendirmesi 3-9 için, ilaç endüstrisinin kullanılan CE bazlı bir tekniktir. CE diğer modları (ör kapiler jel elektroforezi, kapiller izoelektrik odaklama) ya da kromatografisi bazlı yöntemlerden farklı olarak, CZE kendi doğal yapısında 10 yakın mAb'lerin doğasında heterojenite analizini sağlayarak, denatüranlar veya katı faz arayüzleri kullanılmadan yapılabilir . MAb izoformlarının CZE ayrılması bir hidrofilik polimer (nötr kılcal) ile kaplanmış bir kaynaşık silika kılcal içinde oluşur ve yük, kitle, boyut ve şekil (ya da hidrodinamik hacmi) 11 tarafından yönetilir farklı elektroforetik hareketlilik dayanır. mAb parçaları zaman tespit edilirde harekete ve 214 nm'de 4 bir ultraviyole (UV) absorbansı detektörü tarafından algılanan algılama penceresinin geçmesine edilir.
Bu analitik tekniğin başarılı bir şekilde uygulanması öncesi ve deney sırasında detaylara uygun dikkat bağlıdır. sonuçta sürekli başarısızlık ve hayal kırıklığı yol açan, analiz yapmak için maliyet ve zaman artacak, aksi takdirde Oyunculuk.
Burada, çözümleri ve örnekler, CE sistemi kurmak enstrüman yöntemleri, veri toplama hazırlanması hazırlanması detaylı açıklamaları ile CZE tarafından mAb heterojenite başarılı bir analizini yapmak için bir adım-adım kılavuz sunmak ve işlem. Bu dokümanın amacı, bir yeniden birleştirici tam olarak insan anti-tümör nekroz faktörü alfa (anti-TNFa) mAb proteini modeli olarak kullanılır; Ancak, bu protokol kolayca kısa değişiklikler göz önüne alınarak diğer proteinlerin analizi için özelleştirilebilir. birdditionally, çeşitli öneriler potansiyel sorunlar önerilmiştir hafifletmek için. okuyucu kesinlikle artacaktır başarılı olasılık olarak, önerilen protokol takip etmek teşvik edilmektedir.
Protokol
Çözümler 1. hazırlanması
- BGE çözüm hazırlayın.
- % 0.05 oluşan bir çözelti 100 ml hazırlanması (kütle / hacim) hidroksi propil metil selüloz (HPMC), 200 mM ε-amino, n-kaproik asit (EACA) ve 30 mM lityum asetat.
Not: HPMC viskoelastik bir polimer olduğu için, bir cam beher içine toz dökün su 80 ml ilave edilir ve son olarak da karıştırma çubuğu ilave edin. normalde kalan reaktif eklemeye devam edin. o göz tahrişine neden olabilir lityum asetat işlerken güvenlik gözlükleri takın. - % 50 (hac / hac) asetik asit ile 4.8 ± 0.1 pH değerine ayarlar. Çözelti 5 dakika için stabilize etmek ve gerekli ayarlamak için izin ver.
- volümetrik bir şişede 100 ml'lik nihai hacme kadar telafi etmek için su ilave edilir.
- 0.2 um'lik bir gözenek büyüklüğüne sahip bir hidrofilik zardan geçirerek filtre et.
- 7 güne kadar 2-8 ° C'de saklayın.
- % 0.05 oluşan bir çözelti 100 ml hazırlanması (kütle / hacim) hidroksi propil metil selüloz (HPMC), 200 mM ε-amino, n-kaproik asit (EACA) ve 30 mM lityum asetat.
- Iç standart hazırlayın.
- 1 mL hazırlayın% 1 (m / v) histamin oluşan bir çözelti.
- 0.2 um'lik bir gözenek büyüklüğüne sahip bir hidrofilik zardan geçirerek filtre et.
- kadar 1 gün 2-8 ° C'de saklayın.
2. Numune Hazırlama
- 1 mg / ml'lik nihai bir konsantrasyona kadar Tris tamponu (50 mM tris (hidroksimetil) aminometan pH 8.0) ile seyreltildi mAb örnek 180 ul hazırlayın.
- % 1 (m / v) histamin 20 ul ekle.
- Mix ve 5 saniye boyunca 1.000 xg'de santrifüj.
- evrensel bir şişe içinde bir mikro şişe yerleştirin.
- Mikro şişenin içine örnek aktarmak ve evrensel şişe kapağı. Herhangi kabarcıkları tanıtan önlemek için yukarı doğru örnek dağıtın.
- kadar 1 gün 2-8 ° C'de saklayın.
- Numune giriş tepsisine (örnek çözeltisi içeren flakon mikro) ile evrensel flakon yerleştirin.
CE sistemi 3. hazırlanması.
- CE sistem temizleme.
NOT: Davranış inciToz ve döküntü birikiminin elde edilen elektrik akımı sızıntısını önlemek için en az bir kez bir hafta işlemdir. Bununla birlikte uygulamaya bağlı olarak (örneğin, artan viskozitesi ile ya da yüksek tuz konsantrasyonu, artan viskozitesi ile örnekleri ile BGE kullanılması) elektrot ve açma kolu çapraz kontaminasyonu ve örnek taşınmasını önlemek için daha sık temizlenmesi gerekebilir.- CE cihazının güç düğmesini kapatın ve ön kapağı açın.
- suya batırılmış dokunmamış silme ile, örnek tutan sistemi (örnek ve tampon tepsiler), kartuş kapağını, kelepçe bar, arayüz bloğu ve elektrotları numune örtüsünün yüzeyini temizleyin. ile işlemi tekrarlayın bir etanol-nemlendirilmiş silin ve kullanımdan önce kuru.
- su ile iyice açarak kollarını durulayın. bir dokunmamış silme ile yüzeyini temizleyin. ile işlemi tekrarlayın bir etanol-nemlendirilmiş silme ve kurulumdan önce kuru.
- Dikkatli bir fiber optik kablonun iki ucu temizlemesuyla nemlendirilmiş mikrofiber bezle ly. Etanol-nemlendirilmiş bir bezle işlemi tekrarlayın.
- Kartuş montaj.
- paketinden yeni bir nötr kılcal (50 mikron iç çapı) çıkarın.
- Teyp tezgah kılcal koruyucu boru bir ucunda aşağı. , Uncoil düzeltmek ve tüp dışarı kılcal çekin.
- Tezgahında için bant veya bir kağıt parçası sopa ve aşağıda ölçüm işaretleri ekleyin: uzunluk detektörü (30 cm), çıkış ucuna kılcal penceresi (0.2 cm) uzunlukta (10 sm) (yani, 40.2 cm toplam uzunluğu, 30.0 cm efektif uzunluk).
- Referans kağıt 0.2 cm ölçüm işaretine kılcal penceresini hizalayın. bant ile kılcal düzeltmek ve kılcal ölçüm işaretleri dışında 2 mm biter işaretleyin.
- yarma taş floş kenarını kullanarak tek bir düz harekette kılcal giriş ucunda koruyucu kapağı (penceresinden uç uzak) kesin.
- kılcal iç kaplama kalıcı hasarı önlemek için su ile dolu bir kapaklı evrensel şişenin içine kılcal ucunu bırakın. Bu işlemi kapiler ucu fazla 1 dakika için çevre sıcaklığında maruz her tekrarlayın.
- kartuşun çıkış tarafına kılcal giriş ucunu.
- Itin ve kılcal cam kartuş penceresine merkezli dek gerektiği gibi kartuşun içinden kılcal çekin.
- Kartuş penceresine açıklığı tıpasını (100 mm x 200 mm) yerleştirin.
NOT: ışık beyaz kaynağına maruz kaldığında beyaz ışık pencereden geçtiğini onaylayın. geçer ışık kahverengimsi bir görünüm varsa, gerektiği gibi ayarlayın. - (Bu sırayla her iki uçta önceden yüklenmiş boru somun, halkalı ve O-ring ile birlikte), 40.2 cm toplam kapiler uzunluğu önceden oluşturulmuş soğutucu tüp içine kılcal yerleştirin.
- TİKSİNTİ boyunca kılcal itinKılcal boru diğer tarafında görünür kadar gerekli T boru.
- kartuşun çıkış tarafına soğutucu boru ucunu ve boru somunu sıkın.
- kartuşun giriş tarafına kılcal giriş ucunu.
- Itin ve kılcal kartuşun giriş tarafında görünene kadar gerektiği gibi kartuşun içinden kılcal çekin.
- kartuşun giriş tarafına soğutucu boru ucunu ve boru somunu sıkın.
- yarma taş floş kenarını kullanarak tek bir düz harekette kılcal çıkış ucunda (pencerenin en yakın sonu) koruyucu kapağı kesin.
- kılcal uçlarına üzerinde mühür-tutma klipleri yerleştirin ve yerine oturtun için düğmesine basın. Görme kılcal biter kontrol edin. onlar bile değilse, işlemi tekrarlayın.
- tezgah kenarında kılcal uzunluğu şablonu yerleştirin.
- ag aşağı bakacak şekilde yerleştirin kartuşkılcal uzunluğu şablonu ainst ve kılcal şablona referans çizgileri ile biter hizalayın. kılcal ölçüm işaretleri (3.2.4) referans çizgileri aynı hizada değilse, gerektiği gibi ayarlayın.
- kılcal uzunluğu şablonuna karşı kılcal tutun ve şablona referans çizgileri altında yaran taş 2 mm floş kenarını kullanarak kılcal her iki ucunu kesti.
- Görme kılcal büyüteçle biter kontrol edin. kılcal uçları düzgün değilse, yarma taş yumuşak yüzünü kullanarak bunları cilalamak.
- O-ring yerleştirme aracını kullanarak açıklığı tıpası deliğe diyafram O-ring takın.
- şişelere sokulan kılcal uçları hemen kasanın içine kartuş durumda ve yer kartuşu içine su dolu şapkalı evrensel şişeleri takın. Kısa ve uzun süreli depolama için 2-8 ° C'de tutun.
- Tampon tepsileri hazırlanması.
- Dolgu ve şapkalı univers yertampon girişinde el flakon ve çıkış tepsileri (Şekil 1). örneklerin sayısı ile uygun şerit 2, 3, 4 ve 5'te tekrar şişe pozisyonları altı numune enjeksiyon için bir şerit yerleştirme analiz edilecek.
NOT: Mevcut sızıntısını önlemek için flakon kapaklar ıslatma kaçının.
- Dolgu ve şapkalı univers yertampon girişinde el flakon ve çıkış tepsileri (Şekil 1). örneklerin sayısı ile uygun şerit 2, 3, 4 ve 5'te tekrar şişe pozisyonları altı numune enjeksiyon için bir şerit yerleştirme analiz edilecek.
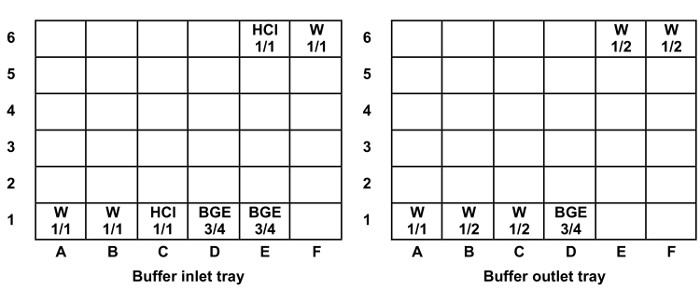
Şekil 1: Pozisyon ve tampon giriş ve çıkış tepsileri evrensel şişeleri düzeyini doldurun. seviyeleri doldurun: 1/1 = 1.400 uL, 3/4 = 1300 uL ve 1/2 = 1000 mcL. Kısaltmalar: B = su, HCI = 0.1 M hidroklorik asit. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- CE sistem bileşenleri montajı.
- UV detektör takın.
- açılış kollarını yükleyinarayüz bloğu içine basarak.
- Fiber optik kabloyu takın. her iki ucu tutarken, saat yönünde döndürmek kelepçe çubuğuna karşılık gelen ucunu ve. UV dedektör diğer ucunu.
NOT: onun kırılmasına neden olabilir bükme beri bu işlem sırasında dikkatli fiber optik kabloyu tutun. - Yeri örnek ve örnek tutma sistemi içine tampon tepsiler ve pozisyona oturtun.
- iki ucunda kelepçe çubuğunu basarken kolları sıkın, arayüz bloğu içine kılcal kartuşunu yerleştirin ve.
4. Enstrüman Yöntemleri Set-up
- Gerilim, maksimum: Aşağıdaki parametreler ve Tablo 1'den göre, klima oluşturma çalışan ve kapatma enstrüman yöntemleri 30.0 kV; Güncel, max: 300.0 uA; Kartuş sıcaklığı: 20.0 ° C; Numune depolama sıcaklığı: 10.0 ° C; UV detektörü başlangıç şartları: Dalga boyu: 214 nm; Veri hızı: 4 Hz; Filtre: Normal; Tepe genişliği () Işaret eder: 16-25; Absorbans sinyali: Doğrudan.
NOT: Veri toplama oranı dar ayırma bölgelerinin kapsamını iyileştirmek amacıyla 25 Hz kadar artırılabilir.
| Klima yöntemi zaman programı | |||||||
| Süresi (dak) | Olay | değer | süre | giriş şişe | çıkış flakon | özet | Yorumlar |
| - | Durulama - Basınç | 2068 mbar | 1.0 dakika | BI: C1 | BO: C1 | ileri | HCI, 0.1 M |
| - | Durulama - Basınç | 2068 mbar | 2.0 dakika | BI: B1 | BO: C1 | ileri | Su |
| - | Durulama - Basınç | 2068 mbar | 10.0 dakika | BI: E1 | BO: C1 | ileri | BGE |
| 0.00 | Ayrı - Gerilim | 15.0 KV | 10.0 dakika | BI: D1 | BO: D1 | 0.17 Min rampa, normal polarite | Ayrı |
| 10.00 | Durulama - Basınç | 2758 mbar | 10.0 dakika | BI: E1 | BO: C1 | ileri | BGE |
| 20.01 | Bekleyin | - | 0.0 dakika | BI: A1 | BO: A1 | - | durulayın ipuçları |
| yöntem zaman programı çalıştıran | |||||||
| Süresi (dak) | Olay | değer | süre | giriş şişe | Çıkış flakon | özet | Yorumlar |
| - | Durulama - Basınç | 2068 mbar | 1.0 dakika | BI: C1 | BO: C1 | İleri, In / Out şişe inc 6 | HCI, 0.1 M |
| - | Durulama - Basınç | 2068 mbar | 2.0 dakika | BI: B1 | BO: C1 | İleri, In / Out şişe inc 6 | Su |
| - | Durulama - Basınç | 2068 mbar | 4.0 dakika | BI: E1 | BO: C1 | İleri, In / Out şişe inc 6 | BGE |
| - | Enjekte - Basınç | 34 mbar | 20.0 sn | SI: A1 | BO: B1 | İleri, geçersiz kıl | örnek Enjeksiyon |
| - | Bekleyin | - | 0.4 dakika | BI: A1 | BÖA1 | In / Out flakon inc 6 | yıkama ipuçları |
| 0 | Ayrı - Gerilim | 15.0 KV | 30.0 dakika | BI: D1 | BO: D1 | 0.17 Min rampa, normal polarite, In / Out şişe inc 6 | örnek Ayırma |
| 0.5 | otomatik sıfır | - | - | - | - | - | - |
| 30.01 | verileri Dur | - | - | - | - | - | - |
| 30.02 | Durulama - Basınç | 2068 mbar | 2.0 dakika | BI: B1 | BO: C1 | İleri, In / Out şişe inc 6 | Su |
| 32.03 | Bekleyin | - | 0.0 dakika | BI: A1 | BO: A1 | In / Out flakon inc 6 | durulayın ipuçları |
| 32.04 | Son | - | - | - | - | - | Son |
| Kapatma yöntemi zaman programı | |||||||
| Süresi (dak) | Olay | değer | süre | giriş şişe | çıkış flakon | özet | Yorumlar |
| - | Durulama - Basınç | 2068 mbar | 1.0 dakika | BI: E6 | BO: E6 | ileri | HCI, 0.1 M |
| - | Durulama - Basınç | 2068 mbar | 6.0 dakika | BI: F6 | BO: F6 | ileri | Su |
| - | Lamba - Kapalı | - | - | - | - | - | - |
| - | Bekleyin | - | 0.0 dakika | BI: A1 | BO: A1 | - | durulayın ipuçları |
Tablo 1: Klima, koşu ve kapatma zamanı programları.
5. Veri Toplama ve İşleme
- Örnek kümesi programlayın.
- Klima cihazı yöntemini kullanarak klima için kılcal Program. Kılcal ilk kez kullanıldığında, program, dört tekrarlar; Aksi takdirde şartlandırma yöntemini sadece iki tekrarlar programlayın.
- çalışan alet yöntemi kullanılarak analiz edilecek numune Program.
- kapatma enstrüman yöntemini kullanarak depolama kılcal programlamak ve bölüm 3.2.22 belirtilen işlemi tekrarlayın.
- deneme çalıştırın.
- elekroferogramlar ihracat.
- göç zamanı ve temel, ana a yüzdesi içeriğini hesaplamakElektroferogram profilinin dikey düşüş çizgisi entegrasyonu kullanarak nd asidik izoformlar.
Sonuçlar
Şekil 2, bir 200 mM EACA, 30 mM lityum asetat, tipik bir elektrik akımı profilini gösterir, Tris tamponu (50 mM, pH 8.0) ile seyreltildi, anti-TNFa mAb, örnek ile pH 4.8 BGE. Görüldüğü gibi, mevcut analiz boyunca stabil olduğu ve 30 ila 35 uA değerleri arasında salınım yapabilir. Tespit edilen pik histamin iç standart karşılık geldiği Şekil 3 boş numunenin CZE Elektroferogram gösterir. 3.7 4.1 dakikalık bir göç vakit geçirmek h...
Tartışmalar
iletken CZE başarılı olasılığını artırmak için mAbs analizleri bu derste, uygun uygulamalarının önemini vurgulamak. CZE rutin olarak kullanılır, ancak, sorunlar kaçınılmaz olarak 12 ortaya çıkar.
En iyi sonuç için, onlar aşmak ve zor adımlar gidermek için analisti yardımcı olacak gibi, protokol boyunca dahil edildi notları takip etmek önemlidir. belirli bir koşullar kümesi optimum çözünürlüğü elde etmek üzere büyük bir göz BGE çözeltisi ...
Açıklamalar
The authors Carlos E. Espinosa-de la Garza, Rodolfo D. Salazar-Flores, Néstor O. Pérez, Luis F. Flores-Ortiz and Emilio Medina-Rivero are employees of Probiomed S.A. de C.V., which is developing, manufacturing and marketing biosimilar products. All authors are involved in the development of biosimilar products for Probiomed.
Teşekkürler
The authors thank Wiley for the granted permission to use the concepts of the following publication for this tutorial. Carlos E. Espinosa-de la Garza, Francisco C. Perdomo-Abúndez, Jesús Padilla-Calderón, Jaime M. Uribe-Wiechers, Néstor O. Pérez, Luis F. Flores-Ortiz, Emilio Medina-Rivero: Analysis of recombinant monoclonal antibodies by capillary zone electrophoresis. Electrophoresis. 2013. 34. 1133-1140. Copyright Wiley-VCH Verlag GmbH & Co. KGaA. This work was supported by CONACyT, Mexico, grant 230551.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Glacial acetic acid | Tecsiquim | AT0035-7 | |
| ACS grade hydrochloric acid | J.T. Baker | 9535-05 | |
| Histamine dihydrochloride | Fluka | 53300 | |
| (Hydroxypropyl) methyl cellulose | Fluka | 09963 | |
| Lithium acetate | Sigma-Aldrich | 517992 | |
| 6-Aminocaproic acid | Sigma-Aldrich | A2504 | |
| eCAP Tris Buffer, 50.0 mM, pH 8 | Beckman Coulter | 477427 | |
| PA 800 Plus Pharmaceutical Analysis System | Beckman Coulter | A66528 | |
| eCAP Neutral capillary | Beckman Coulter | 477441 | |
| Vial, Micro, 200 µl | Beckman Coulter | 144709 | |
| Universal Vial Caps | Beckman Coulter | A62250 | |
| Universal Vials | Beckman Coulter | A62251 | |
| Cable, Optics, UV/Vis | Beckman Coulter | 144093 | |
| UV/Vis Detector Module | Beckman Coulter | 144733 | |
| Cartridge Assembly Kit, Blank | Beckman Coulter | 144738 |
Referanslar
- Bruno, V., Battaglia, G., Nicoletti, F. The advent of monoclonal antibodies in the treatment of chronic autoimmune diseases. Neurol. Sci. 31, 283-288 (2011).
- Liu, H., Gaza-Bulseco, G., Faldu, D., Chumsae, C., Sun, J. Heterogeneity of monoclonal antibodies. J. Pharm. Sci. 97 (7), 2426-2447 (2008).
- Creamer, J. S., Oborny, N. J., Lunte, S. M. Recent advances in the analysis of therapeutic proteins by capillary and microchip electrophoresis. Anal. Methods. 6 (15), 5427-5449 (2014).
- Fekete, S., Guillarme, D., Sandra, P., Sandra, K. Chromatographic, Electrophoretic, and Mass Spectrometric Methods for the Analytical Characterization of Protein Biopharmaceuticals. Anal. Chem. 88 (1), 480-507 (2016).
- He, Y., et al. Analysis of identity, charge variants, and disulfide isomers of monoclonal antibodies with capillary zone electrophoresis in an uncoated capillary column. Anal. Chem. 82 (8), 3222-3230 (2010).
- He, Y., Isele, C., Hu, W., Ruesch, M. Rapid analysis of charge variants of monoclonal antibodies with capillary zone electrophoresis in dynamically coated fused-silica capillary. J. Sep. Sci. 34 (5), 548-555 (2011).
- Zhao, S. S., Chen, D. D. Y. Applications of capillary electrophoresis in characterizing recombinant protein therapeutics. Electrophoresis. 35 (1), 96-108 (2014).
- Štěpánová, S., Kašička, V. Determination of impurities and counterions of pharmaceuticals by capillary electromigration methods. J. Sep. Sci. 37 (15), 2039-2055 (2014).
- Štěpánová, S., Kašička, V. Recent applications of capillary electromigration methods to separation and analysis of proteins. Anal. Chim. Acta. 933, 23-42 (2016).
- Espinosa-de la Garza, C. E., et al. Analysis of recombinant monoclonal antibodies by capillary zone electrophoresis. Electrophoresis. 34 (8), 1133-1140 (2013).
- Staub, A., Guillarme, D., Schappler, J., Veuthey, J. L., Rudaz, S. Intact protein analysis in the biopharmaceutical field. J. Pharm. Biomed. Anal. 55 (4), 810-822 (2011).
- Altria, K. D., Altria, K. D. Troubleshooting. Methods in Molecular Biology, Vol 52. Capillary Electrophoresis Guidebook: Principles, Operation and Applications. , (1996).
- Ma, S., Nashabeh, W. Analysis of protein therapeutics by capillary electrophoresis. Chromatographia. 53 (5), 75-89 (2001).
- Jaccoulet, E., Smadja, C., Prognon, P., Taverna, M. Capillary electrophoresis for rapid identification of monoclonal antibodies for routine application in hospital. Electrophoresis. 36 (17), 2050-2056 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır