É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Electroforese Capilar Separação de Anticorpo Monoclonal isoformas utilizando um capilar de ponto morto
Neste Artigo
Resumo
Here, we present a comprehensive capillary zone electrophoresis protocol for the assessment of intrinsic physicochemical heterogeneity of monoclonal antibodies as a quality attribute.
Resumo
Biotherapeutic proteins, such as monoclonal antibodies (mAbs), are feasible alternatives for the treatment of chronic-degenerative diseases. The biological activity of these proteins depends on their physicochemical properties. The use of high-performance techniques like chromatography and capillary electrophoresis has been described for the analysis of physicochemical heterogeneity of mAbs. Nowadays, capillary zone electrophoresis (CZE) technique constitutes one of the most resolutive and sensitive assays for the analysis of biomolecules. Besides, the electro-driven separation in CZE is governed by extensive properties of matter and offers the advantage of analyzing proteins close to their native state. However, the successful implementation of this technique for routine analysis depends on the skills of the analyst at the critical steps during sample and system preparation. The purpose of this tutorial is to detail the steps to succeed in the CZE analysis of mAbs. Further, this protocol can be used for the development and improvement of skills of the personnel involved in protein analytical chemistry laboratories.
Introdução
Os anticorpos monoclonais (mAbs) são proteínas bioterapêuticos com crescente interesse devido à sua capacidade de agir contra várias doenças crónicas e degenerativas 1. Como outras biomoléculas, os mAbs são propensos a sofrer várias alterações físico-químicos em todas as fases do seu ciclo de vida (ou seja, a partir de biossíntese para o produto final). Tais modificações incluem, mas não estão limitados a: desamidação, glicosilação, oxidação, ciclização, isomerização, a agregação e a clivagem proteolítica 2. Assim, técnicas analíticas capazes de resolver isoformas intrínsecas são necessários para monitorar mAbs heterogeneidade e estabilidade a fim de estabelecer especificações de qualidade.
A electroforese capilar (CE) é uma tecnologia de separação de alta performance realizada outinside de um tubo de sílica fundida estreita (gama uM) cheio com um electrólito de fundo (BGE). Após a aplicação de um campo eléctrico (até 30.000 V), molécula carregadas migrar para o eletrodo com carga oposta (ie, separação orientada por electro). O uso de altas tensões no CE permite análises rápidas e uma maior eficiência, que são superiores a electroforese em gel clássica. Eletroforese capilar de zona (CZE) é uma técnica baseada CE rotineiramente utilizado na indústria biofarmacêutica para a avaliação da qualidade do produto 3-9. Ao contrário de outros modos de Ce (por exemplo, electroforese capilar em gel, isoeléctrica capilar de focagem) ou métodos baseados em cromatografia, CZE pode ser realizado sem a utilização de agentes desnaturantes ou interfaces de fase sólida, permitindo a análise da heterogeneidade inerente de mAbs próximo ao seu estado nativo 10 . CZE separação de isoformas de mAb ocorre dentro de um capilar de sílica fundida coberta com um polímero hidrofílico (capilar neutro) e baseia-se na sua mobilidade electroforética diferente, que é regida por carga, massa, tamanho e forma (ou volume hidrodinâmico) 11. porções de mAb são detectados quandoeles são mobilizadas e passe através da janela de detecção, que é detectada por um detector de ultravioleta (UV) a absorvância a 214 nm de 4.
O sucesso da implementação desta técnica analítica dependerá a devida atenção aos detalhes antes e durante o experimento. Agindo de outra forma vai aumentar o custo eo tempo para realizar a análise, levando a falha constante e frustração.
Aqui, apresentamos um guia passo-a-passo para realizar uma análise bem-sucedida de mAb heterogeneidade por CZE através da explicação detalhada sobre a preparação de soluções e amostras, a preparação do sistema CE, os métodos instrumento criado, a aquisição de dados e o processamento. Para o propósito deste tutorial, um factor alfa de necrose anti-tumoral totalmente humano recombinante (anti-TNF) é o mAb usado como modelo de proteína; no entanto, este protocolo pode ser facilmente customizado para a análise de outras proteínas considerando breves modificações. UMAdditionally, várias recomendações para mitigar possíveis problemas são propostos. O leitor é encorajado a seguir rigorosamente o protocolo proposto, como a probabilidade de sucesso irá aumentar.
Protocolo
1. Preparação de Soluções
- Preparar a solução BGE.
- Preparação de 100 ml de uma solução composta de 0,05% (m / v) de celulose hidroxi propil metil celulose (HPMC), 200 mM de ε amino-n-capróico ácido (EACA) e acetato de lítio 30 mM.
NOTA: Como HPMC é um polímero viscoelástico, despeje o pó para um copo de vidro, adicionar 80 ml de água e, finalmente, adicionar a barra de agitação. Continue a adicionar os restantes reagentes como normalmente. Use óculos de segurança ao manusear acetato de lítio, pois pode causar irritação nos olhos. - Ajustar o valor de pH para 4,8 ± 0,1 com 50% (v / v) de ácido acético. Permitir que a solução para estabilizar durante 5 min e ajustar se necessário.
- Adiciona-se água para perfazer a um volume final de 100 ml em balão volumétrico.
- Filtrar através de uma membrana hidrófila com um tamanho de poro de 0,2 um.
- Armazenar de 2-8 ° C por até 7 dias.
- Preparação de 100 ml de uma solução composta de 0,05% (m / v) de celulose hidroxi propil metil celulose (HPMC), 200 mM de ε amino-n-capróico ácido (EACA) e acetato de lítio 30 mM.
- Prepara-se o padrão interno.
- Prepare 1 mLde uma solução composta de 1% (m / v) de histamina.
- Filtrar através de uma membrana hidrófila com um tamanho de poro de 0,2 um.
- Armazenar de 2-8 ° C por até 1 dia.
Preparação 2. Amostra
- Preparar 180 ul de amostra de mAb diluído com tampão Tris (50 mM de Tris (hidroximetil) aminometano, pH 8,0) a uma concentração final de 1 mg / ml.
- Adicionar 20 ul de 1% (m / v) de histamina.
- Misturar e centrifugar a 1000 xg por 5 s.
- Coloque um micro frasco dentro de um frasco universal.
- Transferir a amostra para o micro frasco e tampa do frasco universal. Dispense a amostra para cima, a fim de evitar a introdução de bolhas.
- Armazenar de 2-8 ° C por até 1 dia.
- Colocar o frasco universal (com micro frasco contendo a solução de amostra) na bandeja de entrada da amostra.
3. Preparação do sistema CE.
- Limpeza do sistema CE.
NOTA: th Condutaé o procedimento, pelo menos, uma vez por semana, a fim de evitar a fuga de corrente eléctrica derivado de acumulação de poeira e detritos. No entanto, dependendo da aplicação (por exemplo, o uso de um BGE com o aumento da viscosidade ou com uma concentração elevada de sal, as amostras com o aumento da viscosidade) e eléctrodos alavanca de abertura pode necessitar de ser limpo mais frequentemente para evitar a contaminação cruzada e a mistura de amostras.- Desligue o interruptor de alimentação do instrumento CE e abra a porta da frente.
- Limpe a superfície da tampa da amostra, sistema de fixação da amostra (amostra e tampão bandejas), tampa do cartucho, bar braçadeira, bloco de interface e eletrodos com um não tecido umedecido em água limpe. Repita o procedimento com um limpe e seco antes do uso umedecido em etanol.
- Lavar as alavancas de abertura abundantemente com água. Limpar sua superfície com um tecido não tecido wipe. Repita o procedimento com um limpar e secar antes da instalação umedecido em etanol.
- Limpe as duas extremidades do cabo de fibra óptica cuidadoly com um pano de microfibra umedecido em água. Repita o procedimento com um pano umedecido em etanol.
- Do cartucho.
- Remover um novo capilar de ponto morto (50 um de diâmetro interno) da embalagem.
- Fita para baixo uma extremidade do tubo de proteção capilar para a bancada. Desenrolar, endireitar e puxar o capilar para fora do tubo.
- Cole um pedaço de fita adesiva ou papel para o ambiente de trabalho e adicionar marcas de medição como se segue: comprimento para o detector (30 cm), a janela capilar (0,2 cm) e o comprimento da extremidade de saída (10 cm) (isto é, comprimento 40,2 cm total 30,0 cm de comprimento eficaz).
- Alinhar janela de capilar para a marca de medição de 0,2 cm de papel de referência. Fixar o capilar com fita e marcar o capilar termina 2 mm fora as marcas de medição.
- Cortar a tampa de protecção na extremidade de entrada capilar (a extremidade mais afastada da janela) num movimento linear utilizando a extremidade de descarga da pedra de clivagem.
- Mergulha-se o final capilar para um frasco tapado universal enchido com água, a fim de evitar danos permanentes para o revestimento interior capilar. Repetir este procedimento cada vez que a extremidade capilar é exposto ao ambiente, durante mais de 1 minuto.
- Inserir a extremidade de entrada capilar para o lado de saída do cartucho.
- Empurrar e puxar o capilar através do cartucho conforme necessário até que a janela do capilar está centrada à janela do cartucho.
- Insira a ficha de abertura (100 mm x 200 mm) na janela do cartucho.
NOTA: Confirmar que a luz branca passa através da janela, quando expostos a uma fonte de luz branca. Se a luz que passa através tem um aspecto acastanhado, ajustar, conforme necessário. - Inserir o capilar para dentro do tubo pré-formado do líquido de arrefecimento para um comprimento total de 40,2 cm capilar (com a porca de tubagem pré-instalados, virola e o O-ring em ambas as extremidades nessa ordem).
- Empurrar o capilar através da coolantubo T, conforme necessário até que o capilar exibida no outro lado do tubo.
- Inserir a extremidade da tubagem de fluido de arrefecimento no lado da saída do cartucho e aperte a porca de tubagem.
- Inserir a extremidade de entrada capilar no lado de entrada do cartucho.
- Empurrar e puxar o capilar através do cartucho conforme necessário até que o capilar exibida no lado de entrada do cartucho.
- Inserir a extremidade do tubo de refrigerante no lado de entrada do cartucho e aperte a porca de tubagem.
- Cortar a tampa de protecção na extremidade de saída capilar (a extremidade mais próxima da janela) num movimento linear utilizando a extremidade de descarga da pedra de clivagem.
- Inserir os clipes de vedação-retentor sobre as extremidades capilares e pressione para encaixar na posição. Inspecione visualmente o capilar termina. Se eles não são ainda, repita o procedimento.
- Coloque o modelo capilar de comprimento na borda da bancada.
- Coloque o cartucho voltado para baixo against o molde capilar de comprimento e alinhar o capilar termina com as linhas de referência no modelo. Se as marcas de medição capilar (ver 3.2.4) não se alinham com as linhas de referência, ajustar conforme necessário.
- Segurar o capilar contra o molde capilar de comprimento e cortar ambas as extremidades do capilar utilizando a extremidade de descarga da clivagem de pedra 2 mm abaixo das linhas de referência no modelo.
- Inspecione visualmente o capilar termina com uma lupa. Se extremidades capilares não são suaves, polir-los usando o rosto suave da pedra clivagem.
- Insira a abertura O-ring no orifício da vela abertura usando a ferramenta de inserção O-ring.
- Instale frascos universais cobertas cheias de água no caso do cartucho eo cartucho lugar em caso imediatamente com extremidades capilares inseridos em frascos. Para armazenamento de curto e longo prazo manter a 2-8 ° C.
- Preparação de tampão de bandejas.
- Preencher e coloque univers tampadasfrascos de Al na entrada do tampão e os tabuleiros de saída (Figura 1). posições dos frascos de repetição em pistas 2, 3, 4 e 5, de acordo com o número de amostras a serem analisadas, colocando uma pista para cada seis injecções de amostra.
NOTA: Evite molhar as tampas dos frascos, a fim de evitar a fuga de corrente.
- Preencher e coloque univers tampadasfrascos de Al na entrada do tampão e os tabuleiros de saída (Figura 1). posições dos frascos de repetição em pistas 2, 3, 4 e 5, de acordo com o número de amostras a serem analisadas, colocando uma pista para cada seis injecções de amostra.
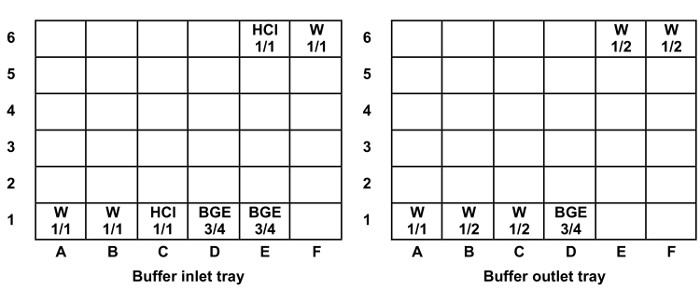
Figura 1: Posição e nível de enchimento de frascos universais nas bandejas de entrada e saída de buffer. Encha níveis: 1/1 = 1,400 mL, 3/4 = 1300 mL e 1000 mL = 1/2. Abreviaturas: W = água, HCl = ácido clorídrico 0,1 M. Por favor clique aqui para ver uma versão maior desta figura.
- Sistema CE montagem de componentes.
- Instalar o detector UV.
- Instalar a alavanca de aberturapressionando-se no bloco de interface.
- Instalar o cabo de fibra óptica. Insira a extremidade correspondente à barra de fixação e, mantendo ambas as extremidades, girar no sentido horário. Ligue a outra extremidade ao detector UV.
NOTA: Lidar com o cabo de fibra óptica com cuidado durante este procedimento desde flexão poderia causar sua fratura. - Colocar a amostra e as bandejas de buffer para o sistema de retenção de amostra e encaixe na posição.
- Coloque o cartucho capilar no bloco de interface e, enquanto pressiona a barra de fixação em ambas as extremidades, apertar os botões.
4. Métodos Instrumento Set-up
- Criar o condicionamento, correndo e métodos instrumento desligamento de acordo com os seguintes parâmetros e Tabela 1: Tensão, max: 30,0 kV; Corrente, máx: 300.0 mA; temperatura do cartucho: 20,0 ° C; temperatura de armazenamento da amostra: 10,0 ° C; Detector de UV condições iniciais: Comprimento de onda: 214 nm; Taxa de dados: 4 Hz; Filtro: Normal; largura do pico (pontos): 16-25; sinal de absorbância: Direct.
NOTA: taxa de aquisição de dados pode ser aumentada até 25 Hz, a fim de melhorar a cobertura das zonas de separação estreitas.
| programa de tempo método de condicionamento | |||||||
| Tempo (min) | Evento | Valor | Duração | frasco de entrada | frasco de saída | Resumo | Comentários |
| - | Lavar - Pressão | 2068 mbar | 1,0 min | BI: C1 | BO: C1 | para a frente | HCl 0,1 M |
| - | Lavar - Pressão | 2068 mbar | 2,0 min | BI: B1 | BO: C1 | para a frente | Água |
| - | Lavar - Pressão | 2068 mbar | 10,0 min | BI: E1 | BO: C1 | para a frente | BGE |
| 0.00 | Separado - Tensão | 15,0 KV | 10,0 min | BI: D1 | BO: D1 | 0,17 rampa Min, polaridade normal, | Separado |
| 10.00 | Lavar - Pressão | 2758 mbar | 10,0 min | BI: E1 | BO: C1 | para a frente | BGE |
| 20.01 | Esperar | - | 0,0 min | BI: A1 | BO: A1 | - | dicas de enxaguamento |
| Correndo método de programa de tempo | |||||||
| Tempo (min) | Evento | Valor | Duração | frasco de entrada | frasco de saída | Resumo | Comentários |
| - | Lavar - Pressão | 2068 mbar | 1,0 min | BI: C1 | BO: C1 | Adiante, In / Out inc frasco 6 | HCl 0,1 M |
| - | Lavar - Pressão | 2068 mbar | 2,0 min | BI: B1 | BO: C1 | Adiante, In / Out inc frasco 6 | água |
| - | Lavar - Pressão | 2068 mbar | 4,0 min | BI: E1 | BO: C1 | Adiante, In / Out inc frasco 6 | BGE |
| - | Injectar - Pressão | 34 mbar | 20,0 seg | SI: A1 | BO: B1 | Substituir, Avançado | injecção da amostra |
| - | Esperar | - | 0,4 min | BI: A1 | BO: A1 | In / Out inc frasco 6 | dicas de lavagem |
| 0 | Separado - Tensão | 15,0 KV | 30,0 min | BI: D1 | BO: D1 | 0,17 Min rampa, polaridade normal, In / Out inc frasco 6 | Separação amostra |
| 0,5 | autozero | - | - | - | - | - | - |
| 30.01 | pare de dados | - | - | - | - | - | - |
| 30.02 | Lavar - Pressão | 2068 mbar | 2,0 min | BI: B1 | BO: C1 | Adiante, In / Out inc frasco 6 | água |
| 32.03 | Esperar | - | 0,0 min | BI: A1 | BO: A1 | In / Out inc frasco 6 | dicas de enxaguamento |
| 32.04 | Fim | - | - | - | - | - | Fim |
| programa de tempo método de desligamento | |||||||
| Tempo (min) | Evento | Valor | Duração | frasco de entrada | frasco de saída | Resumo | Comentários |
| - | Lavar - Pressão | 2068 mbar | 1,0 min | BI: E6 | BO: E6 | para a frente | HCl 0,1 M |
| - | Lavar - Pressão | 2068 mbar | 6,0 min | BI: F6 | BO: F6 | para a frente | água |
| - | Lamp - Off | - | - | - | - | - | - |
| - | Esperar | - | 0,0 min | BI: A1 | BO: A1 | - | dicas de enxaguamento |
Tabela 1: Condicionado, correndo e programas de tempo de desligamento.
5. Aquisição de Dados e Processamento
- Programar o conjunto de amostras.
- Programar o capilar para o condicionamento usando o método de condicionamento instrumento. Quando o capilar é usado pela primeira vez, o programa de quatro repetições; caso contrário programar apenas duas repetições do método de condicionamento.
- Programar as amostras a serem analisadas utilizando o método do instrumento em execução.
- Programar o capilar para armazenamento, utilizando o método instrumento desligamento e repita o procedimento indicado no ponto 3.2.22.
- Executar o experimento.
- Exportar os eletroferogramas.
- Calcule o tempo de migração e o teor percentual de base, um dos principaisisoformas ácidas nd usando integração linha de queda vertical do perfil electrofograma.
Resultados
A Figura 2 mostra o perfil de corrente eléctrica típica de um EACA 200 mM, 30 mM de acetato de lítio, pH 4,8 com BGE amostra anti-TNFa mAb diluído com tampão Tris (50 mM, pH 8,0). Como pode ser observado, a corrente é estável durante toda a análise e pode oscilar entre os valores de 30 a 35 uA. A Figura 3 mostra o electroferograma CZE de uma amostra em branco onde o pico detectado corresponde ao padrão interno de histamina. Espera-se para a hist...
Discussão
Neste tutorial, destacamos a importância de práticas adequadas na condução CZE análises de mAbs, a fim de aumentar a probabilidade de sucesso. No entanto, quando CZE é usado de forma rotineira, questões surgem inevitavelmente 12.
Para melhores resultados, é importante seguir as notas que foram incluídos ao longo do protocolo, como eles vão ajudar o analista a superar e resolver problemas difíceis passos. Uma consideração importante para obter uma melhor resolução a ...
Divulgações
The authors Carlos E. Espinosa-de la Garza, Rodolfo D. Salazar-Flores, Néstor O. Pérez, Luis F. Flores-Ortiz and Emilio Medina-Rivero are employees of Probiomed S.A. de C.V., which is developing, manufacturing and marketing biosimilar products. All authors are involved in the development of biosimilar products for Probiomed.
Agradecimentos
The authors thank Wiley for the granted permission to use the concepts of the following publication for this tutorial. Carlos E. Espinosa-de la Garza, Francisco C. Perdomo-Abúndez, Jesús Padilla-Calderón, Jaime M. Uribe-Wiechers, Néstor O. Pérez, Luis F. Flores-Ortiz, Emilio Medina-Rivero: Analysis of recombinant monoclonal antibodies by capillary zone electrophoresis. Electrophoresis. 2013. 34. 1133-1140. Copyright Wiley-VCH Verlag GmbH & Co. KGaA. This work was supported by CONACyT, Mexico, grant 230551.
Materiais
| Name | Company | Catalog Number | Comments |
| Glacial acetic acid | Tecsiquim | AT0035-7 | |
| ACS grade hydrochloric acid | J.T. Baker | 9535-05 | |
| Histamine dihydrochloride | Fluka | 53300 | |
| (Hydroxypropyl) methyl cellulose | Fluka | 09963 | |
| Lithium acetate | Sigma-Aldrich | 517992 | |
| 6-Aminocaproic acid | Sigma-Aldrich | A2504 | |
| eCAP Tris Buffer, 50.0 mM, pH 8 | Beckman Coulter | 477427 | |
| PA 800 Plus Pharmaceutical Analysis System | Beckman Coulter | A66528 | |
| eCAP Neutral capillary | Beckman Coulter | 477441 | |
| Vial, Micro, 200 µl | Beckman Coulter | 144709 | |
| Universal Vial Caps | Beckman Coulter | A62250 | |
| Universal Vials | Beckman Coulter | A62251 | |
| Cable, Optics, UV/Vis | Beckman Coulter | 144093 | |
| UV/Vis Detector Module | Beckman Coulter | 144733 | |
| Cartridge Assembly Kit, Blank | Beckman Coulter | 144738 |
Referências
- Bruno, V., Battaglia, G., Nicoletti, F. The advent of monoclonal antibodies in the treatment of chronic autoimmune diseases. Neurol. Sci. 31, 283-288 (2011).
- Liu, H., Gaza-Bulseco, G., Faldu, D., Chumsae, C., Sun, J. Heterogeneity of monoclonal antibodies. J. Pharm. Sci. 97 (7), 2426-2447 (2008).
- Creamer, J. S., Oborny, N. J., Lunte, S. M. Recent advances in the analysis of therapeutic proteins by capillary and microchip electrophoresis. Anal. Methods. 6 (15), 5427-5449 (2014).
- Fekete, S., Guillarme, D., Sandra, P., Sandra, K. Chromatographic, Electrophoretic, and Mass Spectrometric Methods for the Analytical Characterization of Protein Biopharmaceuticals. Anal. Chem. 88 (1), 480-507 (2016).
- He, Y., et al. Analysis of identity, charge variants, and disulfide isomers of monoclonal antibodies with capillary zone electrophoresis in an uncoated capillary column. Anal. Chem. 82 (8), 3222-3230 (2010).
- He, Y., Isele, C., Hu, W., Ruesch, M. Rapid analysis of charge variants of monoclonal antibodies with capillary zone electrophoresis in dynamically coated fused-silica capillary. J. Sep. Sci. 34 (5), 548-555 (2011).
- Zhao, S. S., Chen, D. D. Y. Applications of capillary electrophoresis in characterizing recombinant protein therapeutics. Electrophoresis. 35 (1), 96-108 (2014).
- Štěpánová, S., Kašička, V. Determination of impurities and counterions of pharmaceuticals by capillary electromigration methods. J. Sep. Sci. 37 (15), 2039-2055 (2014).
- Štěpánová, S., Kašička, V. Recent applications of capillary electromigration methods to separation and analysis of proteins. Anal. Chim. Acta. 933, 23-42 (2016).
- Espinosa-de la Garza, C. E., et al. Analysis of recombinant monoclonal antibodies by capillary zone electrophoresis. Electrophoresis. 34 (8), 1133-1140 (2013).
- Staub, A., Guillarme, D., Schappler, J., Veuthey, J. L., Rudaz, S. Intact protein analysis in the biopharmaceutical field. J. Pharm. Biomed. Anal. 55 (4), 810-822 (2011).
- Altria, K. D., Altria, K. D. Troubleshooting. Methods in Molecular Biology, Vol 52. Capillary Electrophoresis Guidebook: Principles, Operation and Applications. , (1996).
- Ma, S., Nashabeh, W. Analysis of protein therapeutics by capillary electrophoresis. Chromatographia. 53 (5), 75-89 (2001).
- Jaccoulet, E., Smadja, C., Prognon, P., Taverna, M. Capillary electrophoresis for rapid identification of monoclonal antibodies for routine application in hospital. Electrophoresis. 36 (17), 2050-2056 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados