A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
والاستشعار القائمة على أبتمر لUnchelated الجادولينيوم (III)
In This Article
Summary
The use of polydeoxynucleotide (44-mer aptamer) molecules for sensing unchelated gadolinium(III) ion in an aqueous solution is described. The presence of the ion is detected via an increase in the fluorescence emission of the sensor.
Abstract
A method for determining the presence of unchelated trivalent gadolinium ion (Gd3+) in aqueous solution is demonstrated. Gd3+ is often present in samples of gadolinium-based contrast agents as a result of incomplete reactions between the ligand and the ion, or as a dissociation product. Since the ion is toxic, its detection is of critical importance. Herein, the design and usage of an aptamer-based sensor (Gd-sensor) for Gd3+ are described. The sensor produces a fluorescence change in response to increasing concentrations of the ion, and has a limit of detection in the nanomolar range (~100 nM with a signal-to-noise ratio of 3). The assay may be run in an aqueous buffer at ambient pH (~7 - 7.4) in a 384-well microplate. The sensor is relatively unreactive toward other physiologically relevant metal ions such as sodium, potassium, and calcium ions, although it is not specific for Gd3+ over other trivalent lanthanides such as europium(III) and terbium(III). Nevertheless, the lanthanides are not commonly found in contrast agents or the biological systems, and the sensor may therefore be used to selectively determine unchelated Gd3+ in aqueous conditions.
Introduction
وقد أدت الأهمية المتزايدة للتصوير بالرنين المغناطيسي (MRI) في التشخيص السريري، والذي يحد من حساسية الكامنة في أسلوب في النمو السريع للبحث في تطوير عوامل رواية القائم على الجادولينيوم المقابل (GBCAs) 1. GBCAs هي الجزيئات التي تدار لتحسين جودة الصورة، وأنها عادة ما يكون التركيب الكيميائي للأيون الثلاثي الجادولينيوم (ش ج 3+) منسقة ليجند polydentate. هذا complexation له أهمية حاسمة كما unchelated ش ج 3+ غير سامة. وقد تورط في تطوير تليف النظامية كلوي في بعض المرضى الذين يعانون من أمراض الكلى أو الفشل 2. ونتيجة لذلك، والكشف عن أيون حر مائي غير فعال في ضمان سلامة GBCAs. وجود unchelated ش ج 3+ في حلول GBCA غالبا ما يكون نتيجة رد فعل غير مكتمل بين يجند وأيون، تفكك المجمع، أو displacemenر من قبل غيرها من الكاتيونات المعدنية البيولوجية 3.
ومن بين العديد من التقنيات المستخدمة حاليا لتحديد وجود ش ج 3+، أولئك الذين يعتمدون على اللوني و / أو الطيف رتبة أعلى من حيث التنوع وتطبيق 4. بين مواطن القوة لديهم هي حساسية عالية ودقة، والقدرة على تحليل مختلف المصفوفات عينة (بما في ذلك المصل البشري 5 والبول والشعر 6، 7 مياه الصرف الصحي، وتركيبات وكيل النقيض 8)، والكمي في وقت واحد من عدة ش ج 3+ المجمعات (قائمة من الدراسات قبل 2013 الموضح في مراجعة شاملة من قبل Telgmann وآخرون.) (4). لكن العائق الوحيد هو أن العديد من هذه الأساليب تتطلب أدوات القياس (مثل إضافة بالحث مطياف البلازما الشامل) 4 أن بعض المختبرات قد لا يكون الوصول إليها. في سياق اكتشاف GBCA الرواية في البحث ومستويات إثبات صحة مفهوم، عelatively أكثر ملاءمة، والسريع، وفعالة من حيث التكلفة طريقة القائم الطيفية (مثل امتصاص الأشعة فوق البنفسجية فيس أو مضان) قد يكون بمثابة بديل قيمة. مع هذه التطبيقات في الاعتبار، وقد وضعت الفلورسنت القائم على أبتمر الاستشعار عن مائي ش ج 3+ 9.
وأبتمر (ش ج-أبتمر) هو 44 قاعدة طويلة واحد الذين تقطعت بهم السبل جزيء الحمض النووي مع تسلسل معين من القواعد التي كانت معزولة من خلال عملية التطور المنهجي للبروابط كتبها تخصيب الأسي (سيليكس) 9. لتكييف أبتمر إلى جهاز استشعار الفلورسنت، ويرد على fluorophore إلى محطة 5 'من حبلا، وهو ما يتم تهجين مع حبلا التبريد (QS) عبر 13 قواعد تكميلية (الشكل 1). والموسومة QS مع جزيء فاكهه تقضي الظلام في 'محطة 3. في غياب ش ج 3+، أجهزة الاستشعار (ش ج استشعار)، تتكون من نسبة 1: الخلد 2 ش ج-أبتمر وQS على التوالي، وسيكون الحد الأدنى من الانبعاثات مضان ر المناسبس نقل الطاقة من fluorophore إلى فاكهه تقضي. وإضافة مائي ش ج 3+ تحل محل QS من ش ج-أبتمر، مما أدى إلى زيادة في الانبعاثات مضان.
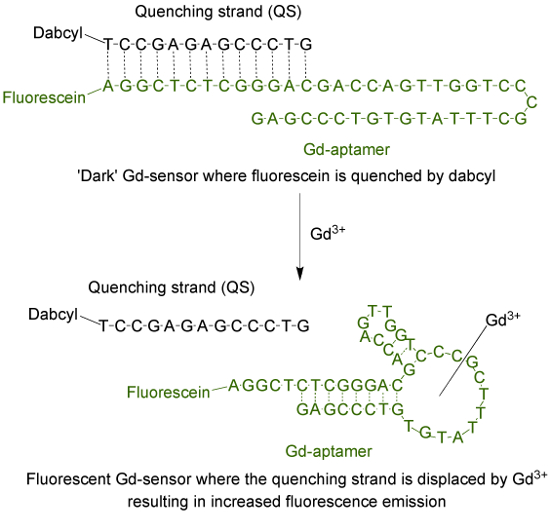
الشكل 1. استشعار (ش ج استشعار) التي تتكون من أبتمر 44 قاعدة طويلة (ش ج-أبتمر) الموسومة مع فلوريسئين (أ fluorophore) و13 قاعدة تبريد طويل حبلا (QS) الموسومة مع dabcyl (فاكهه تقضي الظلام) . في غياب unchelated ش ج 3+، مضان من أجهزة الاستشعار هو الحد الأدنى. مع اضافة كلمة المدير العام 3+، تهجير QS يحدث ولوحظ حدوث زيادة في الانبعاثات مضان. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
هناك في الوقت الحاضر، احد يشيع استخدامها أسلوب قائم على التحليل الطيفي للكشف عنجي مائي ش ج 3+. يستخدم هذا الاختبار البرتقال زايلينول جزيء، والتي تخضع لعملية التحول في أقصى الطول الموجي امتصاص 433-573 نانومتر على عملية إزالة معدن ثقيل إلى أيون 10. نسبة هذين الامتصاصية ماكسيما يمكن أن تستخدم لقياس كمية من unchelated ش ج 3+. أجهزة الاستشعار أبتمر هو بديل (قد تكون أيضا مكملة) لفحص زايلينول البرتقال، وطرق لهما ظروف التفاعل المختلفة (مثل درجة الحموضة وتكوين المحاليل المستخدمة)، الإختياريات الهدف، ويتراوح خطية من تقدير، وطرائق الكشف 9.
Protocol
ملاحظة: يتم استخدام الجزيئي المياه البيولوجيا الصف في كافة الاستعدادات العازلة والحل. جميع أنابيب القابل للتصرف (microcentrifuge لوPCR) ونصائح الماصة هي DNase- وريبونوكلياز خالية. يرجى الاطلاع على ورقة بيانات سلامة المواد (MSDS) لجميع المواد الكيميائية قبل استخدامها. ينصح بشدة استخدام معدات الوقاية الشخصية المناسبة (PPE).
1. إعداد الحلول المالية أبتمر
- شراء 2 خيوط polydeoxynucleotide تجاريا. طلب كل من خيوط بالتطهير عبر الأداء العالي اللوني السائل (HPLC).
حبلا 1 (ش ج-أبتمر):
5 '- / 56-FAM / AGGCTCTCGGGACGACCAGTTGGTCCCGCTTTATGTGTCCCGAG-3 "
حبلا 2 (QS):
5'-GTCCCGAGAGCCT / 3Dab / -3 " - حل كل حبلا في الماء لجعل 100 ميكرومتر الحلول الأسهم الفردية للش ج-أبتمر وQS.
- تخزين هذه الحلول في -20 درجة مئوية. الحلول هي مستقرة حتى الآن، لمدة 3 سنوات.
- لتقليل فريزدورات ذوبان الجليد الإلكترونية، تخزين الحلول الأسهم في 10 مكل.
2. إعداد 2X ش ج استشعار الحل
- إعداد المخزن المؤقت فحص (20 ملي HEPES، 2 مم MgCl 2، 150 مم كلوريد الصوديوم، 5 مم بوكل). ضبط درجة الحموضة إلى ~ 7.4 مع هيدروكسيد الصوديوم وحمض الهيدروكلوريك، وتصفية من خلال معقمة يمكن التخلص منها زجاجة أعلى مرشحات مع 0.2 ميكرومتر غشاء PES. تخزين في زجاجات معقمة. إذا تمت تصفيتها وتخزينها بشكل صحيح (في درجة حرارة الغرفة)، المخزن المؤقت مستقرة حتى الآن، لمدة 2 سنة.
- تمييع 1 ميكرولتر من محلول المخزون ش ج-أبتمر (من الخطوة 1.2) و 2 ميكرولتر من محلول المخزون QS (من الخطوة 1.2) في 497 ميكرولتر من العازلة الفحص. تخلط جيدا باستخدام الدوامة. تركيزاتها في 2X حل ش ج استشعار هي 200 نانومتر و 400 نانومتر، على التوالي.
ملاحظة: حجم 2X حل ش ج استشعار أعد في هذه الخطوة هو 500 ميكرولتر، وهو ما يكفي لاختبار 6-7 تركيزات مختلفة من ش ج 3+ لمنحنى المعايرة والحلول عامل تباين(الخطوة 3). وسيكون لكل عينة تعطي الآبار مكررة في 384 لوحة جيدا.- ضبط حجم 2X حل ش ج استشعار وفقا لعدد من الحلول ش ج 3+ التي تحتاج إلى فحصها.
- نقل 2X حل ش ج استشعار في 9 أنابيب PCR، مع 50 ميكرولتر إلى كل أنبوب. وضع الأنابيب في cycler الحرارية.
- ضبط البرنامج في cycler الحرارية لتسخين الحل في أنابيب إلى 95 درجة مئوية، وعقد لمدة 5 دقائق، ثم تبرد ببطء الحلول إلى 25 درجة مئوية خلال ~ 15 دقيقة (بمعدل ~ ،05-،1 ° C / ق). دورة التدفئة والتبريد هي ضمان التهجين الأمثل بين ش ج-أبتمر وQS. نتائج التهجين جزئية في تبريد غير مكتمل ومضان الخلفية أعلى من أجهزة الاستشعار. إذا كان cycler الحرارية غير متوفر، تنفيذ هذه العملية باستخدام حمام الماء الساخن بدلا من ذلك.
- مرة واحدة يتم تبريده الى 25 درجة مئوية، واستخدامها على الفور الحل، أو الاحتفاظ في cycler الحرارية (تصل إلى حوالي 2 ساعة) حتى يكون على استعداد لمستعمل. عند استخدام حمام ماء للتدفئة، وترك الأنابيب في الحمام كما الماء يبرد ببطء إلى درجة حرارة الغرفة.
3. بناء منحنى الإسفار المعايرة والكشف عن وجود Unchelated ش ج 3+ في حل من وكيل التباين كلمة المدير العام
- حل GdCl 3 الصلبة في المخزن المؤقت فحص (المخزن نفسه كما في الخطوة 2.1).
- من خلال التخفيف المتسلسل، وإعداد 100 ميكرولتر كل من 6 حلول ش ج 3+ مختلفة في أنابيب microcentrifuge في ضعف تركيز المطلوب النهائية لمنحنى المعايرة (2X الحلول).
- على سبيل المثال، لإنشاء معايرة ل0 (العازلة فقط مع عدم وجود GdCl 3)، 50، 100، 200، 400، و 800 نيوتن متر من ش ج 3+، وإعداد الحلول التي تحتوي على 0، 100، 200، 400، 800، و 1،600 نيوتن متر من أيون. تأكد من تضمين دائما "فارغة" مع 0 نانومتر ش ج 3+ كما سيطرة سلبية.
- حل كيل النقيض أن يكون الاختبارإد في المنطقة العازلة الفحص. إعداد 2 أو 3 تركيزات مختلفة من الحلول عامل تباين عبر التخفيف المتسلسل.
ملاحظة: اختبار 3 تركيزات مختلفة من الحل وكيل النقيض من المستحسن. هذا هو التأكد من أن هذه التركيزات ضمن نطاق خطي. إذا كانت العينات المختبرة لا تعرض وجود علاقة خطية، والحد من تركيز وكيل النقيض المستخدمة. - خذ أنابيب PCR يحتوي الحل 2X ش ج استشعار من الخطوة 2.5 من cycler الحرارية.
- إضافة 50 ميكرولتر من كل كلمة المدير العام 3+ حل من الخطوة 3.2 إلى 6 من 9 أنابيب PCR يحتوي الحل 2X ش ج استشعار. مزيج من قبل pipetting صعودا وهبوطا. يحتوي كل أنبوب PCR الآن التركيز المطلوب من ش ج 3+ لفحصها، و 100 نيوتن متر ش ج-أبتمر، و 200 نانومتر QS.
- للأنابيب PCR المتبقية التي تحتوي على 2X حل كلمة المدير العام أجهزة الاستشعار، وإضافة 50 ميكرولتر من الحلول وكيل النقيض من الخطوة 3.3. مزيج جيد من قبل pipetting صعودا وهبوطا عدة مرات.
- احتضان الصورةolutions في أنابيب PCR لحوالي 5 دقائق في درجة حرارة الغرفة. قد يكون من اليسار إلى الوقوف لمدة تصل إلى 30 دقيقة.
- نقل 45 ميكرولتر من كل أنبوب في لوحة 384 جيدا. وسيكون لكل أنبوب PCR تعطي الآبار مكررة.
- تسجيل مضان من كل بئر على طبق من ذهب للقارئ. وfluorophore (فام) المستخدمة في تصميم ش ج-أجهزة الاستشعار لديها الإثارة وانبعاث قصوى تبلغ 495 و 520 نانومتر على التوالي، كما هو موضح على الموقع الإلكتروني للمورد. اختيار المناسبة الإثارة وانبعاث موجات أو مرشحات اعتمادا على ما إذا كان قارئ اللوحة هو monochromator- أو القائم على التصفية.
- رسم بياني من مضان في وحدات مضان التعسفية (AFU) ضد تركيز ش ج 3+.
- رسم بياني مع تغير مضان أضعاف ضد تركيز ش ج 3+. حساب التغير مضان أضعاف بقسمة AFU كل تركيز من قبل AFU من الحل "فارغ" (مع 0 نانومتر ش ج 3+). فإن التغيير مضان أضعاف تسمح للنormalization من النتائج، ينبغي عرض AFU بعض دورية (أيام مختلفة، وما إلى ذلك) الاختلافات.
- مقارنة الانبعاثات مضان من محلول يحتوي على عامل تباين و"فارغة"، وهو محلول يحتوي على 0 نانومتر GdCl 3 (العازلة فقط).
ملاحظة: مضان أعلى من الحل GBCA يعني وجود unchelated ش ج 3+، والتي قد تتطلب المزيد من تنقية وكيل التباين. ويمكن تقدير كمية unchelated ش ج 3+ الحاضر باستخدام منحنى المعايرة التي شيدت في خطوة 3.10 أو 3.11.
النتائج
ويرد التغيير مضان نموذجي من الحل ش ج استشعار بحضور unchelated ش ج 3+ في الشكل 2. قد يكون رسم انبعاث كما تغير مضان أضعاف (الشكل 2A) أو مضان الخام القراءة (الشكل 2B) في وحدات التعسفي (AFU). كلا المؤامرات تسفر عن منحنيات المعايرة متش?...
Discussion
باستخدام كلمة المدير العام استشعار القائم على أبتمر، وزيادة في الانبعاثات مضان أن يتناسب مع تركيز unchelated ش ج 3+ لوحظ. لتقليل كمية العينة المستخدمة، يمكن تشغيل الفحص في صفيحة 384 بشكل جيد مع حجم العينة ما مجموعه 45 ميكرولتر لكل بئر. في هذا التصميم، واختيار فلوريسئين ...
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
We would like to gratefully acknowledge Dr. Milan N Stojanovic from Columbia University, New York, NY for valuable scientific input. This work is supported by funding from the California State University East Bay (CSUEB) and the CSUEB Faculty Support Grant-Individual Researcher. O.E., T.C., and A.L. were supported by the CSUEB Center for Student Research (CSR) Fellowship.
Materials
| Name | Company | Catalog Number | Comments |
| Gd-aptamer | IDTDNA | Input sequence and fluorophore modification in the order form | A fluorophore with a different emission wavelength may be used. The aptamer may also be ordered from another company. |
| Quenching strand | IDTDNA | Input sequence and quencher modification in the order form | A different quencher for optimal energy transfer from the fluorophore may be used. The aptamer may also be ordered from another company. |
| Molecular biology grade water | No specific manufacturer, both DEPC or non-DEPC treated work equally well | ||
| Gadolinium(III) chloride anhydrous | Strem | 936416 | Toxic |
| HEPES | Fisher Scientific | BP310-500 | |
| Magnesium chloride anhydrous | MP Biomedicals | 0520984480 - 100 g | |
| Sodium Chloride | Acros Organics | 327300025 | |
| Potassium chloride | Fisher Scientific | P333-500 | |
| Sodium hydroxide, pellets | Fisher Scientific | BP359 | Corrosive |
| Hydrochloric acid | Fisher Scientific | SA49 | Toxic and corrosive |
| 384-well low flange black flat bottom polystyrene NBS plates | Corning | 3575 | Plates which are suitable for fluorescence reading are required. |
| Nalgene Rapid-Flow sterile disposable bottle top filter | Thermo Scientific | 5680020 | The bottle top is fitted with 0.2 micron PES membrane |
| Disposable sterile bottles 250 mL | Corning | 430281 | A larger or smaller bottle may be used |
| 1.5 mL microcentrifuge tubes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| 0.2 mL PCR tubes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| Micropipets | No specific manufacturer | ||
| Pipet tips (non filter) of appropriate sizes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| Equipment | |||
| Plate reader | Biotek Synergy H1 | Plate readers from other manufacturers would work equally well |
References
- Shen, C., New, E. J. Promising strategies for Gd-based responsive magnetic resonance imaging contrast agents. Curr. Opin. Chem. Biol. 17 (2), 158-166 (2013).
- Cheong, B. Y. C., Muthupillai, R. Nephrogenic systemic fibrosis: a concise review for cardiologists. Tex. Heart Inst. J. 37 (5), 508-515 (2010).
- Hao, D., Ai, T., Goerner, F., Hu, X., Runge, V. M., Tweedle, M. MRI contrast agents: basic chemistry and safety. J Magn. Reson. Imaging. 36 (5), 1060-1071 (2012).
- Telgmann, L., Sperling, M., Karst, U. Determination of gadolinium-based MRI contrast agents in biological and environmental samples: a review. Anal. Chim. Acta. 764, 1-16 (2013).
- Frenzel, T., Lengsfeld, P., Schirmer, H., Hütter, J., Weinmann, H. -. J. Stability of gadolinium-based magnetic resonance imaging contrast agents in human serum at 37 degrees C. Invest. Radiol. 43 (12), 817-828 (2008).
- Loreti, V., Bettmer, J. Determination of the MRI contrast agent Gd-DTPA by SEC-ICP-MS. Anal. Bioanal. Chem. 379 (7), 1050-1054 (2004).
- Telgmann, L., et al. Speciation and isotope dilution analysis of gadolinium-based contrast agents in wastewater. Environ. Sci. Technol. 46 (21), 11929-11936 (2012).
- Cleveland, D., et al. Chromatographic methods for the quantification of free and chelated gadolinium species in MRI contrast agent formulations. Anal. Bioanal. Chem. 398 (7), 2987-2995 (2010).
- Edogun, O., Nguyen, N. H., Halim, M. Fluorescent single-stranded DNA-based assay for detecting unchelated gadolinium(III) ions in aqueous solution. Anal. Bioanal. Chem. 408 (15), 4121-4131 (2016).
- Barge, A., Cravotto, G., Gianolio, E., Fedeli, F. How to determine free Gd and free ligand in solution of Gd chelates. A technical note. Contrast Med. Mol. Imaging. 1 (5), 184-188 (2006).
- Johansson, M. K. Choosing reporter-quencher pairs for efficient quenching through formation of intramolecular dimers. Methods Mol. Biol. 335, 17-29 (2006).
- Sherry, A. D., Caravan, P., Lenkinski, R. E. A primer on gadolinium chemistry. J. Magn. Reson. Imaging. 30 (6), 1240-1248 (2009).
- Shakhverdov, T. A. A cross-relaxation mechanism of fluorescence quenching in complexes of lanthanide ions with organic ligands. Opt. Spectrosc. 95 (4), 571-580 (2003).
- Brittain, H. G. Submicrogram determination of lanthanides through quenching of calcein blue fluorescence. Anal. Chem. 59 (8), 1122-1125 (1987).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved