Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Аптамер на основе датчика для нехелатированной гадолиния (III)
В этой статье
Резюме
The use of polydeoxynucleotide (44-mer aptamer) molecules for sensing unchelated gadolinium(III) ion in an aqueous solution is described. The presence of the ion is detected via an increase in the fluorescence emission of the sensor.
Аннотация
A method for determining the presence of unchelated trivalent gadolinium ion (Gd3+) in aqueous solution is demonstrated. Gd3+ is often present in samples of gadolinium-based contrast agents as a result of incomplete reactions between the ligand and the ion, or as a dissociation product. Since the ion is toxic, its detection is of critical importance. Herein, the design and usage of an aptamer-based sensor (Gd-sensor) for Gd3+ are described. The sensor produces a fluorescence change in response to increasing concentrations of the ion, and has a limit of detection in the nanomolar range (~100 nM with a signal-to-noise ratio of 3). The assay may be run in an aqueous buffer at ambient pH (~7 - 7.4) in a 384-well microplate. The sensor is relatively unreactive toward other physiologically relevant metal ions such as sodium, potassium, and calcium ions, although it is not specific for Gd3+ over other trivalent lanthanides such as europium(III) and terbium(III). Nevertheless, the lanthanides are not commonly found in contrast agents or the biological systems, and the sensor may therefore be used to selectively determine unchelated Gd3+ in aqueous conditions.
Введение
Возрастающее значение магнитно - резонансной томографии (МРТ) в клинической диагностике, которая ограничена присущей чувствительности метода, привело к быстрому росту исследований в области разработки новых гадолиния основе контрастных агентов (GBCAs) 1. GBCAs представляют собой молекулы, которые вводят для улучшения качества изображения, и они , как правило , имеют химическую структуру трехвалентного иона гадолиния (Gd 3+) координирован с полидентатным лигандом. Это комплексообразование имеет решающее значение как нехелатированной Gd 3+ является токсичным; он участвует в развитии нефрогенной системного фиброза у некоторых больных с почечной недостаточностью или недостаточностью 2. Следовательно, обнаружение водного свободного иона играет важную роль в обеспечении безопасности GBCAs. Присутствие нехелатированной Gd 3+ в растворах GBCA часто является результатом неполной реакции между лигандом и ионом, диссоциации комплекса или displacemenт других биологических катионов металлов 3.
Среди нескольких методов , используемых в настоящее время для определения присутствия Gd 3+, те , которые полагаются на хроматографии и / или спектрометрического ранга высшей точки зрения универсальности и применимости 4. Среди их сильные стороны являются высокая чувствительность и точность, возможность анализа различных матриц проб ( в том числе сыворотки человека 5, мочи и волос 6, 7 сточной воды, а также композиций , агентов контрастных 8), а также одновременного количественного определения нескольких 3+ комплексов Gd (листинг исследований до 2013 года описана в комплексном обзоре Telgmann и др.) 4. Единственным недостатком является то, что некоторые из этих методов требует контрольно- измерительные приборы (например, с индуктивно связанной плазмой масс - спектрометрии) 4 , что некоторые лаборатории не могут иметь доступ. В контексте нового открытия GBCA на исследования и доказательство правильности концепции уровней, арelatively более удобный, быстрый и экономически эффективный метод спектроскопического основе (например, УФ-Vis поглощения или флуоресценции), может служить ценным альтернативой. С помощью этих приложений в виду, флуоресцентный аптамеры на основе датчика для водного раствора Gd 3+ был разработан 9.
Аптамеров (Gd-аптамеров) представляет собой 44-щелочное долго одноцепочечной молекулой ДНК с определенной последовательностью оснований, выделенный в процессе систематического выделение лигандов экспоненциальным обогащением (SELEX) 9. Для адаптации аптамер в флуоресцентным датчиком, флуорофор присоединен к концу 5 'нити, которая затем гибридизуют с жаждоутоляющей нити (QS) через 13 дополнительных оснований (рисунок 1). QS помечен темной молекулой гасителя на 3'-конца. При отсутствии Gd 3+, датчик (Gd-сенсор), состоящий из соотношении 1: 2 моль Г.Д.-аптамеров и QS соответственно будут иметь минимальное излучение флуоресценции из - за тпередача энергии от о флуорофора к гасителя. Добавление водного раствора Gd 3+ сместит QS из Gd-аптамеров, что приводит к увеличению флуоресцентной эмиссии.
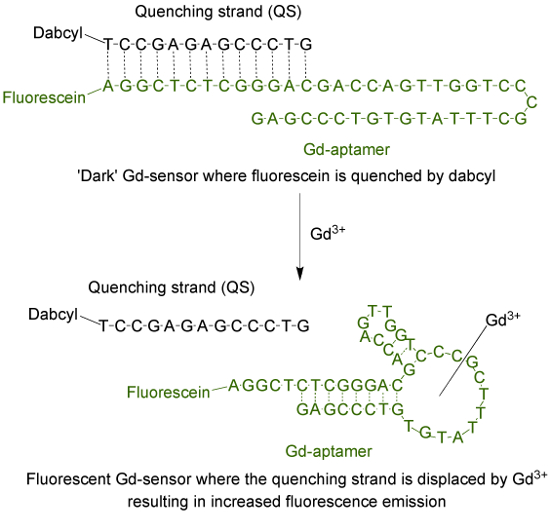
Рисунок 1. Датчик (Gd-сенсор) , который состоит из 44-основания длинной аптамеров (Gd-аптамеров) метили флуоресцеина (флуорофор) и 13-база длиной цепи закалки (QS) помеченным dabcyl (темный гасителя) , При отсутствии нехелатированной Gd 3+, флуоресценция датчика минимальна. С добавлением Gd 3+, смещение QS происходит и наблюдается увеличение эмиссии флуоресценции. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Существует в настоящее время широко используется один спектроскопического основе метод обнаруженияИНГ водного Gd 3+. В этом анализе используют молекулу ксиленоловым апельсин, обнаруживающая сдвиг максимума длины волны поглощения от 433 до 573 нм при хелятации к иону 10. Отношение этих двух максимумов поглощения могут быть использованы для определения количества нехелатированной Gd 3+. Датчик аптамеров является альтернативой (также может быть комплементарной) к ксиленол оранжевого анализа, поскольку эти два метода имеют разные условия реакции (например, рН и состав буферных растворов, используемых), задачи селективностью, линейные диапазоны количественной оценки, а также методов обнаружения 9.
протокол
Примечание: Молекулярная биология класс вода используется во всех буферных растворов и препаратов. Все одноразовые трубки (микроцентрифужных и ПЦР) и пипетки советы DNase- и РНКазы. Пожалуйста, обратитесь к листам безопасности (MSDS) для всех химических веществ перед использованием. Использование соответствующих средств индивидуальной защиты (СИЗ) настоятельно рекомендуется.
1. Приготовление аптамера маточные растворы
- Покупка 2 пряди polydeoxynucleotide на коммерческой основе. Заказать обе нити с очисткой с помощью высокой жидкостной хроматографии (ВЭЖХ).
Strand 1 (GD-аптамер):
5 '- / 56-FAM / AGGCTCTCGGGACGACCAGTTGGTCCCGCTTTATGTGTCCCGAG-3'
Strand 2 (QS):
5'-GTCCCGAGAGCCT / 3Dab / -3 ' - Растворить каждую прядь в воде, чтобы сделать 100 мкМ индивидуальных исходных растворов GD-аптамеров и СМО.
- Храните эти решения при -20 ° С. Растворы стабильны до сих пор, в течение 3-х лет.
- Чтобы свести к минимуму FREEZЦиклы электронной оттаивание, хранить растворы в 10 мкл аликвоты.
2. Подготовка 2x Gd-датчика решения
- Подготовка буфера для анализа (20 мМ HEPES, 2 мМ MgCl 2, 150 мМ NaCl, 5 мМ КСl). Доводят рН до ~ 7,4 с помощью NaOH и HCl, и фильтруют через стерильные одноразовые бутылки верхних фильтров с ПЭС 0,2 мкм мембраны. Хранить в стерильные бутылки. Если фильтруется и хранится надлежащим образом (при комнатной температуре), буфер стабилен до сих пор, в течение 2-х лет.
- Развести 1 мкл Б-г-аптамеров маточного раствора со стадии (1.2) и 2 мкл исходного раствора QS (со стадии 1.2) в 497 мкл буфера для анализа. Хорошо перемешать с помощью вихря. Их концентрации в растворе Б-г-датчика 2x 200 нм и 400 нм, соответственно.
Примечание: Объем раствора Gd-датчика 2x полученное на этом этапе составляет 500 мкл, что достаточно для тестирования 6 - 7 различные концентрации Gd 3+ для калибровочной кривой и решений контрастирующего агента(шаг 3). Каждый образец даст повторяющиеся скважины в 384-луночного планшета.- Отрегулируйте объем раствора Gd-датчика 2x в соответствии с количеством Gd 3+ решений , которые должны быть проверены.
- Переносят раствор Gd-датчика 2x на 9 ПЦР-пробирки с 50 мкл в каждую пробирку. Место труб в амплификатор.
- Установите программу в термоциклеру для нагрева раствора в трубах до 95 ° С, в течение первых 5 мин, а затем медленно охлаждают растворов до 25 ° С в течение ~ 15 мин (со скоростью ~ 0,05 - 0,1 ° С / с). Нагрева и охлаждения цикла для обеспечения оптимальной гибридизации между Gd-аптамеров и СМО. Частичные результаты гибридизации в неполной закалке и более высокой фоновой флуоресценции датчика. Если амплификатор не доступен, осуществить этот процесс, используя ванну с горячей водой вместо этого.
- После охлаждения до 25 ° С, немедленно использовать раствор, или держать в термоциклеру (приблизительно до 2 ч) до полной готовности, чтобы бытьиспользуемый. Когда ванна вода используется для отопления, оставьте трубки в ванне, поскольку вода медленно остывает до комнатной температуры.
3. Построение калибровочной кривой флуоресценции и обнаружения присутствия нехелатированной Gd 3+ в растворе Gd контрастного агента
- Растворите GDCL 3 Твердое вещество в буфере для анализа ( один и тот же буфер , как на шаге 2.1).
- Через серийного разведения, готовят 100 мкл каждого из 6 различных Gd 3+ растворов в микроцентрифужных пробирках при двукратном конечных желательных концентраций для калибровочной кривой (2x решений).
- Например, чтобы построить калибровку для 0 (буфер только не GdCl 3), 50, 100, 200, 400 и 800 нМ Gd 3+, готовят растворы , содержащие 0, 100, 200, 400, 800 и 1600 нМ иона. Убедитесь в том , чтобы всегда включать 'пустой' с 0 нМ Gd 3+ в качестве отрицательного контроля.
- Растворить контрастное вещество, чтобы быть тестэд в буфере для анализа. Подготовьте 2 или 3 различных концентраций растворов контрастного агента через серийного разведения.
Примечание: Тестирование 3 различных концентраций раствора контрастного вещества рекомендуется. Это должно гарантировать, что эти концентрации в пределах линейного диапазона. Если испытанные образцы не показывают линейную зависимость, уменьшить концентрации контрастного агента. - Возьмите пробирки для ПЦР, содержащих раствор 2x Gd-датчика со стадии 2.5 из термоциклеру.
- Добавьте 50 мкл каждого раствора Gd 3+ со стадии 3.2 в 6 из 9 ПЦР - пробирки , содержащие раствор 2x Gd-датчика. Смешайте с помощью пипетки вверх и вниз. Каждая трубка ПЦР теперь содержит требуемую концентрацию Gd 3+ быть испытанным, 100 нм GD-аптамер и 200 нм QS.
- Для остальных пробирки для ПЦР, содержащих раствор Б-г-датчика 2x, добавить 50 мкл растворов контрастирующего агента с шага 3.3. Хорошо перемешать с помощью пипетки вверх и вниз несколько раз.
- Инкубируйте Solutions в пробирки для ПЦР в течение приблизительно 5 мин при комнатной температуре. Они могут быть оставлены стоять в течение до 30 мин.
- Перенесите 45 мкл в каждую пробирку в 384-луночный планшет. Каждая трубка ПЦР дает дублированные лунки.
- Регистрируют флуоресценции каждой лунки на тарелке читателя. Флуорофор (FAM), используемый в конструкции Б-датчика имеет возбуждения и испускания максимумов 495 и 520 нм соответственно, как указано на сайте поставщика. Выберите соответствующие возбуждения и эмиссии длин волн или фильтров в зависимости от того, планшет-ридер является monochromator- или фильтр на основе.
- Постройте график флуоресценции в произвольных единицах флуоресценции (AFU) против концентрации Gd 3+.
- Постройте график , как изменение флуоресценции раза по сравнению с концентрацией Gd 3+. Рассчитать изменение флуоресценции раза путем деления AFU каждой концентрации в ВСУ от "чистого" решения (с 0 нМ Gd 3+). Изменение флуоресценции раза позволит пormalization результатов, должны ли дисплей AFU некоторые периодические ( в разные дни и т.д.) вариации.
- Сравните флуоресценции раствора , содержащего контрастный агент и "пустым", который является раствор , содержащий 0 нМ GDCL 3 (только буфер).
Примечание: Чем выше флуоресценции раствора GBCA подразумевает наличие нехелатированной Gd 3+, которые могут потребовать дальнейшей очистки контрастного агента. Количество нехелатированной Gd 3+ настоящее время может быть оценена с помощью калибровочной кривой , построенную на этапе 3.10 или 3.11.
Результаты
Типичное изменение флуоресценции раствора Gd-датчика в присутствии нехелатированной Gd 3+ показана на рисунке 2. Излучение может быть нанесены в виде изменения флуоресценции кратному (фиг.2А) , или сырой флуоресценции чтения (Фигура 2В) в ?...
Обсуждение
Использование аптамеров на основе Gd-сенсор, увеличение эмиссии флуоресценции, которая пропорциональна концентрации нехелатированной Gd 3+ наблюдается. Для того, чтобы свести к минимуму количество используемого образца, анализ может выполняться в микропланшет 384-луночного с общи?...
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
We would like to gratefully acknowledge Dr. Milan N Stojanovic from Columbia University, New York, NY for valuable scientific input. This work is supported by funding from the California State University East Bay (CSUEB) and the CSUEB Faculty Support Grant-Individual Researcher. O.E., T.C., and A.L. were supported by the CSUEB Center for Student Research (CSR) Fellowship.
Материалы
| Name | Company | Catalog Number | Comments |
| Gd-aptamer | IDTDNA | Input sequence and fluorophore modification in the order form | A fluorophore with a different emission wavelength may be used. The aptamer may also be ordered from another company. |
| Quenching strand | IDTDNA | Input sequence and quencher modification in the order form | A different quencher for optimal energy transfer from the fluorophore may be used. The aptamer may also be ordered from another company. |
| Molecular biology grade water | No specific manufacturer, both DEPC or non-DEPC treated work equally well | ||
| Gadolinium(III) chloride anhydrous | Strem | 936416 | Toxic |
| HEPES | Fisher Scientific | BP310-500 | |
| Magnesium chloride anhydrous | MP Biomedicals | 0520984480 - 100 g | |
| Sodium Chloride | Acros Organics | 327300025 | |
| Potassium chloride | Fisher Scientific | P333-500 | |
| Sodium hydroxide, pellets | Fisher Scientific | BP359 | Corrosive |
| Hydrochloric acid | Fisher Scientific | SA49 | Toxic and corrosive |
| 384-well low flange black flat bottom polystyrene NBS plates | Corning | 3575 | Plates which are suitable for fluorescence reading are required. |
| Nalgene Rapid-Flow sterile disposable bottle top filter | Thermo Scientific | 5680020 | The bottle top is fitted with 0.2 micron PES membrane |
| Disposable sterile bottles 250 mL | Corning | 430281 | A larger or smaller bottle may be used |
| 1.5 mL microcentrifuge tubes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| 0.2 mL PCR tubes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| Micropipets | No specific manufacturer | ||
| Pipet tips (non filter) of appropriate sizes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| Equipment | |||
| Plate reader | Biotek Synergy H1 | Plate readers from other manufacturers would work equally well |
Ссылки
- Shen, C., New, E. J. Promising strategies for Gd-based responsive magnetic resonance imaging contrast agents. Curr. Opin. Chem. Biol. 17 (2), 158-166 (2013).
- Cheong, B. Y. C., Muthupillai, R. Nephrogenic systemic fibrosis: a concise review for cardiologists. Tex. Heart Inst. J. 37 (5), 508-515 (2010).
- Hao, D., Ai, T., Goerner, F., Hu, X., Runge, V. M., Tweedle, M. MRI contrast agents: basic chemistry and safety. J Magn. Reson. Imaging. 36 (5), 1060-1071 (2012).
- Telgmann, L., Sperling, M., Karst, U. Determination of gadolinium-based MRI contrast agents in biological and environmental samples: a review. Anal. Chim. Acta. 764, 1-16 (2013).
- Frenzel, T., Lengsfeld, P., Schirmer, H., Hütter, J., Weinmann, H. -. J. Stability of gadolinium-based magnetic resonance imaging contrast agents in human serum at 37 degrees C. Invest. Radiol. 43 (12), 817-828 (2008).
- Loreti, V., Bettmer, J. Determination of the MRI contrast agent Gd-DTPA by SEC-ICP-MS. Anal. Bioanal. Chem. 379 (7), 1050-1054 (2004).
- Telgmann, L., et al. Speciation and isotope dilution analysis of gadolinium-based contrast agents in wastewater. Environ. Sci. Technol. 46 (21), 11929-11936 (2012).
- Cleveland, D., et al. Chromatographic methods for the quantification of free and chelated gadolinium species in MRI contrast agent formulations. Anal. Bioanal. Chem. 398 (7), 2987-2995 (2010).
- Edogun, O., Nguyen, N. H., Halim, M. Fluorescent single-stranded DNA-based assay for detecting unchelated gadolinium(III) ions in aqueous solution. Anal. Bioanal. Chem. 408 (15), 4121-4131 (2016).
- Barge, A., Cravotto, G., Gianolio, E., Fedeli, F. How to determine free Gd and free ligand in solution of Gd chelates. A technical note. Contrast Med. Mol. Imaging. 1 (5), 184-188 (2006).
- Johansson, M. K. Choosing reporter-quencher pairs for efficient quenching through formation of intramolecular dimers. Methods Mol. Biol. 335, 17-29 (2006).
- Sherry, A. D., Caravan, P., Lenkinski, R. E. A primer on gadolinium chemistry. J. Magn. Reson. Imaging. 30 (6), 1240-1248 (2009).
- Shakhverdov, T. A. A cross-relaxation mechanism of fluorescence quenching in complexes of lanthanide ions with organic ligands. Opt. Spectrosc. 95 (4), 571-580 (2003).
- Brittain, H. G. Submicrogram determination of lanthanides through quenching of calcein blue fluorescence. Anal. Chem. 59 (8), 1122-1125 (1987).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены