È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un sensore Aptamero-based per Unchelated gadolinio (III)
In questo articolo
Riepilogo
The use of polydeoxynucleotide (44-mer aptamer) molecules for sensing unchelated gadolinium(III) ion in an aqueous solution is described. The presence of the ion is detected via an increase in the fluorescence emission of the sensor.
Abstract
A method for determining the presence of unchelated trivalent gadolinium ion (Gd3+) in aqueous solution is demonstrated. Gd3+ is often present in samples of gadolinium-based contrast agents as a result of incomplete reactions between the ligand and the ion, or as a dissociation product. Since the ion is toxic, its detection is of critical importance. Herein, the design and usage of an aptamer-based sensor (Gd-sensor) for Gd3+ are described. The sensor produces a fluorescence change in response to increasing concentrations of the ion, and has a limit of detection in the nanomolar range (~100 nM with a signal-to-noise ratio of 3). The assay may be run in an aqueous buffer at ambient pH (~7 - 7.4) in a 384-well microplate. The sensor is relatively unreactive toward other physiologically relevant metal ions such as sodium, potassium, and calcium ions, although it is not specific for Gd3+ over other trivalent lanthanides such as europium(III) and terbium(III). Nevertheless, the lanthanides are not commonly found in contrast agents or the biological systems, and the sensor may therefore be used to selectively determine unchelated Gd3+ in aqueous conditions.
Introduzione
La crescente importanza della risonanza magnetica (MRI) nella diagnosi clinica, che è limitata dalla sensibilità intrinseca della tecnica, ha portato alla rapida crescita della ricerca per lo sviluppo di nuovi agenti di contrasto a base di gadolinio (GBCAs) 1. GBCAs sono molecole che vengono somministrati per migliorare la qualità dell'immagine, e che in genere hanno la struttura chimica di uno ione trivalente gadolinio (Gd 3+) coordinato ad un ligando polidentato. Questa complessazione è di importanza critica come unchelated Gd 3+ è tossico; essa è stata implicata nello sviluppo di fibrosi sistemica nefrogenica in alcuni pazienti con malattia renale o insufficienza 2. Di conseguenza, rilevando lo ione libero acquosa è fondamentale per garantire la sicurezza dei GBCAs. La presenza di unchelated Gd 3+ nelle soluzioni GBCA spesso è il risultato di una reazione incompleta tra il ligando e lo ione, la dissociazione del complesso, o displacement da altri cationi metallici biologiche 3.
Tra le varie tecniche attualmente utilizzate per la determinazione della presenza di Gd 3+, quelli che usano cromatografia e / o spettrometria grado più alto in termini di versatilità e applicabilità 4. Tra i loro punti di forza sono l'alta sensibilità e precisione, la capacità di analizzare diverse matrici di campioni (compresi siero umano 5, urine e capelli 6, acque di scarico 7 e contrasto agente formulazioni 8), e la quantificazione simultanea di più 3+ complessi di Gd (una scheda di studi prima al 2013 è descritto in una revisione completa da Telgmann et al.) 4. L'unico inconveniente è che molti di questi metodi richiedono strumentazioni (come la spettrometria di massa al plasma accoppiato induttivamente) 4 che alcuni laboratori non possono avere accesso. Nel contesto della nuova scoperta GBCA alla ricerca e livelli proof-of-concept, arMetodo elatively più conveniente, rapida e conveniente spettroscopica basata (come l'assorbimento UV-Vis o fluorescenza) può servire come una valida alternativa. Con queste applicazioni in mente, un sensore di aptameri a base acquosa fluorescente per Gd 3+ è stato sviluppato 9.
Il aptameri (Gd-aptamero) è una lunga molecola di DNA a singolo filamento 44-base con una specifica sequenza di basi che è stata isolata attraverso il processo di evoluzione sistematica dei ligandi di arricchimento esponenziale (SELEX) 9. Per adattare l'aptamero in un sensore fluorescente, un fluoroforo è attaccato al terminale 5 'del filamento, che viene quindi ibridato con un filamento di tempra (QS) con 13 basi complementari (Figura 1). Il QS è etichettato con una molecola quencher scuro al 'capolinea 3. In assenza di Gd 3+, il sensore (Gd-sensore), costituito da un rapporto 1: 2 moli di Gd-aptamero e QS rispettivamente avrà emissione di fluorescenza minima dovuta ttrasferimento di energia o dal fluoroforo alla quencher. L'aggiunta di soluzione acquosa di Gd 3+ sposterà QS dal Gd-aptamer, con un conseguente aumento di emissione di fluorescenza.
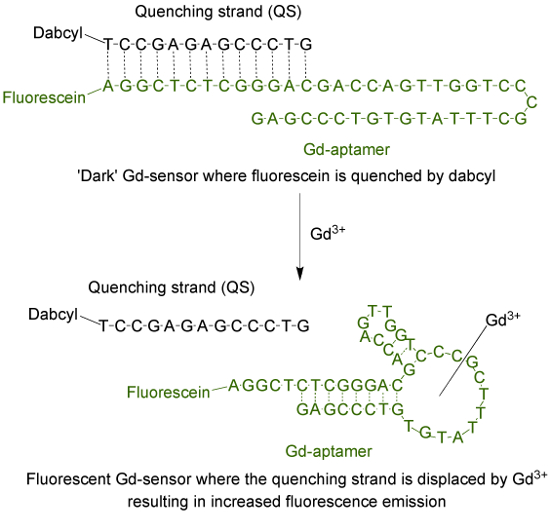
Figura 1. Il sensore (Gd-sensore) che consiste nella aptamer 44-passo lungo (Gd-aptamero) codificata con fluoresceina (un fluoroforo) e il 13-passo lungo tempra filamento (QS) contrassegnati con DABCYL (un quencher scuro) . In assenza di unchelated Gd 3+, la fluorescenza del sensore è minima. Con l'aggiunta di Gd 3+, spostamento del QS si verifica e si osserva un aumento di emissione di fluorescenza. Clicca qui per vedere una versione più grande di questa figura.
Vi è attualmente, quello comunemente usato metodo spettroscopico-based per rilevareing acquosa 3+ Gd. Questo saggio utilizza arancione xilenolo molecola, che subisce uno spostamento della lunghezza d'onda massima assorbimento dai 433 ai 573 nm su di chelazione allo ione 10. Il rapporto tra queste due assorbanza massimi può essere utilizzato per quantificare la quantità di unchelated Gd 3+. Il sensore aptamero è un'alternativa (può anche essere complementari) al dosaggio xilenolo arancio, come i due metodi hanno le condizioni di reazione (come il pH e la composizione delle soluzioni tampone utilizzato), selettività bersaglio, gamme lineari di quantificazione, e le modalità di rilevamento 9.
Protocollo
NOTA: l'acqua di biologia molecolare di grado è utilizzato in tutte le preparazioni tampone ed una soluzione. Tutti i tubi monouso (microcentrifuga e PCR) e puntali sono DNase- e RNase-free. Si prega di consultare la scheda di sicurezza (SDS) per tutte le sostanze chimiche prima dell'uso. L'utilizzo di adeguati dispositivi di protezione individuale (DPI) è fortemente raccomandato.
1. Preparazione dei aptamero archivio Solutions
- Acquisto 2 basi di polydeoxynucleotide commercio. Ordinare entrambi i filamenti con purificazione tramite cromatografia liquida ad alte prestazioni (HPLC).
Parte 1 (Gd-aptamero):
5 '- / 56-FAM / AGGCTCTCGGGACGACCAGTTGGTCCCGCTTTATGTGTCCCGAG-3'
Parte 2 (QS):
5'-GTCCCGAGAGCCT / 3Dab / -3 ' - Sciogliere ogni filo in acqua per fare 100 micron singole soluzioni di riserva del Gd-aptamer e il QS.
- Conservare queste soluzioni a -20 ° C. Le soluzioni sono stabili finora, per 3 anni.
- Per ridurre al minimo freezcicli e-disgelo, memorizzare le soluzioni madre in 10 microlitri aliquote.
2. Preparazione del 2x Gd-sensore Solution
- Preparare il tampone (20 mM HEPES, 2 mM MgCl 2, 150 mM NaCl, 5 mM KCl). Regolare il pH a ~ 7,4 con NaOH e HCl, e filtrare bottiglia migliori filtri sterili monouso con 0,2 micron membrana PES. Conservare in bottiglie sterili. Se filtrato e conservato correttamente (a temperatura ambiente), il buffer è stabile finora, per 2 anni.
- Diluire 1 ml di soluzione di Gd-aptamer magazzino (dal punto 1.2) e 2 ml di soluzione di riserva QS (dal punto 1.2) in 497 ml di tampone. Mescolare bene con un vortice. La loro concentrazione nella soluzione Gd-sensore 2x sono 200 e 400 nm, rispettivamente.
NOTA: Il volume della soluzione Gd-sensore 2x preparato in questa fase è 500 ml, che è sufficiente per testare 6 - 7 concentrazioni variabili di Gd 3+ per la curva di calibrazione e le soluzioni di contrasto(Fase 3). Ogni campione darà pozzetti duplicati in una piastra da 384 pozzetti.- Regolare il volume della soluzione di Gd-sensore 2x in base al numero di soluzioni Gd 3+ che deve essere testato.
- Trasferire la soluzione Gd-sensore 2x in 9 provette PCR, con 50 microlitri in ogni provetta. Mettere le provette in un termociclatore.
- Impostare il programma nel termociclatore per riscaldare la soluzione nei tubi a 95 ° C, tenere premuto per 5 min e quindi raffreddare lentamente la soluzione a 25 ° C sopra ~ 15 min (al tasso di ~ 0.05 - 0,1 ° C / S). Il ciclo di riscaldamento e raffreddamento è di garantire ibridazione ottimale tra il Gd-aptamer e QS. risultati parziali ibridazione in tempra incompleta e uno sfondo più elevata fluorescenza del sensore. Se un termociclatore non è disponibile, effettuare questo processo utilizzando un bagno di acqua calda, invece.
- Una volta raffreddata a 25 ° C, utilizzare immediatamente la soluzione, o mantenere nel termociclatore (fino a circa 2 h) fino al momento di essereusato. Quando un bagno di acqua viene utilizzata per il riscaldamento, lasciare le provette nel bagno come l'acqua si raffredda lentamente a temperatura ambiente.
3. costruire la curva di fluorescenza taratura e rilevare la presenza di Unchelated Gd 3+ in una soluzione di Gd Agente Contrast
- Sciogliere GdCl 3 solido nel tampone (lo stesso buffer come al punto 2.1).
- Attraverso diluizione in serie, preparare 100 ml ciascuna di 6 diverse soluzioni Gd 3+ in tubi microcentrifuga al doppio delle concentrazioni finali desiderati per la curva di calibrazione (2x soluzioni).
- Ad esempio, per costruire una calibrazione per 0 (tampone solo senza GdCl 3), 50, 100, 200, 400, e 800 nM di Gd 3+, preparare soluzioni contenenti 0, 100, 200, 400, 800, e 1600 nM dello ione. Assicurati di includere sempre il 'vuoto' con 0 ns Gd 3+ come il controllo negativo.
- Sciogliere il mezzo di contrasto per essere provaDE al tampone. Preparare 2 o 3 diverse concentrazioni delle soluzioni di contrasto tramite diluizione in serie.
NOTA: Test 3 diverse concentrazioni della soluzione di agente di contrasto è raccomandato. Questo per garantire che queste concentrazioni sono all'interno del range lineare. Se i campioni esaminati non presentano un rapporto lineare, ridurre le concentrazioni di agente di contrasto utilizzato. - Prendere le provette PCR contenente la soluzione 2x Gd-sensore dal punto 2.5 del termociclatore.
- Aggiungere 50 ml di ciascuna soluzione Gd 3+ dal punto 3.2 in 6 delle provette PCR 9 contenente la soluzione 2x Gd-sensore. Mescolare pipettando su e giù. Ogni tubo PCR contiene ora la concentrazione desiderata di Gd 3+ da testare, 100 nM Gd-aptamer, e 200 nM QS.
- Per le provette PCR restanti contenenti la soluzione Gd-sensore 2x, aggiungere 50 ml delle soluzioni di contrasto dal punto 3.3. Mescolare bene pipettando su e giù un paio di volte.
- Incubare le solutions nei tubi PCR per circa 5 min a temperatura ambiente. Essi possono essere lasciati riposare per un massimo di 30 min.
- Trasferire 45 ml di ciascun tubo in una piastra da 384 pozzetti. Ogni tubo di PCR darà pozzetti in duplicato.
- Registrare la fluorescenza di ciascun pozzetto su una piastra-reader. Il fluoroforo (FAM) utilizzati per la progettazione Gd-sensore è di eccitazione e di emissione massimi di 495 e 520 nm, rispettivamente, come indicato sul sito web del fornitore. Scegliere opportune lunghezze d'onda di eccitazione e di emissione o filtri a seconda che la piastra-lettore è monochromator- o filter-based.
- Tracciare il grafico della fluorescenza in unità di fluorescenza arbitrarie (AFU) contro la concentrazione di Gd 3+.
- Tracciare il grafico come il cambiamento di fluorescenza volte contro la concentrazione di Gd 3+. Calcolare la variazione di fluorescenza volte dividendo la AFU di ciascuna concentrazione dal AFU della soluzione 'in bianco' (con 0 nM di Gd 3+). Il cambiamento di fluorescenza piega consentirà di normalization dei risultati, qualora il display AFU alcuni periodica (diversi giorni, ecc) variazioni.
- Confrontare l'emissione di fluorescenza della soluzione contenente l'agente di contrasto e 'blank', che è la soluzione contenente 0 nM GdCl 3 (tampone solo).
NOTA: Una maggiore fluorescenza della soluzione GBCA implica la presenza di unchelated Gd 3+, che può richiedere ulteriore purificazione del mezzo di contrasto. La quantità di unchelated Gd 3+ attuale può essere stimata utilizzando la curva di calibrazione costruita nel punto 3.10 o 3.11.
Risultati
Una tipica variazione di fluorescenza della soluzione di Gd-sensore in presenza di unchelated Gd 3+ è mostrato in Figura 2. L'emissione può essere tracciata come la variazione di fluorescenza piega (Figura 2A) o la fluorescenza grezza lettura (Figura 2B) in unità arbitrarie (AFU). Entrambe le trame producono curve di calibrazione molto simili, con un intervallo lineare per le concentrazioni di Gd 3+ inferiore...
Discussione
Utilizzando il Gd-sensore aptameri base, un aumento di emissione di fluorescenza che è proporzionale alla concentrazione di unchelated Gd 3+ è osservato. Per ridurre al minimo la quantità di campione usato, il saggio può essere eseguito in 384 pozzetti micropiastra con un volume di campione totale di 45 microlitri per pozzetto. In questo disegno, la scelta di fluoresceina (FAM) e DABCYL (Dab) è basata principalmente sul costo dei reagenti; modificare la lunghezza d'onda di emissione, un diverso accop...
Divulgazioni
The authors declare that they have no competing financial interests.
Riconoscimenti
We would like to gratefully acknowledge Dr. Milan N Stojanovic from Columbia University, New York, NY for valuable scientific input. This work is supported by funding from the California State University East Bay (CSUEB) and the CSUEB Faculty Support Grant-Individual Researcher. O.E., T.C., and A.L. were supported by the CSUEB Center for Student Research (CSR) Fellowship.
Materiali
| Name | Company | Catalog Number | Comments |
| Gd-aptamer | IDTDNA | Input sequence and fluorophore modification in the order form | A fluorophore with a different emission wavelength may be used. The aptamer may also be ordered from another company. |
| Quenching strand | IDTDNA | Input sequence and quencher modification in the order form | A different quencher for optimal energy transfer from the fluorophore may be used. The aptamer may also be ordered from another company. |
| Molecular biology grade water | No specific manufacturer, both DEPC or non-DEPC treated work equally well | ||
| Gadolinium(III) chloride anhydrous | Strem | 936416 | Toxic |
| HEPES | Fisher Scientific | BP310-500 | |
| Magnesium chloride anhydrous | MP Biomedicals | 0520984480 - 100 g | |
| Sodium Chloride | Acros Organics | 327300025 | |
| Potassium chloride | Fisher Scientific | P333-500 | |
| Sodium hydroxide, pellets | Fisher Scientific | BP359 | Corrosive |
| Hydrochloric acid | Fisher Scientific | SA49 | Toxic and corrosive |
| 384-well low flange black flat bottom polystyrene NBS plates | Corning | 3575 | Plates which are suitable for fluorescence reading are required. |
| Nalgene Rapid-Flow sterile disposable bottle top filter | Thermo Scientific | 5680020 | The bottle top is fitted with 0.2 micron PES membrane |
| Disposable sterile bottles 250 mL | Corning | 430281 | A larger or smaller bottle may be used |
| 1.5 mL microcentrifuge tubes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| 0.2 mL PCR tubes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| Micropipets | No specific manufacturer | ||
| Pipet tips (non filter) of appropriate sizes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| Equipment | |||
| Plate reader | Biotek Synergy H1 | Plate readers from other manufacturers would work equally well |
Riferimenti
- Shen, C., New, E. J. Promising strategies for Gd-based responsive magnetic resonance imaging contrast agents. Curr. Opin. Chem. Biol. 17 (2), 158-166 (2013).
- Cheong, B. Y. C., Muthupillai, R. Nephrogenic systemic fibrosis: a concise review for cardiologists. Tex. Heart Inst. J. 37 (5), 508-515 (2010).
- Hao, D., Ai, T., Goerner, F., Hu, X., Runge, V. M., Tweedle, M. MRI contrast agents: basic chemistry and safety. J Magn. Reson. Imaging. 36 (5), 1060-1071 (2012).
- Telgmann, L., Sperling, M., Karst, U. Determination of gadolinium-based MRI contrast agents in biological and environmental samples: a review. Anal. Chim. Acta. 764, 1-16 (2013).
- Frenzel, T., Lengsfeld, P., Schirmer, H., Hütter, J., Weinmann, H. -. J. Stability of gadolinium-based magnetic resonance imaging contrast agents in human serum at 37 degrees C. Invest. Radiol. 43 (12), 817-828 (2008).
- Loreti, V., Bettmer, J. Determination of the MRI contrast agent Gd-DTPA by SEC-ICP-MS. Anal. Bioanal. Chem. 379 (7), 1050-1054 (2004).
- Telgmann, L., et al. Speciation and isotope dilution analysis of gadolinium-based contrast agents in wastewater. Environ. Sci. Technol. 46 (21), 11929-11936 (2012).
- Cleveland, D., et al. Chromatographic methods for the quantification of free and chelated gadolinium species in MRI contrast agent formulations. Anal. Bioanal. Chem. 398 (7), 2987-2995 (2010).
- Edogun, O., Nguyen, N. H., Halim, M. Fluorescent single-stranded DNA-based assay for detecting unchelated gadolinium(III) ions in aqueous solution. Anal. Bioanal. Chem. 408 (15), 4121-4131 (2016).
- Barge, A., Cravotto, G., Gianolio, E., Fedeli, F. How to determine free Gd and free ligand in solution of Gd chelates. A technical note. Contrast Med. Mol. Imaging. 1 (5), 184-188 (2006).
- Johansson, M. K. Choosing reporter-quencher pairs for efficient quenching through formation of intramolecular dimers. Methods Mol. Biol. 335, 17-29 (2006).
- Sherry, A. D., Caravan, P., Lenkinski, R. E. A primer on gadolinium chemistry. J. Magn. Reson. Imaging. 30 (6), 1240-1248 (2009).
- Shakhverdov, T. A. A cross-relaxation mechanism of fluorescence quenching in complexes of lanthanide ions with organic ligands. Opt. Spectrosc. 95 (4), 571-580 (2003).
- Brittain, H. G. Submicrogram determination of lanthanides through quenching of calcein blue fluorescence. Anal. Chem. 59 (8), 1122-1125 (1987).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon