Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un sensor basado en aptámero para no quelado de gadolinio (III)
En este artículo
Resumen
The use of polydeoxynucleotide (44-mer aptamer) molecules for sensing unchelated gadolinium(III) ion in an aqueous solution is described. The presence of the ion is detected via an increase in the fluorescence emission of the sensor.
Resumen
A method for determining the presence of unchelated trivalent gadolinium ion (Gd3+) in aqueous solution is demonstrated. Gd3+ is often present in samples of gadolinium-based contrast agents as a result of incomplete reactions between the ligand and the ion, or as a dissociation product. Since the ion is toxic, its detection is of critical importance. Herein, the design and usage of an aptamer-based sensor (Gd-sensor) for Gd3+ are described. The sensor produces a fluorescence change in response to increasing concentrations of the ion, and has a limit of detection in the nanomolar range (~100 nM with a signal-to-noise ratio of 3). The assay may be run in an aqueous buffer at ambient pH (~7 - 7.4) in a 384-well microplate. The sensor is relatively unreactive toward other physiologically relevant metal ions such as sodium, potassium, and calcium ions, although it is not specific for Gd3+ over other trivalent lanthanides such as europium(III) and terbium(III). Nevertheless, the lanthanides are not commonly found in contrast agents or the biological systems, and the sensor may therefore be used to selectively determine unchelated Gd3+ in aqueous conditions.
Introducción
La creciente importancia de la formación de imágenes por resonancia magnética (MRI) en el diagnóstico clínico, que está limitado por la sensibilidad inherente de la técnica, ha dado como resultado el rápido crecimiento de la investigación en el desarrollo de nuevos agentes de contraste a base de gadolinio (GBCAs) 1. GBCAs son moléculas que se administran para mejorar la calidad de la imagen, y por lo general tienen la estructura química de un ion trivalente de gadolinio (Gd 3+) coordinado a un ligando polidentado. Esta formación de complejos es de importancia crítica que no quelado Gd 3+ es tóxico; se ha implicado en el desarrollo de fibrosis sistémica nefrogénica en algunos pacientes con enfermedad renal o insuficiencia 2. En consecuencia, la detección del ion libre acuosa es fundamental para garantizar la seguridad de GBCAs. La presencia de no quelado Gd 3+ en soluciones GBCA a menudo es el resultado de una reacción incompleta entre el ligando y el de iones, la disociación del complejo, o displacement por otros cationes metálicos biológicos 3.
Entre las diversas técnicas que actualmente se utilizan para determinar la presencia de Di-s 3+, aquellos que dependen de cromatografía y / o rango más alto espectrometría en términos de versatilidad y aplicabilidad 4. Entre sus puntos fuertes son de alta sensibilidad y precisión, la capacidad de analizar diversas matrices de muestra (incluyendo suero humano 5, la orina y el pelo 6, aguas residuales 7, y formulaciones de agentes de contraste 8), y la cuantificación simultánea de múltiples complejos de Gd + 3 (un listado de los estudios anteriores a 2013 se describe en una revisión exhaustiva por Telgmann et al.) 4. El único inconveniente es que varios de estos métodos requieren instrumentaciones (como la espectrometría de masas con plasma acoplado inductivamente) 4 que algunos laboratorios no pueden tener acceso a. En el contexto de descubrimiento novedoso GBCA en la investigación y los niveles de prueba de concepto, arbasado en el método espectroscópico elatively más conveniente, rápida y rentable (tales como absorción UV-Vis o fluorescencia) puede servir como una alternativa valiosa. Con estas aplicaciones en mente, un sensor basado en aptámero fluorescente para acuosa Gd 3 + 9 fue desarrollado.
El aptámero (Gd-aptámero) es una larga molécula de ADN de una sola hebra 44-base con una secuencia específica de bases que se aisló a través del proceso de evolución sistemática de ligandos por enriquecimiento exponencial (SELEX) 9. Para adaptar el aptámero en un sensor fluorescente, un fluoróforo está unido al terminal 5 'de la hebra, que después se hibridó con una hebra de temple (QS) a través de 13 bases complementarias (Figura 1). El QS está marcado con una molécula extintor oscuro en el extremo 3 '. En ausencia de Gd 3 +, el sensor (Gd-sensor), compuesto por una relación molar 1: 2 de Gd-aptámero y QS, respectivamente, tendrán mínima emisión de fluorescencia debido to transferencia de energía desde el fluoróforo al extintor. La adición de acuoso Gd 3+ desplazará al QS del Gd-aptámero, resultando en un aumento de la emisión de fluorescencia.
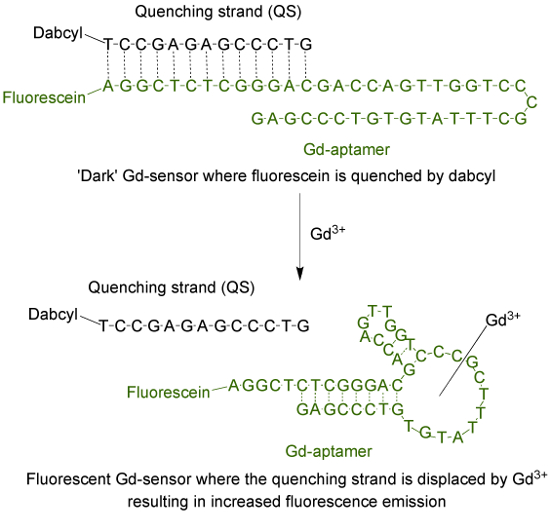
La Figura 1. El sensor (Gd-sensor) que consiste en el largo aptámero 44-base (Gd-aptámero) etiquetadas con fluoresceína (un fluoróforo) y el filamento 13-base largo de temple (QS) etiquetadas con DABCYL (un extintor oscuro) . En ausencia de no quelado Gd 3+, la fluorescencia del sensor es mínimo. Con la adición de Gd 3+, el desplazamiento de la QS se produce y se observa un aumento en la emisión de fluorescencia. Haga clic aquí para ver una versión más grande de esta figura.
Hay en la actualidad, un método basado en la espectroscopia de uso general para detectaring 3+ acuosa Di-s. Este ensayo utiliza el anaranjado de xilenol molécula, que se somete a un cambio en la longitud de onda de absorción máxima 433 a 573 nm sobre la quelación con el ion 10. La relación de estos máximos dos absorbancia se puede utilizar para cuantificar la cantidad de no quelado Gd 3+. El sensor de aptámero es una alternativa (también puede ser complementaria) con el ensayo de naranja de xilenol, como los dos métodos tienen diferentes condiciones de reacción (tales como el pH y la composición de las soluciones tampón se utiliza), selectividades de destino, los rangos lineales de cuantificación, y las modalidades de detección 9.
Protocolo
NOTA: agua de calidad de biología molecular se utiliza en todas las preparaciones de tampón y de solución. Todos los tubos de microcentrífuga desechables (y PCR) y puntas de pipeta son DNasa y RNasa libre. Por favor consulte la hoja de datos de seguridad del material (MSDS) para todos los productos químicos antes de su uso. Se recomienda el uso de equipo de protección personal (EPP) apropiado.
1. Preparación de los aptámeros de archivo Soluciones
- Compra 2 hebras de polidesoxinucleótido comercialmente. Ordenar ambas cadenas con la purificación mediante cromatografía líquida de alta resolución (HPLC).
MODALIDAD 1 (Gd-aptámero):
5 '- / 56-FAM / AGGCTCTCGGGACGACCAGTTGGTCCCGCTTTATGTGTCCCGAG-3'
Capítulo 2 (QS):
5'-GTCCCGAGAGCCT / 3Dab / -3 ' - Disolver cada hebra en agua para hacer 100 mM de soluciones madre individuales del Gd-aptámero y el QS.
- Almacenar estas soluciones a -20 ° C. Las soluciones son estables hasta la fecha, durante 3 años.
- Para minimizar Freezciclos de e-descongelación, almacenar las soluciones madre en 10 alícuotas.
2. Preparación de la 2x Gd-sensor Solution
- Preparar el tampón de ensayo (HEPES 20 mM, 2 mM MgCl2, NaCl 150 mM, KCl 5 mM). Ajustar el pH a ~ 7,4 con NaOH y HCl, y filtrar a través de filtros estériles desechables botella superiores a los 0,2 micras membrana de PES. Almacenar en frascos estériles. Si se filtra y se almacena adecuadamente (a temperatura ambiente), el tampón es estable hasta el momento, por 2 años.
- Diluir 1 l de la solución de Gd-aptámero de la (del paso 1.2) y 2 l de la solución madre de QS (de la etapa 1.2) en 497 l de tampón de ensayo. Mezclar bien usando un vórtice. Sus concentraciones en la solución de Gd-sensor 2x son 200 nM y 400 nM, respectivamente.
Nota: El volumen de la solución de Gd-sensor 2x preparado en este paso es de 500 l, que es suficiente para poner a prueba 6 - 7 concentraciones variables de Gd 3+ para la curva de calibración y las soluciones de agentes de contraste(paso 3). Cada muestra dará a pocillos duplicados de una placa de 384 pocillos.- Ajustar el volumen de la solución de Gd-sensor 2x de acuerdo con el número de soluciones de Gd 3+ que tiene que ser probado.
- Transferir la solución de Gd-sensor de 2x en 9 tubos de PCR, con 50 l en cada tubo. Colocar los tubos en un termociclador.
- Ajuste el programa en el ciclador térmico para calentar la solución en los tubos a 95 ° C, mantener durante 5 min, y luego enfriar lentamente las soluciones a 25 ° C durante ~ 15 min (a razón de ~ 0,05-0,1 ° C / s). El ciclo de calentamiento y enfriamiento es asegurar la hibridación óptima entre el Di-s-aptámero y el QS. resultados de la hibridación parciales en temple incompleta y un fondo más alta de fluorescencia del sensor. Si un termociclador no está disponible, llevar a cabo este procedimiento utilizando un baño de agua caliente en su lugar.
- Una vez enfriado a 25 ° C, utilizar inmediatamente la solución, o mantener en el termociclador (hasta alrededor de 2 h) hasta que esté listo para serusado. Cuando se utiliza un baño de agua para el calentamiento, dejar los tubos en el baño como el agua se enfría lentamente a temperatura ambiente.
3. La construcción de la curva de calibración de fluorescencia y detectar la presencia de no quelado Gd 3+ en una solución de agente de contraste Gd
- Disolver GdCl 3 sólido en el tampón de ensayo (el mismo tampón que en el paso 2.1).
- A través de dilución en serie, preparar 100 l cada uno de 6 diferentes soluciones Gd 3+ en tubos de microcentrífuga a doble de las concentraciones finales deseadas para la curva de calibración (2x soluciones).
- Por ejemplo, para construir una calibración para 0 (sólo tampón sin GdCl 3), 50, 100, 200, 400, y 800 nM de Gd 3+, preparar soluciones que contienen 0, 100, 200, 400, 800, y 1600 nM del ión. Asegúrese de que siempre incluyen el "blanco" con 0 nM Gd 3 + como control negativo.
- Se disuelve el agente de contraste para ser pruebaed en el tampón de ensayo. Preparar 2 o 3 concentraciones diferentes de las soluciones de agentes de contraste a través de dilución en serie.
NOTA: Prueba de 3 concentraciones diferentes de la solución de agente de contraste se recomienda. Esto es para asegurar que estas concentraciones están dentro del rango lineal. Si las muestras analizadas no muestran una relación lineal, reducen las concentraciones del agente de contraste utilizado. - Tomar los tubos de PCR que contienen la solución 2x Di-s-sensor desde el paso 2.5 del termociclador.
- Añadir 50 l de cada solución de Gd 3+ desde el paso 3.2 en 6 de los 9 tubos de PCR que contienen la solución 2x Di-s-sensor. Mezclar pipeteando arriba y abajo. Cada tubo de PCR contiene ahora la concentración deseada de Gd 3+ a ensayar, 100 nM Gd-aptámero, y 200 QS nm.
- Para los tubos de PCR restantes que contienen la solución de Gd-sensor de 2x, se añaden 50 l de las soluciones de agentes de contraste desde el paso 3.3. Mezclar bien pipeteando arriba y abajo varias veces.
- Se incuban las soluciones en los tubos de PCR para alrededor de 5 min a temperatura ambiente. Pueden dejarse reposar durante hasta 30 minutos.
- Transferir 45 l de cada tubo en una placa de 384 pocillos. Cada tubo de PCR dará pocillos duplicados.
- Registrar la fluorescencia de cada pocillo en un lector de placas. El fluoróforo (FAM) utilizado en el diseño de Gd-sensor tiene máximos de excitación y emisión de 495 y 520 nm, respectivamente, como se indica en el sitio web del proveedor. Elija longitudes de onda de excitación y emisión apropiados o filtros en función de si el lector de placas es monochromator- o basado en filtro.
- Trazar la gráfica de la fluorescencia en unidades arbitrarias de fluorescencia (AFU) frente a la concentración de Gd 3+.
- Hacer el gráfico como factor de cambio de fluorescencia frente a la concentración de Gd 3+. Calcular el factor de cambio de fluorescencia dividiendo el AFU de cada concentración por el AFU de la solución "en blanco" (con 0 nM de Gd 3+). El pliegue del cambio de fluorescencia permitirá la normalization de los resultados, en caso de que la pantalla AFU algunos periódica (diferentes días, etc.) variaciones.
- Comparación de la emisión de fluorescencia de la solución que contiene el agente de contraste y el "en blanco", que es la solución que contiene 0 nM GdCl 3 (sólo tampón).
NOTA: una mayor fluorescencia de la solución GBCA implica la presencia de no quelado Gd 3+, que pueden requerir una purificación adicional del agente de contraste. La cantidad de presente no quelado Gd 3+ se puede estimar utilizando la curva de calibración construida en el paso 3.10 o 3.11.
Resultados
Un cambio de fluorescencia típico de la solución de Gd-sensor en presencia de no quelado Gd 3+ se muestra en la Figura 2. La emisión puede ser trazado como el pliegue del cambio de fluorescencia (Figura 2A) o de la lectura de fluorescencia en bruto (Figura 2B) en unidades arbitrarias (AFU). Ambas parcelas producen curvas de calibración muy similares con un rango lineal para las concentraciones de Gd 3+ por debaj...
Discusión
Usando el Gd-sensor basado en aptámero, un aumento en la emisión de fluorescencia que es proporcional a la concentración de Gd no quelado 3+ se observa. Para minimizar la cantidad de muestra utilizada, el ensayo se puede ejecutar en una microplaca de 384 pocillos con un volumen total de la muestra de 45 l por pocillo. En este diseño, la elección de fluoresceína (FAM) y DABCYL (Dab) se basa principalmente en el coste de los reactivos; para modificar la longitud de onda de emisión, una pareja diferente d...
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
We would like to gratefully acknowledge Dr. Milan N Stojanovic from Columbia University, New York, NY for valuable scientific input. This work is supported by funding from the California State University East Bay (CSUEB) and the CSUEB Faculty Support Grant-Individual Researcher. O.E., T.C., and A.L. were supported by the CSUEB Center for Student Research (CSR) Fellowship.
Materiales
| Name | Company | Catalog Number | Comments |
| Gd-aptamer | IDTDNA | Input sequence and fluorophore modification in the order form | A fluorophore with a different emission wavelength may be used. The aptamer may also be ordered from another company. |
| Quenching strand | IDTDNA | Input sequence and quencher modification in the order form | A different quencher for optimal energy transfer from the fluorophore may be used. The aptamer may also be ordered from another company. |
| Molecular biology grade water | No specific manufacturer, both DEPC or non-DEPC treated work equally well | ||
| Gadolinium(III) chloride anhydrous | Strem | 936416 | Toxic |
| HEPES | Fisher Scientific | BP310-500 | |
| Magnesium chloride anhydrous | MP Biomedicals | 0520984480 - 100 g | |
| Sodium Chloride | Acros Organics | 327300025 | |
| Potassium chloride | Fisher Scientific | P333-500 | |
| Sodium hydroxide, pellets | Fisher Scientific | BP359 | Corrosive |
| Hydrochloric acid | Fisher Scientific | SA49 | Toxic and corrosive |
| 384-well low flange black flat bottom polystyrene NBS plates | Corning | 3575 | Plates which are suitable for fluorescence reading are required. |
| Nalgene Rapid-Flow sterile disposable bottle top filter | Thermo Scientific | 5680020 | The bottle top is fitted with 0.2 micron PES membrane |
| Disposable sterile bottles 250 mL | Corning | 430281 | A larger or smaller bottle may be used |
| 1.5 mL microcentrifuge tubes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| 0.2 mL PCR tubes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| Micropipets | No specific manufacturer | ||
| Pipet tips (non filter) of appropriate sizes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| Equipment | |||
| Plate reader | Biotek Synergy H1 | Plate readers from other manufacturers would work equally well |
Referencias
- Shen, C., New, E. J. Promising strategies for Gd-based responsive magnetic resonance imaging contrast agents. Curr. Opin. Chem. Biol. 17 (2), 158-166 (2013).
- Cheong, B. Y. C., Muthupillai, R. Nephrogenic systemic fibrosis: a concise review for cardiologists. Tex. Heart Inst. J. 37 (5), 508-515 (2010).
- Hao, D., Ai, T., Goerner, F., Hu, X., Runge, V. M., Tweedle, M. MRI contrast agents: basic chemistry and safety. J Magn. Reson. Imaging. 36 (5), 1060-1071 (2012).
- Telgmann, L., Sperling, M., Karst, U. Determination of gadolinium-based MRI contrast agents in biological and environmental samples: a review. Anal. Chim. Acta. 764, 1-16 (2013).
- Frenzel, T., Lengsfeld, P., Schirmer, H., Hütter, J., Weinmann, H. -. J. Stability of gadolinium-based magnetic resonance imaging contrast agents in human serum at 37 degrees C. Invest. Radiol. 43 (12), 817-828 (2008).
- Loreti, V., Bettmer, J. Determination of the MRI contrast agent Gd-DTPA by SEC-ICP-MS. Anal. Bioanal. Chem. 379 (7), 1050-1054 (2004).
- Telgmann, L., et al. Speciation and isotope dilution analysis of gadolinium-based contrast agents in wastewater. Environ. Sci. Technol. 46 (21), 11929-11936 (2012).
- Cleveland, D., et al. Chromatographic methods for the quantification of free and chelated gadolinium species in MRI contrast agent formulations. Anal. Bioanal. Chem. 398 (7), 2987-2995 (2010).
- Edogun, O., Nguyen, N. H., Halim, M. Fluorescent single-stranded DNA-based assay for detecting unchelated gadolinium(III) ions in aqueous solution. Anal. Bioanal. Chem. 408 (15), 4121-4131 (2016).
- Barge, A., Cravotto, G., Gianolio, E., Fedeli, F. How to determine free Gd and free ligand in solution of Gd chelates. A technical note. Contrast Med. Mol. Imaging. 1 (5), 184-188 (2006).
- Johansson, M. K. Choosing reporter-quencher pairs for efficient quenching through formation of intramolecular dimers. Methods Mol. Biol. 335, 17-29 (2006).
- Sherry, A. D., Caravan, P., Lenkinski, R. E. A primer on gadolinium chemistry. J. Magn. Reson. Imaging. 30 (6), 1240-1248 (2009).
- Shakhverdov, T. A. A cross-relaxation mechanism of fluorescence quenching in complexes of lanthanide ions with organic ligands. Opt. Spectrosc. 95 (4), 571-580 (2003).
- Brittain, H. G. Submicrogram determination of lanthanides through quenching of calcein blue fluorescence. Anal. Chem. 59 (8), 1122-1125 (1987).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados