A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
חיישן מבוסס-Aptamer עבור Unchelated גדוליניום (III)
In This Article
Summary
The use of polydeoxynucleotide (44-mer aptamer) molecules for sensing unchelated gadolinium(III) ion in an aqueous solution is described. The presence of the ion is detected via an increase in the fluorescence emission of the sensor.
Abstract
A method for determining the presence of unchelated trivalent gadolinium ion (Gd3+) in aqueous solution is demonstrated. Gd3+ is often present in samples of gadolinium-based contrast agents as a result of incomplete reactions between the ligand and the ion, or as a dissociation product. Since the ion is toxic, its detection is of critical importance. Herein, the design and usage of an aptamer-based sensor (Gd-sensor) for Gd3+ are described. The sensor produces a fluorescence change in response to increasing concentrations of the ion, and has a limit of detection in the nanomolar range (~100 nM with a signal-to-noise ratio of 3). The assay may be run in an aqueous buffer at ambient pH (~7 - 7.4) in a 384-well microplate. The sensor is relatively unreactive toward other physiologically relevant metal ions such as sodium, potassium, and calcium ions, although it is not specific for Gd3+ over other trivalent lanthanides such as europium(III) and terbium(III). Nevertheless, the lanthanides are not commonly found in contrast agents or the biological systems, and the sensor may therefore be used to selectively determine unchelated Gd3+ in aqueous conditions.
Introduction
החשיבות הגוברת של דימות תהודה מגנטית (MRI) באבחון קליני, אשר מוגבל על ידי רגישות הטבועה של הטכניקה, הביאה את הצמיחה המהירה של המחקר על פיתוח של חומרי ניגוד מבוססי גדוליניום רומן (GBCAs) 1. GBCAs הם מולקולות אשר מנוהלים על מנת לשפר את איכות התמונה, ובדרך כלל יש להם את המבנה הכימי של יון גדוליניום trivalent (ה 3+) מתואם ליגנד polydentate. Complexation זה הוא בעל חשיבות קריטית כפי שהקב"ה unchelated 3+ הוא רעיל; זה כבר לידי ביטוי בהתפתחות של סיסטיק מערכתית nephrogenic בחלק מהחולים עם מחלת כליות או אי ספיקת 2. כתוצאה מכך, הקולט את היון חינם המימי הוא סייע להבטיח את שלומם של GBCAs. הנוכחות של 3+ unchelated הקב"ה בפתרונות GBCA לעתים קרובות היא תוצאה של תגובה מלאה בין ליגנד ואת יון, דיסוציאציה של המתחם, או displacement ידי קטיונים מתכת ביולוגיים אחרים 3.
בין מספר טכניקות המשמשות כיום לקביעת הנוכחות של קב"ה 3+, שמסתמך על כרומטוגרפיה ו / או דרגת ספקטרומטריית הגבוהה ביותר מבחינת צדדיות ותחולה 4. בין שאר מעלותיו שלהם גבוהה רגישות ודיוק, היכולת לנתח מטריצות מדגם שונות (כולל בסרום אדם 5, שתן ושיער 6, שפכים 7, ועל ניסוחים חומר ניגוד 8), ואת כימות סימולטני של מתחמי ה 3+ מרובים (הרישום של מחקרים קודמים עד 2013 מתוארת סקירה מקיפה על ידי Telgmann et al.) 4. החסרון היחיד הוא כי כמה שיטות אלה דורשים instrumentations (כגון מצמידי אינדוקטיבי ספקטרומטריית פלזמה המונית) 4 כי מעבדות מסוימות עשויות לא תהיינה גישה. במסגרת גילוי GBCA רומן על מחקר הוכחה של קונספט רמות, arelatively יותר נוחה, מהירה, וחסכוני שיטה מבוססת ספקטרוסקופיות (כגון ספיג או קרינת UV-Vis) עשויה לשמש אלטרנטיבה יקרה. בעזרת יישומים אלה בחשבון, חיישן פלורסנט מבוסס aptamer עבור מימיית אלוקים 3+ פותח 9.
Aptamer (חס-aptamer) הוא מולקולת DNA חד-גדילי ארוך 44-בסיס עם רצף של בסיסים כי היה מבודד בתהליך האבולוציה שיטתית של ligands על ידי העשרה מעריכי (Selex) 9. כדי להתאים את aptamer לתוך חיישן ניאון, fluorophore מחוברת התחנה הסופית '5 של גדיל, אשר הוא הכלאה ואז עם גדיל מרווה (QS) באמצעות 13 בסיסים משלימים (איור 1). QS מתויג עם מולקולת מרווה בחושך ב 3 התחנה הסופית '. בהיעדר ה 3+, החיישן (חס-חיישן), מורכב ביחס של 1: 2 חפרפרת של הקב"ה-aptamer ו QS בהתאמה, יהיה t בשל פליטת קרינה מינימאליתo העברת אנרגיה מן fluorophore אל מרווה. התוספת של מימית אלוקים 3+ יהיה לעקור את QS מן הקב"ה-aptamer, וכתוצאה מכך גידול פליטת הקרינה.
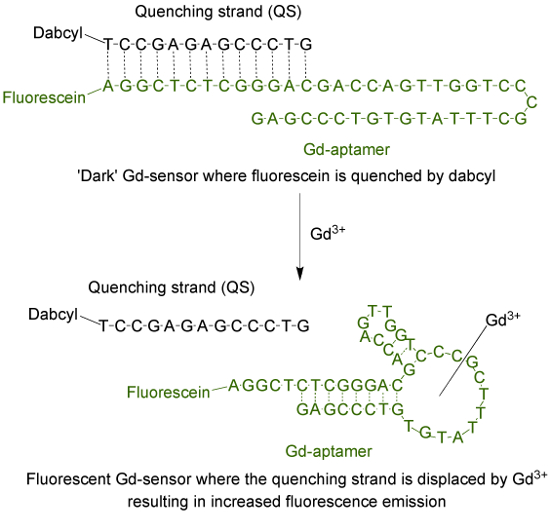
איור 1. החיישן (חס-חיישן) שמורכב של aptamer הארוך 44-הבסיס (-aptamer ה ') מתויג עם והעמסה (א fluorophore) ואת גדיל המרווה ארוך 13-בסיס (QS) מתויג עם dabcyl (א מרווה כהה) . בהעדר unchelated אלוקים 3+, הקרינה של החיישן היא מינימלית. עם תוספת של הקב"ה 3+, עקירה של QS מתרחשת וגידול פליטת הקרינה הוא ציין. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
יש כרגע, אחד נפוצה מבוסס ספקטרוסקופיות שיטה לזהותing 3+ אלוקים מימי. Assay זו משתמשת תפוז xylenol מולקולה, אשר עוברת שינוי אורך הגל קליטה מקסימלית מפני 433 עד 573 ננומטר על קלאציה אל יון 10. יחס מקסימום ספיגת שני אלה יכולים לשמש כדי לכמת את כמות unchelated אלוקים 3+. חיישן aptamer מהווה חלופה (יכול להיות גם משלים) אל assay הכתום xylenol, כמו שתי השיטות יש תנאי תגובה שונים (כגון pH ורכב של תמיסות בופר בשימוש), selectivities היעד, טווח ליניארי של כימות, ואופני זיהוי 9.
Protocol
הערה: מי כיתה וביולוגיה מולקולריים משמשים בכל הכנות חיץ פתרון. כל הצינורות הפנויים (microcentrifuge ו- PCR) וטיפי pipet הם DNase- ו RNase חינם. יש להתייעץ עם גיליון נתוני בטיחות חומרים (MSDS) עבור כל הכימיקלים לפני השימוש. שימוש בציוד מגן אישי מתאים (PPE) מומלץ בחום.
1. הכנת פתרונות מניות Aptamer
- לרכוש 2 קווצות polydeoxynucleotide מסחרית. להזמין שני גדילים עם טיהור באמצעות כרומטוגרפיה נוזלית ביצועים גבוהים (HPLC).
גדיל 1 (-aptamer ה '):
5 '- / 56-FAM / AGGCTCTCGGGACGACCAGTTGGTCCCGCTTTATGTGTCCCGAG-3 "
סטרנד 2 (QS):
5'-GTCCCGAGAGCCT / 3Dab / -3 ' - ממיסים כל קווצה מים לעשות 100 פתרונות מניות בודדות מיקרומטר של aptamer-ה 'ואת QS.
- אחסן פתרונות אלה ב -20 ° C. הפתרונות הם יציבים עד כה, במשך 3 שנים.
- כדי למזער FreeZדואר ההפשרה מחזורים, לאחסן את פתרונות המניות ב 10 aliquots μL.
2. הכנת הפתרון-חיישן ה 2x
- הכן את החיץ assay (20 HEPES מ"מ, 2 מ"מ MgCl 2, 150 מ"מ NaCl, KCl 5 מ"מ). התאם את ה- pH ל ~ 7.4 עם NaOH ו HCl, ולסנן דרך מסננים העליון בקבוק חד פעמי סטרילי עם קרום 0.2 מיקרומטר PES. אחסן בבקבוקים סטריליים. אם מסונן מאוחסן כראוי (בטמפרטורת החדר), למאגר יציב עד כה, עבור 2 שנים.
- לדלל 1 μL של פתרון ה-aptamer המניות (משלב 1.2) ו -2 μL של פתרון המניות QS (משלב 1.2) ב 497 μL של חיץ assay. מערבבים היטב בעזרת מערבולת. הריכוזים שלהם בפתרון ה-חיישן 2x הם 200 ננומטר ו 400 ננומטר, בהתאמה.
הערה: היקף הפתרון ה-חיישן 2x מוכן בשלב זה הוא 500 μL, וזה מספיק כדי לבדוק 6 - 7 ריכוזים שונים של אלוקים 3+ עבור עקומת הכיול ואת הפתרונות חומר ניגוד(שלב 3). כל דגימה תיתן בארות כפולות צלחת 384 גם.- כוון את עוצמת הקול של פתרון 2x אלוקים-החיישן פי מספר פתרונות 3+ האלוקים שצריך להיבדק.
- מעבירים את הפתרון-חיישן ה 2x ל -9 צינורות PCR, עם 50 μL לתוך צינור אחד. מניחים את צינורות Cycler תרמית.
- הגדר את תוכנית Cycler התרמית כדי לחמם את הפתרון המוצע עבור צינורות עד 95 מעלות צלזיוס, להחזיק למשך 5 דקות, ואז לאט לאט לקרר את פתרונות ל -25 מעלות צלזיוס מעל ~ 15 דקות (בשיעור של ~ 0.05 - 0.1 ° C / ים). מחזור החימום וקירור הוא להבטיח הכלאה אופטימלית בין aptamer-ה 'ואת QS. תוצאות הכלאה חלקית מרווה שלמה קרינת רקע גבוהה של החיישן. אם Cycler תרמית אינו זמין, לבצע את התהליך הזה באמצעות אמבט מים חמים במקום.
- לאחר מצונן עד 25 מעלות צלזיוס, מיד להשתמש הפתרון, או לשמור Cycler התרמית (עד כ 2 שעות) עד מוכן להיותמְשׁוּמָשׁ. כאשר באמבט מים משמש למערכות החימום, לעזוב את הצינורות באמבטיה כמו המים מתקררים לאט לטמפרטורת חדר.
3. בניית עקומת כיול הקרינה לאיתור נוכחות של הקב"ה Unchelated 3+ בתמיסה של חומר ניגוד אלוקים
- ממיסים GdCl 3 מוצק למאגר assay (אותו למאגר כמו בשלב 2.1).
- באמצעות דילול סדרתי, להכין 100 μL כל אחד 6 פתרונות 3+ שוני אלוקים צינורות microcentrifuge ב כפול הריכוזים הרצויים הסופיים עבור עקומת הכיול (2x פתרונות).
- לדוגמה, כדי לבנות כיול עבור 0 (מאגר בלבד ללא GdCl 3), 50, 100, 200, 400, ו -800 ננומטר של הקב"ה 3+, להכין תמיסות המכילות 0, 100, 200, 400, 800, ו -1,600 ננומטר של היון. הקפד תמיד לכלול את "אטומים" עם 0 ננומטר אלוקים 3+ כמו שליטה שלילית.
- ממיסים את חומר ניגוד להיות מבחןאד למאגר assay. כן 2 או 3 ריכוזים שונים של פתרונות חומר ניגוד דרך דילול סדרתי.
הערה: בדיקת 3 ריכוזים שונים של פתרון חומר ניגוד מומלצת. זו היא להבטיח כי ריכוזים אלה נמצאים בטווח ליניארי. אם בדגימות שנבדקו אינו מציג קשר לינארי, הקטינו את הריכוזים של חומר הניגוד בשימוש. - קח את צינורות PCR המכיל את פתרון 2x אלוקים-חיישן משלב 2.5 מתוך Cycler התרמית.
- הוסף 50 μL של כל פתרון ה 3+ משלב 3.2 לתוך 6 מתוך 9 צינורות PCR המכיל את פתרון 2x אלוקים-חיישן. מערבבים על ידי pipetting למעלה ולמטה. כל צינור PCR מכיל כעת את הריכוז הרצוי של הקב"ה 3+ להיבדק, 100 ננומטר אלוקים-aptamer, ו -200 ננומטר QS.
- אל צינורות הנותרים PCR המכיל את פתרון 2x אלוקים-חיישן, להוסיף 50 μL של פתרונות חומר ניגוד משלב 3.3. מערבבים היטב על ידי pipetting למעלה ולמטה כמה פעמים.
- דגירה שלolutions בתוך צינורות PCR במשך כ 5 דקות בטמפרטורת החדר. הם עשויים להיות שנותרו לעמוד עד 30 דקות.
- העבר 45 μL של כל צינור לתוך צלחת 384 גם. כל צינור PCR ייתן בארות כפולות.
- רשום את הקרינה של כל אחד גם על קורא צלחת. Fluorophore (FAM) המשמש לעיצוב חיישן-ה 'יש מקסימום עירור ופליטה של ננומטר 495 ו -520 בהתאמה, כמפורט באתר האינטרנט של הספק. בחר אורכי גל עירור ופליטה מתאימים או מסנן תלויים אם הצליח-הקורא monochromator- או מסנן מבוסס.
- שרטט את הגרף של קרינה ביחידות קרינה שרירותיות (עפו) נגד ריכוז של קב"ה 3+.
- שרטט את הגרף כמו שינוי לקפל הקרינה נגד ריכוז של הקב"ה 3+. חשב את השינוי לקפל הקרינה על ידי חלוקת עפו של כל ריכוז ידי עפו של הפתרון "אטומים" (עם 0 ננומטר של הקב"ה 3+). השינוי לקפל קרינה יאפשר עבור normalization של התוצאות, צריך התצוגה עפה עת מסוימת (בימים שונים, וכו ') וריאציות.
- השווה את פליטת הקרינה של תמיסה המכילה חומר הניגוד ו 'ריק', המהווה את התמיסה המכילה 0 ננומטר GdCl 3 (מאגר בלבד).
הערה: קרינה גבוהה יותר של פתרון GBCA מרמזת על הנוכחות של unchelated אלוקים 3+, אשר עשוי להצריך טיהור נוספת של חומר הניגוד. הכמות הנוכחית 3+ unchelated האלוקים ניתן להעריך באמצעות עקומת הכיול נבנתה בשלב 3.10 או 3.11.
תוצאות
שינוי קרינה אופייני הפתרון ה-החיישן בנוכחות unchelated אלוקים 3+ מוצג באיור 2. הפליטה ניתן להתוות כשינוי לקפל פלואורסצנטי (איור 2 א) או את קרינת הגלם לקרוא (תרשים 2B) ביחידות כלשהן (עף). מגרשי שני להניב עקומות כיול דומות מאוד ?...
Discussion
שימוש בחיישן ה-מבוסס aptamer, גידול פליטת קרינה כי היא יחסית ריכוז unchelated אלוקים 3+ הוא ציין. כדי למזער את כמות מדגם, assay ניתן לרוץ microplate 384 גם עם נפח דגימה כולל של 45 μL לכל טוב. בתכנון זה, הבחירה של והעמסה (FAM) ו dabcyl (DAB) התבססה בעיקר על העלות של החומרים הכימיים; כדי לשנות את ...
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
We would like to gratefully acknowledge Dr. Milan N Stojanovic from Columbia University, New York, NY for valuable scientific input. This work is supported by funding from the California State University East Bay (CSUEB) and the CSUEB Faculty Support Grant-Individual Researcher. O.E., T.C., and A.L. were supported by the CSUEB Center for Student Research (CSR) Fellowship.
Materials
| Name | Company | Catalog Number | Comments |
| Gd-aptamer | IDTDNA | Input sequence and fluorophore modification in the order form | A fluorophore with a different emission wavelength may be used. The aptamer may also be ordered from another company. |
| Quenching strand | IDTDNA | Input sequence and quencher modification in the order form | A different quencher for optimal energy transfer from the fluorophore may be used. The aptamer may also be ordered from another company. |
| Molecular biology grade water | No specific manufacturer, both DEPC or non-DEPC treated work equally well | ||
| Gadolinium(III) chloride anhydrous | Strem | 936416 | Toxic |
| HEPES | Fisher Scientific | BP310-500 | |
| Magnesium chloride anhydrous | MP Biomedicals | 0520984480 - 100 g | |
| Sodium Chloride | Acros Organics | 327300025 | |
| Potassium chloride | Fisher Scientific | P333-500 | |
| Sodium hydroxide, pellets | Fisher Scientific | BP359 | Corrosive |
| Hydrochloric acid | Fisher Scientific | SA49 | Toxic and corrosive |
| 384-well low flange black flat bottom polystyrene NBS plates | Corning | 3575 | Plates which are suitable for fluorescence reading are required. |
| Nalgene Rapid-Flow sterile disposable bottle top filter | Thermo Scientific | 5680020 | The bottle top is fitted with 0.2 micron PES membrane |
| Disposable sterile bottles 250 mL | Corning | 430281 | A larger or smaller bottle may be used |
| 1.5 mL microcentrifuge tubes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| 0.2 mL PCR tubes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| Micropipets | No specific manufacturer | ||
| Pipet tips (non filter) of appropriate sizes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| Equipment | |||
| Plate reader | Biotek Synergy H1 | Plate readers from other manufacturers would work equally well |
References
- Shen, C., New, E. J. Promising strategies for Gd-based responsive magnetic resonance imaging contrast agents. Curr. Opin. Chem. Biol. 17 (2), 158-166 (2013).
- Cheong, B. Y. C., Muthupillai, R. Nephrogenic systemic fibrosis: a concise review for cardiologists. Tex. Heart Inst. J. 37 (5), 508-515 (2010).
- Hao, D., Ai, T., Goerner, F., Hu, X., Runge, V. M., Tweedle, M. MRI contrast agents: basic chemistry and safety. J Magn. Reson. Imaging. 36 (5), 1060-1071 (2012).
- Telgmann, L., Sperling, M., Karst, U. Determination of gadolinium-based MRI contrast agents in biological and environmental samples: a review. Anal. Chim. Acta. 764, 1-16 (2013).
- Frenzel, T., Lengsfeld, P., Schirmer, H., Hütter, J., Weinmann, H. -. J. Stability of gadolinium-based magnetic resonance imaging contrast agents in human serum at 37 degrees C. Invest. Radiol. 43 (12), 817-828 (2008).
- Loreti, V., Bettmer, J. Determination of the MRI contrast agent Gd-DTPA by SEC-ICP-MS. Anal. Bioanal. Chem. 379 (7), 1050-1054 (2004).
- Telgmann, L., et al. Speciation and isotope dilution analysis of gadolinium-based contrast agents in wastewater. Environ. Sci. Technol. 46 (21), 11929-11936 (2012).
- Cleveland, D., et al. Chromatographic methods for the quantification of free and chelated gadolinium species in MRI contrast agent formulations. Anal. Bioanal. Chem. 398 (7), 2987-2995 (2010).
- Edogun, O., Nguyen, N. H., Halim, M. Fluorescent single-stranded DNA-based assay for detecting unchelated gadolinium(III) ions in aqueous solution. Anal. Bioanal. Chem. 408 (15), 4121-4131 (2016).
- Barge, A., Cravotto, G., Gianolio, E., Fedeli, F. How to determine free Gd and free ligand in solution of Gd chelates. A technical note. Contrast Med. Mol. Imaging. 1 (5), 184-188 (2006).
- Johansson, M. K. Choosing reporter-quencher pairs for efficient quenching through formation of intramolecular dimers. Methods Mol. Biol. 335, 17-29 (2006).
- Sherry, A. D., Caravan, P., Lenkinski, R. E. A primer on gadolinium chemistry. J. Magn. Reson. Imaging. 30 (6), 1240-1248 (2009).
- Shakhverdov, T. A. A cross-relaxation mechanism of fluorescence quenching in complexes of lanthanide ions with organic ligands. Opt. Spectrosc. 95 (4), 571-580 (2003).
- Brittain, H. G. Submicrogram determination of lanthanides through quenching of calcein blue fluorescence. Anal. Chem. 59 (8), 1122-1125 (1987).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved