Method Article
متعدد الطبقات الكالسيوم الكالسيوم
In This Article
Summary
هنا، نقدم إجراء لأداء على نطاق واسع كا 2 + التصوير مع الخلوية القرار عبر طبقات القشرية متعددة في الفئران تتحرك بحرية. ويمكن ملاحظة مئات من الخلايا النشطة في وقت واحد باستخدام مصغرة، المجهر محمولة على الرأس إلى جانب مسبار المنشور زرع.
Abstract
في الدائرة الحية والمستوى الخلوي التصوير الوظيفي هو أداة حاسمة لفهم الدماغ في العمل. وقد وفرت التصوير عالية الدقة من الخلايا العصبية الماوس القشرية مع اثنين من الفوتون المجهري رؤى فريدة من نوعها في هيكل القشرية، وظيفة واللدونة. ومع ذلك، تقتصر هذه الدراسات على رأس الحيوانات الثابتة، والحد بشكل كبير من التعقيد السلوكي المتاحة للدراسة. في هذه الورقة، ونحن تصف إجراء لأداء المجهري مضان المزمن مع الخلوية القرار عبر طبقات القشرية متعددة في الفئران تتصرف بحرية. استخدمنا المجهر مضان متكامل مضغوط يقترن مسبار المنشور زرع لتصور في وقت واحد وتسجيل ديناميات الكالسيوم من مئات الخلايا العصبية عبر طبقات متعددة من القشرة الحسية الجسدية كما الفأر تعمل في مهمة استكشاف كائن رواية، على مدى عدة أيام. هذه التقنية يمكن أن تتكيف مع مناطق الدماغ الأخرى في أنواع حيوانية مختلفة ل p السلوكية الأخرىaradigms.
Introduction
القشرة هي لاعب أساسي في العديد من الوظائف العقلية والسلوكية المعقدة، من الانتباه، الإدراك الحسي والسيطرة على المعرفي من أعلى إلى أسفل 1 ، 2 ، 3 إلى التحفيز والمكافأة، والإدمان مسارات 4 ، 5 . فهم العمليات الحسابية التي تكمن وراء وظيفتها هو هدف مهم لدفع فهم السريري أفضل من العديد من الاضطرابات النفسية والسلوكية.
العديد من النظريات الحالية من الأمراض النفسية مركز حول فكرة أن القشرية ضعف الدائرة العصبية أو ديسكورديناتيون قد تكمن وراء الشذوذ المعرفي والسلوكي التي هي السمات المميزة لظروف مثل الفصام 6 ، التوحد 7 أو اضطراب الوسواس القهري 8 . وبالتالي، الحصول على مستوى السكان بيانات النشاط العصبي من المشاركوالدوائر التحليلية ضمن السياق السليم للمعلومات السلوكية المتزامنة ذات أهمية كبيرة، ومن الناحية المثالية يمكن أن تستهدف أنواع محددة من الخلايا لأقوى تشريح الدائرة العصبية.
المجاهر مصغرة بالتزامن مع زرع الانكسار مؤشر الانكسار (غرين) ميكرولنسس تمكين الوصول البصري إلى الفرق العصبية تحت ظروف تتحرك بحرية من مجموعة متنوعة من مناطق الدماغ الممكنة 9 ، 10 ، 11 ، 12 ، 13 ، بما في ذلك القشرة 14 ، 15 ، 16 . باستخدام نظام المجهري المحمول إلى جانب مؤشرات الكالسيوم المشفرة وراثيا يسمح للتصوير متسقة من السكان الخلوية نفسها تشمل مئات من الخلايا العصبية على مدى أيام إلى أسابيع في العديد من مناطق الدماغ 9 ، ويمكن أن يكونمستهدفة وراثيا لأنواع محددة من الخلايا باستخدام ناقلات فيروسية أو تقنيات المعدلة وراثيا.
كما هو معروف القشرة لدعم وظائف مختلفة والتواصل مع مناطق الدماغ المختلفة اعتمادا على موقع الخلايا داخل الصفيحة القشرية 17 ، 18 ، 19 ، ونحن مهتمون في الحصول على نشاط العصبية متعددة الطبقات في وقت واحد في موضوعات تتصرف مستيقظا. هنا علينا أن نظهر كيفية صورة مئات من الخلايا العصبية المسمى فلورزنتلي في الفئران تتصرف بحرية على مدى أيام، وذلك باستخدام المجهر مضان مضان 20 يقترن مسبار المنشور زرع، والذي يقدم وجهة نظر متعددة الطبقات من القشرة ( الشكل 1 ).
يتكون مسبار المنشور المستخدمة هنا من اثنين من العدسات غرين منفصلة: منظور وعدسة تتابع أسطواني ( الشكل 1 ). ضوء من المجهر يثير فلوريسنتلي المسمىالخلايا الموجودة على طول وجه التصوير من التحقيق المنشور، بعد أن تنعكس على الوتر من جزء المنشور من التحقيق. الضوء المنبعث من الخلايا يعكس أيضا من الوتر من المنشور، يتم جمعها من خلال الهدف من المجهر ويصل إلى أجهزة الاستشعار في المجهر. يتم تكييف مسبار المنشور المستخدمة في هذا الإجراء لسهولة استخدامها مع المعدات التجسيمي القياسية.
مضان مضان المنمنمة 20 بالكشف عن العمل المحتملين أثار كا 2+ العابرين في السكان الخلايا العصبية مع قرار خلية واحدة، بعد تلك الخلايا قد وصفت على وجه التحديد مع كا 2 + -Sensitive المؤشرات الفلورية المشفرة وراثيا. في هذا البروتوكول، ونحن حقن كا 2 + مؤشر مشفرة في ناقلات الفيروسية (AAV1.CaMKII.GCaMP6f.WPRE.SV40)، زرع التحقيق المنشور، تثبيت المجهر، ثم الحصول على عدة أيام من البيانات الحسية الجسدية (S1 هند أطرافه) من حيوان يعرضد لأسطح الكائن الرواية خلال التنقيب مجانا ( الشكل 2 ).
Protocol
تمت الموافقة على الإجراءات المتعلقة بالمواضيع الحيوانية من قبل اللجنة المؤسسية رعاية الحيوان واستخدام (إاكوك) في الخدمات الحيوية الطبية ليفسورس، مركز أبحاث ناسا إميس، كاليفورنيا.
1. إعداد قبل العملية
- تعقيم الأدوات لاستخدامها في العمليات الجراحية في معقم حبة ساخنة ومسح منطقة الجراحة مع الايثانول 70٪. بدوره على وسادة التدفئة وضعت على مرحلة التجسيمي والحفاظ عليه عند 37 درجة مئوية.
- تخدير الحيوان باستخدام إيسوفلوران (5٪ للتحريض، و 1-2٪ للصيانة، 0.6-0.8 لتر / دقيقة O 2 ). تحقق من عدم وجود منعكس اصبع القدم قرصة لتقييم عمق التخدير.
- جبل الحيوان في إطار التجسيمي مزودة الأذن والقضبان الأسنان.
- تطبيق مرهم عيني على عيون الحيوان وتغطيتها مع قطعة من الورق الداكن لحمايتهم من التجفيف والأضواء الجراحية المكثفة.
- تحت الجلد حقن الحيوان مع كيتوبروفين (2.5ملغم / كغم) أو كاربروفين (2.5 ملغم / كغم)
2. فيروس جراحة الحقن
- تقليم وحلق فروة الرأس بين العينين والأذنين وتطهير الجلد مع 3 مسحات بديلة من الايثانول 70٪ وبيتادين.
- كشف الجمجمة عن طريق إجراء شق في فروة الرأس، بدءا بين العينين وتمتد 1.5 سم روستروكودال مع شفرة جراحية معقمة. فتح الجلد لفضح الجمجمة، وإزالة السمحاق حول موقع الحقن المطلوب باستخدام مسحات القطن ومشرط. شطف الجمجمة مع برنامج تلفزيوني العقيمة. تنظيف وتلميع الجمجمة مع مسحات القطن.
- مستوى الجمجمة، ومع علامة، بمناسبة الإحداثيات التجسيمي لحقن الفيروس. باستخدام لد 0.5 ملم على ميكرودريل عالية السرعة (مجموعة إلى حوالي 7،000-10،000 دورة في الدقيقة)، وخلق ثقب صغير في الجمجمة. تطبيق ضغط طفيف أثناء الحفر وتنظيف بشكل متقطع الغبار العظام وترطيب المنطقة مع برنامج تلفزيوني العقيمة لمنع أنسجة المخ من ارتفاع درجة الحرارة، حتى سطح الدماغ هو إعادةآلم. إبقاء الدماغ رطبة حيث يتم حفر الثقب.
- استخدام إبرة 26 G لالتقاط الفيروس (على سبيل المثال AAV1.CaMKII.GCaMP6f.WPRE.SV40) في ميكروسيرينج، ثم استبداله مع إبرة 35 G للحقن. إرفاق ميكروسيرينج محملة بالفيروس إلى ذراع مناور من الجهاز التجسيمي.
- جلب الحقنة على مقربة من ثقب موقع الحقن وضبط زاوية الإبرة حتى يدخل في زاوية 90 درجة إلى سطح الدماغ. خفض الإبرة حتى تلمس الأم الحنون و بيرس من خلال الجافية. تبدأ خفض الإبرة في الزيادات من 10 ميكرون / ثانية حتى تصل إلى عمق المطلوب (ض). إصلاح موقع الإبرة هناك باستخدام الذراع التجسيمي.
- تعيين مضخة ميكروسيرينج لحقن 250 نل من الفيروس في 25 نل / دقيقة.
- خطوة حاسمة: منذ حجم الفيروس ليتم حقنه يعتمد على العيار والتخفيف، تشغيل تجارب التخفيف مسبقا، لإنشاء الحجم الأمثل ومعايير التركيز لخلايا التصويرفي التجربة.
- إذا كان ينظر إلى بعض الفيروسات ينضح من موقع الحقن، وقفة الحقن والانتظار حتى أنسجة المخ تمتص انخفاض الفيروس. انتظر لمدة 5-7 دقيقة بعد أن تم حقن إجمالي حجم قبل سحب الإبرة. ويمكن أيضا إضافة الأصباغ مثل الأخضر سريع إلى حل الفيروس للمساعدة في السيطرة على معدل الحقن في حال ينظر إلى الفيروس ينضح من سطح الدماغ.
- لوضع العلامات طبقات متعددة في القشرة، واستخدام حقن متعددة إذا لزم الأمر. تبدأ في بطني معظم الموقع أولا، والانتظار لمدة 5-7 دقيقة بعد الحقن، وسحب الإبرة إلى النقطة الأكثر ظهري المقبل للحقن (على سبيل المثال حقن في -1.0 ملم أب، 1.5 ملم ± مل و 400 و 600 ميكرون DV). انتظر 10 دقيقة بعد الحقن النهائي قبل سحب الإبرة وإزالته من الإعداد التجسيمي.
- مزيج كمية صغيرة من في الجسم الحي لاصقة مرنة مرنة المطاط الصناعي من حقنة برميل مزدوج (على سبيل المثال كويك سيل) وتغطية ثقب في الجمجمة معها. تطبيق لاصقة سيانوكريلات على الجزء العلوي من طبقة من لاصق المطاط الصناعي والسماح لها علاج.
- خياطة فروة الرأس والسماح للحيوان للتعافي من التخدير في قفص الانتعاش الحار حتى أنها المتنقلة. إدارة كيتوبروفين (2.5 ملغ / كلغ) أو كاربروفين (2.5 ملغ / كلغ) تحت الجلد قبل أن يعود الحيوان إلى قفص المنزل. المنزل سينغلي المواضيع بعد الجراحة لحماية موقع الجراحة وتكرار الجرعة 24 ساعة في وقت لاحق.
- بعد إزالة ميكروسيرينج، تدفق كل من 26 G و 35 G الإبر 7-10 مرات مع الماء المقطر لتنظيف قبل التخزين.
3. بريزم التحقيق جراحة زرع
- 1-2 أسابيع بعد حقن الفيروس، والاستعداد لجراحة زرع التحقيق المنشور. تطهير التحقيق المنشور في الايثانول 70٪ وتنظيفه مع ورقة العدسة. أدخل مسبار المنشور في أداة حامل العدسة وشد البرغي السداسي مع مفك البراغي. مقعد المجهر في حامل قاعدة (ومغناطيس سيعقد في مكان).
- إعداد الحيوان على النحو المبين في قسم إعداد قبل العملية.
- تقليم وحلق رأس الحيوان بين العينين والأذنين وتطهير الجلد مع مسحات بديلة من الايثانول 70٪ وبيتادين.
- فضح الجمجمة عن طريق تحريض الجلد مع زوج من مقص العقيمة وإزالة رفرف الجلد والأساس السمحاق. تجفيف وتلميع الجمجمة مع مسحات القطن. ضمان إزالة كافية من الأنسجة العضلية المحيطة لإنشاء نظيفة وجافة، وأساس العظام واسعة في التحضير للخطوات التالية.
- زرع مسامير الجمجمة في نصف الكرة المقابل لجعل الغرس مستقرة وآمنة. قد تكون هذه أيضا مفيدة إذا كان اختيار لزرع هيدبار لرأس مستيقظا تثبيت على استعداد الحيوان لدورات التصوير التجريبي في القسم 5.
- مستوى الجمجمة ومع علامة علامة و أب و مل تنسق لإدخال العدسة. باستخدام لد 0.5 ملم على ميكرودريل فتح حج القحف مستديرة، وضمان ثقطر حج القحف هو أكبر فقط من قطر المنشور أي 1.0 ملم في هذه الحالة. حفر بلطف في حين توقف بشكل متقطع لمسح الجمجمة مع برنامج تلفزيوني العقيمة وشفط بعيدا مع مسحات القطن. إزالة الغبار العظام التي يتم إنشاؤها.
- خطوة حاسمة: وضع حج القحف بحيث عندما يتم إدراج المنشور في القشرة، وحافة مسطحة (سطح التصوير) يواجه موقع حقن الفيروس ويقع ضمن دائرة نصف قطرها 150-200 ميكرون.
- وقف الحفر الحق قبل الجمجمة هو ضعفت تماما. الأوعية الدموية يجب أن تكون مرئية من خلال العظام ضعيفة. إزالة المكونات العظام بلطف مع غرامة ملقط 45 درجة.
- إزالة الجافية مع ملقط # 5.
- خطوة حاسمة: مرة واحدة يتم الكشف عن أنسجة المخ، والحفاظ دائما الأنسجة رطبة. وضع مسحة القطن مغموسة في محلول ملحي معقم على حج القحف. وهذا أيضا الحفاظ على الضغط على الأنسجة.
- للتخفيف من الضغط في أنسجة المخ دوإدراج حلقة من التحقيق المنشور، إنشاء المسالك الإدراج قبل الوقت. إرفاق سكين تشريح ذو حدين مستقيم إلى ذراع حامل القطب للجهاز التجسيمي وجبل على جهاز التجسيمي في زاوية بحيث شفرة سكين عمودي على انحناء الجمجمة (زاوية 10 درجة في هذه الحالة) وفي طائرة موازية لعمود حقن الفيروس.
- وضع بعناية السكين فوق حج القحف على طول حافة وسطي الأمامي في هذه الحالة و ~ 200 ميكرون الوحشي إلى موقع حقن الفيروس مع حافة القطع التي تواجه الخلفي ( الشكل 1 ). صفر خارج المحور Z عندما يلمس طرف سكين الحنون وخفض ذلك تدريجيا (في 10 ميكرون / ثانية الزيادات) إلى العمق الذي سيتم إدراج التحقيق المنشور. ثم نقل سكين 1 مم الخلفي لإنشاء مسار حافة الرائدة في المنشور. وقفة والسيطرة على أي نزيف قد يحدث في حين جعل شق مع قطعة معقمة المالحة معقمة قبل جلفوم.
- مرة واحدة في السكين هو في هذا الموقف، مسح الموقع مع محلول ملحي معقم وانتظر حتى ينزل أي نزيف. ثم سحب ببطء سكين باستخدام ميكرومانيبولاتور الذراع التجسيمي في الزيادات 10 ميكرون / ثانية، ووضع قطعة من الإسفنج جلفوم غارقة في محلول ملحي معقم على شق.
- إرفاق حامل العدسة (مع التحقيق المنشور والمجهر) إلى ذراع مناور التجسيمي في نفس زاوية السكين في الخطوة السابقة. محاذاة المنشور مثل أن الجانب المسطح من المنشور هو أكثر من شق وموازية للعمود حقن الفيروس. قد تتطلب هذه الخطوة بعض التصحيح الدقيق للموقف الذراع التجسيمي. ضبط المحاذاة من خلال البقاء على مقربة من الجمجمة للحصول على نتائج أسرع.
- مرة واحدة في المنشور هو في الزاوية الصحيحة، وانخفاض تدريجيا في الدماغ في 10 ميكرون الزيادات إلى ض النهائي من 1.1 ملم لهذا التحقيق، بدءا من سطح الدماغ. سوف توسع أنسجة المخ حول المنشور وأي ضغط يتم إنشاؤه هو وراء فيسواليزاتيعلى متن الطائرة ولن تؤثر على مجال الرؤية. سد العجز في المجهر إلى جهاز كمبيوتر مع برنامج اكتساب تثبيت عبر منفذ USB3 وتصور الحقل مضان من خلال تشغيل ليد.
- تغطية أي الأنسجة المكشوفة حول المنشور في حج القحف في طبقة واقية رقيقة جدا من لاصق المطاط الصناعي باستخدام إبرة 25G.
- بعد شفاء لاصق المطاط الصناعي (عادة في ~ 3-5 دقيقة) استخدام إبرة 25G لتطبيق بعض لاصقة سيانوكريلات لإرفاق الزجاج من عدسة المنشور إلى الجمجمة المجاورة على طبقة من لاصق المطاط الصناعي، لمنع العدسة من التحرك داخل حج القحف. وتشمل حواف الكفة التحقيق مسبار لالتصاق أفضل. لا تحصل على أي لاصق على الوجه العلوي من التحقيق المنشور زرع. مرة واحدة يتم شفاء لاصقة سيانوكريلات فك حامل العدسة وإزالة بعناية المجهر. ثم سحب ببطء ذراع مناور التجسيمي لمغادرة التحقيق المنشور زرع آمن.
- تطبيق طبقة من الاكريليك الأسنان أوسيانوكريلات لاصقة حول الزرع لتغطية جميع يتعرض سطح الجمجمة، وتصل إلى ولكن لا لمس الأنسجة العضلية تراجع المحيطة بها. سوف تغطي مساحة كبيرة من الجمجمة مع هذا الغطاء الجمجمة تساعد في وقت لاحق في المرفق قاعدة. الجلد حول موقع الزرع يجب أن يشفي من تلقاء نفسها حول غطاء الجمجمة.
- خطوة حاسمة: لا تدع لاصقة تلمس أي من الجلد المحيطة أو الأنسجة العضلية، ولا تبتلع أي الجلد في غطاء الجمجمة. القيام بذلك سوف يزعج الجلد، وقد يؤدي إلى الخدش المفرط والأضرار المحتملة للزرع.
- اختياري: إذا رغبت في استخدام إعداد مستقر الرأس مستيقظا لإرفاق وفصل المجهر إلى لوحة أساسية للحيوان في جلسات التصوير التجريبية بدلا من تخدير لفترة وجيزة أو تخدع الحيوان، زرع غطاء الرأس في غطاء الجمجمة الذي يتوافق مع رأس مستيقظا، الإعداد الثابت من الاختيار (لم يظهر في هذا البروتوكول).
- خلط المحفز وقاعدة من السيليكونه حقنة لاصقة ووضع قطرة من المطاط الصناعي داخل الكفة التحقيق مسبار لتغطية عدسة التحقيق العلوي لمنع أي ضرر والغبار من تسوية.
- إزالة الحيوان من الإطار التجسيمي والسماح للشفاء من التخدير في غرفة دافئة. إدارة كيتوبروفين (2.5 ملغ / كلغ) أو كاربروفين (2.5 ملغ / كلغ) تحت الجلد، وعودة الحيوان إلى قفص المنزل نظيفة مرة واحدة هو الإسعافية. بيت سينغلي جميع المواد لحماية الزرع وتكرار الجرعة 24 ساعة في وقت لاحق.
4. تركيب لوح الأساس للمجهر المصغر
- بعد أسبوع واحد إلى 10 أيام بعد زرع التحقيق المنشور، والتحقق من التعبير الفيروس في الأنسجة من خلال التحقيق المنشور زرع، وإرفاق لوحة قاعدة على الجمجمة إذا أظهر إعداد النشاط الخلية. المجهر سوف يرسو على لوحة الأساس أثناء التصوير الحي.
- اتبع الخطوات المبينة في الإجراء قبل الجراحة لإعداد الحيوان لمرفق لوحة الأساس.
- إزالة غطاء لاصق سيليكون على سطح زرع المنشور المنشور عدسة الأعلى. فحص سطح مسبار العدسات، وتنظيف أي حطام بلطف مع ورقة العدسة والإيثانول 70٪ لضمان سطح التصوير نظيفة.
- قم بتوصيل المجهر إلى مربع داق وتوصيله عبر منفذ USB3 إلى الكمبيوتر.
- فتح برنامج الاستحواذ على الكمبيوتر وربط المجهر عبر منفذ USB3. استخدام برنامج اقتناء لفحص النشاط العصبي، وقياس وتوثيق مجال إعدادات العرض للتسجيلات في المستقبل في هذا الموضوع.
- إرفاق لوحة الأساس إلى المجهر وربط المسمار مجموعة لوحة الأساس لعقد لوحة الأساس في الموقف، وتأمين المجهر في القابض المجهر على الذراع ميكرومانيبولاتور التجسيمي من قبل الجسم من المجهر. إرفاق القابض إلى قضيب نيوبورت، والتي يمكن تركيبها على الذراع ميكرومانيبولاتور التجسيمي.
- وضع المجهر فوق عدسة التحقيق المنشور باستخدام قتيريوتاكسيك ميكرومانيبواتور الذراع. فحص بصريا التوجه من خلال عرض عدسة المنشور من الجانب والخلف من مرحلة الحيوان. يجب محاذاة المحاور البصرية لكل من الهدف المجهر وعدسة التحقيق المنشور.
- بدوره على الصمام المجهر من خلال البرنامج. تقييم نوعية المحاذاة المجهر من خلال التركيز على الوجه العلوي من عدسة مسبار المنشور زرع في برنامج الاستحواذ. عند محاذاة بشكل صحيح، يجب أن حواف عدسة التحقيق مسبار الوجه العلوي تكون حادة.
- ضبط المسافة المادية المجهر فوق مسبار المنشور مزروع باستخدام الذراع مناور التجسيمي للحصول على الطائرة البؤري المطلوب داخل الأنسجة. المسافة الأمثل بصريا بين الهدف المجهر وزرع عدسة غرين هو ~ 500 ميكرون.
- حفظ صورة مضان إشارة مرة واحدة يتم التقاط الطائرة التصوير المطلوبة.
نقطة حرجة: من هذه النقطة على، لا ضبط موقف المجهر، وهذا سيغير الموقععلى الطائرة التصوير في الأنسجة.
ملاحظة: تطبيق لاصق في الخطوة التالية إلى إصلاح بشكل دائم موقف لوحة قاعدة فيما يتعلق غطاء الجمجمة. اللاصق قد تواجه بعض انكماش حجم في اليوم التالي أو اثنين، والتي يمكن تغيير الطائرة البؤرية في الأنسجة. حساب استباقي لهذا عن طريق قياس كمية انكماش لمزيج لاصق الخاص بك والمسافة خارج الجسم الحي ، ثم دعم موقف Z النهائي من المجهر + لوحة الأساس من قبل هذا المبلغ قبل التقدم إلى خطوة تطبيق لاصق. - استخدام الاكريليك الأسنان أو سيانوكريلات لربط دائم لوحة الأساس إلى غطاء الاكريليك تغطي الجمجمة الحيوانية، سد الفجوة مع الاكريليك أو لاصق. تطبيق الاكريليك الأسنان / سيانوكريلات تدريجيا وعلاج في مراحل متعددة قد يقلل من تأثير الانكماش المذكور سابقا على الموقف النهائي من طائرة صورة المجهر.
- خطوة حاسمة: الحرص أثناء تطبيق الأسنانالاكريليك / سيانوكريلات لمنع أي مادة من الاتصال عدسة الهدف المجهر، المسمار مجموعة، أو الجسم المجهر، والتي من شأنها منع التشغيل السليم للأجهزة في وقت لاحق.
- خطوة حاسمة: أثناء تطبيق لاصقة، لا تدفع على المجهر. الضغط على المجهر أو لوحة قاعدة يمكن أن يسبب حركة الهدف المجهر نسبة إلى عدسة التحقيق المنشور، والتي يمكن أن تؤدي إلى اختلال أو تغيير المستوى البؤري في الأنسجة التي تتطلب إعادة التكيف الفوري.
- تحقق من أن أكريليك الأسنان / سيانوكريلات قد شفي وتصلب من خلال الاستفادة من الاكريليك مع زوج من ملقط أو طرف حقنة. الحصول على إشارة مضان النهائي الصورة مع برنامج الاستحواذ.
- الافراج عن المجهر من القابض وسحب القابض من المجهر. إذا تم استخدام سيانوكريلات أو لاصق شفاف آخر، وتغطيته مع طلاء الأظافر السوداء أو طبقة من الأسمنت الأسنان السوداء لمنعمبيت تسرب الضوء في غطاء الرأس، والتي يمكن أن تلوث الصور المستقبلية المكتسبة خلال التجارب.
- عند هذه النقطة، وإزالة المجهر إذا لزم الأمر. لفصل المجهر من لوحة القاعدة، الافراج عن المسمار مجموعة لوحة القاعدة عن طريق تحويل المسمار مجموعة تقريبا ½ بدوره عكس اتجاه عقارب الساعة. قرصة الجسم المجهر مع دعم لوحة الأساس وغطاء الاكريليك مع جهة أخرى، وسحب المجهر مباشرة. استبدلها في حاوية التخزين.
- حماية مسبار المنشور زرع مع غطاء لوحة الأساس. وهذا سيمنع أي جزيئات الغبار من الاستقرار على سطح العدسة، والتي يمكن أن تكون صعبة لتنظيف بعد تم تركيب لوحة الأساس.
- قم بتثبيت غطاء اللوحة األساسية على اللوحة األساسية وقم بتدوير المسمار المضبوطة بتقريب ½ انعطف في اتجاه عقارب الساعة أو حتى يتم مسح المسمار المضغوط مع غطاء اللوحة األساسية. لا تبالغ.
- إزالة الحيوان من التخدير ورصد في غرفة الانتعاش الحار حتى المتنقلة. عودة الe، بهيمي، حتى، إيتس، إلي النهاية، سلة لكرة السلة. بيت سينغلي جميع الحيوانات مع زرع باسبلاتس لحماية الزرع.
5. التصوير طبقات القشرية متعددة في الماوس تتحرك بحرية
- إعداد الجهاز السلوكي، (على سبيل المثال فينوتيبر، نولدوس) عن طريق تنظيف وتعقيمه ومحو مع 10٪ محلول التبييض.
- توصيل المجهر إلى مربع داق لها، وربطه بالكمبيوتر وإطلاق برنامج الاستحواذ.
- تحقق من وجود مساحة تخزين الملفات وافرة على الكمبيوتر اقتناء وإفساح المجال لأفلام التصوير الكالسيوم. حفظ مباشرة من البرنامج إلى القرص الثابت المحلي، بدلا من الكتابة إلى القرص الصلب الخارجي، لاستيعاب ارتفاع معدل نقل البيانات بين المجهر والكمبيوتر ومنع فقدان البيانات أثناء التسجيلات.
- تخدير الحيوان مع إيسوفلوران (5٪ في الأكسجين) في غرفة تحريض لإرفاق المجهر. بدلا من ذلك، برفق كشط الحيوان أو استخدام مستيقظا الإعداد ثابت الرأسمع غطاء الرأس إذا كان من المعروف أن التخدير تتداخل مع النموذج السلوكي المفضل.
- قم بإزالة غطاء اللوحة األساسية عن طريق تحويل مجموعة أدوات اللوحة األساسية إلى عكس اتجاه عقارب الساعة ورفع غطاء اللوحة األساسية.
- مقعد المجهر في لوحة الأساس على الحيوان. يجب أن المجهر المفاجئة في مكان مع المعونة من المغناطيس على لوحة الأساس. دفع لوحة المسمار مجموعة الأساسية حتى شعرت مقاومة طفيفة.
- خطوة حاسمة: لا أكثر من تشديد المسمار مجموعة لوحة الأساس لمنع الأضرار التي لحقت السكن المجهر.
- التحقق من الطائرة التصوير في الأنسجة من خلال الحصول على لقطة مضان في البرنامج، وإذا لزم الأمر ضبط الطائرة البؤرية في الأنسجة عن طريق تخفيف المجهر برج مجموعة المسمار، الدورية برج المجهر لضبط التركيز على ما يرام، ثم إعادة تشديد البرج الإسكان مجموعة المسمار.
- خطوة حاسمة: أبدا قوة البرج لتحويل دون أولا تخفيف المسمار مجموعة، ولا أكثر من تشديد برج مجموعة المسمار.
- إذا أجريت دراسة طولية، والعودة إلى موقف برج المادية لالتقاط نفس مجال الرؤية. في الأجهزة، لاحظ عدد من يتحول برج، أو الوضع المادي للبرج، لكل حيوان تصور مع نفس المجهر لعودة سريعة إلى نفس مجال الرؤية.
- الافراج عن الحيوان تحمل المجهر في قفص المنزل أو غرفة السلوكية للتأقلم، وينتظر ارتداء قبالة التخدير إذا كان ذلك ممكنا.
- خطوة حاسمة: تدريب الحيوانات على حمل وزن المجهر باستخدام المجهر وهمية لعدة جلسات حتى تضمن أن ارتداء المجهر لا تتداخل مع سلوكهم العادي، قبل بدء جلسات تجريبية. ومن شأن المعالجة المنتظمة والتدريب على ضبط النفس المستيقظ أن يمنع حدوث ضغوط لا مبرر لها على الحيوانات.
- حدد إعدادات الاستحواذ لاستخدامها لجمع البيانات. وهذا يشمل فرالي معدل لالتقاط البيانات (على سبيل المثال 20 إطارا في الثانية، كسب 1، والطاقة ليد من 50٪). تحقق من الرسم البياني الصورة عند اختيار الإعدادات لضمان شنر جيدة.
ملاحظة: الفتحة العددية لجمع مضان هو 0.35 للمسبار المنشور 1 ملم مقارنة مع 0.5 ل 1 مم التحقيق على التوالي. - إطلاق البرامج السلوكية وبرنامج ذلك لتحريك المجهر في دورة التصوير التصوير المطلوب (على سبيل المثال 4X 5 دقيقة أون 2 دقيقة أوف). قم بتوصيل منفذ تل على مربع نولدوس إو إلى منفذ تريغ على المربع داق عبر RJ45 إلى كابل بنك.
- وضع الحيوان في الساحة السلوكية إن لم يكن هناك بالفعل، وبدء التجربة.
- بعد الحصول على البيانات المطلوبة، وإعادة تخدير الحيوان مع إيسوفلوران (5٪ في الأكسجين) في غرفة تحريض، أو برفق مستيقظا ضبط النفس للحيوان.
- تخفيف المسمار مجموعة لوحة الأساس وفصل المجهر من لوحة الأساس عن طريق سحب بلطف المجهر. استبدال غطاء لوحة الأساس وتشديد بلطف قاعدة الأساستي مجموعة المسمار.
- عودة الحيوان إلى قفص المنزل حتى جلسة التسجيل التالية. استخدام الصور مضان إشارة كدليل لجلسات التصوير اللاحقة للعودة إلى نفس مجال الرؤية.
6. تقييم كبير النطاق كا 2 + التصوير البيانات
- لاستخراج موقع الخلية وكا 2 + ديناميات في مجال الرؤية من البيانات، ومنصات تحليل البيانات المختلفة يمكن استخدامها. الفسيفساء، وهي منصة تحليل البيانات المصممة خصيصا لمعالجة على نطاق واسع كا 2 + أفلام التصوير وقد استخدمت لهذه الدراسة هنا.
- قم بتصحيح وحدات البكسل المعيبة واستيفاء أي إطارات تم إسقاطها بشكل فردي في الأفلام الأولية في خطوة المعالجة المسبقة. بن الصور في الفضاء من كامل 1،440 × 1،080 بكسل من مجال الرؤية إلى 720 × 540 بكسل للحد من البصمة البيانات.
- لتصحيح التحف الحركة في الدماغ فيما يتعلق المجهر صورة الاستشعار، تسجيل الأفلام باستخدام صورة إيماجيج القائمة على إعادة ريغوريستيون ألغوريثم (توربوريغ).
- لتحديد الخلايا العصبية الفردية، إعادة التعبير عن الصور كتغيرات نسبية في مضان ΔF / F 0 = فف 0 / F 0 حيث F 0 هو متوسط الصورة التي تم الحصول عليها عن طريق المتوسط المتوسط للفيلم بأكمله.
- تحديد المرشحات المكانية المقابلة للخلايا الفردية باستخدام خلية خوارزمية فرز الفرز. هنا استخدمنا تحليل المكون الرئيسي والفردي 21 لتحديد الخلايا العصبية الفردية.
ملاحظة: تم تحديد حدث عندما كان اتساع الذروة للحدث في التتبع أكثر من 8 الانحرافات المعيارية من خط الأساس التتبع في مجموعة البيانات لدينا وموقع الخلية وبيانات ديناميكية كا 2 + تم تصديرها لمزيد من التحليل.
النتائج
بروتوكول موضح هنا يصف وسيلة فعالة وفعالة لأداء طولية متعدد الطبقات كا 2 + التصوير من مئات الخلايا العصبية القشرية في الفئران تتصرف بحرية باستخدام تحقيقات المنشور ( الشكل 1 ). المقاربات السابقة نحو التصوير القشري متعدد الطبقات قد اقتصرت في المقام الأول على الحيوانات الثابتة الرأس 22 ، 23 ، 24 ، 25 ، 26 ، 27 . من أجل الحصول على هذا المستوى من البيانات في سياق يتصرف بحرية، تم استخدام منصة المجهر المنمنمة للمرونة السلوكية. تم استخدام مؤشر الكالسيوم المشفر وراثيا (GCaMP6f) لاستهداف مجموعة خلايا معينة (كامكي + خلايا في القشرة)؛ وتم اختيار مسبار المنشور لتوفير مجال مزمن، متعدد الطبقات من الرأي.
-together.within-بادج = "1"> أظهرنا سير العمل لإعداد الحيوان للتصوير. تم حقن ناقلات فيروسية ترميز مؤشر الكالسيوم المناسب في القشرة ( الشكل 2 ، الخطوة 1)، قبل زرع مزمن مسبار المنشور لتمكين الوصول البصري إلى الخلايا المسمى ( الشكل 2 ، الخطوة 2). ثم تم تركيب لوحة الأساس التي تعمل بمثابة قفص الاتهام آمنة ومؤقتة لتحديد المواقع من المجهر خلال جلسات التصوير على رأس الحيوان ( الشكل 2 ، الخطوة 3)، مما يتيح تصور النشاط القشرية عبر طبقات الخلايا متعددة في مستيقظا يتصرف التجريبي الإعداد ( الشكل 2 ، الخطوة 4).
لضمان استهداف السكان الخلوية المطلوب، يظهر قسم الدماغ الاكليلية بعد الوفاة من الماوس التمثيلي في الشكل 3 مع المسالك التحقيق المنشور ومجال الرؤية ملحوظ نسبة إلى مختبر GCaMP6fالخلايا العصبية إليد في الطبقات 2/3 و 5 من القشرة الحسية الجسدية.
خلال التصوير مستيقظا مع النظام، تم تسجيل نشاط الخلايا العصبية القشرية الحسية الجسدية عندما تعرض الماوس لثلاثة بيئات مختلفة - حقل مفتوح (يوم 1)، كائن المعرفة (يوم 2-4) وجوه رواية (يوم 5) ( الشكل 4 ). في يوم 1 وضعت الماوس في الساحة السلوكية خالية من أي كائنات. في يوم 2-4 وضعت الماوس في الساحة مع نفس اثنين من الكائنات تكستورالي مختلفة (وسادة هلام وكتلة الخشب). في يوم 5، تم استبدال واحد من الكائنات مع كائن رواية. تم تصوير الحيوان خلال 5 أيام لمدة 20 دقيقة كل يوم.
بعد استخراج الخلية باستخدام برنامج تحليل البيانات صورة كا 2 + ، كانت المرشحات المكانية المقابلة لمواقع الخلايا مضافين على متوسط إسقاط كثافة الفلورسنت من بيانات تسجيل المجهر( الشكل 5) . وهناك خط أبيض متقطع يفصل بين الطبقات 2/3 و 5 خلايا. المقابلة كا 2 + آثار من 5 خلايا من كل من طبقات تظهر نمط اطلاق النار من الخلايا في اثنين من السياقات السلوكية المختلفة- كائن المعرفة والتعرض كائن رواية. طبقة 2/3 الخلايا كانت أكثر نشاطا مقارنة مع طبقة 5 خلايا في اليوم عندما تعرض الماوس لجسم رواية. وهذا واضح أيضا من المؤامرات النقطية التي تظهر النشاط اطلاق عتبة من جميع الخلايا المصورة في الأيام 1 و 4 و 5.
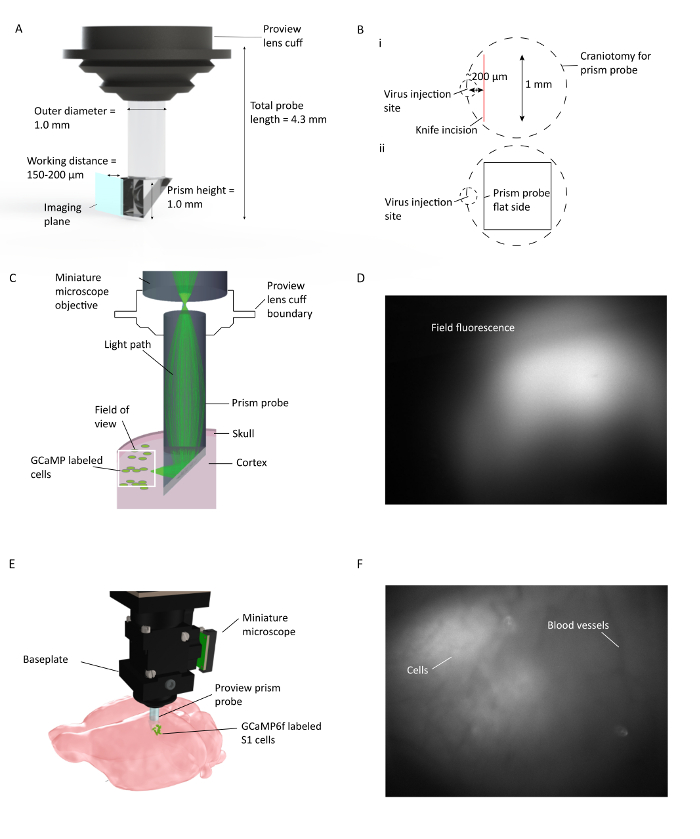
الشكل 1: في فيفو كا 2 + التصوير عبر الطبقات القشرية متعددة في الفئران تتحرك بحرية. ( A ) مواصفات مسبار المنشور وتصوير الطائرة التصوير. طلاء عاكس في الداخل من الوتر يسمح للتصوير 90 درجة من الطائرة الإدراج من التحقيق المنشور. العدسة سوفف يتكامل مع حامل العدسة، الذي يبسط إجراء زرع ويسمح للعرض المحتمل من مضان الأنسجة المحيطة أثناء زرع ( B ) (ط). رسم توضيحي لوضع موضعي التحقيق حج القحف وسكين شق نسبة إلى موقع الحقن الفيروس، و (إي) التوضيح لموقع التحقيق المنشور الجانب المسطح نسبة إلى شق السكين وموقع حقن الفيروس. ( C ) التوضيح من في الجسم الحي كا 2 + الإعداد التصوير تظهر مسار الضوء لمنطقة صغيرة في مجال كامل للعرض من خلال التحقيق المنشور زرعها في قشرة الفأر. ( D ) مثال مجال الرؤية أثناء تثبيت مسبار المنشور. يتم إرفاق المجهر مصغرة إلى حامل العدسة، الذي يحمل التحقيق المنشور يسمح لفحص التعبير الفيروس خلال التثبيت التحقيق المنشور. ( E ) دمج المجهر مع التحقيق المنشور لتصوير القشرية متعددة الطبقات من GCaMP6f المسمى الخلايا S1. F مثال مجال الرؤيةخلال تركيب لوحة الأساس. واضح نمط الأوعية الدموية مرئية في وقت تركيب لوحة الأساس مع بعض الخلايا في صورة خام. المزيد من الخلايا مرئية بوضوح عند تشغيل دف / F في نافذة برنامج الاستحواذ. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
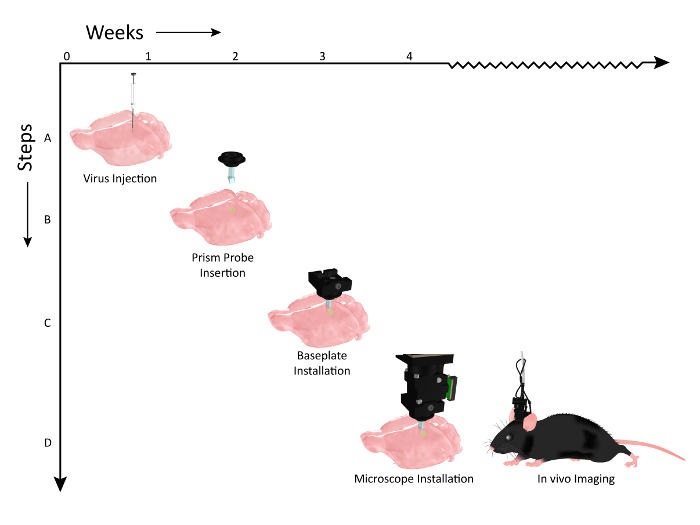
الشكل 2: التخطيطي عرض الجدول الزمني لسير العمل أحداث للبشرية التحقيق زرع وتركيب المجهر. ويمثل عدد الأسابيع على المحور السيني وخطوات سير العمل للإجراءات على طول المحور Y. ( A ) الرسم التوضيحي حقن الفيروسي (AAV1.CaMKII.GCaMP6f.WPRE.SV40) على طول نفس محور ظهري بطني، لتسمية طبقات متعددة من القشرة الحسية الجسدية الماوس. ( B ) 2 أسابيع الحقن بعد الفيروس، وهو المنشور المنشوريتم زرع ه في محور مواز لمواقع حقن الفيروس. ( C ) بعد أسبوع تقريبا من زرع التحقيق المنشور، يتم فحص الحيوان للتعبير مع المجهر ويتم تركيب لوحة قاعدة على الرأس إذا كان عدد من الخلايا مرئية. ( D ) الحيوان هو ثم على استعداد للتصوير المزمن أثناء المهام السلوكية ذات الصلة (ماوس كليب الفن تعديل بعد إذن من UW- ماديسون الكيمياء الحيوية ميديالاب). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
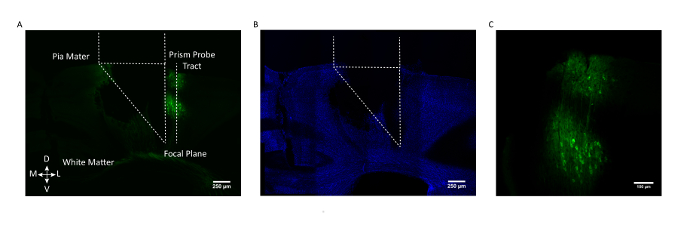
الشكل 3: التحقق من صحة النسيج بعد الوفاة من موقع مسبار المنشور والتعبير غمب. ( A ) القسم الاكليلية من الدماغ الماوس تمثيلية تظهر المسالك التحقيق المنشور ومع الجانب التصوير التي تواجههاوالخلايا المعبر عنها GCAMP6f (AAV1.CaMKII.GCaMP6f أعرب في الخلايا العصبية في طبقات 2/3 و 5). ( ب ) نفس قسم الدماغ الاكليلية التالية تلطيخ ل دابي. شريط مقياس = 250 ميكرون ( C ) التكبير في رأي الخلايا GCaMP6f معربا في القشرة الحسية الجسدية. شريط مقياس = 100 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
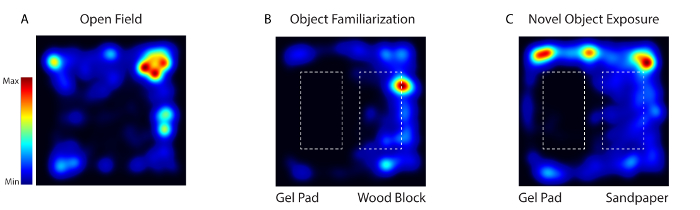
الشكل 4: نشاط الماوس أثناء التعود، والتعرف، واختبار التعرض للكائنات الجديدة تم تتبع الفيديو باستخدام برامج الفيديو. ( A ) في يوم 1، وضعت الحيوان في الساحة السلوكية خالية من أي كائنات (حقل مفتوح). ( ب ) في أيام 2-4، وضعت نفس اثنين من الكائنات تكستورالي مختلفة (وسادة هلام وكتلة الخشب) في الساحة (كائن فاميliarization). ( C ) في يوم 5، تم استبدال واحد من الكائنات مع كائن رواية (كتلة الخشب مع ورقة الرمال) (رواية التعرض كائن). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
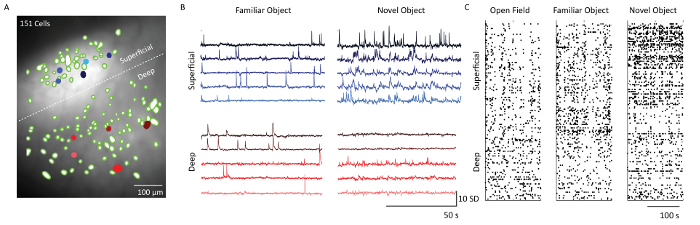
الشكل 5: ديناميات الكالسيوم من الطبقات السطحية والعميقة من اللحاء الحسية الجسدية من ماوس ممثل تصوير مع المجهر. ( A ) صورة مدمجة من المرشحات المكانية العصبية (النقط الخضراء) ومتوسط الإسقاط كثافة الإسقاط من تسجيل المجهر من خلال مجال التحقيق المنشور للعرض. الحدود بين الطبقات فوق الحبيبية والداخلية المشار إليها بخط أبيض متقطع. شريط مقياس = 100 ميكرون. ( ب ) آثار الكالسيوم من خمسة مثال سطحية وخلايا طبقة عميقة (شغل الأزرق والأحمر جألس في لوحة A)، مشيرا إلى وحدات الانحراف المعياري من مضان التالية الرئيسية وتحليل المكون المستقل. شريط مقياس أفقي 50 ثانية وبار عمودي مقياس 10 سد ( C ) مؤامرة النقطية من الخلايا من سطحية (طبقات 2/3) وطبقات عميقة (طبقة 5) التي تظهر على حقل مفتوح، كائن دراية واستكشاف كائن رواية. شريط مقياس = 100 ثانية. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
فهم نشاط الدائرة العصبية خلال السلوك مستيقظا هو مستوى حيوي من التحقيق علم الأعصاب اللازمة لتشريح فعال وظيفة الدماغ في الصحة والمرض. القشرة هي منطقة ذات أهمية خاصة للدراسة في سياق السلوك مستيقظا، لأنها تلعب دورا هاما في العديد من الوظائف الحسية والمعرفية والتنفيذية الحيوية 28 ، 29 .
ويعتقد أن العمود القشرية لتكون الوحدة الوظيفية الأساسية في القشرة والنشاط على مستوى السكان من الخلايا القشرية هو معروف أن تختلف على أساس موقعها الفعلي داخل العمود. على سبيل المثال، الخلايا العصبية المثيرة في الطبقات 2/3 في مشروع القشرة الحسية الجسدية في المقام الأول إلى المناطق القشرية المخية الأخرى وتعديل الشبكات القشرية الأخرى 30 ، في حين أن الخلايا في طبقات أعمق المشروع في المقام الأول إلى المناطق تحت القشرية مثل المهاد 31 . تسجيل نشاط مائةثانية من الخلايا القشرية قبل محددة في وقت واحد وبشكل موثوق مع مرور الوقت عبر الصفيحة مختلفة في المواضيع تتصرف بحرية من شأنه أن يعزز كثيرا فهمنا لتدفق المعلومات القشرية، والسماح لتشريح وظيفي أدق من أعمدة القشرية أبلغت في الوقت الحقيقي المعلومات السلوكية والمهام ذات الصلة الوقت- النطاقات.
جمع هذا المستوى من البيانات الدائرة العصبية هو ممكن مع استخدام كفاءة ومبسطة المنمنمة المنصة المجهرية لإجراء على نطاق واسع كا 2 + التصوير في المواضيع تتصرف بحرية (أو الموضوعات رأس ثابت كما هو مطلوب). تستخدم مع مؤشرات الكالسيوم المشفرة وراثيا لتمكين خلية من نوع محدد الاستهداف، والتصوير مجال متعدد الطبقات للعرض المقدمة من مسبار موشور مزروع مزروع، واستكشاف هذا البروتوكول حالة واحدة من بين العديد من التطبيقات الممكنة: مراقبة الاختلافات الصفحي في معالجة القشرية الحسية الجسدية عند الفئران جسديا تعمل مع كائن رواية ( الشكل 5 ).هذا هو التوضيح الإجرائي الأول من هذا النوع من نوع الخلية محددة، في الجسم الحي نهج لدراسة طبقات القشرية متعددة في مستيقظا، الحيوانات تتصرف بحرية، ويوسع الطيف من الأساليب التجريبية المتاحة لفهم الهياكل الصفحي في الدماغ النشط.
مجال الرؤية المنظار من تمكين مسبار المنشور في هذه التقنية يمكن تطبيقها عمليا على هياكل الدماغ الأخرى عند الحفاظ على الأنسجة مباشرة ظهري إلى منطقة من الفائدة هو المطلوب؛ على سبيل المثال، يمكن أن يتحقق التصوير CA3 دون تعطيل وظيفة الحصين.
نهج التحقيق مسبار بريزم للتصوير النشاط كا 2 + يتطلب الإدراج البدني والزرع الدائم لل ميكروبريسم في القشرة، وهو ما يعادل إنشاء الآفة القشرية حيث يتم إدراج مسبار العدسة. وهذا قد يؤدي إلى اضطرابات في الدوائر العصبية المحلية، بما في ذلك قطع التشعبات القمي والعمليات. تيفإن الإجراء له أيضا أن يسبب تفعيل الأولي للخلايا الدبقية في المنطقة، على الرغم من أن هذا من المتوقع أن تكون مترجمة إلى الأنسجة حوالي 150 ميكرون من وجه المنشور، وتهدأ بعد أن تلتئم الدماغ 22 . من المهم جدا النظر في ما إذا كانت هذه التقنية سوف تؤثر على تشريح الدائرة الطبيعية و / أو سلوك الحيوانات عند التخطيط للتجارب. وينبغي دائما إجراء مجموعات السيطرة السلوكية لضمان عدم وجود تغييرات كبيرة في السلوكيات الأساسية التي يمكن أن تنتج نتائج تجريبية مربكة.
باستخدام هذا المنمنمة، المحمول كا 2 + تقنية التصوير مع التلاعب نيوروفارماكولوجيكال، المعرفية المختلفة، والاجتماعية، والحركية أو النماذج السلوكية الجوهرية، والجمع بينها مع القياسات الفسيولوجية الأخرى يمكن تعميق وإثراء الدراسات التي تركز على فهم الأدوار الوظيفية للدوائر العصبية في السلوك والإشارة معالجة 32 . قمع أو تنشيطيمكن أن تؤثر على بعض مسارات التضمين من قبل المخدرات السلوكيات المرتبطة بها، والتي يمكن دراستها بسهولة باستخدام هذه التكنولوجيا 33 . تتفرع إلى أنواع مختلفة من الخلايا عن طريق تعديل استهداف مؤشر الكالسيوم هو تطبيق قوي ومفيد آخر، وتمكن العديد من مجموعات الإبداعية من الأدوات التجريبية لمعالجة مختلف المسائل الدائرة العصبية.
Disclosures
وقد قرأ المؤلفون سياسة المجلة ولديهم المصالح التالية: سغ، سو و فك مدفوعة الأجر في إنسكوبيكس.
Acknowledgements
ويود المؤلفون أن يشكروا كل من ف. جايارامان و دس كيم و لوجر و K. سفوبودا من مشروع المؤشر العصبي المشفر وراثيا ومشروع الجينات في جانيليا ريزارتش كامبوس بمعهد هاورد هيوز الطبي على تبرعهم السخي من AAV1-GCaMP6f إلى، الجامعة، بسبب، البنسلفانيا سهم التوجيه، كور. كما يودون أن يشكروا أولسون و نيوروزينس المجهري الأساسية في جامعة ستانفورد بدعم من المعاهد الوطنية للصحة NS069375 منحة لخدمات المجهر متحد البؤر.
Materials
| Name | Company | Catalog Number | Comments |
| Neurostar Motorized Ultra Precise Small Animal Stereotaxic Instrument | Kopf | Model 963SD | Surgery |
| Stereoscope | Labomed | Prima DNT | Surgery and Imaging |
| Mini Rectal Thermistor Probe (.062"/1.6 mm diameter) - 1/4" Jack | FHC | 40-90-5D-02 | Surgery |
| Heating Pad 5 X 12.5 cm | FHC | 40-90-2-07 | Surgery |
| DC Temperature Controller | FHC | 40-90-8D | Surgery |
| Microsyringe Pump | World Precision Instruments | UMP3 model; serial 155788 F110 | Surgery |
| NanoFil 10 μL Syringe | World Precision Instruments | NANOFIL | Surgery |
| 35 G Beveled Tip Nanofil NDL 2PK | World Precision Instruments | NF35BV-2 | Surgery |
| Omnidrill35, 115 - 230 V | World Precision Instruments | 503598 | Surgery |
| Burrs for Micro Drill | Fine Science Tools | 19007-05 | Surgery |
| nVista | Inscopix | 100-001048 | Imaging |
| AAV1.CaMKII.GCaMP6f.WPRE.SV40 | Penn Vector Core | AV-1-PV3435 | Surgery |
| Ketoprofen | Victor Medical | 5487 | Surgery |
| Carprofen | Victor Medical | 1699008 | Surgery |
| Isoflurane | Victor Medical | 1001054 | Surgery |
| Gelfoam (Patterson Veterinary Supply Inc Gelfoam Sponge 12 cm x 7 mm) | Pfizer (Fisher Scientific) | NC9841478 | Surgery |
| Dumont #5/45 forceps | Fine Science Tools | 11251-35 | Surgery |
| Dumont #5 forceps | Fine Science Tools | 11251-30 | Surgery |
| Dissecting knives | Fine Science Tools | 10055-12 | Surgery |
| ProView Implant Kit | Inscopix | 100-000756 | Surgery and Imaging |
| ProView Prism Probe 1.0 mm-Dia. ~4.3 mm Length | Inscopix | 100-000592 | Surgery and Imaging |
| Kwik-Sil adhesive pack of 2 | World Precision Instruments | KWIK-SIL | Surgery |
| Kwik-Cast Sealant | World Precision Instruments | KWIK-CAST | Surgery and Imaging |
| Miniature Optical Mounting Post | Newport | M-TSP-3 | Imaging |
| Microscope Baseplate | Inscopix | BPL-2 | Imaging |
| Microscope Baseplate Cover | Inscopix | BPC-2 | Imaging |
References
- McConnell, S. K. Development and decision-making in the mammalian cerebral cortex. Brain Res. 472 (1), 1-23 (1988).
- Kwon, S. E., Yang, H., Minamisawa, G., O'Connor, D. H. Sensory and decision-related activity propagate in a cortical feedback loop during touch perception. Nat. Neurosci. 19 (9), 1243-1249 (2016).
- Miller, E. K., Cohen, J. D. An integrative theory of prefrontal cortex function. Annu. Rev. Neurosci. 24, 167-202 (2001).
- Bailey, M. R., Simpson, E. H., Balsam, P. D. Neural substrates underlying effort, time, and risk-based decision making in motivated behavior. Neurobiol. Learn. Mem. 133, 233-256 (2016).
- Dehaene, S., Changeux, J. P. Reward-dependent learning in neuronal networks for planning and decision making. Prog. Brain Res. 126, 217-229 (2000).
- Ferenczi, E. A., et al. Prefrontal cortical regulation of brainwide circuit dynamics and reward-related behavior. Science. 351 (6268), aac9698(2016).
- Anomal, R. F., et al. Impaired Processing in the Primary Auditory Cortex of an Animal Model of Autism. Front. Sys. Neurosci. 9, 158(2015).
- Pauls, D. L., Abramovitch, A., Rauch, S. L., Geller, D. A. Obsessive-compulsive disorder: an integrative genetic and neurobiological perspective. Nat. Rev. Neurosci. 15 (6), 410-424 (2014).
- Ziv, Y., et al. Long-term dynamics of CA1 hippocampal place codes. Nat. Neurosci. 16 (3), 264-266 (2013).
- Jennings, J. H., et al. Visualizing hypothalamic network dynamics for appetitive and consummatory behaviors. Cell. 160 (3), 516-527 (2015).
- Betley, J. N., et al. Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature. 521 (7551), 180-185 (2015).
- Sun, C., et al. Distinct speed dependence of entorhinal island and ocean cells, including respective grid cells. Proc. Natl. Acad. Sci. 112 (30), 9466-9471 (2015).
- Kitamura, T., et al. Entorhinal Cortical Ocean Cells Encode Specific Contexts and Drive Context-Specific Fear Memory. Neuron. 87 (6), 1317-1331 (2015).
- Pinto, L., Dan, Y. Cell-Type-Specific Activity in Prefrontal Cortex during Goal-Directed Behavior. Neuron. 87 (2), 437-450 (2015).
- Cox, J., Pinto, L., Dan, Y. Calcium imaging of sleep-wake related neuronal activity in the dorsal pons. Nat. Comm. 7, 10763(2016).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nat. Protoc. 11 (3), 566-597 (2016).
- Hooks, B. M., et al. Organization of cortical and thalamic input to pyramidal neurons in mouse motor cortex. The J. Neurosci. 33 (2), 748-760 (2013).
- Masamizu, Y., et al. Two distinct layer-specific dynamics of cortical ensembles during learning of a motor task. Nat. Neurosci. 17 (7), 987-994 (2014).
- Rowland, D. C., Moser, M. -B. From cortical modules to memories. Curr. Opin. Neurobiol. 24 (1), 22-27 (2014).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nat. Methods. 8 (10), 871-878 (2011).
- Mukamel, E. A., Nimmerjahn, A., Schnitzer, M. J. Automated analysis of cellular signals from large-scale calcium imaging data. Neuron. 63 (6), 747-760 (2009).
- Andermann, M. L., et al. Chronic cellular imaging of entire cortical columns in awake mice using microprisms. Neuron. 80 (4), 900-913 (2013).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nat. Protoc. 9 (11), 2515-2538 (2014).
- Chia, T. H., Levene, M. J. In vivo imaging of deep cortical layers using a microprism. J. Vis. Exp. (30), (2009).
- Chia, T. H., Levene, M. J. Microprisms for in vivo multilayer cortical imaging. J. Neurophysiol. 102 (2), 1310-1314 (2009).
- Chia, T. H., Levene, M. J. Multi-layer in vivo imaging of neocortex using a microprism. Cold Spring Harb. Protoc. 2010 (8), pdb.prot5476 (2010).
- Low, R. J., Gu, Y., Tank, D. W. Cellular resolution optical access to brain regions in fissures: imaging medial prefrontal cortex and grid cells in entorhinal cortex. Proc. Natl. Acad. Sci. 111 (52), 18739-18744 (2014).
- Zeisel, A., et al. Brain structure. Cell types in the mouse cortex and hippocampus revealed by single-cell RNA-seq. Science. 347 (6226), 1138-1142 (2015).
- Hawrylycz, M., et al. Inferring cortical function in the mouse visual system through large-scale systems neuroscience. Proc. Natl. Acad. Sci. 113 (27), 7337-7344 (2016).
- Petrof, I., Viaene, A. N., Sherman, S. M. Properties of the primary somatosensory cortex projection to the primary motor cortex in the mouse. J. Neurophysiol. 113 (7), 2400-2407 (2015).
- Aronoff, R., et al. Long-range connectivity of mouse primary somatosensory barrel cortex. Euro. J. Neurosci. 31 (12), 2221-2233 (2010).
- Rogan, S. C., Roth, B. L. Remote control of neuronal signaling. Pharma. Rev. 63 (2), 291-315 (2011).
- Berdyyeva, T., et al. Zolpidem reduces hippocampal neuronal activity in freely behaving mice: a large scale calcium imaging study with miniaturized fluorescence microscope. PloS One. 9 (11), e112068(2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved