Method Article
Multi-couche Cortical Ca
Dans cet article
Résumé
Ici, nous présentons une procédure pour effectuer une image à grande échelle Ca 2+ avec une résolution cellulaire à travers de multiples couches corticales chez des souris qui se déplacent librement. Des centaines de cellules actives peuvent être observées simultanément à l'aide d'un microscope à tête miniature couplé à une sonde de prisme implantée.
Résumé
L' imagerie fonctionnelle en circuit et cellulaire in vivo est un outil essentiel pour comprendre le cerveau en action. L'imagerie haute résolution des neurones corticaux de souris avec microscopie à deux photons a fourni des idées uniques sur la structure corticale, la fonction et la plasticité. Cependant, ces études sont limitées aux animaux fixes en tête, réduisant considérablement la complexité comportementale disponible pour l'étude. Dans cet article, nous décrivons une procédure pour effectuer une microscopie à fluorescence chronique avec une résolution cellulaire à travers de multiples couches corticales chez des souris à comportement libre. Nous avons utilisé un microscope de fluorescence miniaturisé intégré couplé à une sonde de prisme implantée pour visualiser et enregistrer simultanément la dynamique du calcium de centaines de neurones à travers de multiples couches du cortex somatosensoriel lorsque la souris s'est engagée dans une nouvelle tâche d'exploration d'objets sur plusieurs jours. Cette technique peut être adaptée à d'autres régions du cerveau dans différentes espèces animales pour d'autres pAradigms.
Introduction
Le cortex est un acteur essentiel dans de nombreuses fonctions mentales et comportementales complexes, de l'attention, de la perception sensorielle et du contrôle cognitif top-down 1 , 2 , 3 aux voies de motivation, de récompense et d'addiction 4 , 5 . La compréhension des processus informatiques qui sous-tendent sa fonction est un objectif important pour améliorer la compréhension clinique de nombreux troubles mentaux et comportementaux.
Beaucoup de théories actuelles de la maladie psychiatrique se concentrent autour de l'idée que le dysfonctionnement ou la discothèque du circuit nerveux cortical peuvent être à la base d'anomalies cognitives et comportementales qui sont les caractéristiques de conditions telles que la schizophrénie 6 , l'autisme 7 ou le trouble obsessionnel compulsif 8 . Ainsi, l'obtention de données d'activité neuronale au niveau de la population de coLes circuits rythmiques dans le contexte approprié de l'information comportementale simultanée revêtent une grande importance et, idéalement, peuvent être ciblés sur des types de cellules spécifiques pour une dissection plus fine du circuit neuronal.
Les microscopes miniaturisés en conjonction avec des microlentilles d'indice de réfraction à gradient implantable (GRIN) permettent un accès optique à des ensembles neuronaux dans des conditions de déplacement libre à partir d'une diversité de régions potentielles du cerveau 9 , 10 , 11 , 12 , 13 , y compris le cortex 14 , 15 , 16 . L'utilisation d'un système de microscopie mobile couplé à des indicateurs de calcium génétiquement codés permet une imagerie cohérente de la même population cellulaire englobant des centaines de neurones au fil des jours dans de nombreuses régions du cerveau 9 et peut êtreCiblée génétiquement sur des types de cellules spécifiques en utilisant des vecteurs viraux ou des techniques transgéniques.
Comme le cortex est connu pour soutenir différentes fonctions et se connecter à différentes régions du cerveau en fonction de l'emplacement des cellules dans la lame corticale 17 , 18 , 19 , nous sommes intéressés à obtenir une activité neuronale multi-couche simultanée dans des sujets réveillés. Ici, nous démontrons comment imaginer des centaines de neurones marqués par fluorescence chez les souris qui se comportent librement au cours des jours, en utilisant le microscope à fluorescence miniaturisé 20 couplé à une sonde de prisme implantée, qui offre une vue multicouches du cortex ( figure 1 ).
La sonde de prisme utilisée ici est composée de deux lentilles GRIN séparées: un prisme et une lentille de relais cylindrique ( Figure 1 ). La lumière provenant du microscope excite les étiquettes fluorescentesCellules situées le long de la face d'imagerie de la sonde de prisme, après réflexion de l'hypoténuse de la partie prisme de la sonde. La lumière émise par les cellules reflète également l'hypoténuse du prisme, est recueillie par l'objectif du microscope et atteint le capteur au microscope. La sonde de prisme utilisée dans cette procédure est adaptée pour une utilisation facile avec un équipement stéréotaxique standard.
Le microscope à fluorescence miniaturisé 20 détecte des transitoires de Ca 2+ provoqués par un potentiel d'action dans des populations neuronales avec une résolution de cellule unique, après que ces cellules ont été spécialement identifiées avec des indicateurs fluorescents sensibles au gène génétique Ca 2+ . Dans ce protocole, nous injectons un indicateur de Ca 2+ codé dans un vecteur viral (AAV1.CaMKII.GCaMP6f.WPRE.SV40), implanter une sonde de prisme, installer le microscope, puis obtenir plusieurs jours de données d'activité neuronale somatosensorielle (S1) D'un animal exposéD à de nouvelles surfaces d'objets lors de l'exploration gratuite ( figure 2 ).
Protocole
Les procédures impliquant des sujets d'animaux ont été approuvées par le Comité institutionnel pour les soins et l'utilisation des animaux (IACUC) chez LifeSource Biomedical Services, NASA Ames Research Center, Californie.
1. Préparation pré-opératoire
- Stériliser les outils à utiliser dans les procédures chirurgicales dans un stérilisateur à perles chaudes et essuyer la zone chirurgicale avec 70% d'éthanol. Allumez le coussin chauffant placé sur le stade stéréotaxique et maintenez-le à 37 ° C.
- Anesthésier l'animal à l'aide d'isoflurane (5% pour l'induction et 1-2% pour l'entretien, 0,6-0,8 L / min O 2 ). Vérifiez l'absence d'un réflexe de pincement pour évaluer la profondeur de l'anesthésie.
- Monter l'animal dans un cadre stéréotaxique équipé d'oreille et de barres dentées.
- Appliquer une pommade ophtalmique sur les yeux de l'animal et les couvrir d'un morceau de papier noir pour les protéger du séchage et des lampes chirurgicales intenses.
- Injecter par voie sous-cutanée l'animal avec du kétoprofène (2,5Mg / kg) ou carprofène (2,5 mg / kg)
2. Chirurgie par injection de virus
- Garnir et raser le cuir chevelu entre les yeux et les oreilles et désinfecter la peau avec 3 écouvillons de 70% d'éthanol et de betadine.
- Exposez le crâne en faisant une incision dans le cuir chevelu, en commençant entre les yeux et en étendant 1,5 cm rostrocaudal avec une lame chirurgicale stérile. Ouvrez la peau pour exposer le crâne et retirez le périoste autour du site d'injection souhaité à l'aide de coton-tige et d'un scalpel. Rincer le crâne avec du PBS stérile. Nettoyez et polissez le crâne avec des écouvillons en coton.
- Nivelez le crâne et, avec un marqueur, marquez les coordonnées stéréotaxiques pour l'injection de virus. En utilisant une bavure de 0,5 mm sur un microdrillage à grande vitesse (réglé à environ 7 000 à 10 000 tr / min), créez un petit trou dans le crâne. Appliquer une légère pression pendant le forage et nettoyer de manière intermittente la poussière de l'os et humidifier la zone avec du PBS stérile pour éviter que le tissu cérébral ne se surchauffe, jusqu'à ce que la surface du cerveau soit réactiveA fait mal. Gardez le cerveau humide où le trou est foré.
- Utilisez une aiguille 26 G pour récupérer le virus ( p. Ex . AAV1.CaMKII.GCaMP6f.WPRE.SV40) dans la micro-jeringe, puis remplacez-la par une aiguille 35 G pour injection. Fixez la microseringue chargée de virus au bras manipulateur de l'appareil stéréotaxique.
- Apportez la seringue à proximité du trou du site d'injection et ajustez l'angle de l'aiguille afin qu'elle pénètre à un angle de 90 ° par rapport à la surface du cerveau. Abaissez l'aiguille jusqu'à ce qu'elle touche la pia-mère et perfore la dure. Commencer à abaisser l'aiguille par incréments de 10 μm / s jusqu'à ce qu'il atteigne la profondeur souhaitée (z). Fixez l'emplacement de l'aiguille là-bas en utilisant le bras stéréotaxique.
- Réglez la pompe à micro-jeringes pour injecter 250 nL de virus à 25 nL / min.
- Étape critique: Étant donné que le volume du virus à injecter dépend du titre et de la dilution, exécutez les expériences de dilution au préalable, afin d'établir des critères optimaux de volume et de concentration pour les cellules d'imagerieDans l'expérience.
- Si un virus survient hors du site d'injection, mettez en pause l'injection et attendez jusqu'à ce que le tissu cérébral absorbe la chute du virus. Attendez 5-7 minutes après que le volume total a été injecté avant de rétracter l'aiguille. Des colorants tels que du vert rapide pourraient également être ajoutés à la solution de virus pour aider à contrôler la vitesse d'injection dans le cas où le virus est vu exsuder hors de la surface du cerveau.
- Pour l'étiquetage de plusieurs couches dans le cortex, utilisez des injections multiples si nécessaire. Commencez par le premier site ventral, attendez 5-7 minutes après l'injection et tirez l'aiguille vers le point dorsal le plus proche pour injection ( p. Ex., Injectez-le à -1,0 mm AP, 1,5 mm ± ML et 400 et 600 μm DV). Attendez 10 minutes après l'injection finale avant de retirer l'aiguille et de l'enlever de la configuration stéréotaxique.
- Mélanger une petite quantité d'un adhésif élastomère transparent biocompatible in vivo à partir de la seringue à double cylindre (Par exemple Kwik-Sil) et couvrir le trou dans le crâne avec lui. Appliquer un adhésif de cyanoacrylate sur la couche d'adhésif élastomère et le laisser durcir.
- Suture le cuir chevelu et permet à l'animal de se remettre de l'anesthésie dans une cage de récupération chaude jusqu'à ce qu'il soit ambulatoire. Administrer le kétoprofène (2,5 mg / kg) ou le carprofène (2,5 mg / kg) par voie sous-cutanée avant de retourner l'animal dans sa cage à domicile. Les sujets de post-chirurgie d'une maison individuelle pour protéger le site de la chirurgie et répéter la dose 24 heures plus tard.
- Après avoir retiré la micro-jambage, rincer les aiguilles 26 G et 35 G 7 à 10 fois avec de l'eau distillée pour le nettoyer avant le stockage.
3. Prism Probe Implant Surgery
- 1-2 semaines après l'injection de virus, préparez-vous à la chirurgie d'implant de sonde de prisme. Désinfectez la sonde de prisme dans de l'éthanol à 70% et nettoyez-la avec du papier à lentilles. Insérez la sonde de prisme dans l'outil porte-objectif et serrez la vis hexagonale avec le tournevis. Assied le microscope dans le support de base (leLes aimants le maintiendront en place).
- Préparez l'animal tel qu'indiqué dans la section Préparation opérationnelle.
- Garnir et raser la tête de l'animal entre les yeux et les oreilles et désinfecter la peau avec des écouvillons alternatifs d'éthanol et de betadine à 70%.
- Exposez le crâne en incitant la peau avec une paire de ciseaux stériles et enlevez le volet de la peau et le périoste sous-jacent. Sécher et polir le crâne avec des écouvillons en coton. Assurer une élimination adéquate du tissu musculaire environnant pour créer une base osseuse propre, sèche et large pour la préparation des étapes suivantes.
- Implant les vis du crâne dans l'hémisphère contralatéral pour rendre l'implant stable et sécurisé. Ceux-ci peuvent également être utiles si vous choisissez d'implanter une barre de tête pour la fixation de la tête réveillée pour préparer l'animal pour les sessions expérimentales d'imagerie à la section 5.
- Nivelez le crâne et, avec un marqueur marquez les coordonnées AP et ML pour l'insertion des lentilles. L'utilisation d'une bavure de 0,5 mm sur une microdrille ouvre une craniotomie ronde, assurantLe diamètre de la craniotomie est juste supérieur au diamètre du prisme, c'est-à-dire 1,0 mm dans ce cas. Percer doucement tout en s'arrêtant de manière intermittente pour rincer le crâne avec un PBS stérile et l'aspirer avec des cotons à coton. Retirez la poussière d'os qui est générée.
- Étape critique: placer la craniotomie de telle sorte que lorsque le prisme est inséré dans le cortex, son bord plat (surface d'imagerie) est confronté au site d'injection de virus et se situe dans un rayon de 150 à 200 μm.
- Arrêtez le forage juste avant que le crâne ne soit complètement dilué. Les vaisseaux sanguins doivent être visibles à travers l'os dilué. Enlevez délicatement la fiche osseuse avec une fine pince à 45 °.
- Retirez la dureté avec des pince # 5.
- Étape critique: une fois que le tissu cérébral est exposé, gardez toujours le tissu humide. Placez un coton-tige trempé dans une solution saline stérile sur la craniotomie. Cela maintiendra également la pression sur le tissu.
- Pour atténuer la pression dans le tissu cérébral duInsertion de l'anneau de la sonde de prisme, crée un tracé d'insertion à l'avance. Fixez un couteau à dissection à bord droit sur le bras du porte-électrode de l'appareil stéréotaxique et montez-le sur l'appareil stéréotaxique dans un angle tel que la lame du couteau est perpendiculaire à la courbure du crâne (angle de 10 ° dans ce cas) et dans un Plan parallèle à la colonne d'injection de virus.
- Positionnez soigneusement le couteau au-dessus de la craniotomie le long de son bord médian antérieur dans ce cas et ~ 200 μm latéralement par rapport au site d'injection du virus avec la arête de coupe orientée vers l'arrière ( figure 1 ). Éteignez zéro l'axe Z lorsque la pointe du couteau touche la pia et abaissez-la progressivement (par incréments de 10 μm / s) jusqu'à une profondeur à laquelle la sonde de prisme sera insérée. Ensuite, déplacez le couteau 1 mm vers l'arrière pour créer un chemin pour l'avant-garde du prisme. Pause et contrôlez tout saignement qui pourrait se produire lors de l'incision avec un morceau de gelfoam imprégné de solution saline.
- Une fois que le couteau est dans cette position, rincer le site avec une solution salée stérile et attendre que tout saignement diminue. Ensuite, retirez lentement le couteau à l'aide du micromanipulateur du bras stéréotaxique par incréments de 10 μm / s et placez un morceau d'éponge gelfoam trempé dans une solution saline stérile sur l'incision.
- Fixez le porte-objectif (avec la sonde de prisme et le microscope) au bras manipulateur stéréotaxique dans le même angle que le couteau à l'étape précédente. Alignez le prisme de sorte que le côté plat du prisme soit au-dessus de l'incision et parallèle à la colonne d'injection de virus. Cette étape pourrait nécessiter une correction fine de la position du bras stéréotaxique. Ajustez l'alignement en restant près du crâne pour obtenir des résultats plus rapides.
- Une fois que le prisme est à l'angle correct, abaissez-le progressivement dans le cerveau dans des incréments de 10 μm jusqu'à un z final de 1,1 mm pour cette sonde, à partir de la surface du cerveau. Le tissu cérébral s'étendra autour du prisme et toute pression qui est créée est derrière la visualisationSur l'avion et n'affectera pas le champ de vision. Branchez le microscope sur un ordinateur avec un logiciel d'acquisition installé via un port USB3 et visualisez la fluorescence du champ en allumant la LED.
- Couvrir tout tissu exposé autour du prisme dans la craniotomie dans une couche protectrice très mince d'adhésif élastomère à l'aide d'une aiguille 25G.
- Une fois que l'adhésif élastomère est durci (habituellement en ~ 3-5 min), utilisez une aiguille de 25G pour appliquer un adhésif de cyanoacrylate pour attacher le verre de la lentille de prisme au crâne adjacent sur la couche d'adhésif élastomère, pour empêcher l'objectif de se déplacer à l'intérieur La craniotomie. Incluez les bords de la manchette de la prisme pour une meilleure adhérence. Ne pas obtenir d'adhésif sur la face supérieure de la sonde de prisme implantée. Une fois que l'adhésif cyanoacrylate est durci, dévisser le porte-objectif et retirer soigneusement le microscope. Ensuite, retirez lentement le bras du manipulateur stéréotaxique pour laisser la sonde de prisme solidement implantée.
- Appliquer une couche d'acrylique dentaire ouAdhésif de cyanoacrylate autour de l'implant pour couvrir toute la surface du crâne exposée, jusqu'à la toucher du tissu musculaire rétracté environnant. Couvrir une grande zone de crâne avec ce capuchon crânien aidera plus tard à la fixation de la plaque de base. La peau autour du site de l'implant devrait se guérir seul autour du capuchon crânien.
- Étape critique: ne laissez pas l'adhésif toucher la peau ou le tissu musculaire environnant, et ne pas engloutir aucune peau dans le capuchon crânien. Cela pourrait irriter la peau et entraîner des rayures excessives et des dommages potentiels à l'implant.
- Facultatif: si vous désirez utiliser une configuration de tête réveillée pour attacher et détacher le microscope à la plaque de base d'un animal dans des séances expérimentales d'imagerie plutôt que d'anesthésier ou de calmer rapidement l'animal, implanter une barre de têtes dans le capuchon crânien compatible avec une tête éveillée, Installation fixe de choix (non démontrée dans ce protocole).
- Mélanger le catalyseur et la base à partir d'un siliciumSeringue adhésive et déposer une goutte d'élastomère à l'intérieur de la manchette de la prisme pour couvrir le sommet de la lentille de la sonde afin d'éviter toute détérioration et toute poussière lors du décantation.
- Retirer l'animal du cadre stéréotaxique et permettre une récupération de l'anesthésie dans une chambre chaude. Administrer le kétoprofène (2,5 mg / kg) ou le carprofène (2,5 mg / kg) par voie sous-cutanée et renvoyer l'animal dans une cage de maison propre une fois qu'il est ambulatoire. Dominez tous les sujets pour protéger l'implant et répétez la dose 24 h plus tard.
4. Fixation de la plaque de base pour l'installation du microscope miniature
- Une semaine à 10 jours après l'implantation de la sonde de prisme, vérifier l'expression du virus dans le tissu à travers la sonde de prisme implantée et attacher une plaque de base sur le crâne si la préparation montre l'activité cellulaire. Le microscope s'appuiera sur la plaque de base pendant l'imagerie en direct.
- Suivez les étapes décrites dans la procédure préopératoire pour la préparation de l'animal pour la fixation de la plaque de base.
- Retirez le capuchon adhésif en silicone sur la surface du dessus de lentille de sonde de prisme implanté. Examinez la surface de la sonde de l'objectif et nettoyez doucement les débris avec du papier à lentilles et de l'éthanol à 70% pour que la surface d'imagerie soit propre.
- Branchez le microscope sur sa boîte DAQ et connectez-le via le port USB3 au PC.
- Ouvrez le logiciel d'acquisition sur l'ordinateur et connectez le microscope via le port USB3. Utilisez le logiciel d'acquisition pour vérifier l'activité neurale et pour mesurer et documenter les paramètres de champ de vision pour les enregistrements futurs sur ce sujet.
- Fixez une plaque de base au microscope et fixez la vis de fixation de la plaque de base pour maintenir la plaque de base en position et fixez le microscope dans la pince au microscope sur le bras micromanipulateur stéréotaxique par le corps du microscope. Fixez la pince à une tige Newport, qui peut être montée sur le bras micromanipulateur stéréotaxique.
- Positionner le microscope au-dessus de la lentille de la prisme à l'aide de la sBras de micromaniputeur tereotaxique. Inspectez visuellement l'orientation en regardant la lentille de prisme du côté et de l'arrière du stade animal. Les axes optiques de l'objectif du microscope et de la sonde du prisme doivent être alignés.
- Allumez la LED du microscope via le logiciel. Évaluez la qualité de l'alignement du microscope en mettant l'accent sur la face supérieure de la sonde de prisme implantée dans le logiciel d'acquisition. Lorsqu'il est correctement aligné, les bords de la face supérieure de la lentille de la sonde de prisme doivent être tranchants.
- Ajustez la distance physique du microscope au-dessus de la sonde de prisme implantée à l'aide du bras manipulateur stéréotaxique pour obtenir le plan focal souhaité à l'intérieur du tissu. La distance optiquement optimisée entre l'objectif microscope et la lentille GRIN implantée est de ~ 500 μm.
- Enregistrez une image de fluorescence de référence une fois que le plan d'imagerie souhaité est capturé.
Point critique: à partir de ce point, ne pas ajuster la position du microscope, car cela changera la positionSur le plan d'imagerie dans le tissu.
REMARQUE: appliquer de l'adhésif dans l'étape suivante pour réparer en permanence la position de la plaque de base par rapport au capuchon cranial. L'adhésif peut subir un rétrécissement du volume au lendemain ou deux jours, ce qui peut changer le plan focal dans le tissu. Prévenez-le pour cela en mesurant la quantité de retrait pour votre mélange d'adhésif et la distance ex vivo , puis en soutenant la position Z finale du microscope + plaque de base par cette quantité avant de progresser à l'étape d'application de l'adhésif. - Utilisez un acrylique dentaire ou un cyanoacrylate pour attacher de façon permanente la plaque de base au capuchon acrylique qui recouvre le crâne de l'animal, reliant l'espace avec l'acrylique ou l'adhésif. L'application de l'acrylique dentaire / cyanoacrylate progressivement et le durcissement en plusieurs étapes peuvent minimiser l'effet du retrait mentionné précédemment sur la position finale du plan d'image du microscope.
- Étape critique: faites attention lors de l'application dentaireAcrylique / cyanoacrylate pour empêcher tout matériau de contacter l'objectif objectif du microscope, la vis de réglage ou le corps du microscope, ce qui empêchera le fonctionnement correct de l'instrumentation plus tard.
- Étape critique: Lors de l'application de l'adhésif, ne pas pousser sur le microscope. La pression sur le microscope ou la plaque de base peut provoquer un mouvement de l'objectif du microscope par rapport à la sonde du prisme, ce qui pourrait entraîner un désalignement ou un changement du plan focal dans le tissu qui nécessiterait un réajustement rapide.
- Vérifiez que l'acrylique / cyanoacrylate dentaire a durci et durci en tapotant l'acrylique avec une pince ou une pointe de seringue. Acquérir une image de fluorescence de référence finale avec le logiciel d'acquisition.
- Relâchez le microscope de la pince et retirez la pince du microscope. Si un cyanoacrylate ou un autre adhésif transparent a été utilisé, recouvrez-le avec un vernis noir ou une couche de ciment dentaire noir pour éviter unUne fuite de lumière minimale dans le capuchon de la tête, ce qui peut contaminer les images futures acquises lors des expériences.
- À ce stade, retirer le microscope si nécessaire. Pour séparer le microscope de la plaque de base, relâcher la vis de réglage de la plaque de base en tournant la vis de réglage environ ½ tour dans le sens inverse des aiguilles d'une montre. Pincez le corps du microscope tout en soutenant la plaque de base et le capuchon acrylique avec l'autre main, et tirez le microscope vers le haut. Remplacez-le dans son contenant de stockage.
- Protégez la sonde de prisme implantée avec un couvercle de plaque de base. Cela empêchera les particules de poussière de s'installer sur la surface de l'objectif, ce qui peut être difficile à nettoyer après l'installation de la plaque de base.
- Fixez le couvercle de la plaque de base sur la plaque de base et avancez la vis de réglage d'environ ½ tour dans le sens des aiguilles d'une montre ou jusqu'à ce que la vis de réglage soit alignée avec le couvercle de la plaque de base. Ne pas trop serrer.
- Enlevez l'animal de l'anesthésie et surveillez-le dans une chambre de réchauffement jusqu'à l'ambulatoire. RetourE animal à sa cage à domicile. Dominez tous les animaux avec des plaques de base implantées pour protéger l'implant.
5. Imagerie de plusieurs couches corticales dans une souris à mouvement libre
- Préparez l'appareil comportemental ( par exemple , Phenotyper, Noldus) en le nettoyant et en le désinfectant et en essuyant avec une solution d'eau de Javel à 10%.
- Branchez le microscope dans sa boîte DAQ et connectez-le à l'ordinateur et lancez le logiciel d'acquisition.
- Vérifiez l'espace de stockage de fichiers suffisant sur l'ordinateur d'acquisition et faites place aux films d'imagerie au calcium. Enregistrez directement du logiciel sur le disque dur local, plutôt que d'écrire sur un disque dur externe, pour tenir compte du taux élevé de transfert de données entre le microscope et l'ordinateur et éviter la perte de données pendant les enregistrements.
- Anesthésier l'animal avec de l'isoflurane (5% dans l'oxygène) dans une chambre d'induction pour attacher le microscope. Alternativement, débrouillez doucement l'animal ou utilisez une installation de tête réveilléeAvec un barreau si l'anesthésie est connue pour interférer avec le paradigme comportemental de choix.
- Retirez le couvercle de la plaque de base en tournant la vis de fixation de la plaque de base dans le sens inverse des aiguilles d'une montre et en soulevant le couvercle de la plaque de base.
- Placez le microscope dans la plaque de base sur l'animal. Le microscope doit se mettre en place à l'aide des aimants sur la plaque de base. Avancez la vis de fixation de la plaque de base jusqu'à ce qu'une légère résistance soit ressentie.
- Étape critique: Ne pas trop serrer la vis de fixation de la plaque de base pour éviter d'endommager le boîtier du microscope.
- Vérifiez le plan d'imagerie dans le tissu en acquérant un instantané de fluorescence dans le logiciel et, si nécessaire, ajustez le plan focal dans le tissu en desserrant la vis de la tourelle du microscope, en tournant la tourelle du microscope pour ajuster la mise au point fine, puis resserrer la tourelle Vis de fixation du boîtier.
- Étape critique: Ne forcez jamais la tourelle à tourner sans desserrer avant la vis de réglage, etNe pas trop serrer la vis de tourelle.
- Si vous effectuez une étude longitudinale, retournez à la position de la tourelle physique pour capturer le même champ de vision. Dans le matériel, notez le nombre de spires de la tourelle ou la position physique de la tourelle, pour chaque animal imagé avec le même microscope pour un retour rapide dans le même champ de vision.
- Relâchez l'animal portant le microscope dans sa cage à domicile ou dans sa chambre de comportement pour l'acclimatation, et attendez l'usure de l'anesthésie s'il y a lieu.
- Étape critique: entraînez les animaux à porter le poids du microscope à l'aide d'un microscope fictif pendant plusieurs séances jusqu'à ce que le port du microscope n'interfère pas avec leur comportement normal avant de commencer les séances expérimentales. Une manipulation et une formation régulières pour une réanimation réveillée empêcheront les stress des animaux.
- Sélectionnez les paramètres d'acquisition à utiliser pour collecter des données. Cela comprend la fraMoi pour capturer des données ( p. Ex. 20 fps, Gain de 1 et puissance LED de 50%). Vérifiez l'histogramme de l'image lors de la sélection des paramètres pour assurer un bon SNR.
REMARQUE: L'ouverture numérique pour la collecte de fluorescence est de 0,35 pour la sonde de prisme 1 mm par rapport à 0,5 pour la sonde droite de 1 mm. - Lancez le logiciel de comportement et programmez-le pour déclencher le microscope au cycle d'enregistrement d'imagerie désiré ( p. Ex. 4X 5 min ON 2 min OFF). Connectez le port TTL sur la boîte Noldus IO au port TRIG sur la zone DAQ via un câble RJ45 vers BNC.
- Placez l'animal dans l'arène de comportement s'il n'est pas déjà là et commencez l'expérience.
- Après avoir acquis les données souhaitées, ré-anesthésier l'animal avec de l'isoflurane (5% dans l'oxygène) dans une chambre d'induction, ou doucement réveiller l'animal.
- Desserrez la vis de fixation de la plaque de base et détachez le microscope de la plaque de base en tirant doucement le microscope. Replacez le couvercle de la plaque de base et serrez doucement la baseTe set screw.
- Retournez l'animal à la cage d'habitation jusqu'à la prochaine session d'enregistrement. Utilisez les images de fluorescence de référence comme guide pour les sessions d'imagerie suivantes pour revenir au même champ de vision.
6. Évaluation des données d'imagerie à base de Ca 2 + à grande échelle
- Pour extraire la localisation des cellules et la dynamique de Ca 2+ dans le champ de vision à partir des données, différentes plates-formes d'analyse de données peuvent être utilisées. Mosaic, une plate-forme d'analyse de données conçue spécifiquement pour traiter des films d'imagerie Ca 2+ à grande échelle a été utilisée pour cette étude ici.
- Rectifiez les pixels défectueux et interpoliez les cadres individuels abandonnés dans les films bruts dans l'étape de prétraitement. Stockez les images dans l'espace du champ de vision complet de 1 440 x 1 080 pixels à 720 x 540 pixels pour réduire l'empreinte des données.
- Pour corriger les artefacts de mouvement dans le cerveau par rapport au capteur d'image du microscope, enregistrez les films à l'aide d'une image rigoureuse ImageJ reAlgorithme de génération (TurboReg).
- Pour identifier les neurones individuels, ré-exprimer les images en tant que changements relatifs de fluorescence ΔF / F 0 = FF 0 / F 0 où F 0 est l'image moyenne obtenue en faisant la moyenne de l'ensemble du film.
- Identifiez les filtres spatiaux correspondant aux cellules individuelles en utilisant un algorithme de tri cellulaire établi. Nous avons utilisé l'analyse des composantes principale et individuelle 21 pour identifier les neurones individuels.
REMARQUE: Un événement a été spécifié lorsque l'amplitude du pic d'un événement dans une trace était supérieure à 8 écarts types par rapport à la ligne de base de trace dans notre ensemble de données et que l'emplacement de la cellule et les données de la dynamique de Ca 2+ ont été exportées pour une analyse plus approfondie.
Résultats
Le protocole décrit ici décrit un moyen efficace et efficace d'effectuer une imagerie multicouche longitudinale de Ca 2+ à partir de centaines de neurones corticaux chez des souris à comportement libre utilisant des sondes de prisme ( Figure 1 ). Les approches antérieures en matière d'imagerie corticale à couches multiples ont principalement été limitées aux animaux fixés en tête 22 , 23 , 24 , 25 , 26 , 27 . Afin d'acquérir ce niveau de données dans un contexte de comportement libre, une plate-forme de microscope miniaturisé a été utilisée pour la flexibilité comportementale; Un indicateur de calcium génétiquement codé (GCaMP6f) a été utilisé pour cibler une population cellulaire spécifique (cellules CAMKII + dans le cortex); Et une sonde de prisme a été choisie pour fournir un champ de vision chronique et multicouche.
Nous avons démontré le flux de travail pour préparer l'animal à l'imagerie. Un vecteur viral codant pour un indicateur de calcium approprié a été injecté dans le cortex ( Figure 2 , étape 1) avant d'implanter une sonde de prisme pour implanter un accès optique aux cellules marquées ( figure 2 , étape 2). Une plaque de base qui sert de quai sécurisé et temporaire pour le positionnement du microscope lors des sessions d'imagerie a ensuite été installée sur la tête de l'animal ( Figure 2 , Étape 3), ce qui permet de visualiser l'activité corticale dans de multiples couches cellulaires dans un essai expérimental éveillé Installation ( Figure 2 , étape 4).
Pour s'assurer que la population cellulaire souhaitée était ciblée, une section de cerveau coronal post-mortem d'une souris représentative est montrée à la figure 3 avec le tube de sonde de prisme et le champ de vision marqué par rapport au laboratoire GCaMP6fNeurones élevés dans les couches 2/3 et 5 du cortex somatosensoriel.
Au cours de l'imagerie comportementale réveillée avec le système, l'activité des neurones corticaux somatosensoriels a été enregistrée lorsque la souris a été exposée à trois environnements différents: champ ouvert (jour 1), familiarisation avec les objets (jour 2 à 4) et nouvel objet (jour 5) ( Figure 4 ). Le jour 1, la souris a été placée dans une arène comportementale dépourvue de tout objet. Le jour 2-4, la souris a été placée dans l'arène avec les mêmes objets texturément différents (un bloc de gel et un bloc de bois). Le jour 5, l'un des objets a été remplacé par un nouvel objet. L'animal a été imaginé pendant 5 jours pendant 20 min par jour.
Après l'extraction cellulaire à l'aide du logiciel d'analyse de données d'image Ca 2+ , les filtres spatiaux correspondant aux emplacements des cellules ont été superposés à la projection moyenne d'intensité fluorescente des données d'enregistrement du microscope( Figure 5) . Une ligne pointillée blanche sépare les couches 2/3 et 5 cellules. Les traces correspondantes de Ca 2+ provenant de 5 cellules de chacune des couches montrent le motif de tir des cellules dans deux contextes comportementaux différents: la familiarisation avec les objets et l'exposition récente à l'objet. Les cellules de couche 2/3 étaient plus actives par rapport aux cellules de la couche 5 le jour où la souris a été exposée à un nouvel objet. Ceci est également évident à partir des parcelles raster qui montrent l'activité de tir à seuil de toutes les cellules imagées aux jours 1, 4 et 5.
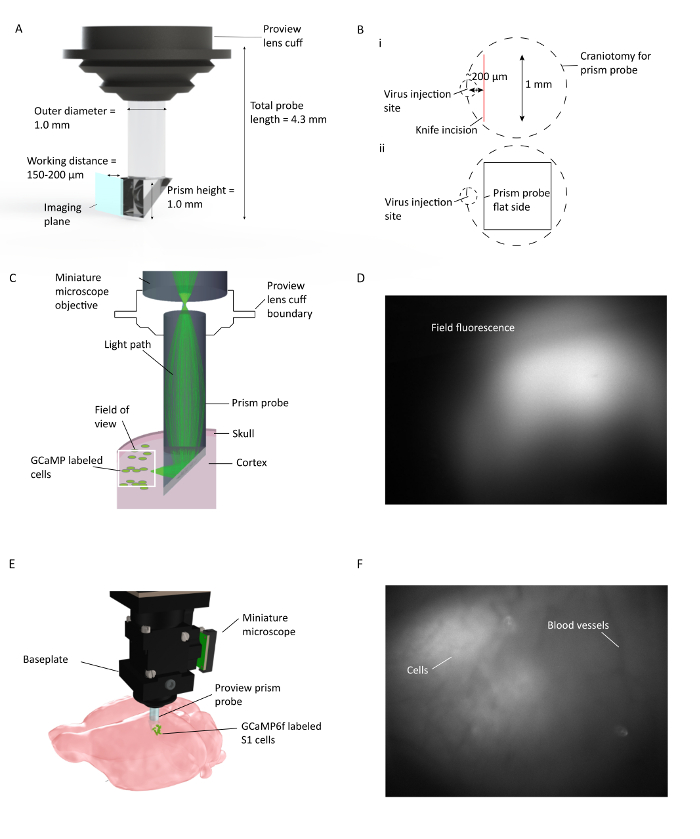
Figure 1: In Vivo Ca 2 + Imagerie dans plusieurs couches corticales chez les souris mobiles. ( A ) Spécifications de la sonde Prism et description du plan d'imagerie. Le revêtement réfléchissant à l'intérieur de l'hypoténuse permet d'imaginer 90 ° à partir du plan d'insertion de la sonde de prisme. La lentilleFf s'intègre avec le support de l'objectif, qui rationalise la procédure d'implantation et permet une visualisation potentielle de la fluorescence du tissu ambiant lors de l'implantation ( B ) (i). Illustration du placement de la craniotomie de la sonde de prisme et de l'incision du couteau par rapport au site d'injection de virus, et (ii) illustration de l'emplacement du côté plat de la sonde de prisme par rapport à l'incision du couteau et au site d'injection de virus. ( C ) Illustration de l'installation d'imagerie Ca 2+ in vivo montrant le chemin de lumière pour une petite zone dans le champ de vision complet à travers une sonde de prisme implantée dans le cortex de souris. ( D ) Exemple de champ de vision pendant l'installation de la sonde de prisme. Le microscope miniature est fixé au support de l'objectif, qui maintient la sonde de prisme permettant de vérifier l'expression du virus pendant l'installation de la sonde de prisme. ( E ) Intégration du microscope avec une sonde de prisme pour l'imagerie corticale multi-couches de cellules S1 marquées par GCaMP6f. F Exemple de champ de visionLors de l'installation de la plaque de base. Le modèle des vaisseaux sanguins propres est visible au moment de l'installation de la plaque de base avec certaines cellules en image brute. Plus de cellules sont clairement visibles lorsque DF / F est activé dans la fenêtre du logiciel d'acquisition. Cliquez ici pour voir une version plus grande de ce chiffre.
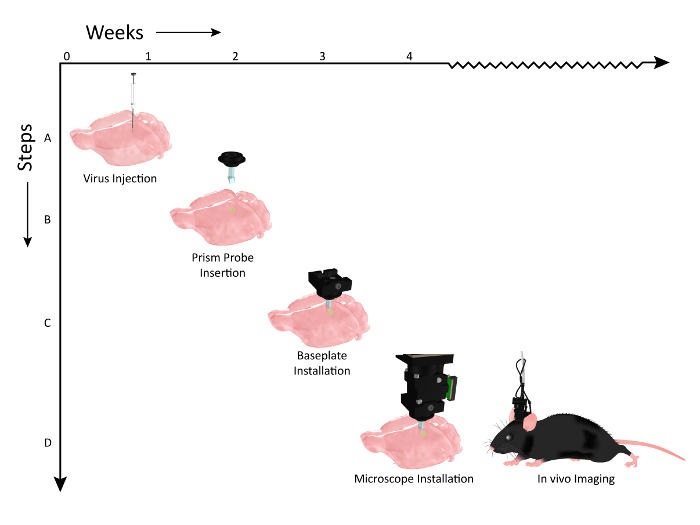
Figure 2: schéma montrant la chronologie des événements du flux de travail pour l'implantation de la sonde prisme et l'installation du microscope. Le nombre de semaines est représenté sur l'axe X et les étapes du flux de travail des procédures selon l'axe des Y. ( A ) Graphique illustrant l'injection virale (AAV1.CaMKII.GCaMP6f.WPRE.SV40) le long du même axe dorso-ventral, pour étiqueter plusieurs couches du cortex somatosensoriel de souris. ( B ) 2 semaines après les injections de virus, un problème de prismeE est implanté sur un axe parallèle aux sites d'injection de virus. ( C ) Environ une semaine après l'implantation de la sonde de prisme, l'animal est vérifié pour l'expression au microscope et une plaque de base est montée sur la tête si une population de cellules est visible. ( D ) L'animal est alors prêt pour l'imagerie chronique pendant les tâches comportementales pertinentes (clip art de la souris modifié après autorisation de UW-Madison Biochemistry MediaLab). Cliquez ici pour voir une version plus grande de ce chiffre.
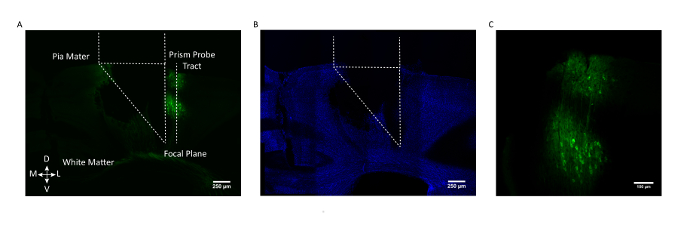
Figure 3: Validation histologique post-mortem de l'emplacement de la sonde Prism et expression GCaMP. ( A ) Section coronal à partir d'un cerveau de souris représentatif montrant le tube de sonde de prisme et avec son côté d'imagerie faceLes cellules exprimant GCaMP6f (AAV1.CaMKII.GCaMP6f exprimées dans les neurones dans les couches 2/3 et 5). ( B ) Même section du cerveau coronal après coloration pour DAPI. Barre d'échelle = 250 μm ( C ) Zoomé en vue des cellules exprimant GCaMP6f dans le cortex somatosensoriel. Barre d'échelle = 100 μm. Cliquez ici pour voir une version plus grande de ce chiffre.
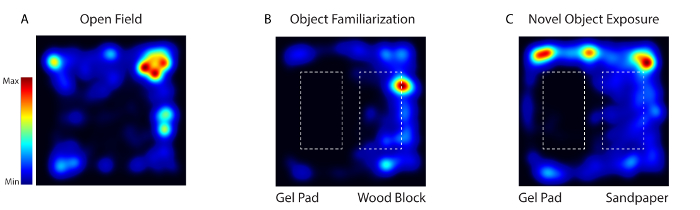
Figure 4: Activité de la souris lors de l'habituation, de la familiarisation et de nouveaux tests d'exposition d'objet a été suivie en vidéo avec un logiciel vidéo. ( A ) Le jour 1, l'animal a été placé dans une arène de comportement dépourvue de tout objet (champ ouvert). ( B ) Aux jours 2 à 4, les deux mêmes objets texturément différents (bloc de gel et bloc de bois) ont été placés dans l'arène (Object FamiLiarisation). ( C ) Le jour 5, l'un des objets a été remplacé par un nouvel objet (bloc de bois avec du papier de sable) (Novel Object Exposure). Cliquez ici pour voir une version plus grande de ce chiffre.
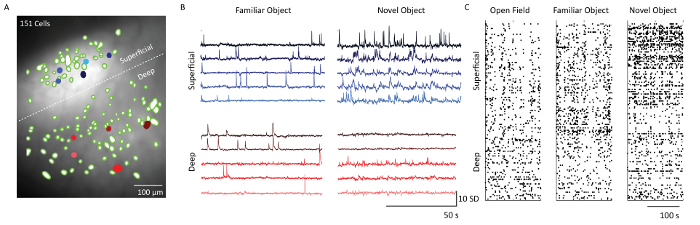
Figure 5: Dynamique du calcium à partir de couches superficielles et profondes du cortex somatosensoriel d'une souris représentative implémentée au microscope. ( A ) Image fusionnée de filtres spatiaux neuronaux (blobs verts) et projection moyenne d'intensité de fluorescence de l'enregistrement par microscope à l'aide d'un champ de vision de prisme. Bordure entre les couches supragranulaire et infragranulaire indiquées par une ligne pointillée blanche. Barre d'échelle = 100 μm. ( B ) Traces de calcium de cinq exemples de cellules superficielles et de couches profondes (remplies de bleu et de rouge cElls dans le panneau A), indiquant des unités d'écart type de fluorescence suite à une analyse de composant principale et indépendante. Barre d'échelle horizontale 50 s et barre d'échelle verticale 10 SD ( C ) Placement de cellules de couches superficielles (couches 2/3) et couches profondes (couche 5) affichées sur le champ Ouvrir, Familiarisation avec les objets et Exploration d'objets nouveaux. Barre d'échelle = 100 s. Cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
La compréhension de l'activité du circuit neuronal pendant le comportement éveillé est un niveau vital d'investigation neurologique nécessaire pour disséquer efficacement le fonctionnement du cerveau dans la santé et la maladie. Le cortex est une région particulièrement importante pour étudier dans le contexte du comportement éveillé, car il joue un rôle important dans de nombreuses fonctions sensorielles, cognitives et exécutives essentielles 28 , 29 .
On pense que la colonne corticale est l'unité fonctionnelle de base dans le cortex et l'activité au niveau de la population des cellules corticales diffère en fonction de leur emplacement physique dans la colonne. Par exemple, les neurones excitateurs dans les couches 2/3 dans le cortex somatosensoriel se dirigent principalement vers d'autres régions néocorticales et modulent d'autres réseaux corticaux 30 , tandis que les cellules dans des couches plus profondes concernent principalement des régions sous-corticales comme le thalamus 31 . Enregistrement de l'activité de centS de cellules corticales pré-spécifiées simultanément et de manière fiable au fil du temps à travers différentes lames dans des sujets à comportement libre, améliorerait considérablement notre compréhension du flux d'information corticale, permettant une dissection fonctionnelle plus fine des colonnes corticales informée par l'information comportementale en temps réel et le temps- Balance.
La collecte de ce niveau de données du circuit neuronal est rendue possible grâce à l'utilisation d'une plate-forme de microscopie miniaturisée efficace et rationalisée pour mener à grande échelle l'imagerie Ca 2 + dans des sujets à comportement libre (ou les sujets fixés en tête, selon vos besoins). Utilisé avec des indicateurs de calcium génétiquement codés pour permettre le ciblage spécifique du type cellulaire et l'imagerie d'un champ de vision multicouche fourni par une sonde de prisme implantée chroniquement, ce protocole a exploré un cas parmi plusieurs applications possibles: observation des différences laminaire dans le traitement cortical somatosensoriel chez les souris Physiquement engagé avec un objet nouveau ( figure 5 ).Il s'agit de la première illustration procédurale de ce genre d'approche spécifique de type cellule in vivo pour étudier de multiples couches corticales chez des animaux éveillés et de comportement libre et élargit le spectre des méthodes expérimentales disponibles pour comprendre les structures lamelles dans le cerveau actif.
Le champ de vision périscopique permis par la sonde de prisme dans cette technique peut être appliqué à d'autres structures cérébrales lorsque la préservation du tissu directement dorsal à une région d'intérêt est souhaitée; Par exemple, l'imagerie CA3 pourrait être obtenue sans interruption de la fonction de l'hippocampe.
L'approche basée sur la sonde Prism pour l'imagerie de l'activité Ca 2+ nécessite l'insertion physique et l'implantation permanente d'un microprisme dans le cortex, ce qui équivaut à la création d'une lésion corticale où la sonde de lentille est insérée. Cela peut entraîner des perturbations dans les circuits neuronaux locaux, y compris la séparation des dendrites apicales et des processus. TSa procédure entraînera également une activation initiale des cellules gliales dans la région, bien que cela soit localisé sur le tissu à environ 150 μm de la face du prisme et pour diminuer après que le cerveau a guéri 22 . Il est très important de considérer si cette technique affectera l'anatomie et / ou le comportement normal des animaux lors de la planification des expériences. Les groupes témoins comportementaux devraient toujours être conduits pour s'assurer qu'il n'y a pas de modifications significatives dans les comportements de base qui pourraient produire des résultats expérimentaux confondus.
L'utilisation de cette technique d'imagerie de Ca 2+ miniaturisée et mobile avec des manipulations neuropharmacologiques, de divers paradigmes de comportement cognitifs, sociaux, moteurs ou intrinsèques, et de la combiner avec d'autres mesures physiologiques peut approfondir et enrichir des études axées sur la compréhension des rôles fonctionnels des circuits neuronaux dans le comportement et le signal Traitement 32 . Suppression ou activitéCertaines voies modulées par les médicaments peuvent influencer les comportements associés, ce qui peut être facilement étudié en utilisant cette technologie 33 . Ramener dans différents types de cellules en modifiant le ciblage de l'indicateur de calcium est une autre application puissante et utile, et permet de nombreuses combinaisons créatives d'outils expérimentaux pour répondre à diverses questions sur les circuits neuronaux.
Déclarations de divulgation
Les auteurs ont lu la politique de la revue et ont les intérêts concurrents suivants: SG, SO et VC sont des employés rémunérés à Inscopix.
Remerciements
Les auteurs tiennent à remercier V. Jayaraman, DS Kim, LL Looger et K. Svoboda du Projet d'identification et d'identification neuronale génétiquement codée (GENIE) à Janelia Research Campus de l'Institut médical Howard Hughes pour leur don généreux de AAV1-GCaMP6f À l'Université de Pennsylvanie Vector Core. Ils souhaiteraient également remercier le A. Olson et Neuroscience Microscopy Core à l'Université de Stanford, soutenus par la subvention NS069375 du NIH pour leurs services de microscopie confocale.
matériels
| Name | Company | Catalog Number | Comments |
| Neurostar Motorized Ultra Precise Small Animal Stereotaxic Instrument | Kopf | Model 963SD | Surgery |
| Stereoscope | Labomed | Prima DNT | Surgery and Imaging |
| Mini Rectal Thermistor Probe (.062"/1.6 mm diameter) - 1/4" Jack | FHC | 40-90-5D-02 | Surgery |
| Heating Pad 5 X 12.5 cm | FHC | 40-90-2-07 | Surgery |
| DC Temperature Controller | FHC | 40-90-8D | Surgery |
| Microsyringe Pump | World Precision Instruments | UMP3 model; serial 155788 F110 | Surgery |
| NanoFil 10 μL Syringe | World Precision Instruments | NANOFIL | Surgery |
| 35 G Beveled Tip Nanofil NDL 2PK | World Precision Instruments | NF35BV-2 | Surgery |
| Omnidrill35, 115 - 230 V | World Precision Instruments | 503598 | Surgery |
| Burrs for Micro Drill | Fine Science Tools | 19007-05 | Surgery |
| nVista | Inscopix | 100-001048 | Imaging |
| AAV1.CaMKII.GCaMP6f.WPRE.SV40 | Penn Vector Core | AV-1-PV3435 | Surgery |
| Ketoprofen | Victor Medical | 5487 | Surgery |
| Carprofen | Victor Medical | 1699008 | Surgery |
| Isoflurane | Victor Medical | 1001054 | Surgery |
| Gelfoam (Patterson Veterinary Supply Inc Gelfoam Sponge 12 cm x 7 mm) | Pfizer (Fisher Scientific) | NC9841478 | Surgery |
| Dumont #5/45 forceps | Fine Science Tools | 11251-35 | Surgery |
| Dumont #5 forceps | Fine Science Tools | 11251-30 | Surgery |
| Dissecting knives | Fine Science Tools | 10055-12 | Surgery |
| ProView Implant Kit | Inscopix | 100-000756 | Surgery and Imaging |
| ProView Prism Probe 1.0 mm-Dia. ~4.3 mm Length | Inscopix | 100-000592 | Surgery and Imaging |
| Kwik-Sil adhesive pack of 2 | World Precision Instruments | KWIK-SIL | Surgery |
| Kwik-Cast Sealant | World Precision Instruments | KWIK-CAST | Surgery and Imaging |
| Miniature Optical Mounting Post | Newport | M-TSP-3 | Imaging |
| Microscope Baseplate | Inscopix | BPL-2 | Imaging |
| Microscope Baseplate Cover | Inscopix | BPC-2 | Imaging |
Références
- McConnell, S. K. Development and decision-making in the mammalian cerebral cortex. Brain Res. 472 (1), 1-23 (1988).
- Kwon, S. E., Yang, H., Minamisawa, G., O'Connor, D. H. Sensory and decision-related activity propagate in a cortical feedback loop during touch perception. Nat. Neurosci. 19 (9), 1243-1249 (2016).
- Miller, E. K., Cohen, J. D. An integrative theory of prefrontal cortex function. Annu. Rev. Neurosci. 24, 167-202 (2001).
- Bailey, M. R., Simpson, E. H., Balsam, P. D. Neural substrates underlying effort, time, and risk-based decision making in motivated behavior. Neurobiol. Learn. Mem. 133, 233-256 (2016).
- Dehaene, S., Changeux, J. P. Reward-dependent learning in neuronal networks for planning and decision making. Prog. Brain Res. 126, 217-229 (2000).
- Ferenczi, E. A., et al. Prefrontal cortical regulation of brainwide circuit dynamics and reward-related behavior. Science. 351 (6268), aac9698(2016).
- Anomal, R. F., et al. Impaired Processing in the Primary Auditory Cortex of an Animal Model of Autism. Front. Sys. Neurosci. 9, 158(2015).
- Pauls, D. L., Abramovitch, A., Rauch, S. L., Geller, D. A. Obsessive-compulsive disorder: an integrative genetic and neurobiological perspective. Nat. Rev. Neurosci. 15 (6), 410-424 (2014).
- Ziv, Y., et al. Long-term dynamics of CA1 hippocampal place codes. Nat. Neurosci. 16 (3), 264-266 (2013).
- Jennings, J. H., et al. Visualizing hypothalamic network dynamics for appetitive and consummatory behaviors. Cell. 160 (3), 516-527 (2015).
- Betley, J. N., et al. Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature. 521 (7551), 180-185 (2015).
- Sun, C., et al. Distinct speed dependence of entorhinal island and ocean cells, including respective grid cells. Proc. Natl. Acad. Sci. 112 (30), 9466-9471 (2015).
- Kitamura, T., et al. Entorhinal Cortical Ocean Cells Encode Specific Contexts and Drive Context-Specific Fear Memory. Neuron. 87 (6), 1317-1331 (2015).
- Pinto, L., Dan, Y. Cell-Type-Specific Activity in Prefrontal Cortex during Goal-Directed Behavior. Neuron. 87 (2), 437-450 (2015).
- Cox, J., Pinto, L., Dan, Y. Calcium imaging of sleep-wake related neuronal activity in the dorsal pons. Nat. Comm. 7, 10763(2016).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nat. Protoc. 11 (3), 566-597 (2016).
- Hooks, B. M., et al. Organization of cortical and thalamic input to pyramidal neurons in mouse motor cortex. The J. Neurosci. 33 (2), 748-760 (2013).
- Masamizu, Y., et al. Two distinct layer-specific dynamics of cortical ensembles during learning of a motor task. Nat. Neurosci. 17 (7), 987-994 (2014).
- Rowland, D. C., Moser, M. -B. From cortical modules to memories. Curr. Opin. Neurobiol. 24 (1), 22-27 (2014).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nat. Methods. 8 (10), 871-878 (2011).
- Mukamel, E. A., Nimmerjahn, A., Schnitzer, M. J. Automated analysis of cellular signals from large-scale calcium imaging data. Neuron. 63 (6), 747-760 (2009).
- Andermann, M. L., et al. Chronic cellular imaging of entire cortical columns in awake mice using microprisms. Neuron. 80 (4), 900-913 (2013).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nat. Protoc. 9 (11), 2515-2538 (2014).
- Chia, T. H., Levene, M. J. In vivo imaging of deep cortical layers using a microprism. J. Vis. Exp. (30), (2009).
- Chia, T. H., Levene, M. J. Microprisms for in vivo multilayer cortical imaging. J. Neurophysiol. 102 (2), 1310-1314 (2009).
- Chia, T. H., Levene, M. J. Multi-layer in vivo imaging of neocortex using a microprism. Cold Spring Harb. Protoc. 2010 (8), pdb.prot5476 (2010).
- Low, R. J., Gu, Y., Tank, D. W. Cellular resolution optical access to brain regions in fissures: imaging medial prefrontal cortex and grid cells in entorhinal cortex. Proc. Natl. Acad. Sci. 111 (52), 18739-18744 (2014).
- Zeisel, A., et al. Brain structure. Cell types in the mouse cortex and hippocampus revealed by single-cell RNA-seq. Science. 347 (6226), 1138-1142 (2015).
- Hawrylycz, M., et al. Inferring cortical function in the mouse visual system through large-scale systems neuroscience. Proc. Natl. Acad. Sci. 113 (27), 7337-7344 (2016).
- Petrof, I., Viaene, A. N., Sherman, S. M. Properties of the primary somatosensory cortex projection to the primary motor cortex in the mouse. J. Neurophysiol. 113 (7), 2400-2407 (2015).
- Aronoff, R., et al. Long-range connectivity of mouse primary somatosensory barrel cortex. Euro. J. Neurosci. 31 (12), 2221-2233 (2010).
- Rogan, S. C., Roth, B. L. Remote control of neuronal signaling. Pharma. Rev. 63 (2), 291-315 (2011).
- Berdyyeva, T., et al. Zolpidem reduces hippocampal neuronal activity in freely behaving mice: a large scale calcium imaging study with miniaturized fluorescence microscope. PloS One. 9 (11), e112068(2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon