Method Article
Многослойный кортикальный Ca
В этой статье
Резюме
Здесь мы представляем процедуру для крупномасштабной визуализации Ca 2+ с клеточным разрешением через несколько корковых слоев у свободно движущихся мышей. Одновременно можно наблюдать сотни активных клеток, используя миниатюрный микроскоп, монтируемый на голову, в сочетании с имплантированным призменным зондом.
Аннотация
Функциональная визуализация in vivo и клеточного уровня - важный инструмент для понимания мозга в действии. Высокое разрешение изображений кортикальных нейронов мыши с двухфотонной микроскопией обеспечило уникальную информацию о структуре, функции и пластичности коры. Однако эти исследования ограничены головными животными, значительно уменьшающими сложность поведения, доступную для изучения. В этой статье мы описываем процедуру для проведения хронической флуоресцентной микроскопии с клеточным разрешением через несколько корковых слоев у свободнодействующих мышей. Мы использовали интегрированный миниатюрный флуоресцентный микроскоп, соединенный с имплантированным зондом призмы, чтобы одновременно визуализировать и регистрировать динамику кальция сотен нейронов на нескольких слоях соматосенсорной коры, поскольку мышь занималась новой задачей исследования объектов в течение нескольких дней. Этот метод можно адаптировать к другим областям мозга у разных видов животных для других поведенческих paradigms.
Введение
Кора является существенным игроком во многих сложных ментальных и поведенческих функциях, от внимания, сенсорного восприятия и нисходящего когнитивного контроля 1 , 2 , 3 до мотивационных, поощрительных и наркотических путей 4 , 5 . Понимание вычислительных процессов, лежащих в основе его функции, является важной задачей для лучшего клинического понимания многих психических и поведенческих расстройств.
Многие современные теории психиатрической болезни сосредотачиваются вокруг идеи о том, что дисфункция коры головного нерва или диссоординация могут лежать в основе когнитивных и поведенческих аномалий, которые являются отличительными чертами таких состояний, как шизофрения 6 , аутизм 7 или обсессивно-компульсивное расстройство. Таким образом, получение данных о нейральной активности населенияВ правильном контексте одновременной поведенческой информации имеет большое значение и в идеале может быть нацелена на конкретные типы клеток для более тонкой диссекции нейронных схем.
Миниатюрные микроскопы в сочетании с микролинзами с имплантируемым градиентным показателем преломления (GRIN) обеспечивают оптический доступ к нейронным ансамблям в условиях свободного перемещения из разнообразных возможных областей мозга 9 , 10 , 11 , 12 , 13 , включая кору 14 , 15 , 16 . Использование мобильной микроскопии в сочетании с генетически кодированными индикаторами кальция позволяет обеспечить последовательную визуализацию той же клеточной популяции, охватывающей сотни нейронов, в течение нескольких дней до нескольких недель во многих областях мозга 9 , и может бытьГенетически ориентированных на конкретные типы клеток с использованием вирусного вектора или трансгенных методов.
Поскольку известно, что кора поддерживает различные функции и соединяется с различными областями мозга в зависимости от местоположения клеток внутри кортикальной пластинки 17 , 18 , 19 , нас интересует одновременная многослойная нейронная активность у бодрствующих субъектов. Здесь мы демонстрируем, как фотографировать сотни флуоресцентно меченых нейронов у свободнодействующих мышей в течение нескольких дней, используя миниатюрный флуоресцентный микроскоп 20, соединенный с имплантированным призменным зондом, который предлагает многослойный вид коры ( рис. 1 ).
Используемый здесь призменный зонд состоит из двух отдельных линз GRIN: призмы и цилиндрического релейного объектива ( рис. 1 ). Свет микроскопа возбуждает флуоресцентно маркированныйЯчейки, расположенные вдоль поверхности изображения зонда призмы, после отражения от гипотенузы призменной части зонда. Испускаемый свет из клеток также отражает от гипотенузы призмы, собирается через объектив микроскопа и достигает датчика в микроскопе. Призматический зонд, используемый в этой процедуре, предназначен для легкого использования со стандартным стереотаксическим оборудованием.
Миниатюрный флуоресцентный микроскоп 20 обнаруживает переходные процессы Ca 2+ с потенциально вызванным потенциалом в популяциях нейронов с разрешением одной клетки, после того как эти клетки были специально маркированы чувствительными к Ca 2+ генетически закодированными флуоресцентными индикаторами. В этом протоколе мы вводим индикатор Ca 2+, закодированный в вирусном векторе (AAV1.CaMKII.GCaMP6f.WPRE.SV40), внедряем зонд призмы, устанавливаем микроскоп, затем получаем несколько дней соматосенсорных (S1 задних конечностей) данных о нейральной активности От животного выставлятьD к новым поверхностям объекта во время свободной разведки ( рис. 2 ).
протокол
Процедуры, связанные с животными, были одобрены Институтом по уходу и использованию животных (IACUC) в LifeSource Biomedical Services, Исследовательском центре NASA Эймс, Калифорния.
1. Предварительная подготовка
- Стерилизуйте инструменты, которые будут использоваться в хирургических процедурах в стерилизаторе с горячим бусильником, и протрите хирургическую зону 70% этанолом. Включите нагревательную подушку, расположенную поверх стереотаксической ступени, и поддерживайте ее при 37 ° C.
- Анестезируйте животное, используя изофлуран (5% для индукции и 1-2% для поддержания, 0,6-0,8 л / мин O 2 ). Проверьте отсутствие рефлекса пальца ноги, чтобы оценить глубину анестезии.
- Установите животное в стереотаксическую раму, снабженную ушами и зубьями.
- Нанесите глазную мазь на глаза животного и накройте их куском темной бумаги, чтобы защитить их от сушки и интенсивных хирургических огней.
- Подкожно вводить животное кетопрофеном (2,5Мг / кг) или карпрофен (2,5 мг / кг)
2. Хирургия инъекций вирусов
- Обрежьте и побрите скальп между глазами и ушами и продезинфицируйте кожу тремя альтернативными тампонами из 70% этанола и бетадина.
- Выложите череп, сделав надрез в скальпе, начиная между глаз и расширяя 1,5 см рострокаудала стерильным хирургическим лезвием. Откройте кожу, чтобы обнажить череп, и удалите надкостницу вокруг желаемого места инъекции с помощью ватных тампонов и скальпеля. Прополощите череп стерильным PBS. Очистите и отполируйте череп ватными тампонами.
- Выровняйте череп и отметьте маркеры стереотаксическими координатами для инъекций вируса. Используя заусенцы 0,5 мм на высокоскоростном микрорубке (установленном около 7000-10 000 об / мин), создайте небольшое отверстие в черепе. Нанесите небольшое давление во время сверления и периодически очищайте костную пыль и смачивайте область стерильным PBS, чтобы предотвратить перегрев ткани головного мозга, пока поверхность мозга не будет повторноболело. Держите мозг влажным, где отверстие просверлено.
- Используйте иглу 26 G для сбора вируса ( например, AAV1.CaMKII.GCaMP6f.WPRE.SV40) в микрошприце, а затем замените его иглой 35 G для инъекций. Прикрепите микроширин, загруженный вирусом к манипулятору рычага стереотаксического аппарата.
- Принесите шприц близко к отверстию для места инъекции и отрегулируйте угол иглы, чтобы она попала под углом 90 ° к поверхности мозга. Опустите иглу, пока она не коснется pia mater и пронзите через твердую поверхность. Начинайте опускать иглу с шагом 10 мкм / с до достижения желаемой глубины (z). Закрепите положение иглы там, используя стереотаксический рычаг.
- Установите микросиринговый насос для инъекции 250 нл вируса при 25 нЛ / мин.
- Критический шаг: поскольку объем вируса, который нужно впрыскивать, зависит от титра и разбавления, эксперименты по разбавлению заблаговременно, чтобы установить оптимальные критерии объема и концентрации для изображенийВ эксперименте.
- Если какой-либо вирус виден из места инъекции, приостановите инъекцию и подождите, пока мозговая ткань не поглотит вирусную каплю. Подождите 5-7 минут после того, как общий объем был введен, прежде чем втягивать иглу. Красители, такие как быстрый зеленый, также могут быть добавлены к раствору вируса, чтобы помочь контролировать скорость инъекции в том случае, если вирус будет выходить из поверхности мозга.
- Для маркировки нескольких слоев в коре используйте при необходимости несколько инъекций. Сначала начинайте на вентральном участке, ожидая 5-7 минут после инъекции, и подтягивая иглу к следующей самой дорзальной точке для инъекций ( например, вводите на уровне -1,0 мм AP, 1,5 мм ± ML и 400 и 600 мкм DV). Подождите 10 минут после окончательной инъекции, прежде чем вытаскивать иглу и удалять ее из стереотаксической установки.
- Смешайте небольшое количество биосовместимого прозрачного эластомерного клея in vivo из шприца с двойным стволом (Например, Kwik-Sil) и покрыть отверстие в черепе. Нанесите цианоакрилатный адгезив поверх слоя эластомерного клея и дайте ему вылечить.
- Шовный скальп и позвольте животному оправиться от анестезии в теплой клетке для восстановления, пока она не станет амбулаторной. Администрирование кетопрофена (2,5 мг / кг) или carprofen (2,5 мг / кг) подкожно до возвращения животного в его домашнюю клетку. Одиночные предметы после операции для защиты места операции и повторная доза через 24 часа.
- После извлечения микросвинка промыть игольчатые иглы 26 G и 35 G в 7-10 раз дистиллированной водой для очистки перед хранением.
3. Хирургия имплантата имплантата призма
- 1-2 недели после инъекции вируса, подготовьтесь к операции имплантата с призматическим зондом. Дезинфицируйте зонд призмы в 70% этаноле и очистите его бумагой для линз. Вставьте зонд призмы в инструмент держателя объектива и затяните шестигранный винт с помощью отвертки. Установите микроскоп в держатель основания (Магниты будут удерживать его на месте).
- Подготовьте животное, как описано в разделе Pre-operative Preparation.
- Обрежьте и побрите голову животного между глазами и ушами и продезинфицируйте кожу альтернативными тампонами из 70% этанола и бетадина.
- Выставляйте череп, вызывая кожу с помощью пары стерильных ножниц и удаляйте лоскут кожи и лежащую под надкостницу. Высушите и полируйте череп ватными тампонами. Обеспечьте адекватное удаление окружающей мышечной ткани, чтобы создать чистый, сухой, широкий костный фундамент для подготовки к следующим этапам.
- Внесите имплантаты из черепа в контрлатеральное полушарие, чтобы сделать имплантат стабильным и безопасным. Они также могут быть полезны, если вы захотите имплантировать подставку для фиксации бодрствования головы, чтобы подготовить животное к экспериментальным сеансам визуализации в разделе 5.
- Выровняйте череп и отметьте маркеры AP и ML для установки объектива. Используя 0,5 мм заусенцев на микротрещине, открывайте круглую краниотомию, обеспечиваяДиаметр краниотомии в этом случае больше, чем диаметр призмы, т.е. 1,0 мм. Мягко будьте осторожны, делая паузу, чтобы очистить череп стерильным PBS и всасывать его ватными тампонами. Удалите образующуюся костную пыль.
- Критический шаг: поместите краниотомию таким образом, чтобы, когда призма была вставлена в кору, ее плоский край (поверхность изображения) обращен к месту инъекции вируса и находится в радиусе 150-200 мкм.
- Прекратите сверление прямо перед тем, как череп полностью разжится. Кровеносные сосуды должны быть видны через разреженную кость. Извлеките костяной штекер осторожно с помощью мелких пинцетов на 45 °.
- Удалите дуру с помощью щипцов № 5.
- Критический шаг: как только ткань мозга обнажается, всегда держите ткань влажной. Поместите ватный тампон, погруженный в стерильный физиологический раствор, по краниотомии. Это также будет поддерживать давление на ткань.
- Чтобы облегчить давление в ткани головного мозга duКольцевая вставка зонда призмы, создайте дорожку ввода раньше времени. Прикрепите нож с прямым обрезанием к кронштейну держателя электрода стереотаксического аппарата и установите его на стереотаксическом аппарате под углом, так что лезвие ножа перпендикулярно кривизне черепа (угол 10 ° в этом случае) и в Плоскостью, параллельной колонке впрыска вируса.
- Осторожно расположите нож над краниотомией вдоль его переднего медиального края в этом случае и ~ 200 мкм в поперечном направлении к месту инъекции вируса с режущей кромкой, обращенной назад ( рис. 1 ). Извлеките ось Z, когда кончик ножа касается пиа и постепенно опустите его (с шагом 10 мкм / с) на глубину, на которой будет вставлен призменный зонд. Затем переместите нож на 1 мм назад, чтобы создать путь для передней кромки призмы. Пауза и контроль для любого кровотечения, которое может произойти при выполнении разреза с предварительно стерильным физиологическим раствором, пропитанным кусочком геллоама.
- Как только нож находится в этом положении, промойте участок стерильным физиологическим раствором и подождите, пока не исчезнет кровотечение. Затем медленно втягивайте нож, используя стереотаксический микроманипулятор руки с шагом 10 мкм / с, и поместите кусок губчатой губки, пропитанной стерильным физиологическим раствором над разрезом.
- Прикрепите держатель объектива (с призменным зондом и микроскопом) к рычагу стереотаксического манипулятора под тем же углом, что и нож на предыдущем шаге. Выровняйте призму так, чтобы плоская сторона призмы была над разрезом и параллельна колонке с инъекцией вируса. Этот шаг может потребовать некоторой тонкой коррекции положения стереотаксического рычага. Отрегулируйте выравнивание, оставаясь рядом с черепом для получения более быстрых результатов.
- После того, как призма находится под правильным углом, постепенно опустите ее в мозг с шагом 10 мкм до конечного z 1,1 мм для этого зонда, начиная с поверхности мозга. Ткань мозга будет расширяться вокруг призмы, и любое давление, которое создается, находится за визуализациейНа плоскости и не повлияет на поле зрения. Подключите микроскоп к компьютеру с программным обеспечением для сбора данных, установленным через порт USB3, и визуализируйте флуоресценцию поля, включив светодиод.
- Оберните любую открытую ткань вокруг призмы в краниотомию в очень тонком защитном слое эластомерного клея, используя иглу 25G.
- После отверждения эластомерного клея (обычно в ~ 3-5 мин) используйте иглу 25G для нанесения какого-либо цианоакрилатного адгезива, чтобы прикрепить стекло призменной линзы к прилегающему черепу над слоем эластомерного клея, чтобы предотвратить перемещение объектива внутри Краниотомия. Включите края манжеты зонда призмы для лучшей адгезии. Не используйте клей на верхней поверхности имплантированного призмы. После отверждения клея цианоакрилата отвинтите держатель объектива и осторожно удалите микроскоп. Затем медленно втягивайте рычаг стереотаксического манипулятора, чтобы надежно имплантировали зонд.
- Нанесите слой зубного акрила илиЦианоакрилатного клея вокруг имплантата, чтобы покрыть всю открытую поверхность черепа, до, но не касаясь окружающей убранной мышечной ткани. Покрытие большой площади черепа с этой черепной крышкой позже поможет в прикреплении к основанию. Кожа вокруг места имплантата должна исцелять самостоятельно вокруг черепной крышки.
- Критический шаг: не допускайте прилипания клея к окружающей среде или к мышечной ткани и не замазывайте кожу краниальной крышкой. Это приведет к раздражению кожи и может привести к чрезмерному царапинам и потенциальному повреждению имплантата.
- Необязательно: если вы хотите использовать пробужденную настройку с фиксированной головой для прикрепления и отсоединения микроскопа к базовой плите животного в экспериментальных сеансах визуализации, а не кратковременного обезболивания или скручивания животного, имплантируйте головной убор в черепном колпачке, который совместим со спиной, Фиксированная настройка выбора (не показана в этом протоколе).
- Смешайте катализатор и основание из кремнияE клейкого шприца и поместите каплю эластомера внутри манжеты призматического зонда, чтобы покрыть верхнюю часть зонда, чтобы предотвратить повреждение и пыль от осаждения.
- Удалите животное из стереотаксического каркаса и позвольте восстановить при анестезии в теплой камере. Администрируйте кетопрофен (2,5 мг / кг) или карпрофен (2,5 мг / кг) подкожно и возвращайте животное в чистую домашнюю клетку, когда он находится в амбулаторном состоянии. Соберите все предметы для защиты имплантата и повторите дозу через 24 часа.
4. Установка базовой плиты для установки миниатюрного микроскопа
- Через неделю или 10 дней после имплантации зонда призмы проверяйте экспрессию вируса в ткани через имплантированный зонд и прикрепите опорную плиту на черепе, если препарат показывает активность клеток. Микроскоп будет закрепляться на базовой плите во время живого изображения.
- Выполните шаги, описанные в предоперационной процедуре подготовки животного к прикреплению к основанию,
- Снимите силиконовый клейкий колпачок поверх поверхности имплантированной линзы зонда зонда. Осмотрите поверхность зонда линзы и аккуратно очистите все обломки бумагой для линз и 70% этанолом, чтобы поверхность изображения была чистой.
- Подключите микроскоп к DAQ-коробке и подключите его через порт USB3 к ПК.
- Откройте программное обеспечение для сбора данных на компьютере и подключите микроскоп через порт USB3. Используйте программное обеспечение для регистрации для проверки нейронной активности, а также для измерения и документирования настроек области просмотра для будущих записей в этом предмете.
- Прикрепите опорную плиту к микроскопу и закрепите установочный винт базовой пластины, чтобы удерживать опорную плиту в нужном положении, и закрепите микроскоп в захвате микроскопа на кронштейне стереотаксического микроманипулятора корпусом микроскопа. Прикрепите захват к стержню Newport, который может быть установлен на стереотаксическом кронштейне микроманипулятора.
- Расположите микроскоп над линзой призмы зонда, используя sТиротаксический микроманипулятор. Визуально осмотрите ориентацию, просмотрев призменный объектив со стороны и сзади животного. Оптические оси объектива объектива микроскопа и призмы должны быть выровнены.
- Включите светодиод микроскопа через программное обеспечение. Оцените качество выравнивания микроскопа, сосредоточив внимание на верхней поверхности имплантированной зондовой линзы призмы в программном обеспечении для сбора данных. При правильной выровненности края лицевой поверхности линзы призмы должны быть острыми.
- Отрегулируйте физическое расстояние микроскопа над имплантированным призменным зондом, используя рычаг стереотаксического манипулятора, чтобы получить желаемую фокальную плоскость внутри ткани. Оптически оптимизированное расстояние между объективом микроскопа и имплантированной линзой GRIN составляет ~ 500 мкм.
- Сохраните опорное изображение флуоресценции после захвата желаемой плоскости изображения.
Критическая точка: с этого момента не настраивайте положение микроскопа, так как это изменит положениеНа плоскости изображения в ткани.
ПРИМЕЧАНИЕ. Приложите клей на следующем шаге, чтобы надолго зафиксировать положение опорной плиты относительно черепной крышки. Клей может испытывать некоторую усадку объема на следующий день или два, что может изменить фокальную плоскость в ткани. Упреждайте это, измеряя количество усадки для вашей адгезивной смеси и расстояния ex vivo , а затем поддерживая конечное положение Z микроскопа + опорную плиту на эту величину до перехода на этап нанесения клея. - Используйте зубной акрил или цианоакрилат для постоянного прикрепления опорной плиты к акриловому колпачку, покрывающему череп животного, перекрывая зазор акрилом или клеем. Применяя зубной акрил / цианоакрилат постепенно и отверждая на нескольких этапах, можно свести к минимуму эффект вышеупомянутой усадки в конечном положении плоскости изображения микроскопа.
- Критический шаг: соблюдайте осторожность при применении зубногоАкриловый / цианоакрилат, чтобы предотвратить контакт любого материала с объективом микроскопа, установочным винтом или корпусом микроскопа, что в дальнейшем предотвратит правильную работу прибора.
- Критический шаг: при нанесении клея не нажимайте на микроскоп. Давление на микроскоп или опорную плиту может привести к перемещению объектива микроскопа относительно объектива зонда призмы, что может привести к смещению или изменению фокальной плоскости в ткани, что потребует быстрой корректировки.
- Убедитесь, что зубной акрил / цианоакрилат отвердело и затвердело, постукивая акрилом парой пинцета или наконечника шприца. Получите окончательное опорное изображение флуоресценции с помощью программного обеспечения для сбора данных.
- Выньте микроскоп из захвата и втяните захват из микроскопа. Если использовали цианакрилат или другой прозрачный клей, накройте его черным лаком для ногтей или слоем черного зубного цемента, чтобы предотвратитьMbient light leakage в головную крышку, которая может загрязнять будущие изображения, полученные во время экспериментов.
- В этот момент удалите микроскоп, если необходимо. Для отделения микроскопа от опорной плиты отпустите установочный винт базовой пластины, повернув установочный винт приблизительно на ½ оборота против часовой стрелки. Зажмите корпус микроскопа, поддерживая опорную плиту и акриловый колпачок другой рукой, и вытащите микроскоп прямо вверх. Замените его в контейнере для хранения.
- Защитите имплантированный призменный зонд с крышкой опорной плиты. Это предотвратит осаждение пылевых частиц на поверхность объектива, что может быть сложно очистить после установки опорной плиты.
- Прикрепите крышку опорной плиты на опорной плите и выдвиньте установочный винт приблизительно на 1/2 оборота по часовой стрелке или до тех пор, пока установочный винт не окажется на одном уровне с крышкой базовой плиты. Не перетягивайте.
- Удалите животное из анестезии и наблюдайте в теплой камере восстановления до амбулаторного лечения. ВозвращениеЕ животное в его домашнюю клетку. Одиночно размещайте всех животных с имплантированными базовыми пластинами для защиты имплантата.
5. Отображение нескольких корковых слоев в свободно движущейся мышке
- Подготовьте поведенческий аппарат ( например, Phenotyper, Noldus), очистив и дезинфицируя его и вытирая 10% раствором отбеливателя.
- Подключите микроскоп к своему ящику DAQ и подключите его к компьютеру и запустите программное обеспечение для сбора данных.
- Проверьте наличие достаточного пространства для хранения файлов на компьютере сбора данных и освободите место для фильмов с изображениями с кальцием. Сохраняйте непосредственно из программного обеспечения на локальный жесткий диск, а не записывайте на внешний жесткий диск, чтобы обеспечить высокую скорость передачи данных между микроскопом и компьютером и предотвратить потерю данных во время записи.
- Анестезируйте животное изофлураном (5% в кислороде) в индукционной камере для прикрепления микроскопа. В качестве альтернативы, аккуратно скрутите животное или используйте пробужденную настройку с фиксированной головойС головкой, если анестезия, как известно, мешает поведенческой парадигме выбора.
- Снимите крышку опорной плиты, повернув установочный винт опорной плиты против часовой стрелки и снимите крышку опорной плиты.
- Поместите микроскоп в опорную плиту на животное. Микроскоп должен защелкнуться на месте с помощью магнитов на опорной плите. Продвиньте винт установочной пластины до тех пор, пока не почувствуете слабое сопротивление.
- Критический шаг: не затягивайте болт установочной пластины, чтобы предотвратить повреждение корпуса микроскопа.
- Проверьте плоскость изображения в ткани, получив флуоресцентный снимок в программном обеспечении, и при необходимости отрегулируйте фокальную плоскость в ткани, ослабив установочный винт башни микроскопа, повернув башню микроскопа, чтобы отрегулировать тонкую фокусировку, затем снова затяните турель Болт крепления корпуса.
- Критический шаг: никогда не заставляйте турель поворачиваться без предварительного ослабления установочного винта иНе затягивайте болт крепления револьверной головки.
- Если вы проводите продольное исследование, вернитесь в физическую позицию башни, чтобы зафиксировать одно и то же поле зрения. В аппаратных средствах обратите внимание на количество поворотов турели или физическое положение башни для каждого животного, изображенного с помощью того же микроскопа, для быстрого возвращения в ту же область обзора.
- Освободите животное, несущее микроскоп, в его домашнюю клетку или поведенческую камеру для акклиматизации и ожидайте отмена анестезии, если это применимо.
- Критический шаг. Обучите животных переносить вес микроскопа с помощью фиктивного микроскопа на несколько сеансов, пока не убедитесь, что ношение микроскопа не мешает их нормальному поведению перед началом экспериментальных сеансов. Регулярное обращение и тренировка для активного сна предотвратят чрезмерный стресс у животных.
- Выберите параметры сбора данных, которые будут использоваться для сбора данных. Это включает в себяСкорость передачи данных ( например, 20 кадров в секунду, коэффициент усиления 1 и мощность светодиода 50%). Проверьте гистограмму изображения при выборе параметров, чтобы обеспечить хорошее SNR.
ПРИМЕЧАНИЕ. Числовая апертура для сбора флуоресценции составляет 0,35 для призма 1 мм по сравнению с 0,5 для 1 мм прямого зонда. - Запустите поведенческое программное обеспечение и запрограммируйте его для запуска микроскопа в желаемом цикле записи изображений ( например , 4X 5 мин. ВКЛ. 2 мин. ВЫКЛ.). Подключите TTL-порт к NODUS IO к порту TRIG в поле DAQ через кабель RJ45-BNC.
- Поместите животное в поведенческую арену, если он еще не существует, и начните эксперимент.
- После получения желаемых данных повторно обезболивают животное с изофлураном (5% в кислороде) в индукционной камере или осторожно бодрствуют - удерживайте животное.
- Ослабьте установочный винт базовой пластины и отсоедините микроскоп от опорной плиты, осторожно потянув микроскоп. Замените крышку опорной плиты и аккуратно затяните baseplaTe комплект винт.
- Верните животное в домашнюю клетку до следующего сеанса записи. Используйте справочные флуоресцентные изображения в качестве руководства для последующих сеансов визуализации, чтобы вернуться в одно и то же поле зрения.
6. Оценка крупномасштабных данных изображения Ca 2+
- Чтобы извлечь местоположение ячейки и динамику Ca 2+ в поле зрения из данных, можно использовать различные платформы анализа данных. Мозаика, платформа анализа данных, разработанная специально для обработки широкомасштабных фильмов с изображениями Ca 2+ , была использована для этого исследования здесь.
- Исправить дефектные пиксели и интерполировать любые отдельные отброшенные кадры в необработанных фильмах на этапе предварительной обработки. Загрузите изображения в пространстве с полного поля зрения 1440 x 1080 пикселей на 720 x 540 пикселей, чтобы уменьшить объем данных.
- Чтобы исправить артефакты движения в мозге относительно датчика изображения микроскопа, зарегистрируйте фильмы, используя строгие изображения на основе ImageJ reАлгоритм регистрации (TurboReg).
- Чтобы идентифицировать отдельные нейроны, повторно выразить изображения как относительные изменения флуоресценции ΔF / F 0 = FF 0 / F 0, где F 0 - среднее изображение, полученное путем усреднения всего фильма.
- Определите пространственные фильтры, соответствующие отдельным ячейкам, используя установленный алгоритм сортировки ячейки. Здесь мы использовали основной и индивидуальный анализ компонентов 21 для идентификации отдельных нейронов.
ПРИМЕЧАНИЕ. Событие было определено, когда пиковая амплитуда события в трассе составляла более 8 стандартных отклонений от базовой линии трассы в нашем наборе данных, а данные о местоположении ячейки и данных динамики Ca 2+ были экспортированы для дальнейшего анализа.
Результаты
Описанный здесь протокол описывает эффективный и эффективный способ получения продольных многослойных изображений Ca 2+ из сотен кортикальных нейронов у свободнодействующих мышей с использованием призменных зондов ( рис. 1 ). Предыдущие подходы к многослойной кортикальной визуализации в основном были ограничены головными неподвижными животными 22 , 23 , 24 , 25 , 26 , 27 . Чтобы получить этот уровень данных в контексте свободного поведения, для гибкости поведения использовалась миниатюрная платформа микроскопа; Для целей специфической популяции клеток (CAMKII + клетки в коре) использовали генно-кодированный индикатор кальция (GCaMP6f); И зонд призмы был выбран для обеспечения хронического многослойного поля зрения.
Мы продемонстрировали рабочий процесс для подготовки животного к визуализации. Вирусный вектор, кодирующий соответствующий индикатор кальция, вводили в кору ( рис. 2 , стадия 1) перед тем, как хронически имплантировать призменный зонд, чтобы обеспечить оптический доступ к меченым клеткам ( рис. 2 , стадия 2). Базовая плита, которая служит в качестве безопасной временной док-станции для позиционирования микроскопа во время сеансов визуализации, затем была установлена над головой животного ( рис. 2 , стадия 3), что позволило визуализировать активность коры на нескольких клеточных слоях при активном эксперименте ( Рисунок 2 , шаг 4).
Для обеспечения того, чтобы целевая клеточная популяция подвергалась таргетированию, на третьем рисунке показана отскок корональной части мозга от типичной мыши с участком зонда призмы и поле зрения, отмеченным относительно лаборатории GCaMP6fЭлюированных нейронов в слоях 2/3 и 5 соматосенсорной коры.
Во время бодрствования при визуализации с системой активность соматосенсорных кортикальных нейронов регистрировалась, когда мышь подвергалась воздействию трех разных сред: открытое поле (день 1), обследование объектов (день 2-4) и новый объект (день 5) ( Рисунок 4 ). В первый день мышь была помещена в поведенческую арену, лишенную каких-либо предметов. В День 2-4 мышь была помещена на арену с теми же двумя текстурно разными объектами (гелевая подушка и деревянный блок). В День 5 один из объектов был заменен новым объектом. Животное отображали через 5 дней в течение 20 минут каждый день.
После извлечения клеток с использованием программного обеспечения для анализа данных изображения Ca 2+ пространственные фильтры, соответствующие ячейкам, были наложены на среднюю проекцию интенсивности флуоресценции данных записи микроскопа( Рисунок 5) . Белая пунктирная линия разделяет слои 2/3 и 5 ячеек. Соответствующие следы Ca 2+ из 5 ячеек из каждого из слоев показывают схему обжига клеток в двух разных поведенческих контекстах: обследование объекта и экспозиция нового объекта. Клетки уровня 2/3 были более активными по сравнению с клетками 5-го уровня в тот день, когда мышь подвергалась воздействию нового объекта. Это также видно из растровых графиков, которые показывают пороговую активность обжига всех отображаемых ячеек в дни 1, 4 и 5.
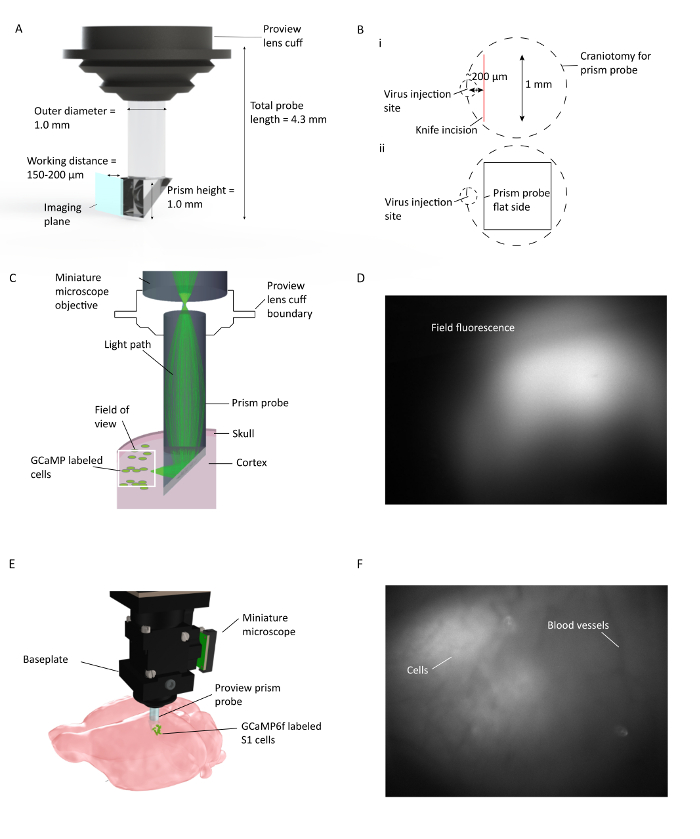
Рисунок 1: In Vivo Ca 2+ Imaging на нескольких корковых слоях у свободно перемещающихся мышей. ( A ) Характеристики зонда призмы и изображение плоскости изображения. Отражающее покрытие на внутренней поверхности гипотенузы позволяет визуализировать 90 ° от плоскости вставки призмы. Объектив cuFf интегрируется с держателем объектива, что упрощает процедуру имплантации и позволяет потенциально наблюдать флуоресценцию окружающей ткани во время имплантации ( B ) (i). Иллюстрация размещения краниотомии зондирующего зонда и разреза ножа относительно места инъекции вируса и (ii) иллюстрации местоположения плоской стороны призматического зонда относительно разреза ножа и места инъекции вируса. ( C ) Иллюстрация установки изображения in-vivo Ca 2+, показывающей путь света для небольшой области в пределах полного поля зрения через призменный зонд, имплантированный в кору мышей. ( D ) Пример поля зрения при установке зонда призмы. Миниатюрный микроскоп прикреплен к держателю объектива, который содержит призменный зонд, позволяющий проверять экспрессию вируса во время установки зонда. ( E ) Интеграция микроскопа с призменным зондом для многослойной кортикальной визуализации меченых клеток S1 GCaMP6f. F Пример поля просмотраПри установке базовой плиты. Четкая картина кровеносного сосуда видна во время установки базовой плиты с некоторыми клетками в необработанном изображении. Больше ячеек хорошо видно, когда DF / F включается в окне программного обеспечения для сбора данных. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
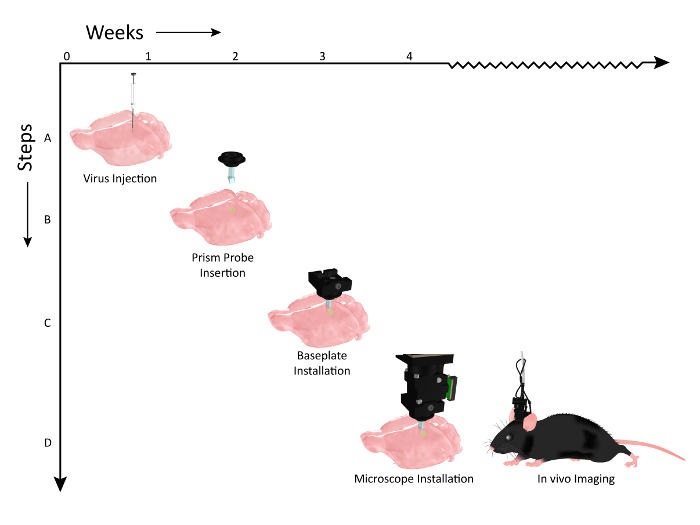
Рисунок 2: Схема, показывающая временную шкалу событий рабочего процесса для имплантации зонда и установки микроскопа. Число недель представлено на оси X и на этапах рабочего процесса процедур вдоль оси Y. ( A ) Графика, иллюстрирующая инъекцию вируса (AAV1.CaMKII.GCaMP6f.WPRE.SV40) вдоль той же дорзо-вентральной оси, чтобы маркировать несколько слоев соматосенсорной коры мыши. ( B ) 2 недели после инъекций вируса, призмыE имплантируется на ось, параллельную сайтам инъекций вирусов. ( C ) Примерно через одну неделю после имплантации имплантата призмы животное проверяется на предмет экспрессии с помощью микроскопа, и на голове устанавливается опорная пластина, если видна популяция клеток. ( D ) Затем животное готово к хроническому отображению во время соответствующих поведенческих задач (клип мыши изменен после разрешения от UW-Madison Biochemistry MediaLab). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
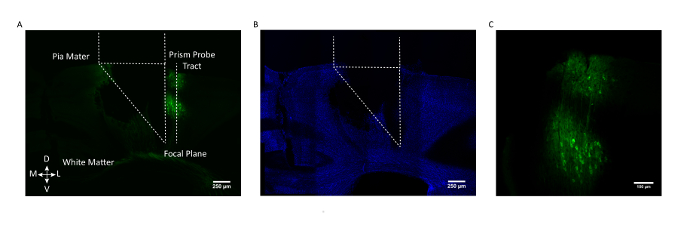
Рисунок 3: Гистологическая валидация места расположения призмы и экспрессия GCaMP. ( A ) Корональный разрез из головного мозга мыши, показывающий тракт призмы и его обратную сторонуЭкспрессирующие клетки GCaMP6f (AAV1.CaMKII.GCaMP6f, выраженные в нейронах в слоях 2/3 и 5). ( B ) То же самое корональное отделение мозга после окрашивания для DAPI. Шкала шкалы = 250 мкм ( C ) Уменьшена с учетом GCaMP6f, экспрессирующего клетки в соматосенсорной коре. Шкала шкалы = 100 мкм. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
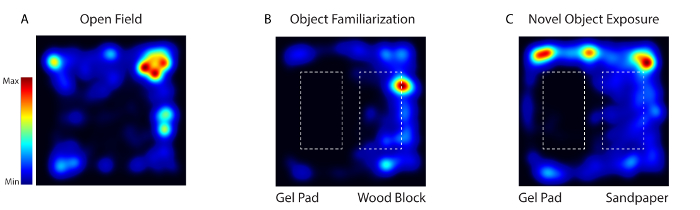
Рисунок 4: Активность мыши во время Habituation, ознакомления и тестирования новых объектов подвергалась видео-отслеживанию с использованием программного обеспечения для видео. ( A ) В первый день животное было помещено в поведенческую арену, лишенную каких-либо предметов (Open Field). ( B ) В дни 2-4 на арену были помещены те же два текстурно разных объекта (гель и деревянный блок) (Object Familiarization). ( C ) В День 5 один из объектов был заменен новым объектом (деревянный блок с песочной бумагой) (Novel Object Exposure). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
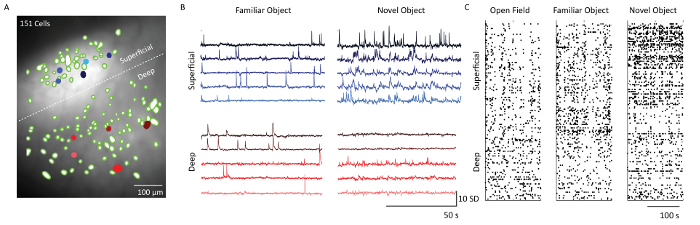
Рисунок 5: Динамика кальция от поверхностных и глубоких слоев соматосенсорной коры головного мозга с микроскопом. ( A ) Объединенное изображение нейронных пространственных фильтров (зеленые капли) и средняя проекция интенсивности флуоресценции записи микроскопа через поле зрения зонда. Граница между надглазурным и инфрагранулярным слоями, обозначенная белой пунктирной линией. Шкала шкалы = 100 мкм. ( B ) Следы кальция из пяти образцов поверхностных и глубоких слоев (заполнены синим и красным cEll в панели A), что указывает единицы стандартного отклонения флуоресценции после основного и независимого анализа компонентов. Полоса горизонтальной шкалы 50 с и вертикальная шкала шкалы 10 SD ( C ) Растровый график ячеек из поверхностных слоев (слоев 2/3) и глубоких слоев (слой 5), отображаемых над полем «Открытое поле», «Обследование объекта» и «Изучение новых объектов». Шкала шкалы = 100 с. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Понимание активности нервного цикла во время бодрствования является жизненно важным уровнем нейрофизиологического исследования, необходимого для эффективного рассечения функции мозга в области здоровья и болезней. Кора является особенно важным регионом для изучения в контексте бодрствующего поведения, поскольку она играет важную роль во многих жизненно важных сенсорных, когнитивных и исполнительных функциях 28 , 29 .
Известно, что кортикальная колонна является основной функциональной единицей в коре и активность клеточных клеток на уровне популяции, как известно, различается в зависимости от их физического расположения внутри столбца. Например, возбуждающие нейроны в слоях 2/3 в соматосенсорной коре представляют собой проекты в основном в других новоорцитарных областях и модулируют другие корковые сети 30 , тогда как клетки в более глубоких слоях выступают в основном в подкорковые области, такие как таламус 31 . Запись деятельности сотенС заранее определенных кортикальных клеток одновременно и надежно с течением времени на разных ламинах в свободно ведящих субъектах значительно продвигало бы наше понимание потока информации о коры, позволяя более тонкое функциональное рассечение кортикальных столбцов, информированное о поведенческой информации в реальном времени, Весы.
Сбор этого уровня данных нейронных цепей стал возможным благодаря использованию эффективной и упрощенной миниатюрной микроскопической платформы для проведения крупномасштабной визуализации Ca 2+ в свободно ведящих субъектах (или по желанию головок). Используемый с генетически закодированными индикаторами кальция для обеспечения специфического таргетинга сотового типа и визуализации многослойного поля зрения, предоставляемого хронически имплантированным призменным зондом, этот протокол исследовал один случай среди многих возможных применений: наблюдение ламинарных различий в обработке соматосенсорной коры при мышах Физически связан с новым объектом ( рис. 5 ).Это первая процедурная иллюстрация такого типа специфического клеточного типа, in vivo, для изучения множественных корковых слоев у бодрствующих, свободно ведящих животных и расширения спектра экспериментальных методов, доступных для понимания ламинарных структур в активном мозге.
Перископическое поле зрения, обеспечиваемое зондом призмы в этом методе, может быть применимо к другим структурам мозга, когда желательно сохранение ткани непосредственно дорсальной области интереса; Например, изображение CA3 может быть достигнуто без нарушения функции гиппокампа.
Подход, основанный на призме, для визуализации активности Ca 2+, требует физической инсерции и постоянной имплантации микропризма в кору, что приравнивается к созданию кортикального поражения, в которое вставлен линзовый зонд. Это может привести к сбоям в локальной нейронной схеме, включая отрыв апикальных дендритов и процессов. TЕго процедура также вызовет первоначальную активацию глиальных клеток в области, хотя ожидается, что она будет локализована в ткани около 150 мкм от поверхности призмы и исчезнет после заживления мозга 22 . Очень важно учитывать, повлияет ли этот метод на нормальную анатомию схемы и / или поведение животных при планировании экспериментов. Группы поведенческого контроля должны всегда проводиться для обеспечения того, чтобы не было существенных изменений в базовом поведении, которое могло бы привести к смешению экспериментальных результатов.
Используя этот миниатюрный мобильный метод Ca 2+ с нейрофармакологической манипуляцией, различные когнитивные, социальные, моторные или внутренние поведенческие парадигмы и сочетая его с другими физиологическими метриками, могут углубить и обогатить исследования, направленные на понимание функциональных ролей нейронных цепей в поведении и сигнале Обработка 32 . Подавление или активизацияВоздействие определенных путей, модулированных лекарственными средствами, может влиять на связанные с ними поведения, которые можно легко изучить с использованием этой технологии. 33 . Разделение на разные типы клеток путем изменения нацеливания индикатора кальция является еще одним мощным и полезным приложением и позволяет использовать множество творческих комбинаций экспериментальных инструментов для решения разнообразных проблем нервной цепи.
Раскрытие информации
Авторы читают политику журнала и имеют следующие конкурирующие интересы: SG, SO и VC оплачиваются сотрудниками Inscopix.
Благодарности
Авторы хотели бы поблагодарить В. Джаярамана, Д. С. Кима, Л. Л. Логера и К. Свободы из проекта Генетически кодированного нейронального индикатора и эффектора (GENIE) в Исследовательском кампусе Джанелии Медицинского института Говарда Хьюза за их щедрое пожертвование AAV1-GCaMP6f В Университет штата Пенсильвания. Они также хотели бы поблагодарить ядро A. Olson и Neuroscience Microscopy Core в Стэнфордском университете, поддерживаемое грантом NIH NS069375 для своих услуг конфокальной микроскопии.
Материалы
| Name | Company | Catalog Number | Comments |
| Neurostar Motorized Ultra Precise Small Animal Stereotaxic Instrument | Kopf | Model 963SD | Surgery |
| Stereoscope | Labomed | Prima DNT | Surgery and Imaging |
| Mini Rectal Thermistor Probe (.062"/1.6 mm diameter) - 1/4" Jack | FHC | 40-90-5D-02 | Surgery |
| Heating Pad 5 X 12.5 cm | FHC | 40-90-2-07 | Surgery |
| DC Temperature Controller | FHC | 40-90-8D | Surgery |
| Microsyringe Pump | World Precision Instruments | UMP3 model; serial 155788 F110 | Surgery |
| NanoFil 10 μL Syringe | World Precision Instruments | NANOFIL | Surgery |
| 35 G Beveled Tip Nanofil NDL 2PK | World Precision Instruments | NF35BV-2 | Surgery |
| Omnidrill35, 115 - 230 V | World Precision Instruments | 503598 | Surgery |
| Burrs for Micro Drill | Fine Science Tools | 19007-05 | Surgery |
| nVista | Inscopix | 100-001048 | Imaging |
| AAV1.CaMKII.GCaMP6f.WPRE.SV40 | Penn Vector Core | AV-1-PV3435 | Surgery |
| Ketoprofen | Victor Medical | 5487 | Surgery |
| Carprofen | Victor Medical | 1699008 | Surgery |
| Isoflurane | Victor Medical | 1001054 | Surgery |
| Gelfoam (Patterson Veterinary Supply Inc Gelfoam Sponge 12 cm x 7 mm) | Pfizer (Fisher Scientific) | NC9841478 | Surgery |
| Dumont #5/45 forceps | Fine Science Tools | 11251-35 | Surgery |
| Dumont #5 forceps | Fine Science Tools | 11251-30 | Surgery |
| Dissecting knives | Fine Science Tools | 10055-12 | Surgery |
| ProView Implant Kit | Inscopix | 100-000756 | Surgery and Imaging |
| ProView Prism Probe 1.0 mm-Dia. ~4.3 mm Length | Inscopix | 100-000592 | Surgery and Imaging |
| Kwik-Sil adhesive pack of 2 | World Precision Instruments | KWIK-SIL | Surgery |
| Kwik-Cast Sealant | World Precision Instruments | KWIK-CAST | Surgery and Imaging |
| Miniature Optical Mounting Post | Newport | M-TSP-3 | Imaging |
| Microscope Baseplate | Inscopix | BPL-2 | Imaging |
| Microscope Baseplate Cover | Inscopix | BPC-2 | Imaging |
Ссылки
- McConnell, S. K. Development and decision-making in the mammalian cerebral cortex. Brain Res. 472 (1), 1-23 (1988).
- Kwon, S. E., Yang, H., Minamisawa, G., O'Connor, D. H. Sensory and decision-related activity propagate in a cortical feedback loop during touch perception. Nat. Neurosci. 19 (9), 1243-1249 (2016).
- Miller, E. K., Cohen, J. D. An integrative theory of prefrontal cortex function. Annu. Rev. Neurosci. 24, 167-202 (2001).
- Bailey, M. R., Simpson, E. H., Balsam, P. D. Neural substrates underlying effort, time, and risk-based decision making in motivated behavior. Neurobiol. Learn. Mem. 133, 233-256 (2016).
- Dehaene, S., Changeux, J. P. Reward-dependent learning in neuronal networks for planning and decision making. Prog. Brain Res. 126, 217-229 (2000).
- Ferenczi, E. A., et al. Prefrontal cortical regulation of brainwide circuit dynamics and reward-related behavior. Science. 351 (6268), aac9698(2016).
- Anomal, R. F., et al. Impaired Processing in the Primary Auditory Cortex of an Animal Model of Autism. Front. Sys. Neurosci. 9, 158(2015).
- Pauls, D. L., Abramovitch, A., Rauch, S. L., Geller, D. A. Obsessive-compulsive disorder: an integrative genetic and neurobiological perspective. Nat. Rev. Neurosci. 15 (6), 410-424 (2014).
- Ziv, Y., et al. Long-term dynamics of CA1 hippocampal place codes. Nat. Neurosci. 16 (3), 264-266 (2013).
- Jennings, J. H., et al. Visualizing hypothalamic network dynamics for appetitive and consummatory behaviors. Cell. 160 (3), 516-527 (2015).
- Betley, J. N., et al. Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature. 521 (7551), 180-185 (2015).
- Sun, C., et al. Distinct speed dependence of entorhinal island and ocean cells, including respective grid cells. Proc. Natl. Acad. Sci. 112 (30), 9466-9471 (2015).
- Kitamura, T., et al. Entorhinal Cortical Ocean Cells Encode Specific Contexts and Drive Context-Specific Fear Memory. Neuron. 87 (6), 1317-1331 (2015).
- Pinto, L., Dan, Y. Cell-Type-Specific Activity in Prefrontal Cortex during Goal-Directed Behavior. Neuron. 87 (2), 437-450 (2015).
- Cox, J., Pinto, L., Dan, Y. Calcium imaging of sleep-wake related neuronal activity in the dorsal pons. Nat. Comm. 7, 10763(2016).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nat. Protoc. 11 (3), 566-597 (2016).
- Hooks, B. M., et al. Organization of cortical and thalamic input to pyramidal neurons in mouse motor cortex. The J. Neurosci. 33 (2), 748-760 (2013).
- Masamizu, Y., et al. Two distinct layer-specific dynamics of cortical ensembles during learning of a motor task. Nat. Neurosci. 17 (7), 987-994 (2014).
- Rowland, D. C., Moser, M. -B. From cortical modules to memories. Curr. Opin. Neurobiol. 24 (1), 22-27 (2014).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nat. Methods. 8 (10), 871-878 (2011).
- Mukamel, E. A., Nimmerjahn, A., Schnitzer, M. J. Automated analysis of cellular signals from large-scale calcium imaging data. Neuron. 63 (6), 747-760 (2009).
- Andermann, M. L., et al. Chronic cellular imaging of entire cortical columns in awake mice using microprisms. Neuron. 80 (4), 900-913 (2013).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nat. Protoc. 9 (11), 2515-2538 (2014).
- Chia, T. H., Levene, M. J. In vivo imaging of deep cortical layers using a microprism. J. Vis. Exp. (30), (2009).
- Chia, T. H., Levene, M. J. Microprisms for in vivo multilayer cortical imaging. J. Neurophysiol. 102 (2), 1310-1314 (2009).
- Chia, T. H., Levene, M. J. Multi-layer in vivo imaging of neocortex using a microprism. Cold Spring Harb. Protoc. 2010 (8), pdb.prot5476 (2010).
- Low, R. J., Gu, Y., Tank, D. W. Cellular resolution optical access to brain regions in fissures: imaging medial prefrontal cortex and grid cells in entorhinal cortex. Proc. Natl. Acad. Sci. 111 (52), 18739-18744 (2014).
- Zeisel, A., et al. Brain structure. Cell types in the mouse cortex and hippocampus revealed by single-cell RNA-seq. Science. 347 (6226), 1138-1142 (2015).
- Hawrylycz, M., et al. Inferring cortical function in the mouse visual system through large-scale systems neuroscience. Proc. Natl. Acad. Sci. 113 (27), 7337-7344 (2016).
- Petrof, I., Viaene, A. N., Sherman, S. M. Properties of the primary somatosensory cortex projection to the primary motor cortex in the mouse. J. Neurophysiol. 113 (7), 2400-2407 (2015).
- Aronoff, R., et al. Long-range connectivity of mouse primary somatosensory barrel cortex. Euro. J. Neurosci. 31 (12), 2221-2233 (2010).
- Rogan, S. C., Roth, B. L. Remote control of neuronal signaling. Pharma. Rev. 63 (2), 291-315 (2011).
- Berdyyeva, T., et al. Zolpidem reduces hippocampal neuronal activity in freely behaving mice: a large scale calcium imaging study with miniaturized fluorescence microscope. PloS One. 9 (11), e112068(2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены