Method Article
Mehrschicht-Cortical Ca
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Verfahren zur Durchführung einer großformatigen Ca 2+ -Bildgebung mit zellulärer Auflösung über mehrere kortikale Schichten in frei beweglichen Mäusen vor. Hunderte von aktiven Zellen können gleichzeitig mit einem Miniatur-, Kopf-Mikroskop gekoppelt mit einer implantierten Prismensonde beobachtet werden.
Zusammenfassung
In-vivo -Schaltung und zelluläre Ebene funktionale Bildgebung ist ein kritisches Werkzeug für das Verständnis des Gehirns in Aktion. Die hochauflösende Bildgebung von Mauskortikalen Neuronen mit Zwei-Photonen-Mikroskopie bietet einzigartige Einblicke in die kortikale Struktur, Funktion und Plastizität. Allerdings sind diese Studien auf Kopf feste Tiere begrenzt, stark reduziert die Verhaltenskomplexität zur Verfügung für die Studie. In dieser Arbeit beschreiben wir ein Verfahren zur Durchführung einer chronischen Fluoreszenzmikroskopie mit zellulärer Auflösung über mehrere kortikale Schichten bei frei verhaltenden Mäusen. Wir verwendeten ein integriertes miniaturisiertes Fluoreszenzmikroskop, gepaart mit einer implantierten Prismensonde, um gleichzeitig die Kalziumdynamik von Hunderten von Neuronen über mehrere Schichten des somatosensorischen Kortex zu visualisieren und aufzuzeichnen, wie die Maus in einer neuartigen Objekt-Explorationsaufgabe über mehrere Tage hinweg. Diese Technik kann an andere Hirnregionen in verschiedenen Tierarten für andere Verhaltensweisen angepasst werdenAradigms
Einleitung
Die Kortex ist ein wesentlicher Spieler in vielen komplexen mentalen und Verhaltensfunktionen, von der Aufmerksamkeit, der sensorischen Wahrnehmung und der top-down kognitiven Kontrolle 1 , 2 , 3 bis hin zu Motivations-, Belohnungs- und Suchtwegen 4 , 5 . Das Verständnis der Rechenprozesse, die seiner Funktion zugrunde liegen, ist ein wichtiges Ziel, ein besseres klinisches Verständnis vieler geistiger und Verhaltensstörungen zu erreichen.
Viele gegenwärtige Theorien der psychiatrischen Erkrankung konzentrieren sich um die Idee, dass kortikale neuronale Kreislaufdysfunktion oder Diskoordination kognitiven und Verhaltensanomalien unterliegen können, die das Kennzeichen von Bedingungen wie Schizophrenie 6 , Autismus 7 oder Zwangsstörungen sind. So erhalten die Populationsniveau neuronale Aktivitätsdaten von coRtische Schaltungen innerhalb des richtigen Kontextes gleichzeitiger Verhaltensinformationen sind von großer Bedeutung und können idealerweise auf spezifische Zelltypen für eine feinere neuronale Schaltungsdissektion ausgerichtet sein.
Miniaturisierte Mikroskope in Verbindung mit implantierbaren Gradientenbrechungsindex (GRIN) Mikrolinsen ermöglichen den optischen Zugang zu neuronalen Ensembles unter frei beweglichen Zuständen aus einer Vielfalt möglicher Hirnareale 9 , 10 , 11 , 12 , 13 einschließlich der Kortex 14 , 15 , 16 . Die Verwendung eines mobilen Mikroskopiesystems, das mit genetisch codierten Calciumindikatoren gekoppelt ist, ermöglicht eine konsistente Abbildung der gleichen zellulären Population, die Hunderte von Neuronen über Tage bis Wochen in vielen Hirnregionen 9 umfasst und kannGenetisch auf spezifische Zelltypen mit viralen Vektor oder transgenen Techniken gerichtet.
Da die Kortex bekannt ist, verschiedene Funktionen zu unterstützen und sich in Abhängigkeit von der Lage der Zellen innerhalb der kortikalen Lamina 17 , 18 , 19 mit verschiedenen Hirnregionen zu verbinden, sind wir daran interessiert, eine gleichzeitige mehrschichtige neuronale Aktivität bei wachverhaltenden Probanden zu erhalten. Hier zeigen wir, wie man Hunderte von fluoreszenzbeschrifteten Neuronen in frei verhaltenden Mäusen über Tage bildt, wobei das miniaturisierte Fluoreszenzmikroskop 20 mit einer implantierten Prismensonde gepaart wird, die eine mehrschichtige Sicht auf die Kortikalis bietet (Abbildung 1 ).
Die hier verwendete Prismensonde besteht aus zwei getrennten GRIN-Objektiven: einem Prisma und einer zylindrischen Relaislinse ( Bild 1 ). Das Licht aus dem Mikroskop erregt die fluoreszenzbeschriftetZellen, die sich entlang der Abbildungsfläche der Prismensonde befinden, nachdem sie von der Hypotenuse des Prismenabschnitts der Sonde reflektiert wurden. Das emittierte Licht aus den Zellen reflektiert auch die Hypotenuse des Prismas, wird durch das Ziel des Mikroskops gesammelt und erreicht den Sensor im Mikroskop. Die in diesem Verfahren verwendete Prismensonde eignet sich für den einfachen Gebrauch mit Standard-Stereotax-Ausrüstung.
Das miniaturisierte Fluoreszenzmikroskop 20 detektiert aktionspotential-evozierte Ca 2+ -Transienten in neuronalen Populationen mit Einzelzell-Auflösung, nachdem diese Zellen spezifisch mit Ca 2+ -sensitiven genetisch codierten Fluoreszenzindikatoren markiert wurden. In diesem Protokoll injizieren wir den in einem viralen Vektor (AAV1.CaMKII.GCaMP6f.WPRE.SV40) codierten Ca 2+ -Anderindikator, implantieren eine Prismensonde, installieren das Mikroskop und erhalten dann mehrere Tage somatosensorische (s1 hintere Gliedmaßen) neuronale Aktivitätsdaten Von einem Tier aussetzenD zu neuartigen Objektoberflächen während der freien Exploration (Abbildung 2 ).
Protokoll
Verfahren, die Tierfächer betreffen, wurden vom Institutional Animal Care and Use Committee (IACUC) bei LifeSource Biomedical Services, dem NASA Ames Research Center, Kalifornien, genehmigt.
1. Vorbereitende Vorbereitung
- Sterilisieren Sie die Werkzeuge, die in chirurgischen Eingriffen in einem heißen Wulst-Sterilisator verwendet werden sollen, und wischen Sie den Operationsbereich mit 70% Ethanol ab. Schalten Sie das Heizkissen über die stereotaxische Bühne und halten Sie es bei 37 ° C.
- Anästhesieren des Tieres mit Isofluran (5% für Induktion und 1-2% für die Instandhaltung, 0,6-0,8 L / min O 2 ). Überprüfen Sie die Abwesenheit eines Zehen-Quetsch-Reflexes, um die Tiefe der Anästhesie zu beurteilen.
- Montiere das Tier in einem stereotaxischen Rahmen mit Ohr- und Zahnstangen.
- Tragen Sie ophthalmische Salbe auf die Augen des Tieres und decken sie mit einem Stück dunkles Papier ab, um sie vor dem Trocknen und intensiven chirurgischen Lichtern zu schützen.
- Subkutan injizieren das Tier mit Ketoprofen (2.5Mg / kg) oder Carprofen (2,5 mg / kg)
2. Virus-Injektions-Chirurgie
- Trimmen und rasieren Sie die Kopfhaut zwischen den Augen und Ohren und desinfizieren Sie die Haut mit 3 alternativen Tupfern von 70% Ethanol und Betadin.
- Setzen Sie den Schädel aus, indem Sie einen Einschnitt in die Kopfhaut, beginnend zwischen den Augen und verlängern 1,5 cm rostrocaudal mit einer sterilen chirurgischen Klinge. Öffnen Sie die Haut, um den Schädel freizulegen, und entfernen Sie das Periost um die gewünschte Injektionsstelle mit Wattestäbchen und einem Skalpell. Spritzen Sie den Schädel mit sterilem PBS. Den Schädel mit Wattestäbchen reinigen und polieren.
- Nimm den Schädel und markiere mit einer Markierung die stereotaktischen Koordinaten für die Virusinjektion. Mit einem 0,5 mm Grat auf einem Hochgeschwindigkeits-Mikrobohrer (auf ca. 7.000-10.000 U / min), schaffen Sie ein kleines Loch im Schädel. Tragen Sie leichten Druck während des Bohrens und intermittierend reinigen Sie den Knochenstaub und befeuchten Sie den Bereich mit sterilen PBS, um zu verhindern, dass Gehirngewebe überhitzt, bis die Hirnoberfläche re istSchmerzte Halten Sie das Gehirn feucht, wo das Loch gebohrt wird.
- Benutze eine 26 G-Nadel zum Aufnehmen von Viren ( zB AAV1.CaMKII.GCaMP6f.WPRE.SV40) in der Mikrospritze und ersetze sie dann durch eine 35 G-Nadel zur Injektion. Befestigen Sie die mit Virus beladene Mikrospritze an den Manipulatorarm des Stereotaxikapparates.
- Bringen Sie die Spritze in die Nähe der Einspritzstelle und stellen Sie den Winkel der Nadel so ein, dass sie in einem 90 ° -Winkel zur Gehirnoberfläche eintritt. Senken Sie die Nadel, bis sie pia mater berührt und durch die Dura durchbohren. Beginnen Sie, die Nadel in Schritten von 10 μm / s zu senken, bis sie die gewünschte Tiefe (z) erreicht. Fixieren Sie die Nadel Platz dort mit dem stereotaxischen Arm.
- Stellen Sie die Mikrospritzenpumpe ein, um 250 nL Virus mit 25 nL / min zu injizieren.
- Kritischer Schritt: Da das zu injizierende Virusvolumen vom Titer und der Verdünnung abhängt, führen Sie im Laufe der Verdünnungsexperimente optimale Volumen- und Konzentrationskriterien für bildgebende Zellen einIm experiment
- Wenn manche Viren aus der Injektionsstelle ausströmen, pausieren Sie die Injektion und warten, bis das Hirngewebe den Virusstropfen aufnimmt. Warten Sie 5-7 Minuten, nachdem das Gesamtvolumen gespritzt wurde, bevor Sie die Nadel zurückziehen. Farbstoffe wie schnelles Grün könnten auch der Viruslösung zugesetzt werden, um zu helfen, die Injektionsrate zu kontrollieren, falls das Virus aus der Hirnoberfläche austritt.
- Für die Etikettierung mehrerer Schichten in Kortex, verwenden Sie mehrere Injektionen, wenn nötig. Starten Sie an der ventralsten Stelle zuerst und warten 5-7 min nach der Injektion und ziehen Sie die Nadel zum nächsten dorsalen Punkt für die Injektion ( z. B. Injektion bei -1,0 mm AP, 1,5 mm ± ML und 400 und 600 μm DV). Warten Sie 10 Minuten nach der letzten Injektion, bevor Sie die Nadel herausziehen und entfernen Sie sie aus dem stereotaxischen Setup.
- Mischen Sie eine kleine Menge eines in vivo biokompatiblen transparenten Elastomer-Klebstoffs aus der Doppel-Fass-Spritze (ZB Kwik-Sil) und decke das Loch im Schädel damit ab. Tragen Sie Cyanoacrylat-Klebstoff auf die Schicht aus Elastomer-Kleber und lassen Sie es heilen.
- Naht die Kopfhaut und lässt das Tier von der Anästhesie in einem warmen Erholungskäfig erholen, bis es ambulant ist. Verabreichen Sie Ketoprofen (2,5 mg / kg) oder Carprofen (2,5 mg / kg) subkutan, bevor Sie das Tier in den Hauskäfig zurückbringen. Singly Haus Post-Chirurgie Themen, um die Chirurgie Website zu schützen und wiederholen Sie die Dosis 24 Stunden später.
- Nach dem Entfernen der Mikrospritze, spülen Sie beide 26 G und 35 G Nadeln 7-10 mal mit destilliertem Wasser, um vor der Lagerung zu reinigen.
3. Prisma-Implantat-Chirurgie
- 1-2 Wochen nach der Virusinjektion, bereiten Sie sich auf die Prismensonde Implantat Chirurgie. Desinfektion der Prismensonde in 70% Ethanol und reinige sie mit Linsenpapier. Setzen Sie die Prismensonde in das Linsenhalterwerkzeug ein und ziehen Sie die Sechskantschraube mit dem Schraubendreher fest. Setzen Sie das Mikroskop in den Sockelhalter (dieMagneten halten es an Ort und Stelle).
- Bereiten Sie das Tier vor, wie im Abschnitt "Präoperative Vorbereitung" beschrieben.
- Trimmen und rasieren Sie den Kopf des Tieres zwischen den Augen und Ohren und desinfizieren Sie die Haut mit wechselnden Tupfern von 70% Ethanol und Betadin.
- Setzen Sie den Schädel aus, indem Sie die Haut mit einer sterilen Schere schneiden und entfernen Sie die Hautklappe und das darunterliegende Periost. Den Schädel mit Wattestäbchen trocknen und polieren. Sorgen Sie für eine ausreichende Entfernung des umgebenden Muskelgewebes, um eine saubere, trockene, breite Knochenfundament in Vorbereitung für die folgenden Schritte zu schaffen.
- Implantatschädelschrauben in der kontralateralen Hemisphäre, um das Implantat stabil und sicher zu machen. Diese können auch nützlich sein, wenn man sich dafür entscheidet, eine Kopfstange für die wache Kopfbefestigung zu implantieren, um das Tier für experimentelle Bildgebungssitzungen in Abschnitt 5 vorzubereiten.
- Nähern Sie den Schädel und mit einem Marker markieren Sie die AP- und ML-Koordinaten für die Linseneinführung. Mit einem 0,5 mm Grat auf einem Mikrobohrer öffnen Sie eine runde Kraniotomie, so dass thE craniotomy Durchmesser ist gerade größer als der Prismen Durchmesser, dh 1,0 mm in diesem Fall. Bohren Sie sanft, während Sie intermittierend pausieren, um den Schädel mit sterilem PBS zu spülen und ihn mit Wattestäbchen abzusaugen. Entfernen Sie den erzeugten Knochenstaub.
- Kritischer Schritt: Legen Sie die Kraniotomie so, dass, wenn das Prisma in die Kortikalis eingefügt wird, seine flache Kante (Abbildungsoberfläche) der Virusinjektionsstelle gegenüberliegt und sich innerhalb eines Radius von 150-200 μm befindet.
- Stoppen Sie die Bohrung, bevor der Schädel vollständig verdünnt ist. Blutgefäße sollten durch den verdünnten Knochen sichtbar sein. Den Knochenstecker vorsichtig mit feiner 45 ° Pinzette entfernen.
- Entfernen Sie die Dura mit # 5 Pinzette.
- Kritischer Schritt: Sobald das Hirngewebe ausgesetzt ist, halten Sie immer das Gewebe feucht. Legen Sie einen Wattestäbchen in sterile Kochsalzlösung über die Kraniotomie getaucht. Dies wird auch den Druck auf das Gewebe beibehalten.
- Um den Druck im Gehirngewebe zu lindernRing-Insertion der Prismensonde, schaffen einen Inserttrakt vor der Zeit. Befestigen Sie ein geradkantiges Sektionsmesser an dem Elektrodenhalterarm des Stereotaxapparates und montieren Sie es auf dem Stereotaxikapparat unter einem Winkel, so dass die Messerklinge senkrecht zur Krümmung des Schädels ist (in diesem Fall 10 °) und in einem Ebene parallel zur Virusinjektionssäule.
- Sorgfältig das Messer oberhalb der Kraniotomie entlang seiner vorderen medialen Kante in diesem Fall und ~ 200 μm lateral zur Virusinjektionsstelle mit der Schneide nach vorne zeigen (Abbildung 1 ). Ziehen Sie die Z-Achse heraus, wenn die Messerspitze die Pia berührt und sie allmählich (in 10 μm / s-Schritten) bis zu einer Tiefe senken, bei der die Prismensonde eingelegt wird. Dann das Messer 1 mm nach hinten bewegen, um einen Weg für die Vorderkante des Prismas zu schaffen. Pause und Kontrolle für jede Blutungen, die auftreten können, während die Inzision mit einem vor-sterilen Kochsalzlösung getränkten Stück Gelfoam.
- Sobald das Messer in dieser Position ist, spülen Sie die Website mit steriler Kochsalzlösung und warten Sie, bis irgendeine Blutung nachlässt. Dann langsam das Messer mit dem stereotaxischen Arm Mikromanipulator in 10 μm / s Schritten zurückziehen und legen Sie ein Stück Gelfoam Schwamm in sterile Kochsalzlösung über den Einschnitt getränkt.
- Befestigen Sie den Objektivhalter (mit Prisma-Sonde und Mikroskop) an den stereotaktischen Manipulatorarm im gleichen Winkel wie das Messer im vorherigen Schritt. Richten Sie das Prisma so aus, dass die flache Seite des Prismas über dem Einschnitt und parallel zur Virusinjektionskolonne liegt. Dieser Schritt könnte eine feine Korrektur der stereotaxischen Armposition erfordern. Passen Sie die Ausrichtung an, indem Sie dem Schädel nahe kommen, um schnellere Ergebnisse zu erzielen.
- Sobald das Prisma im richtigen Winkel ist, senken Sie es im Gehirn in 10-μm-Schritten allmählich auf ein endgültiges z von 1,1 mm für diese Sonde, ausgehend von der Hirnoberfläche. Das Hirngewebe wird sich um das Prisma erweitern und jeder Druck, der geschaffen wird, ist hinter dem VisualizatiAuf dem Flugzeug und wird das Sichtfeld nicht beeinträchtigen. Stecken Sie das Mikroskop auf einen Computer mit über einen USB3-Port installierten Akquisitionssoftware und visualisieren Sie die Feldfluoreszenz, indem Sie die LED einschalten.
- Decken Sie jedes exponierte Gewebe um das Prisma in der Kraniotomie in einer sehr dünnen Schutzschicht aus Elastomer-Kleber mit einer 25G-Nadel.
- Nachdem der Elastomer-Klebstoff gehärtet ist (üblicherweise in ~ 3-5 min), verwenden Sie eine 25G-Nadel, um einen Cyanoacrylat-Kleber aufzubringen, um das Glas der Prismenlinse an den angrenzenden Schädel über der Schicht aus Elastomer-Kleber zu befestigen, um zu verhindern, dass sich die Linse nach innen bewegt Die Kraniotomie. Fügen Sie die Kanten der Prismenfühler-Manschette für eine bessere Haftung ein. Auf der Oberseite der implantierten Prismensonde kein Klebstoff aufnehmen. Sobald der Cyanoacrylat-Kleber ausgehärtet ist, schrauben Sie den Linsenhalter ab und entfernen Sie das Mikroskop vorsichtig. Dann langsam den stereotaxischen Manipulatorarm zurückziehen, um die Prismensonde sicher implantiert zu lassen.
- Tragen Sie eine Schicht aus zahnärztlichem Acryl oderCyanoacrylat-Klebstoff um das Implantat, um alle exponierten Schädeloberflächen zu bedecken, bis hin zum Berühren des umgebenden zurückgezogenen Muskelgewebes. Die Abdeckung einer großen Schädelfläche mit dieser Schädelkappe wird später bei der Herstellung von Basisplatten helfen. Die Haut um die Implantat-Stelle sollte auf eigene Faust um die Schädelkappe heilen.
- Kritischer Schritt: Lassen Sie sich nicht von der umgebenden Haut oder dem Muskelgewebe berühren und verschütten Sie keine Haut in die Schädelkappe. Dadurch wird die Haut irritiert und kann zu übermäßigem Kratzer und potenziellen Schäden am Implantat führen.
- Optional: Wenn Sie ein waches Kopf-feste Setup verwenden möchten, um das Mikroskop an die Basisplatte eines Tieres in experimentellen Imaging-Sessions anzubringen und zu lösen, anstatt das Tier kurz zu betäuben oder zu schälen, implantieren Sie eine Kopfstange in die Schädelkappe, die mit einem wachen Kopf- Feste Einrichtung der Wahl (nicht in diesem Protokoll gezeigt).
- Mischen Sie den Katalysator und die Basis aus einem SiliziumE Klebspritze und legen Sie einen Tropfen des Elastomers in die Prisma-Sonde Manschette, um die Sonde Objektiv oben zu decken, um Schäden und Staub zu verhindern.
- Entfernen Sie das Tier aus dem stereotaxischen Rahmen und erlauben die Erholung von der Anästhesie in einer warmen Kammer. Verabreichen Sie Ketoprofen (2,5 mg / kg) oder Carprofen (2,5 mg / kg) subkutan und bringen Sie das Tier zu einem sauberen Hauskäfig zurück, sobald es ambulant ist. Ein einziges Haus alle Themen, um das Implantat zu schützen und wiederholen Sie die Dosis 24 Stunden später.
4. Grundplattenbefestigung für Miniaturmikroskop-Installation
- Eine Woche bis 10 Tage nach der Implantation der Prismensonde, auf Virus-Expression im Gewebe durch die implantierte Prismensonde prüfen und eine Basisplatte auf den Schädel aufbringen, wenn die Präparation die Zellaktivität zeigt. Das Mikroskop wird während der Live-Bildgebung auf der Basisplatte angedockt.
- Befolgen Sie die Schritte, die in der präoperativen Vorgehensweise für die Vorbereitung des Tieres für die Basisplattenbefestigung beschrieben sind.
- Entfernen Sie die Silikon-Klebstoff-Kappe über die Oberfläche der implantierten Prismensonde Objektiv oben. Untersuche die Linsensondenoberfläche und reinige alle Schmerzen vorsichtig mit Linsenpapier und 70% Ethanol, um sicherzustellen, dass die Abbildungsoberfläche sauber ist.
- Stecken Sie das Mikroskop in die DAQ-Box und verbinden Sie es über den USB3-Port mit dem PC.
- Öffnen Sie die Erfassungssoftware auf dem Computer und schließen Sie das Mikroskop über USB3-Port an. Verwenden Sie die Erfassungssoftware zur Überprüfung der neuronalen Aktivität und zum Messen und Dokumentieren der Sichtfeldeinstellungen für zukünftige Aufnahmen in diesem Fach.
- Befestigen Sie eine Basisplatte am Mikroskop und befestigen Sie die Basisplatten-Set-Schraube, um die Basisplatte in Position zu halten, und sichern Sie das Mikroskop in den Mikroskop-Greifer auf dem stereotaktischen Mikromanipulatorarm durch den Körper des Mikroskops. Bringen Sie den Greifer an einen Newportstab an, der auf dem stereotaxischen Mikromanipulatorarm montiert werden kann.
- Positionieren Sie das Mikroskop über dem Prisma-Objektiv mit den sTereotaxischer Mikromanipuatorarm Sichtprüfung der Orientierung durch Betrachtung des Prismenlins von der Seite und der Rückseite der Tierstufe. Die optischen Achsen sowohl des Mikroskopobjektivs als auch der Prismensonde müssen ausgerichtet sein.
- Schalten Sie die Mikroskop-LED durch die Software ein. Auswertung der Qualität der Mikroskopausrichtung durch Fokussierung auf die Oberseite des implantierten Prismenfühlerobjektivs in der Erfassungssoftware. Bei korrekter Ausrichtung sollten die Kanten der Oberseite des Prismenobjektivs scharf sein.
- Passen Sie den physikalischen Abstand des Mikroskops über die implantierte Prismensonde unter Verwendung des stereotaktischen Manipulatorarms an, um die gewünschte Brennebene innerhalb des Gewebes zu erhalten. Der optisch optimierte Abstand zwischen dem Mikroskopobjektiv und dem implantierten GRIN-Objektiv beträgt ~ 500 μm.
- Speichern Sie ein Referenzfluoreszenzbild, sobald die gewünschte Bilderzeugungsebene erfasst ist.
Kritischer Punkt: Von diesem Punkt an nicht die Position des Mikroskops einstellen, da dies die locati ändern wirdAuf der Abbildungsebene im Gewebe.
HINWEIS: Klebstoff im nächsten Schritt auftragen, um die Position der Grundplatte dauerhaft in Bezug auf die Schädelkappe zu fixieren. Der Klebstoff kann im nächsten Tag oder zwei eine gewisse Volumenschrumpfung erfahren, die die Brennebene im Gewebe verändern kann. Preemptiv dies zu berücksichtigen, indem man die Schrumpfungsmenge für Ihre Klebemischung und den Abstand ex vivo misst und dann die endgültige Z-Position des Mikroskops + Basisplatte um diesen Betrag stützt, bevor sie in den Klebstoffauftragschritt übergeht. - Verwenden Sie zahnärztliches Acryl oder Cyanoacrylat, um die Basisplatte dauerhaft an der Acrylkappe zu befestigen, die den Schädel des Tieres bedeckt und die Lücke mit dem Acryl oder dem Klebstoff überbrückt. Wenn man das Dentalacryl / Cyanoacrylat allmählich einsetzt und in mehreren Stufen härtet, kann der Effekt der zuvor erwähnten Schrumpfung auf die Endposition der Bildebene des Mikroskops minimiert werden.
- Kritischer Schritt: Vorsicht beim Auftragen von ZahnmedizinAcryl / Cyanoacrylat, um zu verhindern, dass jedes Material die Objektivlinse des Mikroskops, die Stellschraube oder den Mikroskopkörper berührt, wodurch ein ordnungsgemäßer Betrieb der Instrumentierung später verhindert wird.
- Kritischer Schritt: Beim Auftragen des Klebers nicht auf das Mikroskop drücken. Der Druck auf das Mikroskop oder die Basisplatte kann eine Bewegung des Mikroskopobjektivs relativ zu der Prismensondenlinse verursachen, was zu einer Fehlausrichtung oder einer Veränderung der Brennebene im Gewebe führen könnte, die eine sofortige Wiedereinstellung erfordert.
- Vergewissern Sie sich, dass das Dental-Acryl / Cyanoacrylat gehärtet und gehärtet ist, indem Sie das Acryl mit einer Pinzette oder Spritzenspitze antippen. Erwerben Sie ein endgültiges Referenzfluoreszenzbild mit der Erfassungssoftware.
- Das Mikroskop vom Greifer lösen und den Greifer vom Mikroskop zurückziehen. Wenn Cyanoacrylat oder ein anderer transparenter Klebstoff verwendet wurde, bedecken Sie ihn mit schwarzem Nagellack oder einer Schicht aus schwarzem Zahnzement, um ein zu verhindernLeckere Leckage in die Kopfhaube, die zukünftige Bilder, die während der Experimente gewonnen wurden, verunreinigen kann.
- An diesem Punkt entfernen Sie das Mikroskop bei Bedarf. Um das Mikroskop von der Grundplatte zu trennen, lösen Sie die Schraube der Grundplatte, indem Sie die Stellschraube ca. 1/2 Umdrehung gegen den Uhrzeigersinn drehen. Pressen Sie den Mikroskop-Körper, während Sie die Grundplatte und die Acrylkappe mit der anderen Hand stützen und das Mikroskop gerade nach oben ziehen. Ersetzen Sie es in seinem Vorratsbehälter.
- Schützen Sie die implantierte Prismensonde mit einer Grundplattenabdeckung. Dadurch wird verhindert, dass sich Staubpartikel auf der Linsenoberfläche absetzen, was nach dem Einbau der Basisplatte schwierig zu reinigen ist.
- Befestigen Sie die Grundplattenabdeckung auf der Grundplatte und schieben Sie die Stellschraube um ca. 1/2 Umdrehung im Uhrzeigersinn oder bis die Stellschraube bündig mit der Grundplattenabdeckung ist. Nicht überdrehen.
- Das Tier aus der Anästhesie entfernen und in einer warmen Erholungskammer bis zum Ambulanten überwachen. Rückkehr thE Tier zu seinem Hauskäfig. Im ganzen Haus alle Tiere mit implantierten Grundplatten zum Schutz des Implantats.
5. Imaging mehrerer kortikaler Schichten in einer frei beweglichen Maus
- Vorbereiten des Verhaltensapparates ( zB Phenotyper, Noldus) durch Reinigung und Desinfektion und Abwischen mit 10% Bleichlösung.
- Stecken Sie das Mikroskop in die DAQ-Box und verbinden Sie es mit dem Computer und starten Sie die Erfassungssoftware.
- Überprüfen Sie auf ausreichend Speicherplatz auf dem Erfassungsrechner und stellen Sie Platz für die Kalzium-Imaging-Filme. Speichern Sie direkt von der Software auf die lokale Festplatte, anstatt auf eine externe Festplatte zu schreiben, um die hohe Datenübertragungsrate zwischen dem Mikroskop und dem Computer zu berücksichtigen und Datenverlust während der Aufnahmen zu vermeiden.
- Betäuben Sie das Tier mit Isofluran (5% in Sauerstoff) in einer Induktionskammer, um das Mikroskop zu befestigen. Alternativ, sanft scruff das Tier oder verwenden Sie eine wach Kopf-feste SetupMit einer Kopfstange, wenn die Anästhesie bekannt ist, das Verhaltens-Paradigma der Wahl zu stören.
- Entfernen Sie die Abdeckung der Grundplatte, indem Sie die Grundplatte-Stellschraube gegen den Uhrzeigersinn drehen und die Grundplattenabdeckung herausheben.
- Setzen Sie das Mikroskop in die Grundplatte auf das Tier. Das Mikroskop sollte mit Hilfe der Magneten auf der Grundplatte einrasten. Vorschub die Grundplatte einstecken, bis ein leichter Widerstand zu spüren ist.
- Kritischer Schritt: Ziehen Sie die Schraube der Grundplatte nicht fest an, um eine Beschädigung des Mikroskopgehäuses zu vermeiden.
- Überprüfen Sie die Abbildungsebene im Gewebe, indem Sie einen Fluoreszenz-Schnappschuss in der Software erwerben und ggf. die Brennebene in das Gewebe einstellen, indem Sie die Mikroskop-Revolver-Set-Schraube lösen, den Mikroskop-Revolver drehen, um den Feinfokus einzustellen und dann den Revolver wieder festzuziehen Gehäuse-Schraube
- Kritischer Schritt: Den Turm niemals zwingen, sich zu drehen, ohne zuerst die Stellschraube zu lösen, undZiehen Sie die Revolver-Schraube nicht mehr fest.
- Wenn Sie eine Längsschnittstudie durchführen, kehren Sie zur physischen Revolverposition zurück, um das gleiche Gesichtsfeld zu erfassen. In der Hardware beachten Sie die Anzahl der Revolverwindungen oder die physische Position des Revolverkopfes, für jedes Tier, das mit demselben Mikroskop abgebildet ist, für eine schnelle Rückkehr zu demselben Gesichtsfeld.
- Lassen Sie das Tier, das das Mikroskop trägt, in den Hauskäfig oder die Verhaltenskammer für die Akklimatisierung und warten Sie auf das Abnutzen der Anästhesie, falls zutreffend.
- Kritischer Schritt: Trainieren Sie die Tiere, um das Gewicht des Mikroskops mit einem Dummy-Mikroskop für mehrere Sitzungen zu tragen, bis sichergestellt ist, dass das Tragen des Mikroskops nicht mit ihrem normalen Verhalten stört, bevor Sie experimentelle Sitzungen beginnen. Regelmäßige Handhabung und Schulung für wache Zurückhaltung wird zu unangemessenen Stress für die Tiere zu verhindern.
- Wählen Sie die Erfassungseinstellungen aus, die zum Sammeln von Daten verwendet werden sollen. Dazu gehört die FraIch Rate für die Erfassung von Daten ( zB 20 fps, Gain of 1 und LED Power von 50%). Überprüfen Sie das Bildhistogramm bei der Auswahl der Einstellungen, um ein gutes SNR zu gewährleisten.
HINWEIS: Die numerische Apertur für die Fluoreszenzsammlung beträgt 0,35 für die 1 mm Prismensonde im Vergleich zu 0,5 für die 1 mm gerade Sonde. - Starten Sie die Verhaltenssoftware und programmieren Sie sie, um das Mikroskop bei dem gewünschten Aufzeichnungszyklus auszulösen ( zB 4X 5 min EIN 2 min AUS). Verbinden Sie den TTL-Port auf der Noldus IO-Box mit dem TRIG-Port der DAQ-Box über ein RJ45-BNC-Kabel.
- Setzen Sie das Tier in die Verhaltensarena, wenn nicht bereits dort, und starten Sie das Experiment.
- Nach dem Erwerb der gewünschten Daten das Tier mit Isofluran (5% in Sauerstoff) in einer Induktionskammer wieder anästhesieren oder das Tier vorsichtig wachhalten.
- Lösen Sie die Schraube der Grundplatte und lösen Sie das Mikroskop von der Grundplatte, indem Sie das Mikroskop vorsichtig hochziehen. Setzen Sie die Grundplatte wieder auf und ziehen Sie die Grundplatte vorsichtig anTe Schraube
- Bringe das Tier bis zur nächsten Aufnahmesession zum Hauskäfig zurück. Verwenden Sie die Referenz-Fluoreszenzbilder als Leitfaden für nachfolgende Bildsitzungen, um in das gleiche Sichtfeld zurückzukehren.
6. Auswertung von großformatigen Ca 2+ -Bildgebungsdaten
- Um den Zellstandort und die Ca 2+ -Dynamik im Sichtfeld aus Daten zu extrahieren, können unterschiedliche Datenanalyseplattformen verwendet werden. Mosaic, eine Datenanalyse-Plattform, die speziell für die Verarbeitung von großformatigen Ca 2+ Imaging-Filmen entwickelt wurde, wurde hier für diese Studie verwendet.
- Beseitigen Sie defekte Pixel und interpolieren Sie alle einzelnen gelöschten Frames in den Rohfilmen im Vorverarbeitungsschritt. Bin die Bilder im Raum aus dem vollen 1.440 x 1.080 Pixel Sichtfeld auf 720 x 540 Pixel, um den Datenabdruck zu reduzieren.
- Um Bewegungsartefakte im Gehirn in Bezug auf den Mikroskop-Bildsensor zu korrigieren, registrieren Sie die Filme mit einem rigorosen ImageJ-basierten BildGistrationsalgorithmus (TurboReg).
- Um einzelne Neuronen zu identifizieren, wiederholen Sie die Bilder als relative Änderungen der Fluoreszenz ΔF / F 0 = FF 0 / F 0, wobei F 0 das mittlere Bild ist, das durch Mittelung des gesamten Films erhalten wird.
- Identifizieren Sie die räumlichen Filter, die einzelnen Zellen entsprechen, mit einem etablierten Zellsortieralgorithmus. Hier haben wir die Haupt- und Einzelkomponentenanalyse 21 zur Identifizierung einzelner Neuronen verwendet.
HINWEIS: Ein Ereignis wurde angegeben, wenn die Spitzenamplitude eines Ereignisses in einer Trace mehr als 8 Standardabweichungen von der Trace-Baseline in unserem Datensatz und dem Zellstandort war und Ca 2+ -Dynamikdaten zur weiteren Analyse exportiert wurden.
Ergebnisse
Das hier beschriebene Protokoll beschreibt einen effektiven und effizienten Weg, um eine mehrschichtige Ca 2+ -Bildgebung von Hunderten von kortikalen Neuronen in frei verhaltenden Mäusen unter Verwendung von Prismensonden durchzuführen (Abbildung 1 ). Bisherige Ansätze zur mehrschichtigen kortikalen Bildgebung wurden in erster Linie auf kopffeste Tiere 22 , 23 , 24 , 25 , 26 , 27 beschränkt. Um diese Datenebene in einem frei verhaltenen Kontext zu erwerben, wurde eine miniaturisierte Mikroskopplattform für Verhaltensflexibilität eingesetzt; Ein genetisch codierter Calciumindikator (GCaMP6f) wurde verwendet, um eine spezifische Zellpopulation (CAMKII + Zellen in der Kortex) zu zielen; Und eine Prismensonde wurde gewählt, um ein chronisches, mehrschichtiges Gesichtsfeld zu schaffen.
Wir haben den Arbeitsablauf zur Vorbereitung des Tieres für die Bildgebung vorgestellt. Ein viraler Vektor, der für einen geeigneten Calciumindikator kodiert, wurde in den Kortex injiziert ( Fig. 2 , Schritt 1), bevor er eine Prismensonde chronisch implantiert, um einen optischen Zugang zu den markierten Zellen zu ermöglichen ( Fig. 2 , Schritt 2). Eine Basisplatte, die als sicheres, temporäres Dock für die Positionierung des Mikroskops während der Bildgebungssitzungen dient, wurde dann über dem Kopf des Tieres installiert (Abbildung 2 , Schritt 3), was die Visualisierung der kortikalen Aktivität über mehrere Zellschichten in einem wachen, das sich experimentell verhält, ermöglicht Setup ( Abbildung 2 , Schritt 4).
Um sicherzustellen, dass die gewünschte zelluläre Population angestrebt wurde, ist in Abbildung 3 ein postmortiver koronaler Hirnabschnitt von einer repräsentativen Maus dargestellt, wobei der Prisma-Sonden-Trakt und das im Vergleich zum GCaMP6f-Labor markierte SichtfeldEeligen Neuronen in den Schichten 2/3 und 5 der somatosensorischen Kortex.
Während des wachen Verhaltens mit dem System wurde die Aktivität der somatosensorischen kortikalen Neuronen aufgezeichnet, als die Maus drei verschiedenen Umgebungen ausgesetzt war - Open Field (Tag 1), Objekt-Vertrautmachung (Tag 2-4) und neuartiges Objekt (Tag 5) ( Abbildung 4 ). Am Tag 1 wurde die Maus in eine Verhaltensarena ohne irgendwelche Gegenstände gelegt. Am Tag 2-4 wurde die Maus in die Arena mit den gleichen zwei texturally verschiedenen Objekten (ein Gel-Pad und ein Holz-Block) platziert. Am 5. Tag wurde eines der Objekte durch ein neuartiges Objekt ersetzt. Das Tier wurde über 5 Tage für 20 min pro Tag abgebildet.
Nach der Zellextraktion unter Verwendung der Ca 2+ Bilddatenanalyse-Software wurden räumliche Filter, die den Zellorten entsprechen, auf der mittleren Fluoreszenzintensitätsprojektion der Mikroskopaufzeichnungsdaten überlagert( Fig. 5) . Eine weiße gestrichelte Linie trennt die Schichten 2/3 und 5 Zellen. Entsprechende Ca 2+ Spuren aus 5 Zellen aus jeder der Schichten zeigen das Zündmuster der Zellen in zwei verschiedenen Verhaltenskontexten - Objektvertrautheit und neuartige Objektbelichtung. Schicht-2/3-Zellen waren im Vergleich zu Schicht-5-Zellen am Tag, an dem die Maus einem neuartigen Objekt ausgesetzt war, aktiver. Dies zeigt sich auch aus den Rasterplots, die an den Tagen 1, 4 und 5 die schwankende Zündaktivität aller abgebildeten Zellen zeigen.
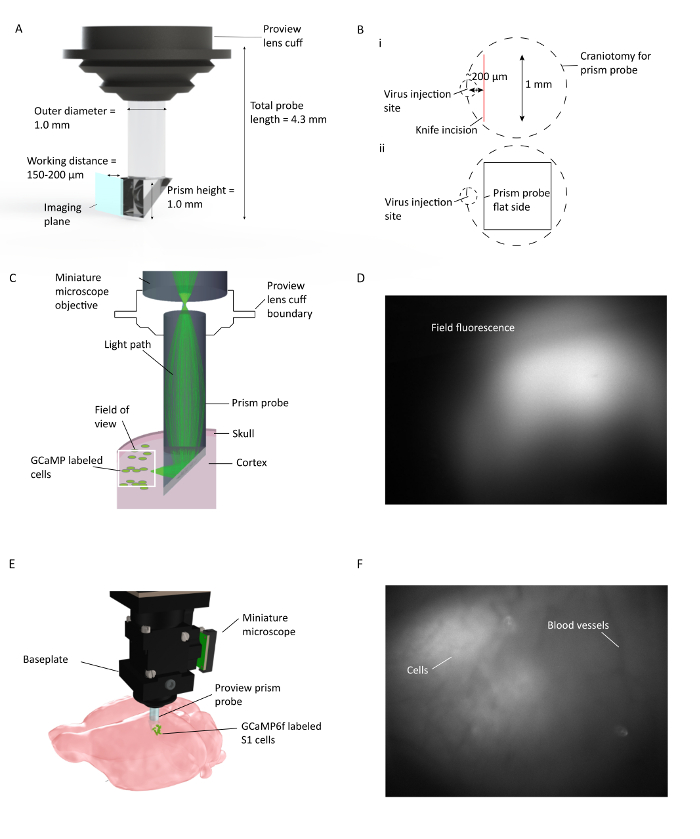
Abbildung 1: In vivo Ca 2+ Bildgebung über mehrere kortikale Schichten in frei beweglichen Mäusen. ( A ) Prismen-Sonden-Spezifikationen und Darstellung der Bilderzeugungsebene. Die reflektierende Beschichtung auf der Innenseite der Hypotenuse ermöglicht die Abbildung von 90 ° aus der Einsteckebene der Prismensonde. Die Linse cuFf integriert sich mit dem Linsenhalter, der das Implantationsverfahren optimiert und eine mögliche Betrachtung der Umgebungsgewebsfluoreszenz während der Implantation ( B ) (i) ermöglicht. Abbildung der Platzierung der Prismensonde Craniotomie und Messerinzision relativ zur Virusinjektionsstelle und (ii) Darstellung der Lage der Prismensonde flache Seite relativ zum Messereinschnitt und der Virusinjektionsstelle. ( C ) Darstellung des in-vivo Ca 2+ -Bildgebungsaufbaus, der den Lichtweg für einen kleinen Bereich innerhalb des vollen Gesichtsfeldes durch eine im Mauskortex implantierte Prismensonde zeigt. ( D ) Beispiel-Sichtfeld bei der Prisma-Sonde. Das Miniaturmikroskop ist an der Linsenhalterung befestigt, die die Prismensonde hält und die Überprüfung der Virusausdruck während der Prisma-Sonde ermöglicht. ( E ) Integration des Mikroskops mit Prismensonde zur mehrschichtigen kortikalen Bildgebung von GCaMP6f-markierten S1-Zellen. F Beispiel SichtfeldBei der Grundplatteninstallation. Klares Blutgefäßmuster ist zum Zeitpunkt der Basisplatte sichtbar mit einigen Zellen im Rohbild sichtbar. Weitere Zellen sind deutlich sichtbar, wenn DF / F im Fenster der Erfassungssoftware eingeschaltet ist. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
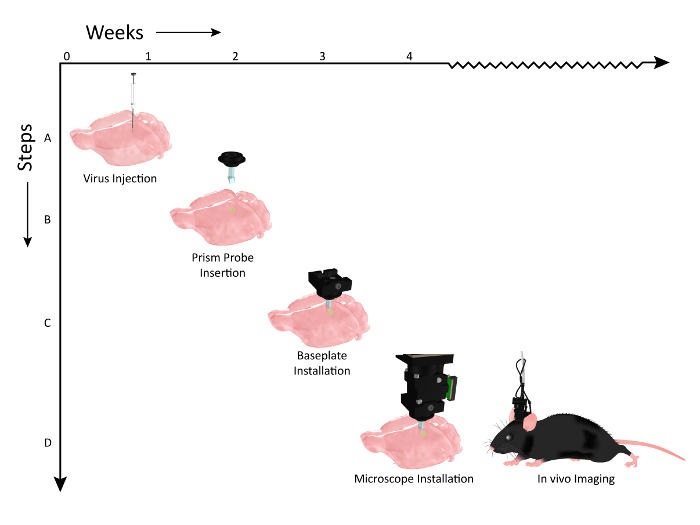
Abbildung 2: Schematische Darstellung der Zeitleiste von Workflow-Ereignissen für Prisma-Sonden-Implantation und Mikroskop-Installation. Die Anzahl der Wochen ist auf der X-Achse und die Workflow-Schritte der Prozeduren entlang der Y-Achse dargestellt. ( A ) Grafische Darstellung der viralen Injektion (AAV1.CaMKII.GCaMP6f.WPRE.SV40) entlang der gleichen dorso-ventralen Achse, um mehrere Schichten der Maus somatosensorischen Kortex zu markieren. ( B ) 2 Wochen nach Virusinjektionen, ein PrismaproblemE wird an einer Achse implantiert, die parallel zu den Virusinjektionsstellen ist. ( C ) Ungefähr eine Woche nach der Prismensondenimplantation wird das Tier auf den Ausdruck mit dem Mikroskop überprüft und eine Basisplatte wird auf dem Kopf angebracht, wenn eine Population von Zellen sichtbar ist. ( D ) Das Tier ist dann für die chronische Bildgebung bei relevanten Verhaltensaufgaben bereit (Mausclip, modifiziert nach Genehmigung von - UW-Madison Biochemistry MediaLab). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
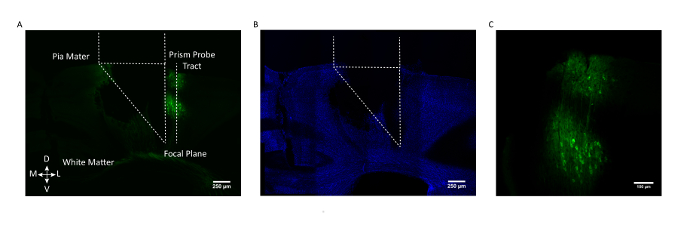
Abbildung 3: Postmortem Histologische Validierung der Prismensondenposition und GCaMP Expression. ( A ) Koronaler Abschnitt von einem repräsentativen Maus-Gehirn, das den Prismen-Sonden-Trakt zeigt und mit seiner bildgebenden SeiteDie GCaMP6f-exprimierenden Zellen (AAV1.CaMKII.GCaMP6f, ausgedrückt in Neuronen in den Schichten 2/3 und 5). ( B ) Gleiche koronale Hirnsektion nach Färbung für DAPI. Maßstab = 250 μm ( C ) Vergrößerte Ansicht von GCaMP6f-exprimierenden Zellen in somatosensorischem Kortex. Maßstab = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
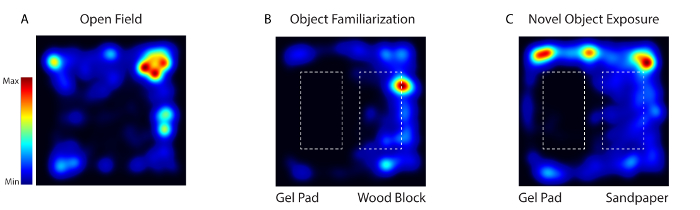
Abbildung 4: Mäuseaktivität während der Habituation, Vertrautmachung und neuartige Objektbelichtungstests wurde mit Video-Software aufgezeichnet. ( A ) Am Tag 1 wurde das Tier in eine Verhaltensarena ohne irgendwelche Gegenstände (Open Field) gestellt. ( B ) An den Tagen 2-4 wurden die gleichen zwei texturisch unterschiedlichen Objekte (Gel-Pad und Holzblock) in die Arena gelegt (Object FamiLilierung). ( C ) Am Tag 5 wurde eines der Objekte durch ein neuartiges Objekt (Holzblock mit Sandpapier) ersetzt (Novel Object Exposure). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
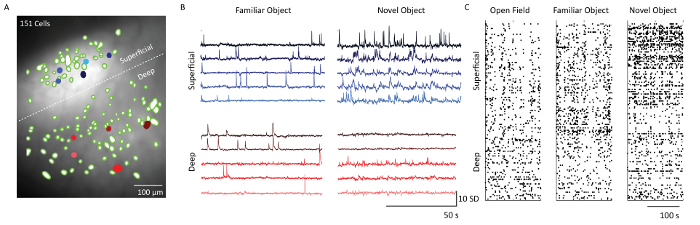
Abbildung 5: Calcium-Dynamik von oberflächlichen und tiefen Schichten des somatosensorischen Cortex einer repräsentativen Maus mit dem Mikroskop abgebildet. ( A ) Zusammengeführtes Bild von neuronalen Raumfiltern (grüne Blobs) und mittlere Fluoreszenzintensitätsprojektion der Mikroskopaufnahme durch Prismensondenfeld. Grenze zwischen supragranularen und infragranulären Schichten, die durch eine weiße gestrichelte Linie dargestellt sind. Maßstab = 100 μm. ( B ) Calciumspuren aus fünf beispielhaften oberflächlichen und tiefen Schichtzellen (gefüllt blau und rot cElls in Panel A), Angabe von Einheiten der Standardabweichung der Fluoreszenz nach prinzipieller und unabhängiger Komponentenanalyse. Horizontale Skalenstange 50 s und vertikale Skalenleiste 10 SD ( C ) Rasterplot von Zellen aus oberflächlichen (Schichten 2/3) und tiefen Schichten (Schicht 5) gezeigt über offenes Feld, Objekt-Vertrautmachung und neuartige Objekt-Exploration. Maßstab = 100 s. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Das Verständnis der neuronalen Kreislaufaktivität während des wachen Verhaltens ist ein wichtiges Niveau der neurowissenschaftlichen Untersuchung, die benötigt wird, um die Gehirnfunktion in Gesundheit und Krankheit wirksam zu sezieren. Die Kortex ist eine besonders wichtige Region, um im Kontext des wachen Verhaltens zu studieren, da sie in vielen lebenswichtigen sensorischen, kognitiven und exekutiven Funktionen eine wichtige Rolle spielt. 28 , 29 .
Es wird angenommen, dass die kortikale Säule die grundlegende funktionelle Einheit in der Kortex ist und die Populationsaktivität von kortikalen Zellen auf der Grundlage ihrer physikalischen Lage innerhalb der Säule bekannt ist. Zum Beispiel projizieren exzitatorische Neuronen in Schichten 2/3 im somatosensorischen Kortex vorwiegend in andere neokortikale Regionen und modulieren andere kortikale Netzwerke 30 , während Zellen in tieferen Schichten primär zu subkortikalen Regionen wie dem Thalamus 31 projizieren. Aufzeichnung der Aktivität von hundertS von vordefinierten kortikalen Zellen gleichzeitig und zuverlässig über die Zeit über verschiedene Lamina in frei verhaltenden Themen würde unser Verständnis des kortikalen Informationsflusses erheblich vorantreiben, was eine feinere funktionelle Dissektion von kortikalen Säulen ermöglicht, die durch Echtzeit-Verhaltensinformationen und aufgabenrelevante Zeit- Waage.
Das Sammeln dieses Niveaus der neuronalen Schaltungsdaten wird durch die Verwendung einer effizienten und stromlinienförmigen miniaturisierten Mikroskopieplattform ermöglicht, um eine großformatige Ca 2+ -Bildgebung in frei verhaltenden Probanden (oder kopffesten Themen wie gewünscht) durchzuführen. Verwendet mit genetisch codierten Calciumindikatoren, um zelltypspezifisches Targeting zu ermöglichen und ein mehrschichtiges Sichtfeld, das von einer chronisch implantierten Prismensonde bereitgestellt wird, zu untersuchen, untersuchte dieses Protokoll einen Fall unter vielen möglichen Anwendungen: Beobachten von laminaren Unterschieden in der somatosensorischen kortikalen Verarbeitung bei Mäusen Physisch mit einem neuartigen Objekt beschäftigt (Abbildung 5 ).Dies ist die erste prozedurale Darstellung dieser Art von zelltypspezifischen, in vivo- Ansatz, um mehrere kortikale Schichten in wachen, frei verhaltenden Tieren zu untersuchen und erweitert das Spektrum der experimentellen Methoden, um Laminarstrukturen im aktiven Gehirn zu verstehen.
Das periskopische Sichtfeld, das durch die Prismensonde in dieser Technik ermöglicht wird, kann auf andere Hirnstrukturen angewendet werden, wenn die Erhaltung des Gewebes, das direkt zu einem interessierenden Bereich dorsal ist, erwünscht ist; Zum Beispiel konnte CA3-Bildgebung ohne Unterbrechung der Hippocampus-Funktion erreicht werden.
Der prisma-basierte Ansatz zur Abbildung der Ca 2+ -Aktivität erfordert die physikalische Insertion und permanente Implantation eines Mikroprismas in die Kortikalis, was der Entstehung einer kortikalen Läsion entspricht, bei der die Linsensonde eingesetzt wird. Dies kann zu Störungen der lokalen neuronalen Schaltungen führen, einschließlich der Trennung von apikalen Dendriten und Prozessen. TSeine Prozedur wird auch eine anfängliche Aktivierung von Gliazellen in der Region verursachen, obwohl dies erwartet wird, dass sie auf das Gewebe etwa 150 & mgr; m von der Prismenfläche lokalisiert werden, und um nach dem Gehirn zu verhärten 22 . Es ist sehr wichtig zu prüfen, ob diese Technik die normale Schaltkreisanatomie und / oder das Verhalten der Tiere bei der Planung von Experimenten beeinflussen wird. Behavioral Control Groups sollten immer durchgeführt werden, um sicherzustellen, dass es keine signifikanten Veränderungen in Baseline-Verhaltensweisen, die zu verletzenden experimentellen Ergebnissen führen könnte.
Mit dieser miniaturisierten, mobilen Ca 2+ Imaging-Technik mit neuropharmakologischer Manipulation können verschiedene kognitive, soziale, motorische oder intrinsische Verhaltensparadigmen kombiniert und mit anderen physiologischen Metriken kombiniert werden, um Studien zu vertiefen und zu bereichern, die auf das Verständnis der funktionellen Rollen von neuronalen Schaltungen in Verhalten und Signal ausgerichtet sind Verarbeitung 32 . Unterdrückung oder AktivierungDie durch Medikamente moduliert werden, können die damit verbundenen Verhaltensweisen beeinflussen, die mit dieser Technologie leicht untersucht werden können 33 . Die Verzweigung in verschiedene Zelltypen durch die Änderung der Ausrichtung des Kalziumindikators ist eine weitere leistungsfähige und nützliche Anwendung und ermöglicht viele kreative Kombinationen von experimentellen Werkzeugen, um verschiedene neuronale Schaltungsfragen zu lösen.
Offenlegungen
Die Autoren haben die Politik der Zeitschrift gelesen und haben folgende konkurrierende Interessen: SG, SO und VC sind bezahlte Mitarbeiter bei Inscopix.
Danksagungen
Die Autoren danken V. Jayaraman, DS Kim, LL Looger und K. Svoboda aus dem Genetisch-Encoded Neuronal Indicator und Effector (GENIE) Projekt am Janelia Research Campus des Howard Hughes Medical Institute für ihre großzügige Spende von AAV1-GCaMP6f Zur Universität von Pennsylvania Vector Core. Sie danken auch der A. Olson und Neuroscience Microscopy Core an der Stanford University, unterstützt von NIH NS069375 Grant für ihre konfokalen Mikroskopie Dienstleistungen.
Materialien
| Name | Company | Catalog Number | Comments |
| Neurostar Motorized Ultra Precise Small Animal Stereotaxic Instrument | Kopf | Model 963SD | Surgery |
| Stereoscope | Labomed | Prima DNT | Surgery and Imaging |
| Mini Rectal Thermistor Probe (.062"/1.6 mm diameter) - 1/4" Jack | FHC | 40-90-5D-02 | Surgery |
| Heating Pad 5 X 12.5 cm | FHC | 40-90-2-07 | Surgery |
| DC Temperature Controller | FHC | 40-90-8D | Surgery |
| Microsyringe Pump | World Precision Instruments | UMP3 model; serial 155788 F110 | Surgery |
| NanoFil 10 μL Syringe | World Precision Instruments | NANOFIL | Surgery |
| 35 G Beveled Tip Nanofil NDL 2PK | World Precision Instruments | NF35BV-2 | Surgery |
| Omnidrill35, 115 - 230 V | World Precision Instruments | 503598 | Surgery |
| Burrs for Micro Drill | Fine Science Tools | 19007-05 | Surgery |
| nVista | Inscopix | 100-001048 | Imaging |
| AAV1.CaMKII.GCaMP6f.WPRE.SV40 | Penn Vector Core | AV-1-PV3435 | Surgery |
| Ketoprofen | Victor Medical | 5487 | Surgery |
| Carprofen | Victor Medical | 1699008 | Surgery |
| Isoflurane | Victor Medical | 1001054 | Surgery |
| Gelfoam (Patterson Veterinary Supply Inc Gelfoam Sponge 12 cm x 7 mm) | Pfizer (Fisher Scientific) | NC9841478 | Surgery |
| Dumont #5/45 forceps | Fine Science Tools | 11251-35 | Surgery |
| Dumont #5 forceps | Fine Science Tools | 11251-30 | Surgery |
| Dissecting knives | Fine Science Tools | 10055-12 | Surgery |
| ProView Implant Kit | Inscopix | 100-000756 | Surgery and Imaging |
| ProView Prism Probe 1.0 mm-Dia. ~4.3 mm Length | Inscopix | 100-000592 | Surgery and Imaging |
| Kwik-Sil adhesive pack of 2 | World Precision Instruments | KWIK-SIL | Surgery |
| Kwik-Cast Sealant | World Precision Instruments | KWIK-CAST | Surgery and Imaging |
| Miniature Optical Mounting Post | Newport | M-TSP-3 | Imaging |
| Microscope Baseplate | Inscopix | BPL-2 | Imaging |
| Microscope Baseplate Cover | Inscopix | BPC-2 | Imaging |
Referenzen
- McConnell, S. K. Development and decision-making in the mammalian cerebral cortex. Brain Res. 472 (1), 1-23 (1988).
- Kwon, S. E., Yang, H., Minamisawa, G., O'Connor, D. H. Sensory and decision-related activity propagate in a cortical feedback loop during touch perception. Nat. Neurosci. 19 (9), 1243-1249 (2016).
- Miller, E. K., Cohen, J. D. An integrative theory of prefrontal cortex function. Annu. Rev. Neurosci. 24, 167-202 (2001).
- Bailey, M. R., Simpson, E. H., Balsam, P. D. Neural substrates underlying effort, time, and risk-based decision making in motivated behavior. Neurobiol. Learn. Mem. 133, 233-256 (2016).
- Dehaene, S., Changeux, J. P. Reward-dependent learning in neuronal networks for planning and decision making. Prog. Brain Res. 126, 217-229 (2000).
- Ferenczi, E. A., et al. Prefrontal cortical regulation of brainwide circuit dynamics and reward-related behavior. Science. 351 (6268), aac9698(2016).
- Anomal, R. F., et al. Impaired Processing in the Primary Auditory Cortex of an Animal Model of Autism. Front. Sys. Neurosci. 9, 158(2015).
- Pauls, D. L., Abramovitch, A., Rauch, S. L., Geller, D. A. Obsessive-compulsive disorder: an integrative genetic and neurobiological perspective. Nat. Rev. Neurosci. 15 (6), 410-424 (2014).
- Ziv, Y., et al. Long-term dynamics of CA1 hippocampal place codes. Nat. Neurosci. 16 (3), 264-266 (2013).
- Jennings, J. H., et al. Visualizing hypothalamic network dynamics for appetitive and consummatory behaviors. Cell. 160 (3), 516-527 (2015).
- Betley, J. N., et al. Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature. 521 (7551), 180-185 (2015).
- Sun, C., et al. Distinct speed dependence of entorhinal island and ocean cells, including respective grid cells. Proc. Natl. Acad. Sci. 112 (30), 9466-9471 (2015).
- Kitamura, T., et al. Entorhinal Cortical Ocean Cells Encode Specific Contexts and Drive Context-Specific Fear Memory. Neuron. 87 (6), 1317-1331 (2015).
- Pinto, L., Dan, Y. Cell-Type-Specific Activity in Prefrontal Cortex during Goal-Directed Behavior. Neuron. 87 (2), 437-450 (2015).
- Cox, J., Pinto, L., Dan, Y. Calcium imaging of sleep-wake related neuronal activity in the dorsal pons. Nat. Comm. 7, 10763(2016).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nat. Protoc. 11 (3), 566-597 (2016).
- Hooks, B. M., et al. Organization of cortical and thalamic input to pyramidal neurons in mouse motor cortex. The J. Neurosci. 33 (2), 748-760 (2013).
- Masamizu, Y., et al. Two distinct layer-specific dynamics of cortical ensembles during learning of a motor task. Nat. Neurosci. 17 (7), 987-994 (2014).
- Rowland, D. C., Moser, M. -B. From cortical modules to memories. Curr. Opin. Neurobiol. 24 (1), 22-27 (2014).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nat. Methods. 8 (10), 871-878 (2011).
- Mukamel, E. A., Nimmerjahn, A., Schnitzer, M. J. Automated analysis of cellular signals from large-scale calcium imaging data. Neuron. 63 (6), 747-760 (2009).
- Andermann, M. L., et al. Chronic cellular imaging of entire cortical columns in awake mice using microprisms. Neuron. 80 (4), 900-913 (2013).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nat. Protoc. 9 (11), 2515-2538 (2014).
- Chia, T. H., Levene, M. J. In vivo imaging of deep cortical layers using a microprism. J. Vis. Exp. (30), (2009).
- Chia, T. H., Levene, M. J. Microprisms for in vivo multilayer cortical imaging. J. Neurophysiol. 102 (2), 1310-1314 (2009).
- Chia, T. H., Levene, M. J. Multi-layer in vivo imaging of neocortex using a microprism. Cold Spring Harb. Protoc. 2010 (8), pdb.prot5476 (2010).
- Low, R. J., Gu, Y., Tank, D. W. Cellular resolution optical access to brain regions in fissures: imaging medial prefrontal cortex and grid cells in entorhinal cortex. Proc. Natl. Acad. Sci. 111 (52), 18739-18744 (2014).
- Zeisel, A., et al. Brain structure. Cell types in the mouse cortex and hippocampus revealed by single-cell RNA-seq. Science. 347 (6226), 1138-1142 (2015).
- Hawrylycz, M., et al. Inferring cortical function in the mouse visual system through large-scale systems neuroscience. Proc. Natl. Acad. Sci. 113 (27), 7337-7344 (2016).
- Petrof, I., Viaene, A. N., Sherman, S. M. Properties of the primary somatosensory cortex projection to the primary motor cortex in the mouse. J. Neurophysiol. 113 (7), 2400-2407 (2015).
- Aronoff, R., et al. Long-range connectivity of mouse primary somatosensory barrel cortex. Euro. J. Neurosci. 31 (12), 2221-2233 (2010).
- Rogan, S. C., Roth, B. L. Remote control of neuronal signaling. Pharma. Rev. 63 (2), 291-315 (2011).
- Berdyyeva, T., et al. Zolpidem reduces hippocampal neuronal activity in freely behaving mice: a large scale calcium imaging study with miniaturized fluorescence microscope. PloS One. 9 (11), e112068(2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten