Method Article
Multi-layer Cortical Ca
Neste Artigo
Resumo
Aqui, apresentamos um procedimento para a realização de imagens de Ca 2 + em larga escala com resolução celular em múltiplas camadas corticais em camundongos que se movem livremente. Centenas de células ativas podem ser observadas simultaneamente usando um microscópio em miniatura montado na cabeça acoplado com uma sonda de prisma implantada.
Resumo
O circuito in vivo e a imagem funcional de nível celular é uma ferramenta crítica para a compreensão do cérebro em ação. A imagem em alta resolução de neurônios corticais de mouse com microscopia de dois fótons forneceu informações únicas sobre estrutura cortical, função e plasticidade. No entanto, esses estudos são limitados aos animais fixos de cabeça, reduzindo grandemente a complexidade comportamental disponível para estudo. Neste artigo, descrevemos um procedimento para a realização de microscopia de fluorescência crônica com resolução celular em múltiplas camadas corticais em ratos de comportamento livre. Utilizamos um microscópio de fluorescência miniaturizado integrado emparelhado com uma sonda de prisma implantada para visualizar simultaneamente e registrar a dinâmica de cálcio de centenas de neurônios em várias camadas do córtex somatossensorial, enquanto o mouse se envolveu em uma nova tarefa de exploração de objetos em vários dias. Esta técnica pode ser adaptada a outras regiões do cérebro em diferentes espécies animais para outros comportamentos pAradigmas.
Introdução
O córtex é um jogador essencial em muitas funções mentais e comportamentais complexas, desde a atenção, a percepção sensorial e o controle cognitivo de cima para baixo 1 , 2 , 3 para vias de motivação, recompensa e dependência 4 , 5 . Compreender os processos computacionais subjacentes à sua função é um objetivo importante para melhorar a compreensão clínica de muitas doenças mentais e comportamentais.
Muitas teorias atuais da doença psiquiátrica se centram na idéia de que a disfunção ou a discordância do circuito neural cortical podem estar subjacentes a anormalidades cognitivas e comportamentais que são características de condições como esquizofrenia 6 , autismo 7 ou transtorno obsessivo-compulsivo 8 . Assim, obtendo dados de atividade neural de nível populacional de coOs circuitos físicos dentro do contexto adequado da informação comportamental simultânea são de grande importância e, idealmente, podem ser direcionados a tipos de células específicos para uma dissecação mais fina do circuito neural.
Os microscópios miniaturizados, em conjunto com microfilmes de índice de refração de gradiente implantável (GRIN) permitem o acesso óptico a conjuntos neuronais sob condições de movimento livre de uma diversidade de possíveis regiões cerebrais 9 , 10 , 11 , 12 , 13 , incluindo o córtex 14 , 15 , 16 . O uso de um sistema de microscopia móvel acoplado com indicadores de cálcio codificados geneticamente permite uma imagem consistente da mesma população celular que engloba centenas de neurônios ao longo de dias a semanas em muitas regiões cerebrais 9 e pode serGeneticamente direcionados para tipos de células específicas usando vetores virais ou técnicas transgênicas.
Como o córtex é conhecido por suportar diferentes funções e se conectar a regiões cerebrais diferentes dependendo da localização das células dentro da lâmina cortical 17 , 18 , 19 , estamos interessados em obter atividade neural multi-camada simultânea em indivíduos com comportamentos acordados. Aqui, demonstramos como a imagem de centenas de neurônios marcados fluorescentemente em ratos que se comportam livremente ao longo de dias, usando o microscópio de fluorescência miniaturizado 20 emparelhado com uma sonda de prisma implantada, que oferece uma visão multicamada do córtex ( Figura 1 ).
A sonda de prisma utilizada aqui é composta por duas lentes GRIN separadas: um prisma e uma lente de relé cilíndrica ( Figura 1 ). A luz do microscópio excita a etiqueta fluorescenteCélulas localizadas ao longo da face de imagem da sonda de prisma, após refletir a hipotenusa da porção de prisma da sonda. A luz emitida das células também se reflete na hipotenusa do prisma, é coletada através do objetivo do microscópio e atinge o sensor no microscópio. A sonda de prisma utilizada neste procedimento é adaptada para fácil utilização com equipamentos estereotáxicos padrão.
O microscópio de fluorescência miniaturizado 20 detecta transientes de Ca 2+ evocados por potencial de ação em populações neuronais com resolução de célula única, depois que essas células foram especificamente marcadas com indicadores fluorescentes sensíveis a c2 + sensíveis a genes. Neste protocolo, injetamos o indicador de Ca 2+ codificado em um vetor viral (AAV1.CaMKII.GCaMP6f.WPRE.SV40), implantamos uma sonda de prisma, instalamos o microscópio e, em seguida, obtemos vários dias de dados da atividade neuronal somatossensorial (membro do membro traseiro S1) De uma exposição animalD para novas superfícies de objetos durante a exploração livre ( Figura 2 ).
Protocolo
Os procedimentos envolvendo assuntos de animais foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC) no LifeSource Biomedical Services, NASA Ames Research Center, Califórnia.
1. Preparação pré-operatória
- Esterilize as ferramentas para ser usado em procedimentos cirúrgicos em um esterilizador de contas quentes e limpe a área cirúrgica com 70% de etanol. Ligue a almofada de aquecimento colocada sobre o estágio estereotáxico e mantenha-a a 37 ° C.
- Anestesiar o animal usando isoflurano (5% para indução e 1-2% para manutenção, 0,6-0,8 L / min O 2 ). Verifique a ausência de um reflexo de pinça para avaliar a profundidade da anestesia.
- Monte o animal em uma armação estereotáxica equipada com barras de orelha e dentes.
- Aplique pomada oftálmica nos olhos do animal e cubra-os com um pedaço de papel escuro para protegê-los de secar e intensas luzes cirúrgicas.
- Injete subcutaneamente o animal com cetoprofeno (2,5Mg / kg) ou carprofeno (2,5 mg / kg)
2. Cirurgia de Injeção de Vírus
- Corte e raspe o couro cabeludo entre os olhos e as orelhas e desinfete a pele com 3 esfregaços alternativos de etanol a 70% e betadina.
- Exponha o crânio fazendo uma incisão no couro cabeludo, começando entre os olhos e estendendo 1,5 cm de rostrocaudal com uma lâmina cirúrgica estéril. Abra a pele para expor o crânio e remova o periostio em torno do local de injeção desejado usando cotonete e um bisturi. Enxaguar o crânio com PBS estéril. Limpe e polvilhe o crânio com cotonetes de algodão.
- Nivele o crânio e, com um marcador, marque as coordenadas estereotáxicas para a injeção do vírus. Usando uma rebarba de 0,5 mm em uma microdrill de alta velocidade (ajustada para cerca de 7,000-10,000 rpm), crie um pequeno orifício no crânio. Aplique uma ligeira pressão durante a perfuração e remova intermitentemente a poeira dos ossos e umedeça a área com PBS estéril para evitar o superaquecimento do tecido cerebral, até que a superfície do cérebro rejaDoeu. Mantenha o cérebro úmido onde o furo é perfurado.
- Use uma agulha de 26 G para apanhar vírus ( por exemplo, AAV1.CaMKII.GCaMP6f.WPRE.SV40) na microvexa e, em seguida, substitua-a por uma agulha de 35 G para injeção. Anexe a micro-microplaqueta carregada com vírus ao braço manipulador do aparelho estereotáxico.
- Traga a seringa perto do orifício do local da injeção e ajuste o ângulo da agulha para que ele entre com um ângulo de 90 ° para a superfície do cérebro. Abaixe a agulha até tocar na pia mater e perfurar a dura-dura. Comece a baixar a agulha em incrementos de 10 μm / s até atingir a profundidade desejada (z). Corrija a localização da agulha lá usando o braço estereotáxico.
- Coloque a bomba de microbiologia para injetar 250 nL de vírus a 25 nL / min.
- Passo crítico: Uma vez que o volume de vírus a ser injetado depende do título e da diluição, execute experimentos de diluição de antemão, para estabelecer o ótimo valor de volume e concentração para células de imagemNo experimento.
- Se algum vírus for visto saindo do local da injeção, pausar a injeção e esperar até que o tecido cerebral absorva a queda do vírus. Aguarde 5 a 7 minutos após o volume total ter sido injetado antes de retrair a agulha. Corantes como o verde rápido também podem ser adicionados à solução do vírus para ajudar a controlar a taxa de injeção no caso de o vírus ser visto saindo da superfície do cérebro.
- Para rotular várias camadas no córtex, use injeções múltiplas, se necessário. Comece no primeiro local ventral primeiro, aguardando 5-7 minutos após a injeção e puxando a agulha para o próximo ponto dorsal mais injetável ( por exemplo, injete em AP de -1,0 mm, 1,5 mm ± ML e 400 e 600 μm DV). Aguarde 10 minutos após a injeção final antes de retirar a agulha e removê-la da configuração estereotáxica.
- Misture uma pequena quantidade de um adesivo de elastômero transparente biocompatível in vivo da seringa de duplo cilindro (Por exemplo, Kwik-Sil) e cubra o buraco no crânio com ele. Aplique adesivo de cianoacrilato em cima da camada de adesivo de elastômero e deixe-o curar.
- Suturar o couro cabeludo e permitir que o animal se recupere da anestesia em uma gaiola de recuperação quente até ser ambulatorial. Administrar ketoprofeno (2,5 mg / kg) ou carprofen (2,5 mg / kg) por via subcutânea antes de retornar o animal à sua gaiola doméstica. Domicílios únicos de pós-cirurgia para proteger o local da cirurgia e repetir a dose 24 h depois.
- Depois de retirar a microfusão, elimine ambas as agulhas 26 G e 35 G 7-10 vezes com água destilada para limpar antes do armazenamento.
3. Prism Probe Implant Surgery
- 1-2 semanas após a injeção de vírus, prepare-se para a cirurgia de implante de sonda de prisma. Desinfecte a sonda de prisma em etanol a 70% e limpe-a com papel de lentes. Insira a sonda do prisma na ferramenta do suporte da lente e aperte o parafuso hexagonal com a chave de fenda. Assente o microscópio no suporte base (oOs ímãs o manterão no lugar).
- Prepare o animal conforme descrito na seção Preparação pré-operatória.
- Corte e raspe a cabeça do animal entre os olhos e as orelhas e desinfete a pele com swabs alternados de etanol a 70% e betadina.
- Exponha o crânio através da incisão da pele com um par de tesouras estéreis e remova a aba da pele e o perioste subjacente. Secar e polir o crânio com cotonetes de algodão. Assegurar a remoção adequada do tecido muscular circundante para criar uma base de osso limpa, seca e ampla, em preparação para as seguintes etapas.
- Implante os parafusos do crânio no hemisfério contralateral para tornar o implante estável e seguro. Estes também podem ser úteis se optar por implantar uma barra de cabeça para a fixação de cabeça acordada para preparar o animal para sessões experimentais de imagem na Seção 5.
- Nivele o crânio e com um marcador marque as coordenadas AP e ML para a inserção da lente. Usando uma rebarba de 0,5 mm em uma microdrill, abra uma craniotomia redonda, garantindoO diâmetro da craniotomia e é apenas maior do que o diâmetro do prisma, ou seja, 1,0 mm neste caso. Aperte suavemente enquanto faz uma pausa intermitente para liberar o crânio com PBS estéril e sugue-o com cotonetes de algodão. Remova a poeira do osso que é gerada.
- Passo crítico: Coloque a craniotomia de modo que, quando o prisma é inserido no córtex, a sua borda plana (superfície de imagem) está voltada para o local da injeção do vírus e está dentro de um raio de 150-200 μm.
- Pare de perfurar logo antes que o crânio seja completamente diluído. Os vasos sanguíneos devem ser visíveis através do osso diluído. Remova o plugue ósseo suavemente com pinças finas de 45 °.
- Retire a dura com pinças # 5.
- Passo crítico: uma vez que o tecido cerebral está exposto, mantenha sempre o tecido úmido. Coloque um cotonete de cotonete mergulhado em solução salina estéril sobre a craniotomia. Isso também irá manter a pressão sobre o tecido.
- Para aliviar a pressão no tecido cerebralInserção do anel da sonda do prisma, crie um traço de inserção antes do tempo. Anexe uma faca de dissecção de borda reta ao braço do suporte do eletrodo do aparelho estereotáxico e monte-o no aparelho estereotáxico em um ângulo tal que a lâmina da faca é perpendicular à curvatura do crânio (ângulo de 10 ° neste caso) e em um Plano paralelo à coluna de injeção de vírus.
- Posicione cuidadosamente a faca acima da craniotomia ao longo de sua borda mediana anterior neste caso e ~ 200 μm lateral ao local de injeção do vírus com a aresta de corte voltada para trás ( Figura 1 ). Limpe o eixo Z quando a ponta da faca toca a pia e baixe-a gradualmente (em incrementos de 10 μm / s) até uma profundidade na qual a sonda de prisma será inserida. Em seguida, mova a faca 1 mm posteriormente para criar um caminho para a vantagem do prisma. Pausar e controlar qualquer sangramento que possa acontecer ao fazer a incisão com um pedaço de gelfoam pré-esterilizado com solução salina.
- Uma vez que a faca está nesta posição, lave o local com solução salina estéril e espere até que qualquer sangramento diminua. Em seguida, retire lentamente a faca usando o micromanipulador do braço estereotáxico em incrementos de 10 μm / s e coloque um pedaço de esponja gelfoam embebida em solução salina estéril sobre a incisão.
- Anexe o suporte da lente (com a sonda prisma e o microscópio) ao braço manipulador estereotáxico no mesmo ângulo que a faca no passo anterior. Alinhe o prisma de tal forma que o lado plano do prisma supera a incisão e paralelo à coluna de injeção de vírus. Este passo pode exigir uma correção fina da posição do braço estereotáxico. Ajuste o alinhamento ao ficar perto do crânio para resultados mais rápidos.
- Uma vez que o prisma está no ângulo correto, baixe-o gradualmente no cérebro em incrementos de 10 μm para um z final de 1,1 mm para essa sonda, a partir da superfície do cérebro. O tecido cerebral expandirá em torno do prisma e qualquer pressão que é criada está por trás da visualizaçãoNo avião e não afetará o campo de visão. Conecte o microscópio a um computador com o software de aquisição instalado através de uma porta USB3 e visualize a fluorescência do campo acendendo o LED.
- Cubra todo o tecido exposto ao redor do prisma na craniotomia em uma camada protetora muito fina de adesivo de elastômero usando uma agulha 25G.
- Após o adesivo elastomérico é curado (geralmente em ~ 3-5 min) use uma agulha de 25G para aplicar um adesivo de cianoacrilato para fixar o vidro da lente do prisma ao crânio adjacente sobre a camada de adesivo de elastômero, para evitar que a lente se mova para dentro A craniotomia. Inclua as bordas do manguito da sonda de prisma para uma melhor adesão. Não obtenha nenhum adesivo na face superior da sonda de prisma implantada. Uma vez que o adesivo de cianoacrilato é curado, desenrosque o suporte da lente e remova cuidadosamente o microscópio. Em seguida, retire lentamente o braço manipulador estereotáxico para deixar a sonda de prisma implantada de forma segura.
- Aplique uma camada de acrílico dental ouAdesivo de cianoacrilato ao redor do implante para cobrir toda a superfície do crânio exposto, até não tocar o tecido muscular retratado circundante. A cobertura de uma grande área do crânio com esta tampa craniana ajudará mais tarde na fixação da placa base. A pele ao redor do local do implante deve curar por conta própria em torno da tampa craniana.
- Passo crítico: não deixe o adesivo tocar qualquer pele ou tecido muscular circundante, e não engolir qualquer pele na gola craniana. Fazer isso irrita a pele e pode resultar em riscas excessivas e danos potenciais ao implante.
- Opcional: se quiser usar uma configuração de cabeça acordada para fixar e separar o microscópio na placa de base de um animal em sessões de imagem experimentais, em vez de anestesiar ou escorregar o animal, implante uma barra de cabeça na tampa craniana que seja compatível com uma cabeça desperta, Configuração fixa de escolha (não demonstrada neste protocolo).
- Misture o catalisador e base a partir de um silícioE uma seringa adesiva e coloque uma gota do elastômero dentro do manguito da sonda de prisma para cobrir a parte superior da lente da sonda para evitar que se solte e dê poeira.
- Remova o animal do quadro estereotáxico e permita a recuperação da anestesia em uma câmara quente. Administrar ketoprofeno (2,5 mg / kg) ou carprofeno (2,5 mg / kg) por via subcutânea e devolver o animal a uma gaiola doméstica limpa, uma vez que é ambulatorial. Hospede todos os assuntos para proteger o implante e repita a dose 24 h depois.
4. Fixação da base para instalação em microscópio em miniatura
- Uma semana a 10 dias após a implantação da sonda de prisma, verifique a expressão do vírus no tecido através da sonda de prisma implantada e prenda uma placa de base no crânio se a preparação mostrar a atividade celular. O microscópio encostará na placa base durante imagens ao vivo.
- Siga as etapas descritas no procedimento pré-operatório para a preparação do animal para o anexo da placa base.
- Remova a tampa adesiva de silicone sobre a superfície do topo da lente da sonda do prisma implantado. Examine a superfície da sonda da lente e remova suavemente os resíduos com papel de lentes e 70% de etanol para garantir que a superfície de imagem esteja limpa.
- Conecte o microscópio à sua caixa DAQ e conecte-o através da porta USB3 ao PC.
- Abra o software de aquisição no computador e conecte o microscópio via porta USB3. Use o software de aquisição para verificar a atividade neural e para medir e documentar as configurações de campo de exibição para futuras gravações neste assunto.
- Anexe uma placa de base ao microscópio e aperte o parafuso de ajuste da placa de base para segurar a placa de base na posição e prenda o microscópio na pinça do microscópio no braço micromanipulador estereotáxico pelo corpo do microscópio. Anexe a pinça a uma haste Newport, que pode ser montada no braço micromanipulador estereotáxico.
- Posicione o microscópio acima da lente da sonda de prisma usando o sBraço de micromanipuador tereotaxico. Inspecione visualmente a orientação observando a lente do prisma do lado e da parte traseira do estágio animal. Os eixos ópticos do objetivo do microscópio e da lente da sonda de prisma devem estar alinhados.
- Ligue o LED do microscópio através do software. Avalie a qualidade do alinhamento do microscópio concentrando-se na face superior da lente da sonda de prisma implantada no software de aquisição. Quando alinhados corretamente, as bordas da face superior da lente da sonda do prisma devem ser afiadas.
- Ajuste a distância física do microscópio acima da sonda de prisma implantada usando o braço manipulador estereotáxico para obter o plano focal desejado dentro do tecido. A distância opticamente otimizada entre o objetivo do microscópio e a lente GRIN implantada é de ~ 500 μm.
- Salve uma imagem de fluorescência de referência uma vez que o plano de imagem desejado seja capturado.
Ponto crítico: A partir deste ponto, não ajuste a posição do microscópio, pois isso mudará a localização.Sobre o plano de imagem no tecido.
NOTA: aplique adesivo no próximo passo para consertar permanentemente a posição da placa de base em relação à tampa do crânio. O adesivo pode sofrer algum encolhimento no dia seguinte ou dois, o que pode alterar o plano focal no tecido. Preemptivamente, considere isso medindo a quantidade de encolhimento para a sua mistura adesiva e a distância ex vivo , em seguida, apoiando a posição Z final do microscópio + placa de base por essa quantidade antes de avançar para o passo de aplicação do adesivo. - Use acrílico dental ou cianoacrilato para fixar permanentemente a placa de base à tampa acrílica que cobre o crânio do animal, superando o espaço com o acrílico ou o adesivo. A aplicação do acrílico / cianoacrilato dentário gradualmente e cura em múltiplos estágios pode minimizar o efeito do encolhimento mencionado anteriormente na posição final do plano da imagem do microscópio.
- Passo crítico: tome cuidado ao aplicar dentalAcrílico / cianoacrilato para evitar que qualquer material entre em contato com a lente objetiva do microscópio, o parafuso de ajuste ou o corpo do microscópio, o que impedirá o funcionamento correto da instrumentação mais tarde.
- Passo crítico: Ao aplicar o adesivo, não pressione o microscópio. A pressão no microscópio ou na placa de base pode causar o movimento do objetivo do microscópio em relação à lente da sonda de prisma, o que pode resultar em desalinhamento ou mudança do plano focal no tecido que exigiria reajuste rápido.
- Verifique se o acrílico dental / cianoacrilato cura e endurece tocando o acrílico com um par de fórceps ou com a ponta da seringa. Adquira uma imagem de fluorescência de referência final com o software de aquisição.
- Solte o microscópio da pinça e retraia a garra do microscópio. Se fosse usado cianoacrilato ou outro adesivo transparente, cubra-o com esmalte de unha preto ou uma camada de cimento dental preto para prevenir umaVazamento de luz mbiente na tampa da cabeça, que pode contaminar imagens futuras adquiridas durante os experimentos.
- Neste ponto, remova o microscópio, se necessário. Para separar o microscópio da placa de base, solte o parafuso de ajuste da placa base girando o parafuso de ajuste aproximadamente ½ volta no sentido anti-horário. Aperte o corpo do microscópio enquanto apoia a placa de base e a tampa de acrílico com a outra mão, e puxe o microscópio para cima. Substitua-o no seu recipiente de armazenamento.
- Proteja a sonda de prisma implantada com uma tampa da placa base. Isso evitará que as partículas de poeira se apliquem na superfície da lente, o que pode ser complicado de limpar após a placa base ter sido instalada.
- Conecte a tampa da placa de base na placa de base e avance o parafuso de ajuste em torno de ½ volta no sentido horário ou até o parafuso de ajuste ficar nivelado com a tampa da placa de base. Não aperte demais.
- Remova o animal da anestesia e monitore em uma câmara de recuperação quente até o ambulatório. RetornarE animal para sua gaiola de casa. Hospede todos os animais com placas de base implantadas para proteger o implante.
5. Imaging várias camadas de cortical em um mouse de movimento livre
- Prepare o aparelho comportamental ( por exemplo , Phenotyper, Noldus), limpando e desinfetando-o e limpando com 10% de solução de branqueamento.
- Conecte o microscópio à sua caixa DAQ e conecte-o ao computador e inicie o software de aquisição.
- Verifique o amplo espaço de armazenamento de arquivos no computador de aquisição e faça espaço para os filmes de imagem de cálcio. Salve diretamente do software no disco rígido local, em vez de escrever para um disco rígido externo, para acomodar a alta taxa de transferência de dados entre o microscópio e o computador e evitar a perda de dados durante as gravações.
- Anestesiar o animal com isoflurano (5% em oxigênio) em uma câmara de indução para fixar o microscópio. Alternativamente, remova suavemente o animal ou use uma configuração de cabeça acordadaCom uma barra de cabeça se a anestesia for conhecida por interferir no paradigma comportamental de escolha.
- Remova a tampa da placa de base girando o parafuso de ajuste da placa base no sentido anti-horário e levantando a tampa da placa de base.
- Assente o microscópio na placa de base no animal. O microscópio deve encaixar no lugar com a ajuda dos ímãs na placa de base. Avança o parafuso de ajuste da placa base até sentir uma ligeira resistência.
- Passo crítico: Não aperte demais o parafuso de ajuste da placa base para evitar danos no invólucro do microscópio.
- Verifique o plano de imagem no tecido através da aquisição de um instantâneo de fluorescência no software e, se necessário, ajuste o plano focal no tecido, afrouxando o parafuso de ajuste da torreta do microscópio, girando a torre do microscópio para ajustar o foco fino, depois apertando novamente a torreta Parafuso de fixação da caixa.
- Passo crítico: Nunca force a torre girar sem primeiro afrouxar o parafuso de ajuste, eNão aperte demais o parafuso de ajuste da torre.
- Se estiver conduzindo um estudo longitudinal, volte para a posição da torreta física para capturar o mesmo campo de visão. No hardware, observe o número de voltas da torre ou a posição física da torre, para cada animal com o mesmo microscópio para um retorno rápido ao mesmo campo de visão.
- Solte o animal que transporta o microscópio para a sua gaiola doméstica ou câmara de comportamento para aclimatação e aguarde o desgaste da anestesia, se aplicável.
- Passo Crítico: Treine os animais para carregar o peso do microscópio usando um microscópio manequim para várias sessões até garantir que o uso do microscópio não interfira com seu comportamento normal, antes de iniciar as sessões experimentais. O manuseio e treinamento regular para a restrição desperta evitarão estresse excessivo para os animais.
- Selecione as configurações de aquisição a serem usadas para coletar dados. Isso inclui o fraEu avaliarei a captura de dados ( por exemplo, 20 fps, Ganho de 1 e potência LED de 50%). Verifique o histograma da imagem ao selecionar as configurações para garantir o bom SNR.
NOTA: A abertura numérica para a coleta de fluorescência é de 0,35 para a sonda de prisma de 1 mm em comparação com 0,5 para a sonda direta de 1 mm. - Inicie o software comportamental e programe-o para disparar o microscópio no ciclo de gravação de imagem desejado ( por exemplo, 4X 5 min ON 2 min OFF). Conecte a porta TTL na caixa Noldus IO à porta TRIG na caixa DAQ através de um cabo RJ45 a BNC.
- Coloque o animal na arena comportamental, se não estiver lá, e comece a experiência.
- Depois de adquirir os dados desejados, re-anestesiar o animal com isoflurano (5% em oxigênio) em uma câmara de indução, ou suavemente remanescente-restrição do animal.
- Solte o parafuso de ajuste da placa base e retire o microscópio da placa de base puxando suavemente o microscópio. Substitua a tampa da placa de base e aperte suavemente a baseplaTire o parafuso.
- Retorne o animal para a gaiola de casa até a próxima sessão de gravação. Use as imagens de fluorescência de referência como guia para sessões de imagem subsequentes para retornar ao mesmo campo de visão.
6. Avaliando dados de imagem de Ca 2 + de grande escala
- Para extrair a localização da célula e a dinâmica de Ca 2+ no campo de exibição a partir de dados, podem ser utilizadas diferentes plataformas de análise de dados. Mosaic, uma plataforma de análise de dados projetada especificamente para processar filmes de imagem de Ca 2 + em larga escala foi usada para este estudo aqui.
- Rectifique os pixels defeituosos e interpola todos os quadros individuais perdidos nos filmes em bruto na etapa de pré-processamento. Coloque as imagens no espaço a partir do campo de visão completo de 1.440 x 1.080 pixels para 720 x 540 pixels para reduzir a pegada de dados.
- Para corrigir os artefatos de movimento no cérebro em relação ao sensor de imagem do microscópio, registre os filmes usando uma imagem baseada em ImageJ rigorosa.Algoritmo de verificação (TurboReg).
- Para identificar neurônios individuais, reexpresar as imagens como mudanças relativas na fluorescência ΔF / F 0 = FF 0 / F 0 onde F 0 é a imagem média obtida pela média do filme inteiro.
- Identifique os filtros espaciais correspondentes a células individuais usando um algoritmo de classificação de células estabelecido. Aqui, utilizamos análise de componente principal e individual 21 para identificar neurônios individuais.
NOTA: Um evento foi especificado quando a amplitude de pico de um evento em um traço foi superior a 8 desvios padrão da linha de base do traço em nosso conjunto de dados e a localização da célula e os dados da dinâmica do Ca 2+ foram exportados para análise posterior.
Resultados
O protocolo descrito aqui descreve uma maneira efetiva e eficiente de realizar imagens longitudinais de Ca 2+ de várias camadas a partir de centenas de neurônios corticais em ratos de comportamento livre usando sondas de prisma ( Figura 1 ). As abordagens anteriores para a imagem cortical de várias camadas foram primariamente restritas aos animais fixos de cabeça 22 , 23 , 24 , 25 , 26 , 27 . Para adquirir esse nível de dados em um contexto de comportamento livre, utilizou-se uma plataforma de microscópio miniaturizado para flexibilidade comportamental; Um indicador de cálcio codificado geneticamente (GCaMP6f) foi usado para atingir uma população celular específica (células CAMKII + no córtex); E uma sonda de prisma foi escolhida para fornecer um campo de visão crônico e multicamadas.
Demonstrou o fluxo de trabalho para a preparação do animal para imagens. Um vetor viral que codifica um indicador de cálcio apropriado foi injetado no córtex ( Figura 2 , Etapa 1), antes de implantar cronicamente uma sonda de prisma para habilitar o acesso óptico às células rotuladas ( Figura 2 , Etapa 2). Uma placa de base que serve como uma doca segura e temporária para o posicionamento do microscópio durante as sessões de imagem foi então instalada sobre a cabeça do animal ( Figura 2 , Etapa 3), permitindo a visualização da atividade cortical em múltiplas camadas de células em um experimento de comportamento acordado Configuração ( Figura 2 , Etapa 4).
Para assegurar que a população celular desejada estivesse sendo alvo, uma seção de cérebro coronal pós mortem de um mouse representativo é mostrada na Figura 3 com o traço da sonda do prisma e o campo de visão marcado em relação ao laboratório GCaMP6fNeurônios em camadas 2/3 e 5 do córtex somatossensorial.
Durante a imagem de comportamento acordado com o sistema, a atividade dos neurônios corticais somatossensoriais foi registrada quando o mouse foi exposto a três ambientes diferentes: Campo aberto (Dia 1), Familiarização com Objetos (Dia 2-4) e Objeto Novo (Dia 5) ( Figura 4 ). No dia 1, o mouse foi colocado em uma arena comportamental desprovida de qualquer objeto. No dia 2-4, o mouse foi colocado na arena com os mesmos dois objetos texturalmente diferentes (um bloco de gel e um bloco de madeira). No dia 5, um dos objetos foi substituído por um novo objeto. O animal foi fotografado em 5 dias por 20 minutos por dia.
Após a extração celular usando o software de análise de dados de imagem do Ca 2+ , os filtros espaciais correspondentes aos locais das células foram sobrepostos na projeção de intensidade fluorescente média dos dados de gravação do microscópio( Figura 5) . Uma linha tracejada branca separa camadas 2/3 e 5 células. Os traços correspondentes de Ca 2+ de 5 células de cada uma das camadas mostram o padrão de disparo das células em dois contextos comportamentais diferentes: Object Familiarization e Novel Object Exposure. As células da camada 2/3 foram mais ativas em comparação com as células da camada 5 no dia em que o mouse foi exposto a um novo objeto. Isso também é evidente a partir das parcelas de quadriciclo que mostram a atividade de disparo limiar de todas as células fotográficas nos dias 1, 4 e 5.
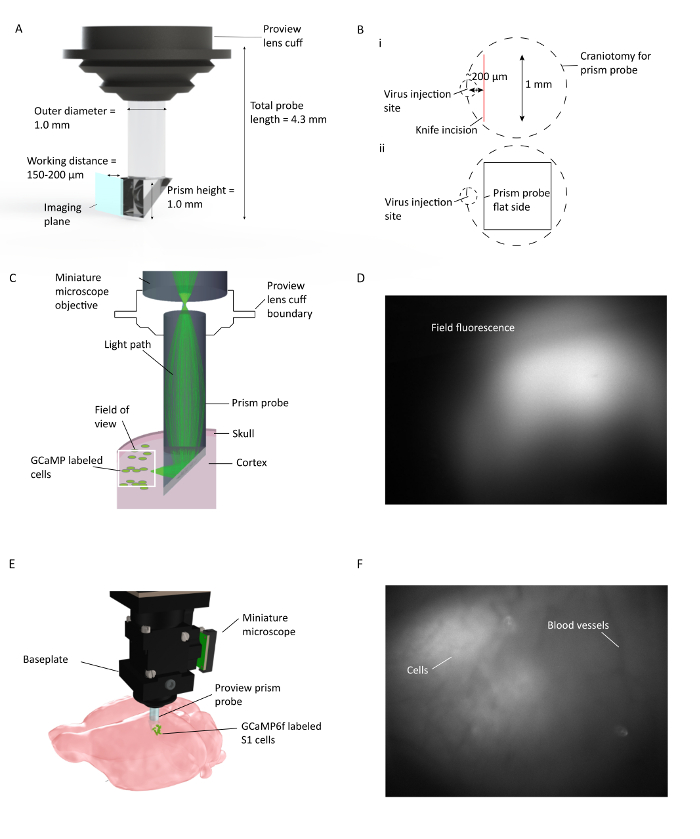
Figura 1: In Vivo Ca 2 + Imaging através de múltiplas camadas corticais em ratos de movimento livre. ( A ) Especificações da sonda prisma e representação do plano de imagem. O revestimento reflexivo no interior da hipotenusa permite a formação de imagens de 90 ° a partir do plano de inserção da sonda prisma. O cuFf integra-se com o suporte da lente, que agiliza o procedimento de implantação e permite a visualização potencial da fluorescência do tecido ambiente durante a implantação ( B ) (i). Ilustração da colocação de craniotomia de sonda de prisma e incisão de faca em relação ao local de injeção de vírus, e (ii) ilustração da localização do lado plano da sonda de prisma em relação à incisão de faca e ao local de injeção de vírus. ( C ) Ilustração da instalação de imagem Ca 2+ in vivo mostrando o caminho da luz para uma pequena área dentro do campo de visão completo através da sonda de prisma implantada no córtex do mouse. ( D ) Exemplo de campo de visão durante a instalação da sonda prisma. O microscópio em miniatura está ligado ao suporte da lente, que contém a sonda de prisma permitindo verificar a expressão do vírus durante a instalação da sonda de prisma. ( E ) Integração de microscópio com sonda de prisma para imagens corticais de várias camadas de células S1 marcadas com GCaMP6f. F Exemplo de campo de visãoDurante a instalação da placa base. O padrão de vasos sanguíneos claros é visível no momento da instalação da placa base com algumas células na imagem em bruto. Mais células são claramente visíveis quando DF / F é ativado na janela do software de aquisição. Clique aqui para ver uma versão maior desta figura.
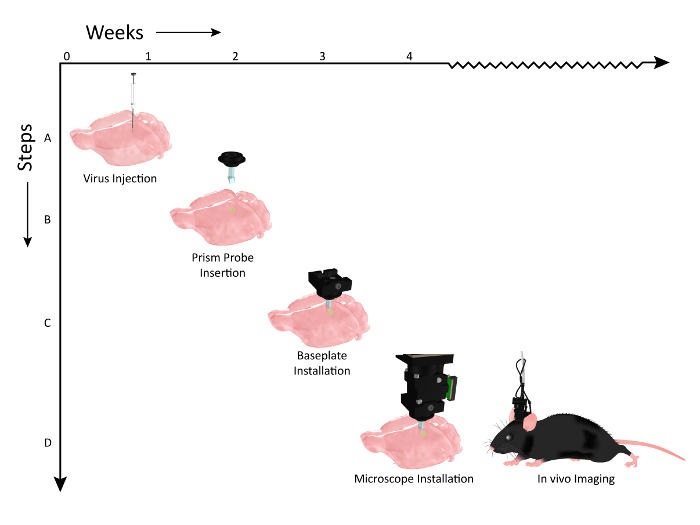
Figura 2: Esquema mostrando o cronograma dos eventos de fluxo de trabalho para implantação de implante de prisma e instalação de microscópio. O número de semanas é representado no eixo X e as etapas do fluxo de trabalho dos procedimentos ao longo do eixo Y. ( A ) Gráfico ilustrando a injeção viral (AAV1.CaMKII.GCaMP6f.WPRE.SV40) ao longo do mesmo eixo dorso-ventral, para rotular várias camadas do córtex somatossensorial do mouse. ( B ) 2 semanas após injeções de vírus, um problema de prismaE é implantado em um eixo paralelo aos sites de injeção de vírus. ( C ) Aproximadamente uma semana após a implantação da sonda do prisma, o animal é verificado para a expressão com o microscópio e uma placa de base é montada na cabeça se uma população de células estiver visível. ( D ) O animal está pronto para imagens crônicas durante tarefas comportamentais relevantes (clip art do mouse modificado após permissão de UW-Madison Biochemistry MediaLab). Clique aqui para ver uma versão maior desta figura.
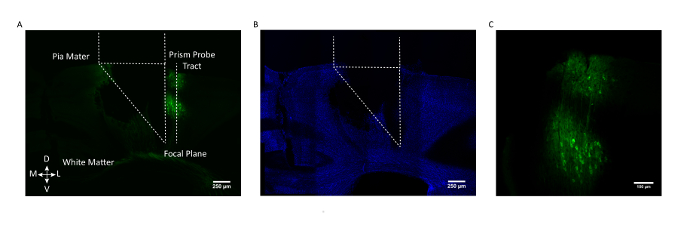
Figura 3: Validação histológica pós-mortem da localização da sonda prisma e expressão GCaMP. ( A ) Seção Coronal de um cérebro de mouse representativo que mostra o traço da sonda do prisma e com o lado da imagem voltadaAs células que expressam GCaMP6f (AAV1.CaMKII.GCaMP6f expressadas nos neurônios nas camadas 2/3 e 5). ( B ) Mesma seção do coração coronal após a coloração para DAPI. Barra de escala = 250 μm ( C ) Zoomed vista de GCaMP6f expressando células no córtex somatossensorial. Barra de escala = 100 μm. Clique aqui para ver uma versão maior desta figura.
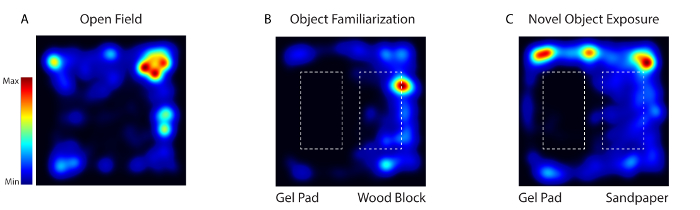
Figura 4: A atividade do mouse durante a habituação, a familiarização e o teste de exposição de objetos novos foram rastreados por vídeo usando o software de vídeo. ( A ) No dia 1, o animal foi colocado em uma arena comportamental desprovida de qualquer objeto (campo aberto). ( B ) Nos dias 2-4, os mesmos dois objetos texturizados diferentes (gel pad e bloco de madeira) foram colocados na arena (Object FamiLiarização). ( C ) No dia 5, um dos objetos foi substituído por um novo objeto (bloco de madeira com papel de areia) (Novel Object Exposure). Clique aqui para ver uma versão maior desta figura.
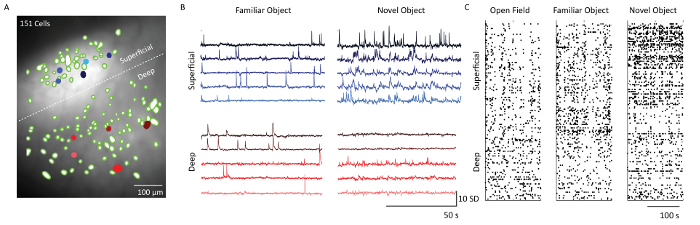
Figura 5: Dinâmica do cálcio de camadas superficiais e profundas do córtex somatossensorial de um mouse representado com o Microscópio. ( A ) Imagem mesclada de filtros espaciais neuronais (bolhas verdes) e projeção média de intensidade de fluorescência da gravação do microscópio através do campo de visão da sonda prisma. Borda entre camadas supragranular e infragranular indicadas por uma linha tracejada branca. Barra de escala = 100 μm. ( B ) Traços de cálcio de cinco exemplos de células superficiais e de camada profunda (cheio azul e vermelho cElls no painel A), indicando unidades de desvio padrão de fluorescência após análise de componente principal e independente. Barra de escala horizontal 50 s e barra de escala vertical 10 SD ( C ) Raster parcela de células de camadas superficiais (camadas 2/3) e profundas (camada 5) mostradas em campo aberto, Familiarização de objetos e exploração de novo objeto. Barra de escala = 100 s. Clique aqui para ver uma versão maior desta figura.
Discussão
Compreender a atividade do circuito neural durante o comportamento desperto é um nível vital de investigação neurocientífica necessária para efetivamente dissecar a função cerebral na saúde e na doença. O córtex é uma região particularmente importante para estudar no contexto do comportamento desperto, pois desempenha um papel importante em muitas funções sensoriais, cognitivas e executivas vitais 28 , 29 .
A coluna cortical é pensada para ser a unidade funcional básica no córtex e a atividade de nível populacional de células corticais é conhecida por diferir com base em sua localização física dentro da coluna. Por exemplo, neurônios excitatórios nas camadas 2/3 no córtex somatossensorial, principalmente para outras regiões neocorticais e modulam outras redes corticais 30 , enquanto que as células em camadas mais profundas são projetadas principalmente para regiões subcorticais como o tálamo 31 . Gravando a atividade de cemS de células corticais pré-especificadas simultaneamente e de forma confiável ao longo do tempo em diferentes lâminas em indivíduos que se comportam livremente, avançarão muito nossa compreensão do fluxo de informação cortical, permitindo uma dissecação funcional mais fina de colunas corticais informadas por informações comportamentais em tempo real e tempo- Escalas.
A coleta deste nível de dados do circuito neural é possível com o uso de uma plataforma de microscopia miniaturizada eficiente e racionalizada para conduzir imagens de Ca 2+ em larga escala em indivíduos que se comportam livremente (ou assuntos fixos de cabeça, conforme desejado). Usado com indicadores de cálcio codificados geneticamente para permitir a segmentação específica do tipo celular e imaginar um campo de visão de camada múltipla fornecido por uma sonda de prisma implantada cronicamente, este protocolo explorou um caso entre muitas aplicações possíveis: observando diferenças laminares no processamento cortical somatossensorial quando os ratos Fisicamente envolvido com um novo objeto ( Figura 5 ).Esta é a primeira ilustração processual desse tipo de abordagem específica do tipo celular, in vivo , para estudar múltiplas camadas corticais em animais acordados e de comportamento livre, e amplia o espectro de métodos experimentais disponíveis para compreender as estruturas laminares no cérebro ativo.
O campo de visão periscopico habilitado pela sonda de prisma nesta técnica pode ser aplicado de forma viável a outras estruturas cerebrais quando a preservação do tecido diretamente dorsal para uma região de interesse é desejada; Por exemplo, a imagem CA3 pode ser alcançada sem interrupção da função do hipocampo.
A abordagem baseada em sonda de prisma para imaginar a atividade de Ca 2 + requer a inserção física e implantação permanente de um microprisma no córtex, o que equivale à criação de uma lesão cortical onde a sonda da lente está inserida. Isso pode resultar em interrupções nos circuitos neurais locais, incluindo a separação de dendritos e processos apical. TSeu procedimento também causará uma ativação inicial das células gliais na região, embora isso seja esperado para ser localizado no tecido a cerca de 150 μm do rosto do prisma e para diminuir após o cérebro curar 22 . É muito importante considerar se esta técnica afetará a anatomia do circuito normal e / ou o comportamento dos animais ao planejar experimentos. Os grupos de controle comportamental devem sempre ser conduzidos para garantir que não haja alterações significativas nos comportamentos basais que possam produzir resultados experimentais confusos.
A utilização desta técnica de imagem móvel miniaturais, Ca 2 + com manipulação neurofarmacológica, vários paradigmas comportamentais cognitivos, sociais, motores ou intrínsecos e combinando-a com outras métricas fisiológicas pode aprofundar e enriquecer os estudos focados na compreensão dos papéis funcionais dos circuitos neurais no comportamento e no sinal Processamento 32 . Supressão ou ativaçãoAção de certos caminhos modulados por drogas pode influenciar os comportamentos associados, que podem ser facilmente estudados usando esta tecnologia 33 . Ramificar para diferentes tipos de células, modificando a segmentação do indicador de cálcio é outra aplicação poderosa e útil, e permite muitas combinações criativas de ferramentas experimentais para abordar diversas questões do circuito neural.
Divulgações
Os autores leram a política da revista e têm os seguintes interesses concorrentes: SG, SO e VC são funcionários remunerados da Inscopix.
Agradecimentos
Os autores agradecem a V. Jayaraman, DS Kim, LL Looger e K. Svoboda do Projeto Indicador e Efeito Neuronal (GENIE) codificado genéticamente no Campus de Investigação Janelia do Instituto Médico Howard Hughes por sua generosa doação de AAV1-GCaMP6f Para o Núcleo do Vector da Universidade da Pensilvânia. Eles também gostariam de agradecer a A. Olson e Neuroscience Microscopy Core na Universidade de Stanford apoiada pelo NIH NS069375 para os seus serviços de microscopia confocal.
Materiais
| Name | Company | Catalog Number | Comments |
| Neurostar Motorized Ultra Precise Small Animal Stereotaxic Instrument | Kopf | Model 963SD | Surgery |
| Stereoscope | Labomed | Prima DNT | Surgery and Imaging |
| Mini Rectal Thermistor Probe (.062"/1.6 mm diameter) - 1/4" Jack | FHC | 40-90-5D-02 | Surgery |
| Heating Pad 5 X 12.5 cm | FHC | 40-90-2-07 | Surgery |
| DC Temperature Controller | FHC | 40-90-8D | Surgery |
| Microsyringe Pump | World Precision Instruments | UMP3 model; serial 155788 F110 | Surgery |
| NanoFil 10 μL Syringe | World Precision Instruments | NANOFIL | Surgery |
| 35 G Beveled Tip Nanofil NDL 2PK | World Precision Instruments | NF35BV-2 | Surgery |
| Omnidrill35, 115 - 230 V | World Precision Instruments | 503598 | Surgery |
| Burrs for Micro Drill | Fine Science Tools | 19007-05 | Surgery |
| nVista | Inscopix | 100-001048 | Imaging |
| AAV1.CaMKII.GCaMP6f.WPRE.SV40 | Penn Vector Core | AV-1-PV3435 | Surgery |
| Ketoprofen | Victor Medical | 5487 | Surgery |
| Carprofen | Victor Medical | 1699008 | Surgery |
| Isoflurane | Victor Medical | 1001054 | Surgery |
| Gelfoam (Patterson Veterinary Supply Inc Gelfoam Sponge 12 cm x 7 mm) | Pfizer (Fisher Scientific) | NC9841478 | Surgery |
| Dumont #5/45 forceps | Fine Science Tools | 11251-35 | Surgery |
| Dumont #5 forceps | Fine Science Tools | 11251-30 | Surgery |
| Dissecting knives | Fine Science Tools | 10055-12 | Surgery |
| ProView Implant Kit | Inscopix | 100-000756 | Surgery and Imaging |
| ProView Prism Probe 1.0 mm-Dia. ~4.3 mm Length | Inscopix | 100-000592 | Surgery and Imaging |
| Kwik-Sil adhesive pack of 2 | World Precision Instruments | KWIK-SIL | Surgery |
| Kwik-Cast Sealant | World Precision Instruments | KWIK-CAST | Surgery and Imaging |
| Miniature Optical Mounting Post | Newport | M-TSP-3 | Imaging |
| Microscope Baseplate | Inscopix | BPL-2 | Imaging |
| Microscope Baseplate Cover | Inscopix | BPC-2 | Imaging |
Referências
- McConnell, S. K. Development and decision-making in the mammalian cerebral cortex. Brain Res. 472 (1), 1-23 (1988).
- Kwon, S. E., Yang, H., Minamisawa, G., O'Connor, D. H. Sensory and decision-related activity propagate in a cortical feedback loop during touch perception. Nat. Neurosci. 19 (9), 1243-1249 (2016).
- Miller, E. K., Cohen, J. D. An integrative theory of prefrontal cortex function. Annu. Rev. Neurosci. 24, 167-202 (2001).
- Bailey, M. R., Simpson, E. H., Balsam, P. D. Neural substrates underlying effort, time, and risk-based decision making in motivated behavior. Neurobiol. Learn. Mem. 133, 233-256 (2016).
- Dehaene, S., Changeux, J. P. Reward-dependent learning in neuronal networks for planning and decision making. Prog. Brain Res. 126, 217-229 (2000).
- Ferenczi, E. A., et al. Prefrontal cortical regulation of brainwide circuit dynamics and reward-related behavior. Science. 351 (6268), aac9698 (2016).
- Anomal, R. F., et al. Impaired Processing in the Primary Auditory Cortex of an Animal Model of Autism. Front. Sys. Neurosci. 9, 158 (2015).
- Pauls, D. L., Abramovitch, A., Rauch, S. L., Geller, D. A. Obsessive-compulsive disorder: an integrative genetic and neurobiological perspective. Nat. Rev. Neurosci. 15 (6), 410-424 (2014).
- Ziv, Y., et al. Long-term dynamics of CA1 hippocampal place codes. Nat. Neurosci. 16 (3), 264-266 (2013).
- Jennings, J. H., et al. Visualizing hypothalamic network dynamics for appetitive and consummatory behaviors. Cell. 160 (3), 516-527 (2015).
- Betley, J. N., et al. Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature. 521 (7551), 180-185 (2015).
- Sun, C., et al. Distinct speed dependence of entorhinal island and ocean cells, including respective grid cells. Proc. Natl. Acad. Sci. 112 (30), 9466-9471 (2015).
- Kitamura, T., et al. Entorhinal Cortical Ocean Cells Encode Specific Contexts and Drive Context-Specific Fear Memory. Neuron. 87 (6), 1317-1331 (2015).
- Pinto, L., Dan, Y. Cell-Type-Specific Activity in Prefrontal Cortex during Goal-Directed Behavior. Neuron. 87 (2), 437-450 (2015).
- Cox, J., Pinto, L., Dan, Y. Calcium imaging of sleep-wake related neuronal activity in the dorsal pons. Nat. Comm. 7, 10763 (2016).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nat. Protoc. 11 (3), 566-597 (2016).
- Hooks, B. M., et al. Organization of cortical and thalamic input to pyramidal neurons in mouse motor cortex. The J. Neurosci. 33 (2), 748-760 (2013).
- Masamizu, Y., et al. Two distinct layer-specific dynamics of cortical ensembles during learning of a motor task. Nat. Neurosci. 17 (7), 987-994 (2014).
- Rowland, D. C., Moser, M. -. B. From cortical modules to memories. Curr. Opin. Neurobiol. 24 (1), 22-27 (2014).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nat. Methods. 8 (10), 871-878 (2011).
- Mukamel, E. A., Nimmerjahn, A., Schnitzer, M. J. Automated analysis of cellular signals from large-scale calcium imaging data. Neuron. 63 (6), 747-760 (2009).
- Andermann, M. L., et al. Chronic cellular imaging of entire cortical columns in awake mice using microprisms. Neuron. 80 (4), 900-913 (2013).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nat. Protoc. 9 (11), 2515-2538 (2014).
- Chia, T. H., Levene, M. J. In vivo imaging of deep cortical layers using a microprism. J. Vis. Exp. (30), (2009).
- Chia, T. H., Levene, M. J. Microprisms for in vivo multilayer cortical imaging. J. Neurophysiol. 102 (2), 1310-1314 (2009).
- Chia, T. H., Levene, M. J. Multi-layer in vivo imaging of neocortex using a microprism. Cold Spring Harb. Protoc. 2010 (8), (2010).
- Low, R. J., Gu, Y., Tank, D. W. Cellular resolution optical access to brain regions in fissures: imaging medial prefrontal cortex and grid cells in entorhinal cortex. Proc. Natl. Acad. Sci. 111 (52), 18739-18744 (2014).
- Zeisel, A., et al. Brain structure. Cell types in the mouse cortex and hippocampus revealed by single-cell RNA-seq. Science. 347 (6226), 1138-1142 (2015).
- Hawrylycz, M., et al. Inferring cortical function in the mouse visual system through large-scale systems neuroscience. Proc. Natl. Acad. Sci. 113 (27), 7337-7344 (2016).
- Petrof, I., Viaene, A. N., Sherman, S. M. Properties of the primary somatosensory cortex projection to the primary motor cortex in the mouse. J. Neurophysiol. 113 (7), 2400-2407 (2015).
- Aronoff, R., et al. Long-range connectivity of mouse primary somatosensory barrel cortex. Euro. J. Neurosci. 31 (12), 2221-2233 (2010).
- Rogan, S. C., Roth, B. L. Remote control of neuronal signaling. Pharma. Rev. 63 (2), 291-315 (2011).
- Berdyyeva, T., et al. Zolpidem reduces hippocampal neuronal activity in freely behaving mice: a large scale calcium imaging study with miniaturized fluorescence microscope. PloS One. 9 (11), e112068 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados