Method Article
Ca Cortical Multi-capa
En este artículo
Resumen
Aquí, presentamos un procedimiento para la realización de gran escala Ca 2 + imágenes con resolución celular a través de múltiples capas corticales en los ratones que se mueven libremente. Cientos de células activas se pueden observar simultáneamente usando un microscopio en miniatura montado en la cabeza acoplado con una sonda de prisma implantada.
Resumen
El circuito in vivo y la imagen funcional de nivel celular es una herramienta crítica para entender el cerebro en acción. Imágenes de alta resolución de las neuronas corticales de ratón con microscopía de dos fotones ha proporcionado una visión única en la estructura cortical, la función y la plasticidad. Sin embargo, estos estudios se limitan a los animales fijos de la cabeza, reduciendo en gran medida la complejidad del comportamiento disponible para el estudio. En este artículo, se describe un procedimiento para realizar la microscopía de fluorescencia crónica con la resolución celular a través de múltiples capas corticales en los ratones que se comportan libremente. Utilizamos un microscopio de fluorescencia miniaturizado integrado emparejado con una sonda de prisma implantada para visualizar y registrar simultáneamente la dinámica del calcio de cientos de neuronas a través de múltiples capas de la corteza somatosensorial mientras el ratón participaba en una nueva tarea de exploración de objetos durante varios días. Esta técnica puede adaptarse a otras regiones cerebrales de diferentes especies animales para otras pAradigmas
Introducción
La corteza es un actor esencial en muchas funciones mentales y de comportamiento complejas, desde la atención, la percepción sensorial y el control cognitivo de arriba hacia abajo 1 , 2 , 3 a las vías de motivación, recompensa y adicción 4 , 5 . La comprensión de los procesos computacionales que subyacen en su función es un objetivo importante para impulsar una mejor comprensión clínica de muchos trastornos mentales y del comportamiento.
Muchas teorías actuales de la enfermedad psiquiátrica se centran en torno a la idea de que la disfunción del circuito neural cortical o la discordiación puede ser la causa de anormalidades cognitivas y conductuales que son las características de condiciones como la esquizofrenia 6 , el autismo 7 o el trastorno obsesivo-compulsivo 8 . Por lo tanto, la obtención de datos de la actividad neural de la población de coRtical circuitos dentro del contexto adecuado de la información de comportamiento simultánea es de gran importancia, y idealmente puede ser dirigido a tipos de células específicas para una disección de circuito neural más fino.
Los microscopios miniaturizados junto con las microlentes de índice de refracción de gradiente implantables (GRIN) permiten el acceso óptico a conjuntos neuronales bajo condiciones de movimiento libre desde una diversidad de posibles regiones cerebrales 9 , 10 , 11 , 12 , 13 , incluyendo la corteza 14 , 15 , 16 . El uso de un sistema de microscopía móvil, junto con los indicadores de calcio genéticamente codificados permite imágenes consistentes de la misma población celular que abarca cientos de neuronas durante días o semanas en muchas regiones del cerebro [ 9] , y puede serGenéticamente dirigidos a tipos celulares específicos utilizando vectores virales o técnicas transgénicas.
Como se sabe que la corteza soporta diferentes funciones y se conecta a diferentes regiones cerebrales dependiendo de la ubicación de las células dentro de la lámina cortical 17 , 18 , 19 , estamos interesados en obtener simultánea actividad neuronal multicapa en sujetos que se comportan despiertos. Aquí se demuestra cómo la imagen de cientos de neuronas marcadas fluorescentemente en los ratones que se comportan libremente durante días, utilizando el microscopio de fluorescencia miniaturizado 20 emparejado con una sonda de prisma implantado, que ofrece una visión multicapa de la corteza ( Figura 1 ).
La sonda de prisma usada aquí está compuesta por dos lentes GRIN separadas: un prisma y una lente relé cilíndrica ( Figura 1 ). La luz del microscopio excita el marcado fluorescenteCélulas situadas a lo largo de la cara de formación de imágenes de la sonda de prisma, después de haber sido reflejadas por la hipotenusa de la porción de prisma de la sonda. La luz emitida de las células también refleja la hipotenusa del prisma, se recoge a través del objetivo del microscopio y llega al sensor en el microscopio. La sonda de prisma utilizada en este procedimiento está adaptada para facilitar su uso con equipos estereotáxicos estándar.
El microscopio de fluorescencia miniaturizado 20 detecta transitorios de Ca 2+ potencialmente evocados potencialmente en poblaciones neuronales con una sola resolución de células, después de que dichas células han sido específicamente marcadas con indicadores fluorescentes codificados genéticamente con Ca2 + . En este protocolo, se inyecta Ca 2 + indicador codificado en un vector viral (AAV1.CaMKII.GCaMP6f.WPRE.SV40), el implante de una sonda de prisma, instalar el microscopio, a continuación, obtener varios días de somatosensorial (S1 miembro posterior) datos de actividad neuronal De una exposición de animalesD a nuevas superficies de objetos durante la exploración libre ( Figura 2 ).
Protocolo
Los procedimientos que involucran sujetos animales han sido aprobados por el Comité de Cuidado y Uso de Animales Institucionales (IACUC) en LifeSource Biomedical Services, NASA Ames Research Center, California.
1. Preparación preoperatoria
- Esterilice las herramientas que se utilizarán en los procedimientos quirúrgicos en un esterilizador de cuentas calientes y limpie el área de la cirugía con etanol al 70%. Encienda la almohadilla calentadora colocada sobre la etapa estereotáxica y manténgala a 37 ° C.
- Anestesiar al animal con isoflurano (5% para la inducción, y 1-2% para el mantenimiento, 0.6-0.8 L / min O 2 ). Compruebe la ausencia de un reflejo pinchazo para determinar la profundidad de la anestesia.
- Montar el animal en un marco estereotáxico equipado con barras de oreja y dientes.
- Aplique un ungüento oftálmico en los ojos del animal y cúbralos con un pedazo de papel oscuro para protegerlos del secado e intensas luces quirúrgicas.
- Inyectar el animal por vía subcutánea con cetoprofeno (2,5Mg / kg) o carprofeno (2,5 mg / kg)
2. Cirugía de inyección de virus
- Recortar y afeitar el cuero cabelludo entre los ojos y las orejas y desinfectar la piel con 3 hisopos alternativos de etanol al 70% y betadina.
- Exponer el cráneo haciendo una incisión en el cuero cabelludo, comenzando entre los ojos y extendiéndose 1,5 cm rostrocaudal con una hoja quirúrgica estéril. Abra la piel para exponer el cráneo y retire el periostio alrededor del sitio de inyección deseado usando hisopos de algodón y un bisturí. Enjuague el cráneo con PBS estéril. Limpiar y pulir el cráneo con hisopos de algodón.
- Nivel del cráneo, y con un marcador, marcar las coordenadas estereotáxicas para la inyección de virus. Usando una fresa de 0,5 mm en un microdrill de alta velocidad (establecido a alrededor de 7.000-10.000 rpm), crear un pequeño agujero en el cráneo. Aplique una ligera presión durante la perforación y limpie intermitentemente el polvo de hueso y humedezca el área con PBS estéril para evitar que el tejido cerebral sobrecaliente, hasta que la superficie del cerebro estéDolido Mantenga el cerebro húmedo donde se perfora el agujero.
- Use una aguja de 26 G para recoger virus ( por ejemplo, AAV1.CaMKII.GCaMP6f.WPRE.SV40) en la microjeringe, y luego reemplazarla con una aguja de 35 G para inyección. Conecte la microjeringe cargada con virus al brazo manipulador del aparato estereotáxico.
- Lleve la jeringa cerca del agujero del sitio de inyección y ajuste el ángulo de la aguja para que entre en un ángulo de 90 ° con respecto a la superficie del cerebro. Baje la aguja hasta que toque pia mater y perfore a través de la duramadre. Comience a bajar la aguja en incrementos de 10 μm / s hasta que alcance la profundidad deseada (z). Fijar la localización de la aguja allí usando el brazo estereotáxico.
- Coloque la bomba de microjeras para inyectar 250 nL de virus a 25 nL / min.
- Paso crítico: Dado que el volumen del virus a inyectar depende del título y la dilución, ejecute los experimentos de dilución de antemano, para establecer el volumen óptimo y los criterios de concentración para las células de imagenEn el experimento.
- Si se ve algún virus exudado fuera del sitio de inyección, haga una pausa en la inyección y espere hasta que el tejido cerebral absorba la caída del virus. Espere 5-7 minutos después de inyectar el volumen total antes de retraer la aguja. Los colorantes como el verde rápido también se podrían agregar a la solución del virus para ayudar a controlar la tasa de inyección en el caso de que el virus se ve exudado fuera de la superficie del cerebro.
- Para etiquetar múltiples capas en la corteza, use inyecciones múltiples si es necesario. Comienza primero en el sitio más ventral, esperando 5-7 min después de la inyección y tirando de la aguja hasta el siguiente punto más dorsal para inyección ( por ejemplo, inyectar a -1,0 mm AP, 1,5 mm ± ML y 400 y 600 μm DV). Espere 10 minutos después de la inyección final antes de extraer la aguja y retirarla de la disposición estereotáxica.
- Mezcle una pequeña cantidad de un adhesivo de elastómero transparente biocompatible in vivo de la jeringa de doble cilindro (Por ejemplo Kwik-Sil) y cubrir el agujero en el cráneo con él. Aplique adhesivo de cianoacrilato en la parte superior de la capa de adhesivo de elastómero y deje que cure.
- Suturar el cuero cabelludo y permitir que el animal para recuperarse de la anestesia en una jaula de recuperación de calor hasta que es ambulatorio. Administrar ketoprofeno (2,5 mg / kg) o carprofeno (2,5 mg / kg) por vía subcutánea antes de devolver el animal a su jaula de origen. Singularmente casa después de la cirugía los sujetos para proteger el sitio de la cirugía y repetir la dosis 24 horas después.
- Después de retirar la microjeringe, enjuague las agujas de 26 G y 35 G 7-10 veces con agua destilada para limpiar antes de guardarlo.
3. Cirugía de Implante de Sonda de Prisma
- 1-2 semanas después de la inyección del virus, se preparan para la cirugía del implante de la sonda del prisma. Desinfecte la sonda de prisma en etanol al 70% y límpiela con papel para lentes. Inserte la sonda de prisma en la herramienta porta-lente y apriete el tornillo hexagonal con el destornillador. Asiente el microscopio en el soporte de la base (elLos imanes lo tendrán en su lugar).
- Prepare el animal como se describe en la sección Preparación preoperatoria.
- Recortar y afeitar la cabeza del animal entre los ojos y las orejas y desinfectar la piel con hisopos alternos de etanol al 70% y betadina.
- Exponer el cráneo mediante la incisión de la piel con un par de tijeras estériles y retirar el colgajo cutáneo y periostio subyacente. Secar y pulir el cráneo con hisopos de algodón. Asegúrese de quitar adecuadamente el tejido muscular circundante para crear una base de hueso amplia, limpia y seca, en preparación para los siguientes pasos.
- Implante los tornillos del cráneo en el hemisferio contralateral para hacer el implante estable y seguro. Estos también pueden ser útiles si se elige implantar un cabezal para la fijación de cabeza despierta para preparar al animal para sesiones de imágenes experimentales en la Sección 5.
- Nivele el cráneo y marque con un marcador las coordenadas AP y ML para la inserción de la lente. El uso de una rebaba de 0,5 mm en un microdrill abre una craneotomíaEl diámetro de la craneotomía es sólo mayor que el diámetro del prisma, es decir 1,0 mm en este caso. Taladre suavemente mientras hace una pausa intermitente para enjuagar el cráneo con PBS estéril y succionar con hisopas de algodón. Retire el polvo de hueso que se genera.
- Paso crítico: Colocar la craneotomía de tal manera que cuando el prisma se inserta en la corteza, su borde plano (superficie de imagen) se enfrenta al sitio de inyección del virus y se encuentra dentro de un radio de 150-200 μm.
- Deje de perforar justo antes de que el cráneo esté completamente adelgazado. Los vasos sanguíneos deben ser visibles a través del hueso adelgazado. Retire el tapón de hueso suavemente con pinzas finas de 45 °.
- Retire la duramadre con pinzas # 5.
- Paso crítico: Una vez que el tejido cerebral está expuesto, siempre mantener el tejido húmedo. Coloque un hisopo de algodón sumergido en solución salina estéril sobre la craneotomía. Esto también mantendrá la presión sobre el tejido.
- Para aliviar la presión en el tejido cerebral duAnillo de inserción de la sonda de prisma, crear un tramo de inserción antes de tiempo. Conecte un cuchillo de disección de filo recto al brazo portaelectrodos del aparato estereotáxico y colóquelo en el aparato estereotáxico en un ángulo tal que la cuchilla sea perpendicular a la curvatura del cráneo (ángulo de 10 ° en este caso) y en un Paralelo a la columna de inyección de virus.
- Cuidadosamente colocar el cuchillo por encima de la craneotomía a lo largo de su borde medial anterior en este caso y ~ 200 μm lateral al sitio de inyección del virus con el filo de corte hacia atrás ( Figura 1 ). Cero fuera del eje Z cuando la punta del cuchillo toca el pia y baje gradualmente (en incrementos de 10 μm / s) a una profundidad a la cual se inserta la sonda del prisma. A continuación, mueva el cuchillo 1 mm hacia atrás para crear un camino para el borde de ataque del prisma. Pausa y control de cualquier sangrado que pueda ocurrir mientras se realiza la incisión con un trozo de gelfoam empapado en solución salina pre-estéril.
- Una vez que el cuchillo esté en esta posición, enjuague el sitio con solución salina estéril y espere hasta que desaparezca cualquier sangrado. A continuación, retraer lentamente la cuchilla utilizando el micromanipulador del brazo estereotáxico en incrementos de 10 μm / sy colocar un trozo de esponja de gelatina empapada en solución salina estéril sobre la incisión.
- Conecte el soporte del objetivo (con la sonda de prisma y el microscopio) al brazo manipulador estereotáxico con el mismo ángulo que el cuchillo en el paso anterior. Alinee el prisma de manera que el lado plano del prisma se encuentre sobre la incisión y paralelo a la columna de inyección de virus. Este paso podría requerir una corrección fina de la posición del brazo estereotáxica. Ajuste la alineación manteniéndose cerca del cráneo para obtener resultados más rápidos.
- Una vez que el prisma esté en el ángulo correcto, gradualmente baje en el cerebro en incrementos de 10 μm hasta un z final de 1,1 mm para esta sonda, comenzando desde la superficie del cerebro. El tejido cerebral se expandirá alrededor del prisma y cualquier presión que se cree está detrás de la visualizaciónEn el plano y no afectará el campo de visión. Conecte el microscopio a un ordenador con software de adquisición instalado a través de un puerto USB3 y visualice la fluorescencia de campo encendiendo el LED.
- Cubra cualquier tejido expuesto alrededor del prisma en la craneotomía en una capa protectora muy fina de adhesivo de elastómero usando una aguja de 25G.
- Después de que el adhesivo de elastómero se cure (usualmente en ~ 3-5 min) use una aguja de 25G para aplicar un poco de adhesivo de cianoacrilato para fijar el cristal de la lente de prisma al cráneo adyacente sobre la capa de adhesivo de elastómero, La craneotomía. Incluya los bordes del manguito de la sonda prismática para una mejor adherencia. No coloque ningún adhesivo sobre la superficie superior de la sonda de prisma implantada. Una vez que se haya curado el adhesivo de cianoacrilato, desenrosque el portaobjetos y retire cuidadosamente el microscopio. A continuación, retraer lentamente el brazo manipulador estereotáxico para dejar la sonda de prisma firmemente implantada.
- Aplique una capa de acrílico dental oCyanoacrylate alrededor del implante para cubrir toda la superficie expuesta del cráneo, hasta pero no tocando el tejido de músculo retraído circundante. Cubrir un área grande del cráneo con este casquillo craneal ayudará más adelante en el accesorio de la placa base. La piel alrededor del sitio del implante debe curarse por sí misma alrededor de la tapa craneal.
- Paso crítico: No deje que el adhesivo toque nada de la piel circundante o tejido muscular, y no engullir ninguna piel en la tapa craneal. Hacerlo irritará la piel, y puede resultar en raspadura excesiva y daño potencial al implante.
- Opcional: Si desea utilizar una configuración de cabeza fija despierta para conectar y desacoplar el microscopio a la placa base de un animal en sesiones de formación de imágenes experimentales en lugar de anestesiar o anidar brevemente al animal, implante un cabezal en la cápsula craneal que sea compatible con una cabeza despierta, Configuración fija de elección (no se demuestra en este protocolo).
- Mezclar el catalizador y la base de un silicioE una jeringa adhesiva y coloque una gota del elastómero en el interior del manguito de la sonda prismática para cubrir la parte superior de la lente de la sonda para evitar cualquier daño y el polvo de sedimentación.
- Quitar el animal del marco estereotáxico y permitir la recuperación de la anestesia en una cámara caliente. Administrar ketoprofeno (2,5 mg / kg) o carprofeno (2,5 mg / kg) por vía subcutánea y devolver el animal a una jaula casera limpia una vez que sea ambulatorio. Singly casa todos los sujetos para proteger el implante y repetir la dosis 24 h más tarde.
4. Accesorio de la placa base para la instalación del microscopio en miniatura
- Una semana a 10 días después de implantar la sonda de prisma, comprobar la expresión del virus en el tejido a través de la sonda de prisma implantada y fijar una placa de base en el cráneo si la preparación muestra actividad celular. El microscopio se acoplará en la placa base durante la imagen en vivo.
- Siga los pasos indicados en el procedimiento preoperatorio para preparar el animal para la fijación de la placa base.
- Retire la tapa adhesiva de silicona sobre la superficie de la parte superior de la lente de la sonda prismática implantada. Examine la superficie de la sonda de la lente y limpie los residuos cuidadosamente con papel para lentes y etanol al 70% para asegurar que la superficie de la imagen esté limpia.
- Conecte el microscopio a su caja DAQ y conéctelo a través del puerto USB3 al PC.
- Abra el software de adquisición en la computadora y conecte el microscopio a través del puerto USB3. Utilice el software de adquisición para comprobar la actividad neuronal y para medir y documentar la configuración del campo de visión para futuras grabaciones en este tema.
- Conecte una placa de base al microscopio y fije el tornillo de fijación de la placa base para sujetar la placa base en posición y asegure el microscopio en la pinza del microscopio en el brazo del micromanipulador estereotáxico por el cuerpo del microscopio. Conecte la pinza a una varilla de Newport, que se puede montar en el brazo del micromanipulador estereotáxico.
- Coloque el microscopio por encima de la lente de la sonda de prisma utilizando los sBrazo micromanipuador tereotáxico. Inspeccione visualmente la orientación observando la lente del prisma desde el lado y la parte posterior de la etapa animal. Los ejes ópticos del objetivo del microscopio y de la lente de la sonda de prisma deben estar alineados.
- Encienda el microscopio LED a través del software. Evaluar la calidad de la alineación del microscopio centrándose en la cara superior de la lente de sonda prismática implantada en el software de adquisición. Cuando estén correctamente alineados, los bordes de la cara superior de la lente de la sonda de prisma deben ser afilados.
- Ajuste la distancia física del microscopio por encima de la sonda de prisma implantada utilizando el brazo manipulador estereotáxico para obtener el plano focal deseado dentro del tejido. La distancia ópticamente optimizada entre el objetivo del microscopio y la lente GRIN implantada es de ~ 500 μm.
- Guarde una imagen de fluorescencia de referencia una vez que se capture el plano de imagen deseado.
Punto crítico: A partir de este punto, no ajustar la posición del microscopio, ya que esto cambiará la locatiEn el plano de imagen en el tejido.
NOTA: Aplique adhesivo en el siguiente paso para fijar permanentemente la posición de la placa base en relación con la tapa craneal. El adhesivo puede experimentar cierta contracción de volumen en el día siguiente o dos, lo que puede cambiar el plano focal en el tejido. Preemptivamente cuenta de esto mediante la medición de la cantidad de contracción de su mezcla adhesiva y la distancia ex vivo , a continuación, el respaldo de la posición final Z del microscopio + placa base en esa cantidad antes de avanzar a la etapa de aplicación de adhesivo. - Utilice acrílico dental o cianoacrilato para fijar permanentemente la placa de base a la tapa de acrílico que cubre el cráneo del animal, puenteando el hueco con el acrílico o el adhesivo. La aplicación gradual del acrílico / cianoacrilato dental y el curado en múltiples etapas pueden minimizar el efecto de la contracción anteriormente mencionada sobre la posición final del plano de imagen del microscopio.
- Paso crítico: Tenga cuidado al aplicar los dientesAcrílico / cianoacrilato para evitar que cualquier material entre en contacto con la lente objetiva del microscopio, el tornillo de fijación o el cuerpo del microscopio, lo que impedirá el correcto funcionamiento de la instrumentación más adelante.
- Paso crítico: Mientras se aplica el adhesivo, no presione el microscopio. La presión sobre el microscopio o la placa base puede causar el movimiento del objetivo del microscopio con respecto a la lente de la sonda de prisma, lo que podría dar lugar a una desalineación o un cambio del plano focal en el tejido que requeriría un reajuste rápido.
- Verifique que el acrílico / cianoacrilato dental haya curado y endurecido tocando el acrílico con un par de fórceps o una punta de jeringa. Adquirir una imagen de fluorescencia de referencia final con el software de adquisición.
- Suelte el microscopio de la pinza y retraiga la pinza del microscopio. Si se utilizó cianoacrilato u otro adhesivo transparente, cubrirlo con esmalte de uñas negro o una capa de cemento dental negro paraMbient fuga de luz en la tapa de la cabeza, que puede contaminar futuras imágenes adquiridas durante los experimentos.
- En este punto, retire el microscopio si es necesario. Para separar el microscopio de la placa base, suelte el tornillo de ajuste de la placa base girando el tornillo de ajuste aproximadamente ½ vuelta en sentido antihorario. Pellizque el cuerpo del microscopio mientras sostiene la placa base y la tapa acrílica con la otra mano, y tire del microscopio hacia arriba. Vuelva a colocarlo en su recipiente de almacenamiento.
- Proteja la sonda de prisma implantada con una cubierta de placa base. Esto evitará que las partículas de polvo se asienten en la superficie de la lente, lo cual puede ser difícil de limpiar después de que la placa base haya sido instalada.
- Sujete la cubierta de la placa de base en la placa base y avance el tornillo de ajuste en un ½ vuelta aproximadamente en el sentido de las agujas del reloj o hasta que el tornillo de ajuste quede al ras con la cubierta de la placa base. No lo apriete demasiado.
- Retire el animal de la anestesia y el monitor en una cámara de recuperación caliente hasta ambulatorio. RegresoE animal a su jaula de origen. Aloje individualmente a todos los animales con bases implantadas para proteger el implante.
5. Imaging múltiples capas corticales en un ratón que se mueve libremente
- Prepare el aparato conductual ( por ejemplo , Phenotyper, Noldus) limpiándolo y desinfectándolo y limpiándolo con una solución de lejía al 10%.
- Conecte el microscopio a su caja DAQ, y conéctelo al ordenador y ejecute el software de adquisición.
- Compruebe el amplio espacio de almacenamiento de archivos en la computadora de adquisición y haga espacio para las películas de imágenes de calcio. Guarde directamente desde el software en el disco duro local, en lugar de escribir en un disco duro externo, para acomodar la alta velocidad de transferencia de datos entre el microscopio y la computadora y evitar la pérdida de datos durante las grabaciones.
- Anestesiar el animal con isoflurano (5% en oxígeno) en una cámara de inducción para fijar el microscopio. Alternativamente, suavemente scruff el animal o utilizar una configuración de cabeza fija despiertoCon un cabezal si se sabe que la anestesia interfiere con el paradigma conductual de elección.
- Retire la cubierta de la placa base girando el tornillo de la placa base en sentido contrario a las agujas del reloj y levantando la cubierta de la placa base.
- Asiente el microscopio en la base del animal. El microscopio debe encajar en su lugar con la ayuda de los imanes en la placa base. Avance el tornillo de fijación de la placa base hasta que se sienta una ligera resistencia.
- Paso crítico: No apriete demasiado el tornillo de fijación de la placa base para evitar daños en la carcasa del microscopio.
- Compruebe el plano de imagen en el tejido mediante la adquisición de una instantánea de fluorescencia en el software y, si es necesario, ajustar el plano focal en el tejido, aflojando el tornillo de la torreta del microscopio, girando la torreta de microscopio para ajustar el enfoque fino y volver a apretar la torreta Tornillo de fijación de la carcasa.
- Paso crítico: Nunca fuerce la torreta a girar sin primero aflojar el tornillo de ajuste, yNo apriete demasiado el tornillo de fijación de la torreta.
- Si se realiza un estudio longitudinal, volver a la posición de torreta física para capturar el mismo campo de visión. En el hardware, tenga en cuenta el número de vueltas de la torreta, o la posición física de la torreta, para cada animal con imágenes del mismo microscopio para un rápido retorno al mismo campo de visión.
- Libere al animal que transporta el microscopio a su jaula doméstica o cámara de conducta para que se aclimate y espere a que se le quite la anestesia, si corresponde.
- Paso crítico: Capacitar a los animales para que lleven el peso del microscopio usando un microscopio ficticio durante varias sesiones hasta asegurarse de que el uso del microscopio no interfiera con su comportamiento normal, antes de comenzar las sesiones experimentales. Manejo y entrenamiento regulares para la retención despierta prevenir el estrés innecesario a los animales.
- Seleccione los ajustes de adquisición que se utilizarán para recopilar datos. Esto incluye el fraMe para la captura de datos ( por ejemplo, 20 fps, ganancia de 1, y la potencia del LED de 50%). Compruebe el histograma de la imagen al seleccionar los ajustes para garantizar una buena SNR.
NOTA: La apertura numérica para la recolección de fluorescencia es de 0,35 para la sonda de prisma de 1 mm en comparación con 0,5 para la sonda recta de 1 mm. - Inicie el software de comportamiento y programarlo para activar el microscopio en el ciclo de grabación de imágenes deseado ( por ejemplo, 4X 5 min ON 2 min OFF). Conecte el puerto TTL de la caja de Noldus IO al puerto TRIG de la caja DAQ a través de un cable RJ45 a BNC.
- Coloque al animal en el campo de comportamiento si no está ya allí, e inicie el experimento.
- Después de adquirir los datos deseados, volver a anestesiar el animal con isoflurano (5% en oxígeno) en una cámara de inducción, o suavemente despierta-restringir el animal.
- Afloje el tornillo de fijación de la placa de base y separe el microscopio de la placa de base tirando suavemente del microscopio. Vuelva a colocar la cubierta de la placa base y apriete suavemente la placa baseEl tornillo de ajuste.
- Devuelva el animal a la jaula de casa hasta la próxima sesión de grabación. Utilice las imágenes de fluorescencia de referencia como guía para que las siguientes sesiones de formación de imágenes vuelvan al mismo campo de visión.
6. Evaluación de los datos de formación de imágenes de Ca 2+ a gran escala
- Para extraer la localización celular y la dinámica de Ca 2 + dentro del campo de visión a partir de datos, se pueden utilizar diferentes plataformas de análisis de datos. Mosaic, una plataforma de análisis de datos diseñada específicamente para procesar a gran escala Ca 2 + películas de imágenes se ha utilizado para este estudio aquí.
- Rectificar píxeles defectuosos e interpolar cualquier fotogramas individuales en las películas sin procesar en el paso de preprocesamiento. Bin las imágenes en el espacio desde el campo de visión de 1.440 x 1.080 píxeles a 720 x 540 píxeles para reducir la huella de datos.
- Para corregir los artefactos de movimiento en el cerebro con respecto al sensor de imagen del microscopio, registre las películas usando una imagen basada en ImageJAlgoritmo de registro (TurboReg).
- Para identificar las neuronas individuales, re-expresar las imágenes como cambios relativos en la fluorescencia ΔF / F 0 = FF 0 / F 0 donde F 0 es la media de la imagen obtenida mediante el promedio de toda la película.
- Identificar los filtros espaciales correspondientes a las células individuales utilizando un algoritmo establecido de clasificación de células. Aquí hemos utilizado el análisis de componente principal e individual 21 para identificar las neuronas individuales.
NOTA: Se especificó un evento cuando la amplitud máxima de un evento en una traza era más de 8 desviaciones estándar de la línea de base de la traza en nuestro conjunto de datos y la ubicación de la celda y los datos de dinámica de Ca2 + se exportaron para análisis adicionales.
Resultados
El protocolo descrito aquí describe una manera eficaz y eficiente para realizar longitudinal de múltiples capas Ca 2 + imágenes de cientos de neuronas corticales en libremente comportarse ratones utilizando prisma sondas ( Figura 1 ]. Los enfoques previos hacia la formación de imágenes corticales multicapa se han limitado principalmente a los animales fijos 22 , 23 , 24 , 25 , 26 , 27 . Con el fin de adquirir este nivel de datos en un contexto de libre comportamiento, una plataforma de microscopio miniaturizado se utilizó para la flexibilidad de comportamiento, Se usó un indicador de calcio codificado genéticamente (GCaMP6f) para dirigir una población celular específica (células CAMKII + en la corteza); Y se eligió una sonda de prisma para proporcionar un campo crónico de visión de múltiples capas.
Hemos demostrado el flujo de trabajo para la preparación del animal para la obtención de imágenes. Se inyectó un vector viral que codifica un indicador de calcio apropiado en la corteza ( Figura 2 , Paso 1), antes de implantar crónicamente una sonda de prisma para permitir el acceso óptico a las células marcadas ( Figura 2 , Etapa 2). Una placa base que sirve como muelle temporal seguro para la colocación del microscopio durante las sesiones de formación de imágenes se instaló entonces sobre la cabeza del animal ( Figura 2 , Paso 3), permitiendo la visualización de la actividad cortical a través de múltiples capas celulares en un comportamiento despierto experimental ( Figura 2 , Paso 4).
Para asegurar que la población celular deseada estaba siendo dirigida, en la Figura 3 se muestra una sección cerebral coronal post-mortem de un ratón representativo, con el tracto de sonda prismática y el campo de visión marcados con respecto al laboratorio GCaMP6fEled neuronas en las capas 2/3 y 5 de la corteza somatosensorial.
Durante el estado de vigilia, la actividad de las neuronas corticales somatosensoriales se registró cuando el ratón fue expuesto a tres entornos diferentes: campo abierto (día 1), familiarización con el objeto (día 2-4) y objeto novel (día 5) ( Figura 4 ). El día 1 el ratón fue colocado en un campo de comportamiento carente de cualquier objeto. El día 2-4 el ratón fue colocado en la arena con los mismos dos objetos texturalmente diferentes (una almohadilla de gel y un bloque de madera). El día 5, uno de los objetos fue reemplazado por un objeto nuevo. El animal se formó imágenes a lo largo de 5 días durante 20 minutos cada día.
Después de la extracción celular utilizando el software de análisis de datos de imagen Ca2 + , se superpusieron filtros espaciales correspondientes a las ubicaciones de células en la proyección de intensidad fluorescente media de los datos de registro de microscopio( Figura 5) . Una línea discontinua blanca separa las capas 2/3 y 5 células. Correspondientes Ca 2 + trazas a partir de 5 células de cada una de las capas muestran el patrón de disparo de las células en dos contextos de comportamiento diferentes - objeto familiarización y novela objeto exposición. Las células de la capa 2/3 eran más activas en comparación con las células de la capa 5 el día en que el ratón fue expuesto a un objeto nuevo. Esto también es evidente a partir de los diagramas de trama que muestran la actividad de activación umbral de todas las células de imagen en los días 1, 4 y 5.
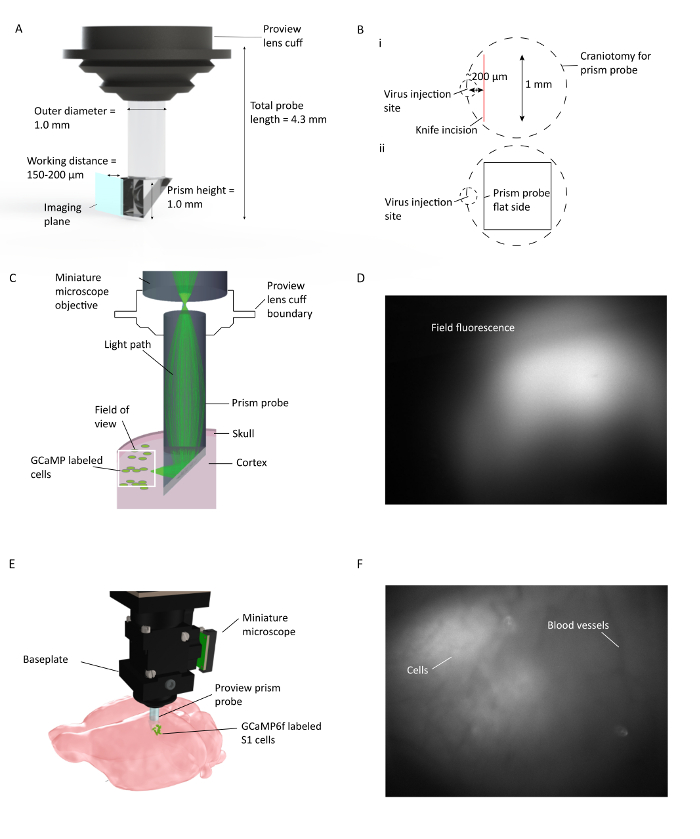
Figura 1: In Vivo Ca 2 + imágenes a través de múltiples capas corticales en movimientos libres de ratones. ( A ) Especificaciones de la sonda de prisma y representación del plano de imagen. El recubrimiento reflectante en el interior de la hipotenusa permite la formación de imágenes 90 ° desde el plano de inserción de la sonda de prisma. La lente cuFf se integra con el soporte de la lente, lo que agiliza el procedimiento de implantación y permite la visualización potencial de la fluorescencia del tejido ambiental durante la implantación ( B ) (i). Ilustración de la colocación de la craneotomía con sonda de prisma y la incisión del cuchillo en relación con el sitio de inyección del virus, y (ii) la ilustración de la localización del lado plano de la sonda del prisma con respecto a la incisión del cuchillo y el sitio de inyección del virus. ( C ) Ilustración de la configuración de formación de imágenes de Ca 2+ in vivo que muestra el recorrido de la luz para un área pequeña dentro del campo de visión completo a través de la sonda de prisma implantada en la corteza del ratón. ( D ) Ejemplo de campo de visión durante la instalación de la sonda de prisma. Microscopio en miniatura se une al soporte de la lente, que contiene la sonda de prisma que permite comprobar la expresión del virus durante la instalación de la sonda de prisma. ( E ) Integración de microscopio con sonda prismática para la obtención de imágenes corticales multicapa de células S1 marcadas con GCaMP6f. F Ejemplo de campo de visiónDurante la instalación de la placa base. El patrón transparente de vasos sanguíneos es visible en el momento de la instalación de la placa base con algunas células en imagen cruda. Más células son claramente visibles cuando se activa DF / F en la ventana del software de adquisición. Haga clic aquí para ver una versión más grande de esta figura.
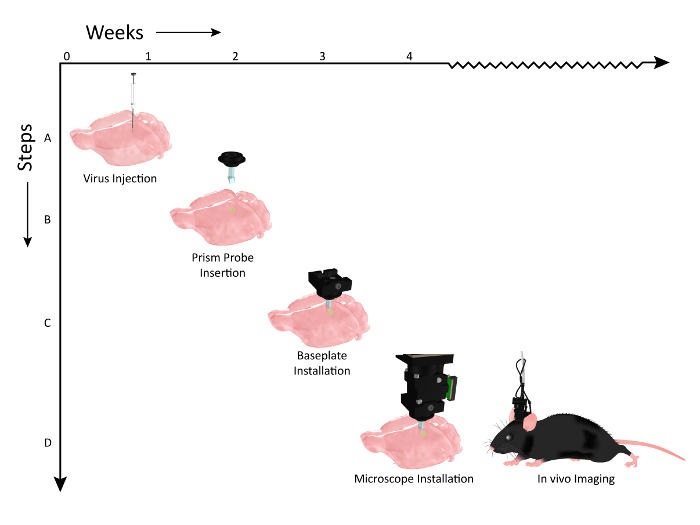
Figura 2: Esquema que muestra la línea de tiempo de los eventos de flujo de trabajo para la implantación de la sonda de prisma y la instalación de microscopio. El número de semanas se representa en el eje X y los pasos del flujo de trabajo de los procedimientos a lo largo del eje Y. ( A ) Gráfico que ilustra la inyección viral (AAV1.CaMKII.GCaMP6f.WPRE.SV40) a lo largo del mismo eje dorso-ventral, para etiquetar múltiples capas de la corteza somatosensorial del ratón. ( B ) 2 semanas después de las inyecciones de virus, un problema de prismaE se implanta en un eje que es paralelo a los sitios de inyección de virus. ( C ) Aproximadamente una semana después de la implantación de la sonda de prisma, se comprueba la expresión del animal con el microscopio y se monta una placa de base en la cabeza si una población de células es visible. ( D ) El animal está entonces listo para la imagen crónica durante las tareas de comportamiento relevantes (Clip art de ratón modificado después de permiso de UW-Madison Bioquímica MediaLab). Haga clic aquí para ver una versión más grande de esta figura.
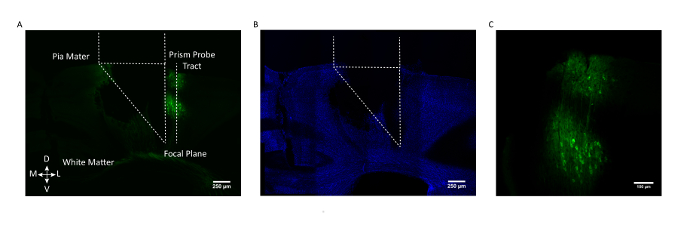
Figura 3: Validación histológica postmortem de la localización de la sonda de prisma y expresión de GCaMP. ( A ) Sección coronal de un cerebro de ratón representativo que muestra el tramo de la sonda prismática y con su lado de formación de imágenes enfrentadoLas células que expresan GCaMP6f (AAV1.CaMKII.GCaMP6f expresadas en neuronas en las capas 2/3 y 5). ( B ) La misma sección coronaria cerebral después de la tinción para DAPI. Barra de escala = 250 μm ( C ) Visualización ampliada de las células que expresan GCaMP6f en la corteza somatosensorial. Barra de escala = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
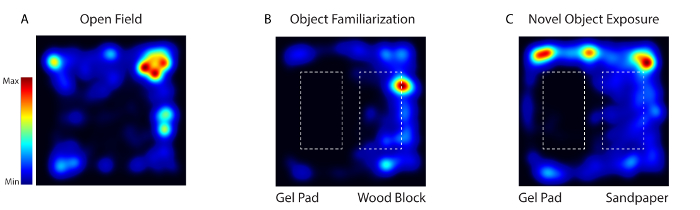
Figura 4: La actividad del ratón durante la habituación, la familiarización y la prueba de exposición de objetos noveles fue rastreada mediante video utilizando software de vídeo. ( A ) El día 1, el animal fue colocado en un campo de comportamiento desprovisto de cualquier objeto (Campo Abierto). ( B ) En los días 2-4, se colocaron los mismos dos objetos texturalmente diferentes (almohadilla de gel y bloque de madera) en la arena (Object FamiLiarización). ( C ) El día 5, uno de los objetos fue reemplazado por un objeto novedoso (bloque de madera con papel de lija) (Novel Object Exposure). Haga clic aquí para ver una versión más grande de esta figura.
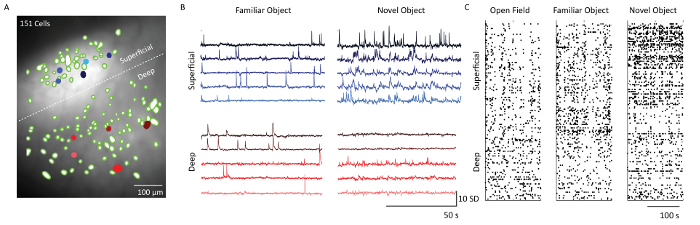
Figura 5: Dinámica de calcio de capas superficiales y profundas de la corteza somatosensorial de un ratón representativo de imágenes con el microscopio. ( A ) Imagen fusionada de filtros espaciales neuronales (manchas verdes) y proyección de intensidad de fluorescencia media de la grabación del microscopio a través del campo de visión de la sonda prismática. Frontera entre capas supragranulares e infragranulares indicadas por una línea blanca discontinua. Barra de escala = 100 μm. ( B ) Trazas de calcio de cinco células superficiales y profundas de capa de ejemplo (llena azul y rojo cElls en el panel A), indicando unidades de desviación estándar de fluorescencia siguiendo el análisis de componente principal y independiente. Barra de escala horizontal 50 s y barra de escala vertical 10 SD ( C ) Gráfica ráster de las células de capas superficiales (capas 2/3) y profundas (capa 5) mostradas sobre Campo abierto, Familiarización de objetos y Exploración de objetos noveles. Barra de escala = 100 s. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La comprensión de la actividad del circuito neural durante el comportamiento despierto es un nivel vital de investigación neurocientífica necesaria para diseccionar eficazmente la función cerebral en la salud y la enfermedad. La corteza es una región particularmente importante para estudiar en el contexto del comportamiento despierto, ya que desempeña un papel importante en muchas funciones sensoriales, cognitivas y ejecutivas vitales 28 , 29 .
Se cree que la columna cortical es la unidad funcional básica en la corteza y se sabe que la actividad a nivel de población de las células corticales difiere en función de su ubicación física dentro de la columna. Por ejemplo, las neuronas excitatorias en capas 2/3 en la corteza somatosensorial se proyectan principalmente a otras regiones neocorticales y modulan otras redes corticales 30 , mientras que las células en capas más profundas se proyectan principalmente a regiones subcorticales como el tálamo 31 . Registro de la actividad de cienS de las células corticales preespecificadas simultáneamente y de forma fiable a lo largo del tiempo a través de diferentes láminas en sujetos que se comportan libremente, mejorarían considerablemente nuestra comprensión del flujo de información cortical, permitiendo una más fina disección funcional de las columnas corticales informadas por información conductual en tiempo real, escamas.
La recopilación de este nivel de datos de circuitos neuronales se hace posible con el uso de una plataforma de microscopía miniaturizada eficiente y aerodinámica para llevar a cabo la formación de imágenes de Ca 2+ a gran escala en sujetos que se comportan libremente (o sujetos fijados a la cabeza según se desee). Utilizado con los indicadores de calcio genéticamente codificados para permitir la focalización específica de tipo celular y la obtención de imágenes de un campo de visión de múltiples capas proporcionado por una sonda de prisma crónicamente implantada, este protocolo exploró un caso entre muchas aplicaciones posibles: observar diferencias laminares en procesamiento cortico somatosensorial cuando ratones Físicamente comprometido con un objeto novedoso ( Figura 5 ).Esta es la primera ilustración procedural de este tipo de método específico de tipo celular in vivo para estudiar múltiples capas corticales en animales despiertos y que se comportan libremente y amplía el espectro de métodos experimentales disponibles para comprender las estructuras laminares en el cerebro activo.
El campo de visión periscópico habilitado por la sonda de prisma en esta técnica puede aplicarse de manera factible a otras estructuras cerebrales cuando se desea la preservación del tejido directamente dorsal a una región de interés; Por ejemplo, la obtención de imágenes CA3 podría lograrse sin interrupción de la función del hipocampo.
El enfoque basado en la sonda de prisma para la obtención de imágenes de la actividad de Ca 2+ requiere la inserción física y la implantación permanente de un microprisma en la corteza, lo que equivale a la creación de una lesión cortical donde se inserta la sonda de lente. Esto puede resultar en interrupciones de los circuitos neuronales locales, incluyendo el corte de dendritas apicales y procesos. TSu procedimiento también causará una activación inicial de las células gliales en la región, aunque se espera que esté localizada en el tejido a unos 150 μm de la cara del prisma, y que se disipe después de que el cerebro haya cicatrizado 22 . Es muy importante considerar si esta técnica afectará la anatomía normal del circuito y / o el comportamiento de los animales al planear experimentos. Siempre deben llevarse a cabo grupos de control conductual para asegurar que no haya alteraciones significativas en los comportamientos basales que podrían producir resultados confundidores experimentales.
Utilizando esta técnica miniaturizada de imágenes de Ca 2+ móvil con manipulación neurofarmacológica, diversos paradigmas cognitivos, sociales, motores o intrínsecos de comportamiento, y combinándolo con otras métricas fisiológicas pueden profundizar y enriquecer los estudios enfocados en la comprensión de los roles funcionales de los circuitos neuronales en el comportamiento y la señal Procesamiento 32 . Supresión o activaciónLa modificación de ciertas vías moduladas por fármacos puede influir en comportamientos asociados, que pueden ser fácilmente estudiados utilizando esta tecnología 33 . Ramificación en diferentes tipos de células mediante la modificación de la orientación del indicador de calcio es otra aplicación potente y útil, y permite muchas combinaciones creativas de herramientas experimentales para abordar diversas preguntas del circuito neuronal.
Divulgaciones
Los autores han leído la política de la revista y tienen los siguientes intereses en competencia: SG, SO y VC son empleados pagados en Inscopix.
Agradecimientos
Los autores desean agradecer a V. Jayaraman, DS Kim, LL Looger y K. Svoboda del Proyecto GENIE (Genetically-Encoded Neuronal Indicator and Effector) en el Campus de Investigación Janelia del Instituto Médico Howard Hughes por su generosa donación de AAV1-GCaMP6f A la Universidad de Pennsylvania Vector Core. También les gustaría dar las gracias al A. Olson y Neuroscience Microscopy Core en la Universidad de Stanford apoyado por NIH NS069375 subvención para sus servicios de microscopía confocal.
Materiales
| Name | Company | Catalog Number | Comments |
| Neurostar Motorized Ultra Precise Small Animal Stereotaxic Instrument | Kopf | Model 963SD | Surgery |
| Stereoscope | Labomed | Prima DNT | Surgery and Imaging |
| Mini Rectal Thermistor Probe (.062"/1.6 mm diameter) - 1/4" Jack | FHC | 40-90-5D-02 | Surgery |
| Heating Pad 5 X 12.5 cm | FHC | 40-90-2-07 | Surgery |
| DC Temperature Controller | FHC | 40-90-8D | Surgery |
| Microsyringe Pump | World Precision Instruments | UMP3 model; serial 155788 F110 | Surgery |
| NanoFil 10 μL Syringe | World Precision Instruments | NANOFIL | Surgery |
| 35 G Beveled Tip Nanofil NDL 2PK | World Precision Instruments | NF35BV-2 | Surgery |
| Omnidrill35, 115 - 230 V | World Precision Instruments | 503598 | Surgery |
| Burrs for Micro Drill | Fine Science Tools | 19007-05 | Surgery |
| nVista | Inscopix | 100-001048 | Imaging |
| AAV1.CaMKII.GCaMP6f.WPRE.SV40 | Penn Vector Core | AV-1-PV3435 | Surgery |
| Ketoprofen | Victor Medical | 5487 | Surgery |
| Carprofen | Victor Medical | 1699008 | Surgery |
| Isoflurane | Victor Medical | 1001054 | Surgery |
| Gelfoam (Patterson Veterinary Supply Inc Gelfoam Sponge 12 cm x 7 mm) | Pfizer (Fisher Scientific) | NC9841478 | Surgery |
| Dumont #5/45 forceps | Fine Science Tools | 11251-35 | Surgery |
| Dumont #5 forceps | Fine Science Tools | 11251-30 | Surgery |
| Dissecting knives | Fine Science Tools | 10055-12 | Surgery |
| ProView Implant Kit | Inscopix | 100-000756 | Surgery and Imaging |
| ProView Prism Probe 1.0 mm-Dia. ~4.3 mm Length | Inscopix | 100-000592 | Surgery and Imaging |
| Kwik-Sil adhesive pack of 2 | World Precision Instruments | KWIK-SIL | Surgery |
| Kwik-Cast Sealant | World Precision Instruments | KWIK-CAST | Surgery and Imaging |
| Miniature Optical Mounting Post | Newport | M-TSP-3 | Imaging |
| Microscope Baseplate | Inscopix | BPL-2 | Imaging |
| Microscope Baseplate Cover | Inscopix | BPC-2 | Imaging |
Referencias
- McConnell, S. K. Development and decision-making in the mammalian cerebral cortex. Brain Res. 472 (1), 1-23 (1988).
- Kwon, S. E., Yang, H., Minamisawa, G., O'Connor, D. H. Sensory and decision-related activity propagate in a cortical feedback loop during touch perception. Nat. Neurosci. 19 (9), 1243-1249 (2016).
- Miller, E. K., Cohen, J. D. An integrative theory of prefrontal cortex function. Annu. Rev. Neurosci. 24, 167-202 (2001).
- Bailey, M. R., Simpson, E. H., Balsam, P. D. Neural substrates underlying effort, time, and risk-based decision making in motivated behavior. Neurobiol. Learn. Mem. 133, 233-256 (2016).
- Dehaene, S., Changeux, J. P. Reward-dependent learning in neuronal networks for planning and decision making. Prog. Brain Res. 126, 217-229 (2000).
- Ferenczi, E. A., et al. Prefrontal cortical regulation of brainwide circuit dynamics and reward-related behavior. Science. 351 (6268), aac9698(2016).
- Anomal, R. F., et al. Impaired Processing in the Primary Auditory Cortex of an Animal Model of Autism. Front. Sys. Neurosci. 9, 158(2015).
- Pauls, D. L., Abramovitch, A., Rauch, S. L., Geller, D. A. Obsessive-compulsive disorder: an integrative genetic and neurobiological perspective. Nat. Rev. Neurosci. 15 (6), 410-424 (2014).
- Ziv, Y., et al. Long-term dynamics of CA1 hippocampal place codes. Nat. Neurosci. 16 (3), 264-266 (2013).
- Jennings, J. H., et al. Visualizing hypothalamic network dynamics for appetitive and consummatory behaviors. Cell. 160 (3), 516-527 (2015).
- Betley, J. N., et al. Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature. 521 (7551), 180-185 (2015).
- Sun, C., et al. Distinct speed dependence of entorhinal island and ocean cells, including respective grid cells. Proc. Natl. Acad. Sci. 112 (30), 9466-9471 (2015).
- Kitamura, T., et al. Entorhinal Cortical Ocean Cells Encode Specific Contexts and Drive Context-Specific Fear Memory. Neuron. 87 (6), 1317-1331 (2015).
- Pinto, L., Dan, Y. Cell-Type-Specific Activity in Prefrontal Cortex during Goal-Directed Behavior. Neuron. 87 (2), 437-450 (2015).
- Cox, J., Pinto, L., Dan, Y. Calcium imaging of sleep-wake related neuronal activity in the dorsal pons. Nat. Comm. 7, 10763(2016).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nat. Protoc. 11 (3), 566-597 (2016).
- Hooks, B. M., et al. Organization of cortical and thalamic input to pyramidal neurons in mouse motor cortex. The J. Neurosci. 33 (2), 748-760 (2013).
- Masamizu, Y., et al. Two distinct layer-specific dynamics of cortical ensembles during learning of a motor task. Nat. Neurosci. 17 (7), 987-994 (2014).
- Rowland, D. C., Moser, M. -B. From cortical modules to memories. Curr. Opin. Neurobiol. 24 (1), 22-27 (2014).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nat. Methods. 8 (10), 871-878 (2011).
- Mukamel, E. A., Nimmerjahn, A., Schnitzer, M. J. Automated analysis of cellular signals from large-scale calcium imaging data. Neuron. 63 (6), 747-760 (2009).
- Andermann, M. L., et al. Chronic cellular imaging of entire cortical columns in awake mice using microprisms. Neuron. 80 (4), 900-913 (2013).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nat. Protoc. 9 (11), 2515-2538 (2014).
- Chia, T. H., Levene, M. J. In vivo imaging of deep cortical layers using a microprism. J. Vis. Exp. (30), (2009).
- Chia, T. H., Levene, M. J. Microprisms for in vivo multilayer cortical imaging. J. Neurophysiol. 102 (2), 1310-1314 (2009).
- Chia, T. H., Levene, M. J. Multi-layer in vivo imaging of neocortex using a microprism. Cold Spring Harb. Protoc. 2010 (8), pdb.prot5476 (2010).
- Low, R. J., Gu, Y., Tank, D. W. Cellular resolution optical access to brain regions in fissures: imaging medial prefrontal cortex and grid cells in entorhinal cortex. Proc. Natl. Acad. Sci. 111 (52), 18739-18744 (2014).
- Zeisel, A., et al. Brain structure. Cell types in the mouse cortex and hippocampus revealed by single-cell RNA-seq. Science. 347 (6226), 1138-1142 (2015).
- Hawrylycz, M., et al. Inferring cortical function in the mouse visual system through large-scale systems neuroscience. Proc. Natl. Acad. Sci. 113 (27), 7337-7344 (2016).
- Petrof, I., Viaene, A. N., Sherman, S. M. Properties of the primary somatosensory cortex projection to the primary motor cortex in the mouse. J. Neurophysiol. 113 (7), 2400-2407 (2015).
- Aronoff, R., et al. Long-range connectivity of mouse primary somatosensory barrel cortex. Euro. J. Neurosci. 31 (12), 2221-2233 (2010).
- Rogan, S. C., Roth, B. L. Remote control of neuronal signaling. Pharma. Rev. 63 (2), 291-315 (2011).
- Berdyyeva, T., et al. Zolpidem reduces hippocampal neuronal activity in freely behaving mice: a large scale calcium imaging study with miniaturized fluorescence microscope. PloS One. 9 (11), e112068(2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados