A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ترانزفاجينال شبكة الإدراج في نموذج أوفين
In This Article
Summary
يصف هذا البروتوكول زرع شبكة في الحاجز ريكتوفاجينال المبيض باستخدام تقنية شق مهبلي واحد، مع وبدون إدراج مبزل موجهة من الأسلحة رسو.
Abstract
يصف هذا البروتوكول شبكة الإدراج في الحاجز ريكتوفاجينال في الأغنام باستخدام تقنية شق المهبل واحد، مع وبدون إدراج مبزل موجهة من الأسلحة رسو. خضعت الأغنام باروس تشريح الحاجز ريكتوفاجينال، تليها إدخال زرع مع أو بدون أربعة رسو الأسلحة، وكلاهما مصممة لتناسب التشريح البيضاوي. وقد وضعت الأسلحة رسو في مكان باستخدام مبزل وتقنية "في الخارج". تم تمرير الأسلحة الجمجمة من خلال السدادة، غراسيليس، والعضلات المقربة ماغنوس. تم تثبيت الأسلحة الذيلية بالقرب من الرباط العجزي، من خلال عضلات العصعص. هذه التقنية تسمح لمحاكاة الإجراءات الجراحية التي أجريت في النساء الذين يعانون من هبوط الجهاز الحوض. يتم تحديد المساحات والعناصر التشريحية بسهولة. الجزء الأكثر أهمية من الإجراء هو إدراج مبزل الجمجمة، والتي يمكن أن تخترق بسهولة التجويف البريتوني أو أجهزة الحوض المحيطة بها. ثيs يمكن تجنبها من قبل تشريح خلف الصفاق أكثر شمولا وتوجيه مبزل أكثر أفقيا. تم تصميم هذا النهج فقط لاختبار تجريبي من الغرسات الجديدة في نماذج حيوانية كبيرة، كما يتم استخدام الإدراج الموجهة مبزل حاليا سريريا.
Introduction
يتم تشخيص هبوط الجهاز الحوض سريريا في نصف النساء اللائي لديهن على الأقل تسليم المهبل واحد، ولكن بشكل شخصي، فإنه يزعج نصف النساء عموما 1 . الدعامة الأساسية للعلاج هو إعادة الإعمار الجراحي باستخدام الأنسجة الأصلية أو مواد زرع، ولكن كل من هذه الأساليب له حدوده، بما في ذلك تكرار أو مضاعفات المحلية 2 ، 3 ، 4 . لم يتم بعد تحديد الغرسة المثالية؛ وبالتالي، هناك طلب مستمر على ابتكار المنتجات وتطوير خط أنابيب مناسب للتجريب قبل السريرية قبل إدخال منتجات وتقنيات جديدة إلى السوق. واحدة من الخطوات في هذا المسار هو التقييم التجريبي على نماذج حيوانية مناسبة 5 ، 6 . ومن الناحية المثالية، ينبغي أن تحاكي البيئات التشريحية والبيوميكانيكية والبيولوجية. عندما يتعلق الأمرe تقييم تجريبي من الغرسات الجديدة، وعادة ما يتم اختبارها أولا في نماذج أصغر، إما للتوافق مع الحياة الحيوية أو لإعادة بناء عيوب جدار البطن. وقد انتقد هذا النوع من التجارب، لأن الغرسات لا تدخل في مجال الاهتمام ( أي المهبل) 7 . نماذج الجراحة المهبلية هي أكثر ندرة، وبالتأكيد عندما يكون الهدف من التجربة لتوثيق الخصائص الميكانيكية الحيوية من إكسلانتس. لهذا السبب، كان هناك انتقال من الأرانب إلى الأغنام 8 . النعاج الكبار هي نماذج الحيوانات الكبيرة مع المهبل الحجم معقول ويمكن الوصول إليها. ويمكن استخدامها لتقييم منتصف المدة للزرع الجديدة، ويمكن إعادة إنتاج التعرض المهبلي مع مواد معينة 9 ، 10 ، 11 ، 12 ، 13 . ليس فقط الأبعاد والتشريحمن المهبل البيضاوي وأرضية الحوض مماثلة لتلك الموجودة في البشر، ولكن أيضا حدوث عفوية من هبوط، والذي يحدث في 15٪ من النعاج. إن هبوط عوامل الخطر متداخلة ( أي التعدد، والتاريخ السابق للملوثات العضوية الثابتة، وزيادة الضغط داخل البطن الناجم عن ارتفاع وزن الجسم أو عند الرعي على التلال، والآثار القابلة للمقارنة للإستروجينات النباتية) 6 ، 14 . في أوروبا، الأغنام هي البديل المعقول الوحيد، حيث أن الأبحاث على الرئيسيات غير البشرية قد حظرت تماما تقريبا. هنا، تم اتخاذ نموذج خطوة أخرى أبعد من ذلك عن طريق محاكاة إدخال ترانسفاجينال من يزرع باستخدام تروكارس وأدلة للتوضع خالية من التوتر تنسجم في الحاجز المستقيم المهبلي. وأعقب ذلك تحديد زرع باستخدام رسو مع الأسلحة من خلال أربطة العضلات، والتي يمكن اعتبارها تعادل الممارسة السريرية 15 ، 16 . حتى الآن، هذه التقنيةعلى الرغم من أن الكثيرين يعتقدون أن مضاعفات محددة قد تحدث بسبب استخدام هذه الشرائط الأطول و / أو ثقب الهياكل التشريحية.
في دراسة تشريحية مفصلة في وقت سابق، تمت مقارنة أرضية حوض الحوض مع الحوض الأنثوي 17 . عندما يتعلق الأمر بترسيخ الغرسة، لا تملك الأغنام الرباط العجزي، إلا أنها تتمتع برباط كيسيرتوبيروس واسع التطور. العصب بودندال يمتد بطني أكثر من ذلك، مما يجعل من غير آمنة لاستخدام هذا المعلم كنقطة تعليق. على العكس من ذلك، العضلة العصعصية ولفافة، وكذلك الغشاء المسد، يمكن الوصول إليها من خلال الفضاء ريكتوفاجينال. هنا، ويقترح الوصول وموقف الهياكل التشريحية لتثبيت الأسلحة رسو. وتناقش الأدوات التي يمكن استخدامها لوضع شبكة. وأخيرا، فإن العلاقة بين الأسلحة أو تروكارس إلى الهياكل التشريحية المجاورة، مثل السفن والأعصاب، وs وكذلك المضاعفات المحتملة أثناء العملية، كما وصفها.
Protocol
تم الحصول على الموافقة الأخلاقية لهذه التجربة من لجنة الأخلاقيات للتجربة الحيوانية من جامعة ليوفن (P065 / 2013). تم التعامل مع الحيوانات وفقا للمبادئ التوجيهية الوطنية الحالية بشأن رعاية الحيوان.
1. المواد والحيوان التجريبي
- إعداد الجراحة
- في الجراحة المسرح تغطية طاولة مع ثنى العقيمة وإعداد مبطن معقمة واحدة معقمة ( الشكل 1 ، لوحة A)، والأدوات الجراحية المعقمة، والغرز، والشاش العقيمة. إجراء الإجراء الجراحي بأكمله في ظروف معقمة إذا كانت التجربة تشمل المتابعة. وضع جميع الصكوك على الطاولة لتكون جاهزة للاستخدام أثناء الجراحة.
- إزالة زرع مستطيلة معقمة و / أو زرع مع رسو الأسلحة من حزمة معقمة ووضعها على الطاولة مغطاة ثنى العقيمة ( الشكل 1B ، C، و D ).
FO: المحافظة على together.within الصفحات = "1"> 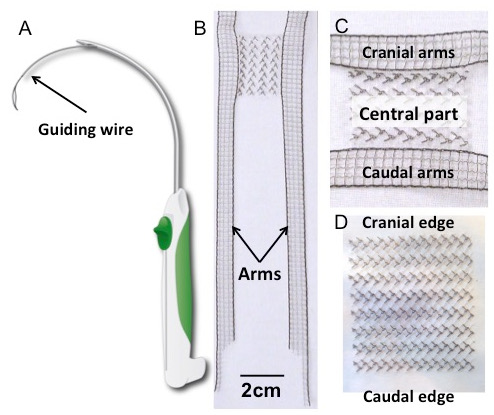
الشكل 1: البزل والزرع. ( A ) تخطيطي، التخطيط، بسبب، ال التعريف، تروكار. ( B ) على شكل H فلوريد البولي فينيلين (بفدف) زرع، مع تفاصيل من الجزء المركزي (لوحة C ). شكله مستوحى من تنسجم أربعة الذراع المتاحة حاليا لإصلاح هبوط المهبل. يتم تمديد الجسم المستطيل (30 × 40 مم 2 ) أفقيا بأربعة أذرع ممدودة (150 × 10 مم 2 ). تم تصميم أبعاد الأسلحة لتكون طويلة بما فيه الكفاية لكسر هياكل التعليق ذات الصلة، استنادا إلى الدراسات التشريحية السابقة 17 . ( D ) زرع مستطيلة (30 × 40 مم 2 ). كل من يزرع مصنوعة من فلوريد البولي فينيل؛ خصائص النسيج والخصائص في الجدول 1 .
- حيوان تجريبي (إوه، 45-60 كجم)
- إدارة التخدير من 1 مل من 15 ملغ / مل كبريتات الأتروبين و 1 مل / 50 كجم من زيلازين هكل العضل (إم) 30 دقيقة قبل إجراء العمليات الجراحية.
- بعد 30 دقيقة، تأكد من أن التخدير جعلت الأغنام الخمول والنعاس.
- إدراج قسطرة في الوريد في الوريد الوداجي وإدارة 0.075 مل / كغ من الكيتامين 100 ملغ / مل حمض الهيدروكلوريك. تأكيد التخدير العميق من خلال مراقبة عدم وجود رد فعل على المحفزات المؤلمة.
- نقل الحيوان على الطاولة الجراحية وتأمين الشعب الهوائية عن طريق التنبيب. الحفاظ على التخدير مع 2.5٪ إيسوفلوران في 5 L / دقيقة الأكسجين.
- الحفاظ على خط الوريد إدراجها في الوريد الوداجي وتوريد 500 مل من محلول ملحي بمعدل تدفق 150 مل / ساعة.
- إدارة المضادات الحيوية وقائية إم (أموكسيسيلين كلافولانات، 7 ملغ / كغ) والمسكنات ما بعد الجراحة (بوبرينورفين والكلوروكرسول، 1 مل) أو ما يعادلها وفقا للبروتوكولات المحلية.
- وضع الحيوان في مضاءةموقف هوتومي على نهاية الجدول الجراحي وتأمين أطرافه، مع الوركين في فرط الانثناء، وذلك باستخدام الحبال ( الشكل 2 ، لوحة A).
- تفريغ المثانة والمستقيم يدويا عن طريق الضغط عليها عبر المهبل.
- يحلق العجان، الجزء الإنسي من الفخذ، والذيل طيات وتطهير مع بوليفيدون أيوديوم 7.5٪ ( الشكل 2 ، لوحة B و C).
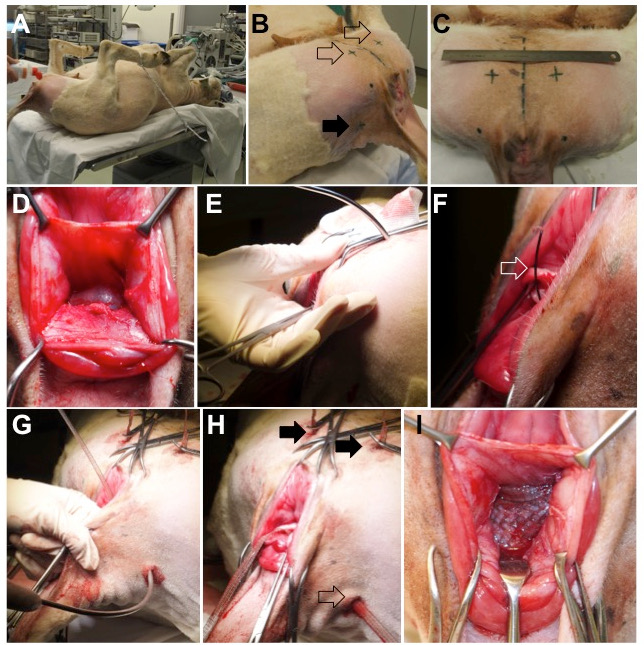
الشكل 2: جراحة الحيوان. ( A ) الأغنام وضعت في موقف ضعيف، مع الوركين فرط فليكسد من خلال تأمين الأطراف السفلية. ( ب ) نقاط الدخول الخارجية لإدراج مبزل هي على الجانب البطني (السهم الفارغ) وظهريا على طيات الجانبية الذيل (السهم الكامل). ( C ) موقف نقاط الإدراج بطني. يمثل خط متقطع في الوسطال التعريف، ميدساجيتال، حلق، بسبب، ال التعريف، أنيمال. ( D ) تشريح ريكتوفاجينال الحاجز. ( E ) إدراج مبزل بطني من خلال العضلات على الجانب الإنسي من الفخذ، الثقبة المسدة، ومساحة بارافاجينال. يتم التحكم في مسار بزل خارقة مع الاصبع. ( f و g ) مرة واحدة في مبزل في مكان، سلك حبال (فتح السهم) متقدمة ومحملة الذراع من شبكة المهبل. ( H ) الموقف النهائي للبطني (الأسهم الكاملة) والظهرية (السهم فارغة) الأسلحة. ( I ) يتم وضع الجزء المركزي التوتر خالية بين الجدار المهبلي و أدفنتيتيا المستقيم.
- إعداد الموظفين لعملية جراحية في ظروف معقمة. وضع على غطاء الجراحية وقناع الفم، وغسل اليدين لعملية جراحية، ووضع على ثوب الجراحية والقفازات المعقمة.
- تغطية الحيوان مع ثنى عقيمة وجعل افتتاح فوق الأعضاء التناسليةتوقف.
2. الإجراء الجراحي
- إعداد الحاجز ريكتوفاجينال
- فهم الجدار المهبلي الظهري 3 سم الجمجمة إلى حلقة النسجية باستخدام ملقط أليس.
- خذ حقنة محملة 10 مل من المياه المالحة ومزودة إبرة 22 G. إدراجه من خلال ظهارة المهبل (حوالي 3-4 ملم عميق) وفي خط الوسط من الحاجز ريكتوفاجينال، 1.5 سم الجمجمة إلى حلقة النسجية.
- أداء "المائية تشريح" عن طريق حقن المياه المالحة في الحاجز ريكتوفاجينال 11 .
- جعل شق خط الوسط 3 سم طويلة على ظهارة المهبل، بدءا الذيلية إلى ملقط أليس (الخطوة 2.1.1) وتنتهي في حلقة النسجية باستخدام مشرط. أدخل الفضاء المستقيم المهبلي من خلال هذا شق.
- وضع ضام الإبقاء على النفس (انظر جدول المواد ) على العجان ووضع أربعة السنانير إقامة حادة في شق المهبل للحفاظ على فتحه.
- بإصبعك، تشريح بصراحة اللفافة المستقيم المهبلي من جدار المهبل أفقيا نحو الجدران الجانبية الحوض و كرانيالي تصل إلى الجانب الذيلية من طريق مسدود دي الكيس. خلق مساحة مناسبة لل 30 × 40 مم 2 الجزء المركزي للشبكة ( الشكل 2 ، لوحة D).
- أداء الارقاء مع ملقط هيموستاتيك أو ربطة متقابلة الأرقاء كلما لزم الأمر.
ملاحظة: يمكن أن تكون مثبتة صغيرة بليدرز مع ملقط مرقئ. هذا يسحق السفينة ويبدأ سلسلة التخثر الطبيعي. للحصول على نزيف أقوى، فهم السفينة النزيف مع ملقط ووضع رباط متقاطع، وتأمين ذلك مع عقدة مربع. عند هذه النقطة، يمكن للمرء إما إدراج زرع مستطيلة (الخطوة 2.2) أو الاستمرار مع تشريح لإدراج الغرسة مع رسو الأسلحة (الخطوة 2.3).
- شقة شبكة الإدراج
- إدراج مثبط المهبل في شق المهبل للسماح رؤية أفضل منالجزء القحفي، بسبب، ال التعريف، تشريح، أريا.
- خياطة الزاوية اليسرى واليسرى الجمجمة من الزرع مع توقف بسيط 3/0 خياطة البولي بروبلين على الجانبين الأيسر والأيمن من الجانب الأكثر الجمجمة من الفضاء المستقيم الشرجي المهبل. قطع المواد خياطة المتبقية. الحفاظ على خياطة بعيدا عن التجويف المهبلي ( أي، لا تخترق جدار المهبل).
ملاحظة: يتم خياطة الغرسة دائما إلى النسيج الضام تشمل الحاجز المستقيم المهبلي. لا يتم اختراق جدار المهبل إذا كان لا يمكن أن ينظر إلى المواد خياطة في المهبل. - إضافة واحدة إضافية بسيطة خياطة توقف في منتصف الطريق على طول الجانب الجمجمة من الزرع.
- خياطة الحواف الجانبية للزرع في منتصف الطريق على النسيج الضام المحيطة مع بسيطة توقف 3/0 البولي بروبيلين. إبقاء الزرع مسطحة قدر الإمكان والتوتر خالية.
- خياطة الزوايا الذيلية اليسرى واليمنى مع بسيطة توقف 3/0 خيوط البولي بروبلين على اليسار واليمينجانبي الجانب الأكثر الذيلية من الفضاء ريكتوفاجينال.
- إضافة واحدة إضافية بسيطة خياطة توقف في منتصف الطريق على طول الجانب الذيلية من الزرع.
- إغلاق الشقوق المهبلية مع تشغيل 3/0 بوليغلاكتين خياطة.
- إدراج وترسيخ زرع بالأسلحة (تقنية موجهة مبزل).
- مواصلة تشريح الفضاء المستقيم المهبلي التي تم إنشاؤها في الخطوة 2.1 كرانيو بطني للوصول إلى الجانب الإنسي من الثقبة السدادة، والتي يمكن بسهولة أن جس.
- تشريح الفضاء كودو-أفقيا للوصول إلى الجانب الذيلية من الرباط المقدسة والعضلة العصعصية تقع كاوديجيوس.
- مع لا. 24 شفرة، وجعل أربعة شقوق 1 سم واسعة على الجانب الفرج، وقطع من خلال الجلد والسطحية العضلة اللفافة ( الشكل 2 ، لوحة B و C).
- جعل اثنين من "بطني" الشقوق على الجانب الإنسي من الفخذ، ما يقرب من 4 سم الجمجمة من الحدود الذيلية سو القوس الوركي ( أي ، الحدود السفلية من الارتفاق) و 3 سم الوحشي من خط الوسط ( الشكل 2 ، لوحة C).
- جعل اثنين من الشقوق "الظهرية" على مستوى إدراج طيات الذيل، 2 سم وسطي إلى درنة إسكياديكوم، والتي يمكن بسهولة جس ( الشكل 2 ، لوحة B).
- وضع مبزل منحني من خلال واحدة من الشقوق بطني ( الشكل 2 ، لوحة E).
- تمرير مبزل من خلال العضلة المقربة ماغنوس، السدادة الخارجي، والجانب الإنسي من الثقبة المسد.
- السيطرة على تطور مبزل مع إصبع إدراجها من خلال شق المهبل. توجيه طرفها إلى قوس الوترية من العضلة الرافعة الرافعة ( الشكل 2 ، لوحة E).
- فضح الأسلاك التوجيهية في شق الجدار المهبلي وتحميله مع المقابلة المماثل ذراع شبكة الجمجمة ( الشكل 2 ، لوحة F).
- سحب مبزل محملة مع مإيش الذراع من خلال الهياكل المذكورة أعلاه. إبقاء الذراع خالية من التوتر.
- كرر العملية مع الذراع الجمجمة الثاني من خلال شق بطني على الجانب الآخر من الحيوان.
- من خلال واحدة من الشقوق الظهرية، وتمرير مبزل من خلال العضلة العصعصية، فقط البعيدة إلى الرباط المقدسة ( الشكل 2 ، لوحة G).
- فضح سلك دليل من خلال شق المهبل، فهم الذراع الظهرية للشبكة، وسحب بها. الحفاظ على التوتر الذراع خالية وتكرار على الجانب الآخر.
- ضبط الموقف من شبكة عن طريق تسطيح وتطبيق التوتر على الأسلحة، ولكن الحفاظ على شبكة خالية من التوتر ( الشكل 2، لوحة I؛ الشكل 3 ).
- إصلاح الجسم من شبكة مع بسيطة توقف 3/0 خياطة البولي بروبيلين في منتصف الحدود الذيلية، وتأمينه إلى النسيج الضام المحيطة بها.
- قطع الأسلحة على مستوى الجلد وإغلاق جميع شقوق الجلد مع توقف بسيط 3/0 بوليجلخيوط ايكابرون ( الشكل 2 ، لوحة H).
- إغلاق شق المهبل مع تشغيل 3/0 بوليغلكابرون خياطة.
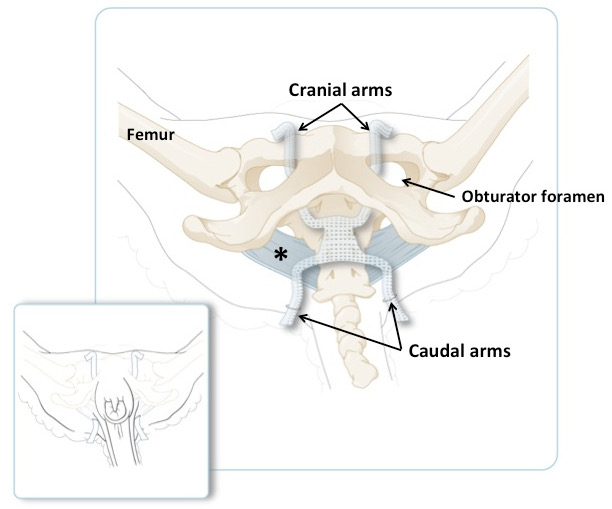
الشكل 3: رسم تخطيطي من الحوض أوفين، مع الأسلحة القحفية تمر عبر الثقبة السدادة والأسلحة الذيلية يمر من خلال طيات الذيل. الرباط العجزي العريض هو باللون الأزرق. لوحة أصغر يوضح موقف الأسلحة على حيوان في موقف راقد، قبل تقصير كمية مفرطة من المواد. تظهر اللوحة الرئيسية نفسها ولكن مع إزالة الجلد والعضلات.
النتائج
الإدارة في إعداد مراقبة أطول
بعد إجراء العمليات الجراحية، قد يتم إدخال التعبئة المهبلية (حزمة شاش منقوعة من محلول ملحي تم إدخالها في المهبل مباشرة بعد الجراحة) لمدة 24 ساعة لتأمين موضع...
Discussion
هنا، وصفنا إجراء تجريبي في الأغنام، تهدف إلى تقليد تشريح المهبل وإدخال شبكة عبر المهبل من زرع مع أو بدون رسو الأسلحة. وقد استلهمت الخطوات والصكوك اللاحقة من العمليات الجراحية التي أجريت ل بوب والإجهاد سلس البول 15 ، 16 ، 1...
Disclosures
تم دعم هذا البرنامج البحثي على نموذج الأوبئة بمنحة غير مشروط من مدري و بلاسينغام، بورش، غارارد وأشلي (أتلانتا غا، الولايات المتحدة الأمريكية). ويجري التعامل مع الاتفاقات عن طريق مكتب نقل البحوث والتنمية في ليوفين. لم يتدخل الرعاة في التخطيط أو التنفيذ أو الإبلاغ عن هذه التجربة، كما أنهم لا يمتلكون النتائج. و نس و ل مستلمين من منحة من المفوضية الأوروبية في إطار FP7 (بيب-أوبي المشروع؛ NMP3-لا-2012-310389). تم دعم التمويل الإضافي من خلال منحة من المفوضية الأوروبية في برنامج الشراكة الصناعية الأكاديمية (251356).
Acknowledgements
نشكر إيفان ليرمانز، روزيتا كينارت، آن ليسنس (مركز التكنولوجيات الجراحية، كو ليوفن، لوفين، بلجيكا). وقدم جو فيربينن وكريستوف رينيرز (معهد فيساليوس للتشريح، كلية الطب، جامعة ليوفن، لوفين، بلجيكا) الدعم التقني خلال التجربة. نشكر لين مورتيه للمساعدة في إدارة البيانات والمخطوطات. نشكر فيغ تكستيلتشنيكن لتصنيع تنسجم النموذج، وتعقيم لهم، والتبرع لهم دون قيد أو شرط للبحث.
Materials
| Name | Company | Catalog Number | Comments |
| Animals: | |||
| parous female sheep (45 - 65 kg) | Zoötechnical Institute of the KU Leuven | NA | experimetnal animal |
| Sterile clothing: | |||
| sterile drape 45 x 75 cm | Lohmann & Rauscher, Regensdorf, Germany | 33002 | other material |
| sterile OR drape 150 x 180 cm | Lohmann & Rauscher, Regensdorf, Germany | 33009 | other material |
| sterile glowes 2x | Lohmann & Rauscher, Regensdorf, Germany | 16652 | other material |
| sterile surgical gown 2x | Lohmann & Rauscher, Regensdorf, Germany | 19342 | other material |
| surgical head cap 2x | Lohmann & Rauscher, Regensdorf, Germany | 17427 | other material |
| surgical face mask 2x | Lohmann & Rauscher, Regensdorf, Germany | 11983 | other material |
| Other surgical material | |||
| implant | FEG Textiltechnik GmbH, Aachen, Germany | NA | purposely designed implant |
| 3/0 polypropylene suture | Prolene, Ethicon, Diegem, Belgium | 8762H | suture material |
| 3/0 polygecaprone suture | Vicryl, Ethicon | J311H | suture material |
| gauze swabs 10 x 10 cm 10x, 12-ply | Lohmann & Rauscher, Regensdorf, Germany | 11574 | other material |
| syringe 20 mL | Becton Dickinsosn S.A., Madrid, Spain | 300613 | aqua-dissection |
| needle 16 gauge | Terumo, Leuven, Belgium | NN-2238R | aqua-dissection |
| Surgical equipment: | |||
| blade no.22 | Fine science isntruments, Heidelberg, Germany | 10022-00 | surgical instruments |
| Allis tissue forceps 1x | Fine science isntruments, Heidelberg, Germany | 11091-15 | surgical instruments |
| Standart pattern forceps 1x2 theeth 1x | Fine science isntruments, Heidelberg, Germany | 11023-14 | surgical instruments |
| Standart pattern forceps straight serrated 1x | Fine science isntruments, Heidelberg, Germany | 11000-14 | surgical instruments |
| Scalpel handle 1x | Fine science isntruments, Heidelberg, Germany | 10004-13 | surgical instruments |
| Halstead-Mosquito forceps 2x | Fine science isntruments, Heidelberg, Germany | 13008-12 | surgical instruments |
| Standart pattern scissors 1x | Fine science isntruments, Heidelberg, Germany | 14001-14 | surgical instruments |
| Metzenbaum scissors 1x | Fine science isntruments, Heidelberg, Germany | 14016-18 | surgical instruments |
| Crile Wood needle holder 1x | Fine science isntruments, Heidelberg, Germany | 12003-15 | surgical instruments |
| Kell forceps 1x | Fine science isntruments, Heidelberg, Germany | 13018-14 | surgical instruments |
| Long Starr Self-Retaining Retractor with eight 5mm sharp stay hooks | Cooper Surgical, Tumbull, USA | 3704 | surgical instruments |
| Heaney Simon Vaginal Retractor | Medical supplies & equipments co., Katy, Texas, USA | 403-129FSI | surgical instruments |
| Trocar (Insnare) | Bard, West Sussex, United Kingdom | NA | any trocar on market for transvaginal mesh implantation |
| Medication: | |||
| amoxilicilline clavulanate 1000mg / 300 mL (Ampiciline) | GSK, Wavre, Belgium | NA | antibiotics |
| buprenorfin 0.3 mg/mL + chlorocresol 1.35 mg/mL (Vetregesic) | Ecuphar, Oostkamp, Belgium | NA | analgesia |
| ketamin HCL 100mg/mL (Ketamine 1000) | Ceva Sante Animale, Brussels, Belgium | NA | anesthesia |
| isoflurane (IsoFlo) | Abbott Laboratories Ltd, Maidenhead, Berkshire, UK | NA | anesthesia |
| polyvidone iodium 7.5% (Braunol) | B. Braun Medical, Machelen, Belgium | NA | local desinfection |
| saline solution 500ml | B. Braun Medical, Machelen, Belgium | NA | aqua-dissection |
| Xxylazine HCl , 1 mL/50 kg | Vexylan, Ceva Sante Animale, Belgium | NA | premedication |
| atropine Sulfate 15 mg/ml (), | Viatris, Belgium | NA | premedication |
References
- Glazener, C., et al. Childbirth and prolapse: Long-term associations with the symptoms and objective measurement of pelvic organ prolapse. BJOG An Int. J. Obstet. Gynaecol. 120 (2), 161-168 (2013).
- Jia, X., et al. Efficacy and safety of using mesh or grafts in surgery for anterior and/or posterior vaginal wall prolapse: systematic review and meta-analysis. BJOG. 115 (11), 1350-1361 (2008).
- Maher, C., et al. Transvaginal mesh or grafts compared with native tissue repair for vaginal prolapse. Review. 2 (2), 10-13 (2016).
- Nieminen, K., et al. Outcomes after anterior vaginal wall repair with mesh: a randomized, controlled trial with a 3 year follow-up. Am. J. Obstet. Gynecol. 203 (3), e1-e8 (2010).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: a review. Eur. J. Obstet. Gynecol. Reprod. Biol. 144, S146-S158 (2009).
- Couri, B., Lenis, A., Borazjani, A., Paraiso, M. F. R., Damaser, M. S. Animal models of female pelvic organ prolapse: lessons learned. Expert Rev. Obs. Gynecol. 7 (3), 249-260 (2012).
- Deprest, J., et al. The biology behind fascial defects and the use of implants in pelvic organ prolapse repair. Int. Urogynecol. J. Pelvic Floor Dysfunct. 17, S16-S25 (2006).
- Ozog, Y., Mazza, E., De Ridder, D., Deprest, J. Biomechanical effects of polyglecaprone fibers in a polypropylene mesh after abdominal and rectovaginal implantation in a rabbit. Int. Urogynecol. J. 23 (10), 1397-1402 (2012).
- Manodoro, S., et al. Graft-related complications and biaxial tensiometry following experimental vaginal implantation of flat mesh of variable dimensions. BJOG. 120 (2), 244-250 (2013).
- Endo, M., et al. Cross-linked xenogenic collagen implantation in the sheep model for vaginal surgery. Gynecol. Surg. , 113-122 (2015).
- Feola, A., et al. Host reaction to vaginally inserted collagen containing polypropylene implants in sheep. Am. J. Obstet. Gynecol. 212 (4), e1-e474 (2015).
- Barnhart, K. T., et al. Baseline dimensions of the human vagina. Hum. Reprod. 21 (6), 1618-1622 (2006).
- Tayrac, R., Alves, A., Thérin, M. Collagen-coated vs noncoated low-weight polypropylene meshes in a sheep model for vaginal surgery. A pilot study. Int. Urogynecol. J. Pelvic Floor Dysfunct. 18 (5), 513-520 (2007).
- Sobiraj, A., Busse, G., I, H. B. O. S. E. D. Ivastigation into the blood plasma profiles progesterone in sheep sufferingform vaignal inversion and prolapse. Br. Vet. J. 142 (142), 218-223 (1986).
- Reisenauer, C., Kirschniak, A., Drews, U., Wallwiener, D. Anatomical conditions for pelvic floor reconstruction with polypropylene implant and its application for the treatment of vaginal prolapse. Eur. J. Obstet. Gynecol. Reprod. Biol. 131, 214-225 (2007).
- Carey, M., Slack, M., Higgs, P., Wynn-Williams, M., Cornish, A. Vaginal surgery for pelvic organ prolapse using mesh and a vaginal support device. BJOG An Int. J. Obstet. Gynaecol. 115 (3), 391-397 (2008).
- Urbankova, I., et al. Comparative anatomy of the ovine and female pelvis. Gynecol. Obstet. Invest. , (2016).
- Maurer, M. M., Röhrnbauer, B., Feola, a., Deprest, J., Mazza, E. Mechanical biocompatibility of prosthetic meshes: A comprehensive protocol for mechanical characterization. J. Mech. Behav. Biomed. Mater. 40, 42-58 (2014).
- Leval, J. Novel Surgical Technique for the Treatment of Female Stress Urinary Incontinence. Transobturator Vaginal Tape Inside-Out. Eur. Urol. 44 (6), 724-730 (2003).
- Reisenauer, C., Kirschniak, A., Drews, U., Wallwiener, D. Transobturator vaginal tape inside-out. Eur. J. Obstet. Gynecol. Reprod. Biol. 127 (1), 123-129 (2006).
- Bafghi, A., et al. Bowel perforation as late complication of tension-free vaginal tape. J Gynecol Obs. Biol Reprod. 34 (6), 606-607 (2005).
- Hinoul, P., Vanormelingen, L., Roovers, J. P., de Jonge, E., Smajda, S. Anatomical variability in the trajectory of the inside-out transobturator vaginal tape technique (TVT-O). Int. Urogynecol. J. Pelvic Floor Dysfunct. 18 (10), 1201-1206 (2007).
- Schaller, O., et al. . Illustrated Veterinary Anatomical Nomenclature. , (2007).
- . Serious Complications Associated with Transvaginal Placement of Surgical Mesh for Pelvic Organ Prolapse. FDA Safety Communication. , (2016).
- Reinier, M., Groep, G. Final Opinion on the use of meshes in urogynecological surgery. SCENIHR- European Commission. , (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved