Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Вставка трансвагинальной сетки в модель овечки
В этой статье
Резюме
Этот протокол описывает имплантацию сетки в ревтовагинальную перегородку овчины с использованием единой вагинальной методики разреза, с и без троакаровской вставки якорных рычагов.
Аннотация
Этот протокол описывает вставку сетки в ректовагинальную перегородку у овец с использованием одной вагинальной методики разреза, с и без троакара вставки якорных рычагов. Парусные овцы подвергались рассечению ректовагинальной перегородки, после чего вводили имплантат с четырьмя крепежными плечами или без них, оба предназначенные для соответствия анатомии овец. Крепежные рычаги были установлены на место с использованием троакара и техники «снаружи». Руки черепа прошли через обтуратор, грацилис и притягивали мышцы мышц. Каудальные руки были закреплены рядом с сугробной связкой через мышцы копчика. Этот метод позволяет имитировать хирургические процедуры, выполняемые у женщин, страдающих пролапсом тазовых органов. Анатомические пространства и элементы легко идентифицируются. Наиболее важной частью процедуры является введение черепного троакара, который может легко проникать в брюшную полость или окружающие органы таза. ThiS можно избежать путем более обширной забрюшинной диссекции и путем направления троакара более латерально. Этот подход предназначен только для экспериментальных испытаний новых имплантатов на крупных животных моделях, так как в настоящее время троическая вставка не используется клинически.
Введение
Пролапс органов таза клинически диагностирован у половины женщин, у которых была хотя бы одна вагинальная родоразрешение, но субъективно она беспокоит половину женщин в целом 1 . Основой терапии является хирургическая реконструкция с использованием либо нативной ткани, либо материалов имплантатов, но каждый из этих методов имеет свои ограничения, включая рецидив или локальные осложнения 2 , 3 , 4 . Идеальный имплантат еще не идентифицирован; Следовательно, существует постоянный спрос на инновации продукта и на разработку надлежащего трубопровода для доклинических экспериментов до внедрения на рынок новых продуктов и технологий. Одним из этапов этого трека является экспериментальная оценка подходящих моделей животных 5 , 6 . В идеале они должны имитировать анатомическую, биомеханическую и биологическую среду. Когда дело доходит доE экспериментальной оценки новых имплантатов, они, как правило, сначала тестируются в небольших моделях, либо для биосовместимости, либо для восстановления дефектов брюшной стенки. Этот тип экспериментов был подвергнут критике, потому что имплантаты не вставляются в область интереса (то есть, влагалище) 7. Модели вагинальной хирургии более скудны, конечно, когда целью эксперимента является документирование биомеханических характеристик эксплантов. По этой причине произошел переход от кроликов к овцам 8 . Взрослые овцы - это модели с большим животным с достаточно широким и доступным влагалищем. Они могут использоваться для среднесрочной оценки новых имплантатов, и можно воспроизводить вагинальные экспозиции с помощью определенных материалов 9 , 10 , 11 , 12 , 13 . Не только размеры и анатомияОвальной влагалища и тазового дна сопоставимы с таковыми у людей, но также и спонтанное возникновение пролапса, которое возникает у 15% овец. Факторы риска пролапса накладываются друг на друга ( т. Е. Многополярность, предыдущая история СОЗ, повышенное внутрибрюшное давление, вызванное более высоким весом тела или при выпасе на холмах и сопоставимые эффекты (фито) эстрогенов) 6 , 14 . В Европе овец являются единственной разумной альтернативой, так как исследования о приматах, не являющихся людьми, почти полностью запрещены. Здесь модель была сделана еще на один шаг, имитируя трансвагинальную вставку имплантатов с использованием троакаров и направляющих для без растяжения сеток в ректо-вагинальную перегородку. За этим последовало закрепление имплантата с помощью фиксации с помощью рук через связки мышц, что можно считать эквивалентным клинической практике 15 , 16 . До сих пор эта техникаХотя многие считают, что могут возникнуть определенные осложнения из-за использования этих более длинных полос и / или прокалывания анатомических структур.
В более раннем детальном анатомическом исследовании тазовой пол тазобедренного сустава сравнивали с тазом женского пола 17 . Когда речь идет о закреплении имплантата, у овец нет священной связки, но у них есть очень хорошо развитая и широкая сугробная связка. Пудендальный нерв протекает по ней, что делает его небезопасным, чтобы использовать этот ориентир в качестве точки подвески. Напротив, мышца копчика и ее фасция, а также мембрана обтуратора доступны через ректовагинальное пространство. Здесь предлагается доступ и расположение анатомических структур для фиксации якорных рычагов. Обсуждаются инструменты, которые могут использоваться для размещения сетки. Наконец, связь оружия или троакаров с соседними анатомическими структурами, такими как сосуды и нервы,А также потенциальные интраоперационные осложнения.
протокол
Этическое одобрение для этого эксперимента было получено в Комитете по этике по экспериментам на животных KU Leuven (P065 / 2013). Животных обрабатывали в соответствии с действующими национальными рекомендациями по охране здоровья животных.
1. Материал и экспериментальное животное
- Хирургическая подготовка
- В хирургическом театре накрывают стол стерильной драпировкой и готовят один стерильный изогнутый троакар ( рис. 1 , панель А), стерильные хирургические инструменты, швы и стерильную марлю. Выполните всю хирургическую процедуру в стерильных условиях, если эксперимент включает последующее наблюдение. Поместите все инструменты на стол, чтобы они были готовы к использованию во время операции.
- Удалите стерильный прямоугольный имплантат и / или имплантат с закрепляющими рычагами из стерильной упаковки и положите их на стол, покрытый стерильной драпировкой ( рис. 1B , C и D ).
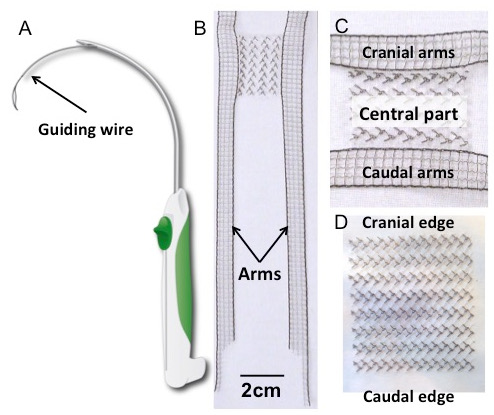
Рисунок 1: Трокарь и имплантаты. ( A ) Схематический рисунок троакара. ( B ) Имплантат H-образного поливинилиденфторида (PVDF) с деталью центральной части (панель C ). Его форма была вдохновлена четырьмя рукавами, которые в настоящее время доступны для трансвагинального лечения пролапса. Прямоугольное тело (30 x 40 мм 2 ) выдвигается сбоку четырьмя вытянутыми руками (150 x 10 мм 2 ). Размеры оружия рассчитаны на достаточно длительный срок, чтобы пробить соответствующие конструкции подвески, основанные на более ранних анатомических исследованиях 17 . ( D ) Прямоугольный имплантат (30 x 40 мм 2 ). Оба имплантата были изготовлены из поливинилиденфторида; Текстильные характеристики и свойства приведены в таблице 1 .
- Экспериментальное животное (EwД, 45-60 кг)
- Администрирование премедикации 1 мл 15 мг / мл атропина сульфата и 1 мл / 50 кг ксилазина HCl внутримышечно (им) за 30 минут до хирургической процедуры.
- Через 30 минут убедитесь, что премедикация сделала овец летаргической и сонной.
- Вставьте внутривенный катетер в яремную вену и введите 0,075 мл / кг кетамина 100 мг / мл HCl. Подтвердите глубокую анестезию, наблюдая отсутствие реакции на болезненные раздражители.
- Переместите животное на хирургический стол и закрепите его дыхательные пути интубацией. Поддерживайте анестезию с помощью 2,5% изофлурана в кислороде 5 л / мин.
- Держите внутривенную линию, вставленную в яремную вену, и поставьте 500 мл солевого раствора при скорости потока 150 мл / ч.
- Администрировать профилактические антибиотики im (амоксициллин клавуланат, 7 мг / кг) и послеоперационные анальгетики (бупренорфин и хлоркрезол, 1 мл) или эквивалент в соответствии с местными протоколами.
- Поместите животное в светлоеПоложение на столе в конце хирургического стола и закрепите его конечностями, с бедрами в гипергибкостях, используя веревки ( рис. 2 , панель A).
- Ручной пуст мочевого пузыря и прямой кишки, нажав на них трансвагинально.
- Бритья промежности, медиальной части бедра, а хвост складки и продезинфицировать поливидон натрия 7,5% ( рис. 2 , панель B и C).
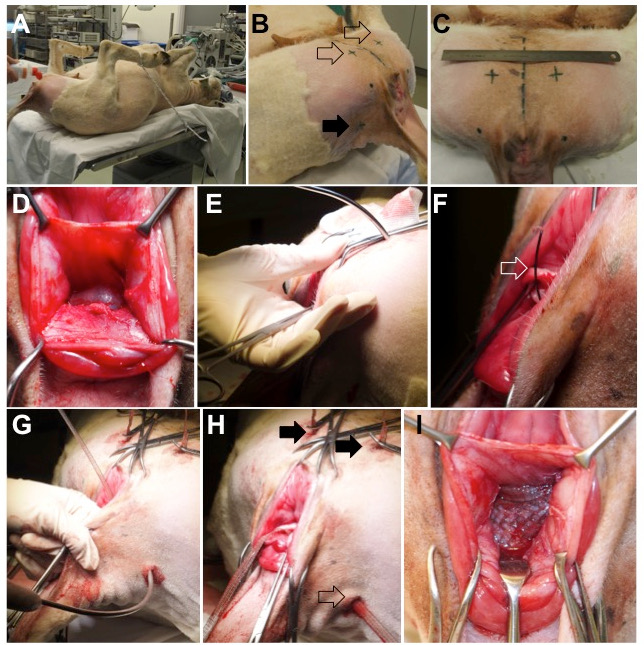
Рисунок 2: Хирургия животных. ( A ) Овечка помещается в положение лежа на спине, при этом бедра сгибаются, закрепляя нижние конечности. ( B ) Внешние входные точки для вставки троакара находятся на вентральной стороне (пустая стрелка) и дорсально на боковых хвостовых складках (полная стрелка). ( C ) положение точек вентральной вставки; Пунктирная линия в середине представляетМидагитальная плоскость животного. ( D ) Рассеянная ректовагинальная перегородка. ( E ) Вставка брюшного троакара через мышцы на медиальной стороне бедра, отверстие обтуратора и паравагинальное пространство. Траектория пирсингового троакара контролируется пальцем. ( F и G ). Когда троакар находится на месте, проводная стропа (стрелка открывания) продвигается и нагружается плечом вагинальной сетки. ( H ) Конечное положение вентральных (полных стрел) и дорсальных (пустых стрел) рук. ( I ) Центральная часть размещена без натяжения между стенкой влагалища и ректальной адвентицией.
- Подготовьте персонал для операции в стерильных условиях. Наденьте хирургическую крышку и маску для рта, вымойте руки для операции, наденьте хирургическое платье и стерильные перчатки.
- Накройте животное стерильной драпировкой и сделайте отверстие над генитальнымрасщелина.
2. Хирургическая процедура
- Подготовка ректовагинальной перегородки
- Возьмите дорзальную стенку влагалища 3 см черепно-мозгового кольца с использованием щипцов Allis.
- Возьмите шприц, загруженный 10 мл физиологического раствора и снабженный иглой 22 G. Вставьте его через вагинальный эпителий (приблизительно 3 - 4 мм в глубину) и в среднюю линию ректовагинальной перегородки, 1,5 см черепного к гименальному кольцу.
- Выполните «аква-рассечение» путем инъекции солевого раствора в ректовагинальную перегородку 11 .
- Сделайте разрез средней линии длиной 3 см на вагинальном эпителии, начиная с хвостовика с помощью щипцов Allis (шаг 2.1.1) и заканчивая на гименальном кольце с помощью скальпеля. Войдите через ректально-вагинальное пространство через этот разрез.
- Поместите самозатягивающийся ретрактор (см. Таблицу материалов ) поверх промежности и поставьте четыре острых крючка для отдыха в вагинальном разрезе, чтобы он не открывался.
- С пальцем тупо рассечь ректо-вагинальную фасцию от стенки влагалища сбоку к тазовым боковым стенкам и черепно до каудального аспекта тупика. Создайте подходящее место для центральной части 30 x 40 мм 2 сетки ( рис. 2 , панель D).
- Выполняйте гемостаз с помощью гемостатических щипцов или крестообразной гемостатической лигатуры, когда это необходимо.
ПРИМЕЧАНИЕ. Маленькие кровотечения могут быть зажаты с помощью кровоостанавливающих щипцов. Это разрушает сосуд и инициирует естественный каскад коагуляции. Для более сильного кровопускания возьмитесь за кровоточащий сосуд с помощью щипцов и поместите крест-накрестную лигатуру, обеспечив ее квадратным узлом. На этом этапе можно либо вставить прямоугольный имплантат (шаг 2.2), либо продолжить вскрытие, чтобы вставить имплантат с помощью анкерных рычагов (шаг 2.3).
- Вставка плоской сетки
- Вставьте вагинальный ретрактор в вагинальный разрез, чтобы обеспечить лучший обзорКраниальная часть рассеченной области.
- Наложите левый и правый краниальный угол имплантата с помощью простого прерванного полипропиленового шва 3/0 с левой и правой сторон самого краниального аспекта расчлененного ректовагинального пространства. Вырежьте остаточный шовный материал. Держите шов от вагинального просвета ( т. Е. Не проникайте в стенку влагалища).
ПРИМЕЧАНИЕ. Имплантат всегда прикрепляется к соединительной ткани, содержащей ректо-вагинальную перегородку. Влагалищная стенка не проникает, если шовный материал не может быть виден во влагалище. - Добавьте еще один простой прерывистый шов на полпути по краниальному аспекту имплантата.
- Швы на боковые края имплантата посередине на окружающую соединительную ткань с помощью простого прерванного полипропилена 3/0. Держите имплантат как можно более плоским и без натяжения.
- Швы на левый и правый хвостовые углы с помощью простых прерванных швов полипропилена 3/0 слева и справаСтороны самого каудального аспекта ректовагинального пространства.
- Добавьте еще один простой прерывистый шов на полпути вдоль каудального аспекта имплантата.
- Закройте влагалищные надрезы с помощью полиглактинового шва 3/0.
- Вставка и закрепление имплантата с помощью рук (техника с троакаром).
- Продолжите рассечение ректо-вагинального пространства, созданного на этапе 2.1, кранио-вентрально, чтобы достичь медиального аспекта отверстия обтуратора, которое можно легко пальпировать.
- Рассекайте пространство каудо-латерально, чтобы достичь каудального аспекта крестообразной связки и каудально расположенной мышцы копчика.
- С №. 24, сделайте четыре разреза шириной 1 см на стороне вульвы, прорезайте кожу и поверхностную мышечную фасцию ( рис. 2 , панель B и C).
- Сделайте два «вентральных» разреза на медиальном аспекте бедра, около 4 см черепных с каудальной границы oF - седалищная арка ( т. Е. Нижняя граница симфиза) и 3 см в поперечном направлении от средней линии ( рис. 2 , панель C).
- Сделайте два «дорзальных» разреза на уровне вставки хвостовых складок, на 2 см медиально до клубня ischiadicum, которые можно легко пальпировать ( рис. 2 , панель B).
- Поместите изогнутый троакар через один из вентральных разрезов ( рис. 2 , панель E).
- Пройдите троакар через мышцу аддуктора magnus, внешний обтуратор и медиальный аспект отверстия обтуратора.
- Контролируйте прогрессирование троакара пальцем, вставленным через вагинальный разрез. Направляйте его кончик к сухожильной дуге мышцы levator ani ( рис. 2 , панель E).
- Выставить направляющий провод в разрез вагинальной стенки и загрузить его соответствующим ипсилатеральным черепным рычагом ( рис. 2 , панель F).
- Потяните троакарь, загруженный с помощью мEsh через вышеуказанные структуры. Держите руку без натяжения.
- Повторите этот процесс со второй черепной мышцей через вентральный разрез на другой стороне животного.
- Через один из дорзальных разрезов пройдите троакар через мышцу копчика, только дистальнее к сугрозно-связной связки ( рис. 2 , панель G).
- Выставить направляющий провод через вагинальный разрез, схватить дорзальный рычаг сетки и вытащить его. Держите руку без натяжения и повторяйте ее с другой стороны.
- Отрегулируйте положение сетки, сплющив ее и надавив на плечи, но держите сетку без натяжения ( рис. 2, панель I, рисунок 3 ).
- Закрепите тело сетки простым прерванным полипропиленовым швом 3/0 в середине его каудальной границы, обеспечив его в окружающую соединительную ткань.
- Вырежьте руки на уровне кожи и закройте все разрезы кожи простым прерывистым 3/0 polyglECAPRON SUS ( рисунок 2 , панель H).
- Закройте вагинальный разрез с помощью шприца с полигликатроном 3/0.
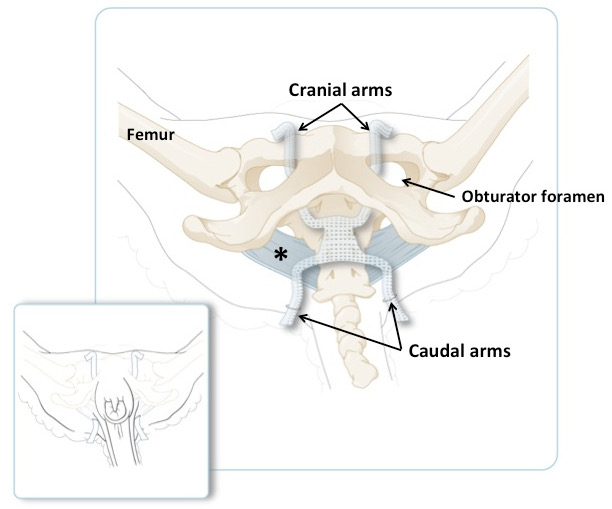
Рисунок 3: Схематическое изображение овечьего таза с краниальным оружием, проходящим через обтураторное отверстие и каудальное оружие, проходящее через хвостовые складки. Широкая сугробная связка синева. Небольшая панель иллюстрирует положение плеч животного в лежачем положении, непосредственно перед укорочением чрезмерного количества материала. Основная панель показывает то же самое, но с удаленной кожей и мышцами.
Результаты
Управление в более длительной установке наблюдения
После хирургической процедуры вагинальная упаковка (солевая соль-раствор-пропитанная марлевая упаковка, вставленная во влагалище сразу после операции) может быть вставле?...
Обсуждение
Здесь мы описываем экспериментальную процедуру у овец, нацеленную на имитацию вагинальной диссекции и трансвагинальную сетчатую вставку имплантата с или без закрепляющих рычагов. Последующие шаги и инструменты были вдохновлены хирургическими процедурами, сделанными для POP и стресс?...
Раскрытие информации
Эта исследовательская программа по модели овец была поддержана безусловным грантом от Medri и Blasingame, Burch, Garrard и Ashley (Atlanta GA, США). Соглашения обрабатываются через бюро переводов Leuven Research and Development. Спонсоры не мешали планированию, исполнению или представлению отчета об этом эксперименте, а также не имели результатов. NS и LH являются получателями гранта от ЕС в рамках FP7 (проект Bip-Upy, NMP3-LA-2012-310389). AF поддержали грант от ЕС в отраслевой программе академического партнерства (251356).
Благодарности
Мы благодарим Ивана Лаермана, Розиту Кинарт, Энн Лиссенс (Центр хирургических технологий, КУ Лёвен, Лёвен, Бельгия). Jo Verbinnen и Kristof Reyniers (Институт анатомии Vesalius, медицинский факультет, KU Leuven, Leuven, Бельгия) оказали техническую поддержку в ходе эксперимента. Мы благодарим Leen Mortier за помощь в управлении данными и рукописью. Мы благодарим FEG Textiltechniken за изготовление прототипных сеток, их стерилизацию и безоговорочную передачу их на исследования.
Материалы
| Name | Company | Catalog Number | Comments |
| Animals: | |||
| parous female sheep (45 - 65 kg) | Zoötechnical Institute of the KU Leuven | NA | experimetnal animal |
| Sterile clothing: | |||
| sterile drape 45 x 75 cm | Lohmann & Rauscher, Regensdorf, Germany | 33002 | other material |
| sterile OR drape 150 x 180 cm | Lohmann & Rauscher, Regensdorf, Germany | 33009 | other material |
| sterile glowes 2x | Lohmann & Rauscher, Regensdorf, Germany | 16652 | other material |
| sterile surgical gown 2x | Lohmann & Rauscher, Regensdorf, Germany | 19342 | other material |
| surgical head cap 2x | Lohmann & Rauscher, Regensdorf, Germany | 17427 | other material |
| surgical face mask 2x | Lohmann & Rauscher, Regensdorf, Germany | 11983 | other material |
| Other surgical material | |||
| implant | FEG Textiltechnik GmbH, Aachen, Germany | NA | purposely designed implant |
| 3/0 polypropylene suture | Prolene, Ethicon, Diegem, Belgium | 8762H | suture material |
| 3/0 polygecaprone suture | Vicryl, Ethicon | J311H | suture material |
| gauze swabs 10 x 10 cm 10x, 12-ply | Lohmann & Rauscher, Regensdorf, Germany | 11574 | other material |
| syringe 20 mL | Becton Dickinsosn S.A., Madrid, Spain | 300613 | aqua-dissection |
| needle 16 gauge | Terumo, Leuven, Belgium | NN-2238R | aqua-dissection |
| Surgical equipment: | |||
| blade no.22 | Fine science isntruments, Heidelberg, Germany | 10022-00 | surgical instruments |
| Allis tissue forceps 1x | Fine science isntruments, Heidelberg, Germany | 11091-15 | surgical instruments |
| Standart pattern forceps 1x2 theeth 1x | Fine science isntruments, Heidelberg, Germany | 11023-14 | surgical instruments |
| Standart pattern forceps straight serrated 1x | Fine science isntruments, Heidelberg, Germany | 11000-14 | surgical instruments |
| Scalpel handle 1x | Fine science isntruments, Heidelberg, Germany | 10004-13 | surgical instruments |
| Halstead-Mosquito forceps 2x | Fine science isntruments, Heidelberg, Germany | 13008-12 | surgical instruments |
| Standart pattern scissors 1x | Fine science isntruments, Heidelberg, Germany | 14001-14 | surgical instruments |
| Metzenbaum scissors 1x | Fine science isntruments, Heidelberg, Germany | 14016-18 | surgical instruments |
| Crile Wood needle holder 1x | Fine science isntruments, Heidelberg, Germany | 12003-15 | surgical instruments |
| Kell forceps 1x | Fine science isntruments, Heidelberg, Germany | 13018-14 | surgical instruments |
| Long Starr Self-Retaining Retractor with eight 5mm sharp stay hooks | Cooper Surgical, Tumbull, USA | 3704 | surgical instruments |
| Heaney Simon Vaginal Retractor | Medical supplies & equipments co., Katy, Texas, USA | 403-129FSI | surgical instruments |
| Trocar (Insnare) | Bard, West Sussex, United Kingdom | NA | any trocar on market for transvaginal mesh implantation |
| Medication: | |||
| amoxilicilline clavulanate 1000mg / 300 mL (Ampiciline) | GSK, Wavre, Belgium | NA | antibiotics |
| buprenorfin 0.3 mg/mL + chlorocresol 1.35 mg/mL (Vetregesic) | Ecuphar, Oostkamp, Belgium | NA | analgesia |
| ketamin HCL 100mg/mL (Ketamine 1000) | Ceva Sante Animale, Brussels, Belgium | NA | anesthesia |
| isoflurane (IsoFlo) | Abbott Laboratories Ltd, Maidenhead, Berkshire, UK | NA | anesthesia |
| polyvidone iodium 7.5% (Braunol) | B. Braun Medical, Machelen, Belgium | NA | local desinfection |
| saline solution 500ml | B. Braun Medical, Machelen, Belgium | NA | aqua-dissection |
| Xxylazine HCl , 1 mL/50 kg | Vexylan, Ceva Sante Animale, Belgium | NA | premedication |
| atropine Sulfate 15 mg/ml (), | Viatris, Belgium | NA | premedication |
Ссылки
- Glazener, C., et al. Childbirth and prolapse: Long-term associations with the symptoms and objective measurement of pelvic organ prolapse. BJOG An Int. J. Obstet. Gynaecol. 120 (2), 161-168 (2013).
- Jia, X., et al. Efficacy and safety of using mesh or grafts in surgery for anterior and/or posterior vaginal wall prolapse: systematic review and meta-analysis. BJOG. 115 (11), 1350-1361 (2008).
- Maher, C., et al. Transvaginal mesh or grafts compared with native tissue repair for vaginal prolapse. Review. 2 (2), 10-13 (2016).
- Nieminen, K., et al. Outcomes after anterior vaginal wall repair with mesh: a randomized, controlled trial with a 3 year follow-up. Am. J. Obstet. Gynecol. 203 (3), e1-e8 (2010).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: a review. Eur. J. Obstet. Gynecol. Reprod. Biol. 144, S146-S158 (2009).
- Couri, B., Lenis, A., Borazjani, A., Paraiso, M. F. R., Damaser, M. S. Animal models of female pelvic organ prolapse: lessons learned. Expert Rev. Obs. Gynecol. 7 (3), 249-260 (2012).
- Deprest, J., et al. The biology behind fascial defects and the use of implants in pelvic organ prolapse repair. Int. Urogynecol. J. Pelvic Floor Dysfunct. 17, S16-S25 (2006).
- Ozog, Y., Mazza, E., De Ridder, D., Deprest, J. Biomechanical effects of polyglecaprone fibers in a polypropylene mesh after abdominal and rectovaginal implantation in a rabbit. Int. Urogynecol. J. 23 (10), 1397-1402 (2012).
- Manodoro, S., et al. Graft-related complications and biaxial tensiometry following experimental vaginal implantation of flat mesh of variable dimensions. BJOG. 120 (2), 244-250 (2013).
- Endo, M., et al. Cross-linked xenogenic collagen implantation in the sheep model for vaginal surgery. Gynecol. Surg. , 113-122 (2015).
- Feola, A., et al. Host reaction to vaginally inserted collagen containing polypropylene implants in sheep. Am. J. Obstet. Gynecol. 212 (4), e1-e474 (2015).
- Barnhart, K. T., et al. Baseline dimensions of the human vagina. Hum. Reprod. 21 (6), 1618-1622 (2006).
- Tayrac, R., Alves, A., Thérin, M. Collagen-coated vs noncoated low-weight polypropylene meshes in a sheep model for vaginal surgery. A pilot study. Int. Urogynecol. J. Pelvic Floor Dysfunct. 18 (5), 513-520 (2007).
- Sobiraj, A., Busse, G., I, H. B. O. S. E. D. Ivastigation into the blood plasma profiles progesterone in sheep sufferingform vaignal inversion and prolapse. Br. Vet. J. 142 (142), 218-223 (1986).
- Reisenauer, C., Kirschniak, A., Drews, U., Wallwiener, D. Anatomical conditions for pelvic floor reconstruction with polypropylene implant and its application for the treatment of vaginal prolapse. Eur. J. Obstet. Gynecol. Reprod. Biol. 131, 214-225 (2007).
- Carey, M., Slack, M., Higgs, P., Wynn-Williams, M., Cornish, A. Vaginal surgery for pelvic organ prolapse using mesh and a vaginal support device. BJOG An Int. J. Obstet. Gynaecol. 115 (3), 391-397 (2008).
- Urbankova, I., et al. Comparative anatomy of the ovine and female pelvis. Gynecol. Obstet. Invest. , (2016).
- Maurer, M. M., Röhrnbauer, B., Feola, a., Deprest, J., Mazza, E. Mechanical biocompatibility of prosthetic meshes: A comprehensive protocol for mechanical characterization. J. Mech. Behav. Biomed. Mater. 40, 42-58 (2014).
- Leval, J. Novel Surgical Technique for the Treatment of Female Stress Urinary Incontinence. Transobturator Vaginal Tape Inside-Out. Eur. Urol. 44 (6), 724-730 (2003).
- Reisenauer, C., Kirschniak, A., Drews, U., Wallwiener, D. Transobturator vaginal tape inside-out. Eur. J. Obstet. Gynecol. Reprod. Biol. 127 (1), 123-129 (2006).
- Bafghi, A., et al. Bowel perforation as late complication of tension-free vaginal tape. J Gynecol Obs. Biol Reprod. 34 (6), 606-607 (2005).
- Hinoul, P., Vanormelingen, L., Roovers, J. P., de Jonge, E., Smajda, S. Anatomical variability in the trajectory of the inside-out transobturator vaginal tape technique (TVT-O). Int. Urogynecol. J. Pelvic Floor Dysfunct. 18 (10), 1201-1206 (2007).
- Schaller, O., et al. . Illustrated Veterinary Anatomical Nomenclature. , (2007).
- . Serious Complications Associated with Transvaginal Placement of Surgical Mesh for Pelvic Organ Prolapse. FDA Safety Communication. , (2016).
- Reinier, M., Groep, G. Final Opinion on the use of meshes in urogynecological surgery. SCENIHR- European Commission. , (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены