Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Transvaginal Mesh Insertion im Schaf-Modell
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Mesh-Implantation im Schaf-Rektovaginal-Septum unter Verwendung einer einzigen vaginalen Inzisionstechnik mit und ohne das trokargeführte Einführen von Verankerungsarmen.
Zusammenfassung
Dieses Protokoll beschreibt die Einfügung des Netzes in das rectovaginale Septum bei Schafen unter Verwendung einer einzigen vaginalen Inzisionstechnik mit und ohne das trokargeführte Einführen von Verankerungsarmen. Parus Schafe unterzog die Sektion des rectovaginalen Septums, gefolgt von der Einfügung eines Implantats mit oder ohne vier Verankerungsarme, die beide für die Schafanatomie geeignet waren. Die Verankerungsarme wurden mit einem Trokar und einer "Außen-in" Technik eingesetzt. Die kranialen Arme wurden durch den Obturator, Gracilis und Adductor magnus Muskeln geführt. Die Schwanzarme wurden in der Nähe des sakrotuberischen Bandes durch die Steißbeinmuskeln fixiert. Diese Technik ermöglicht die Nachahmung von chirurgischen Eingriffen bei Frauen, die an Beckenorganprolaps leiden. Die anatomischen Räume und Elemente sind leicht zu erkennen. Der wichtigste Teil des Verfahrens ist die Insertion des Schädel-Trokars, die leicht in die Peritonealhöhle oder die umliegenden Beckenorgane eindringen kann. ThiS kann durch eine umfangreichere retroperitoneale Dissektion vermieden werden und indem man den Trokar mehr seitlich führt. Dieser Ansatz ist nur für die experimentelle Prüfung von neuartigen Implantaten in großen Tiermodellen konzipiert, da die Trokar-geführte Insertion derzeit nicht klinisch genutzt wird.
Einleitung
Pelvic Organ Prolaps ist klinisch diagnostiziert in der Hälfte der Frauen, die mindestens eine vaginale Lieferung hatte, aber subjektiv, es stört die Hälfte der Frauen insgesamt 1 . Die Hauptstütze der Therapie ist die chirurgische Rekonstruktion mit entweder nativem Gewebe oder Implantatmaterial, aber jede dieser Methoden hat ihre Grenzen, einschließlich Rezidiv oder lokale Komplikationen 2 , 3 , 4 . Das ideale Implantat ist noch nicht identifiziert worden; Daher gibt es eine kontinuierliche Nachfrage nach Produktinnovation und für die Entwicklung einer geeigneten Pipeline für präklinische Experimente vor der Einführung neuer Produkte und Techniken auf den Markt. Einer der Schritte in diesem Track ist die experimentelle Bewertung der geeigneten Tiermodelle 5 , 6 . Idealerweise sollten sie die anatomischen, biomechanischen und biologischen Umgebungen nachahmen. Wenn es darum geht,E experimentelle Auswertung von neuartigen Implantaten werden sie typischerweise zuerst in kleineren Modellen getestet, entweder für die Biokompatibilität oder für die Rekonstruktion von Bauchwanddefekten. Diese Art von Experimenten wurde kritisiert, weil die Implantate nicht in den interessanten Bereich ( dh die Vagina) eingefügt werden 7 . Vaginalchirurgie-Modelle sind knapper, sicherlich, wenn das Ziel des Experiments ist, die biomechanischen Eigenschaften von Explantaten zu dokumentieren. Aus diesem Grund gab es einen Umzug von Kaninchen zu Schafen 8 . Erwachsene Mutterschafe sind große Tiermodelle mit einer vernünftig großen und zugänglichen Vagina. Sie können für die Halbzeitbewertung von neuartigen Implantaten verwendet werden, und es ist möglich, mit bestimmten Materialien 9 , 10 , 11 , 12 , 13 vaginale Exposition zu reproduzieren. Nicht nur die Dimensionen und AnatomieDer Schafvagina und des Beckenbodens sind vergleichbar mit denen beim Menschen, aber auch das spontane Auftreten von Prolaps, der bei 15% der Schafe auftritt. Prolaps-Risikofaktoren überlappen ( dh Multiparität, Vorgeschichte von POP, erhöhter intra-abdominaler Druck, induziert durch ein höheres Körpergewicht oder beim Weiden auf Hügeln und vergleichbare Effekte von (Phyto) Östrogenen) 6 , 14 . In Europa sind Schafe die einzig vernünftige Alternative, da die Forschung an nichtmenschlichen Primaten fast vollständig verboten ist. Hier wurde das Modell noch einen Schritt weiter gemacht, indem man die transvaginale Insertion von Implantaten mit Trokaren und Führungen für die spannungsfreie Platzierung von Maschen in das Recto-Vaginalseptum nachahmte. Darauf folgte die Fixierung des Implantats mittels Verankerung mit Armen durch die Bänder der Muskeln, die als äquivalent zur klinischen Praxis 15 , 16 angesehen werden können . So weit, diese TechnikWurde nicht untersucht, obwohl viele glauben, dass spezifische Komplikationen aufgrund der Verwendung dieser längeren Streifen und / oder des Durchstechens anatomischer Strukturen auftreten können.
In einer früheren detaillierten anatomischen Studie wurde der Beckenboden mit dem weiblichen Becken 17 verglichen. Wenn es darum geht, das Implantat zu verankern, haben Schafe nicht das sakrospinöse Ligament, aber sie haben ein sehr gut entwickeltes und breites sakrotuberöses Ligament. Der pudendale Nerv läuft ventral darüber, so dass es unsicher ist, dieses Wahrzeichen als Aufhängepunkt zu benutzen. Umgekehrt sind der Steißbeinmuskel und seine Faszie sowie die Obturatormembran durch den rektovaginalen Raum zugänglich. Hier wird der Zugang und die Lage der anatomischen Strukturen zur Fixierung von Verankerungsarmen vorgeschlagen. Die Instrumente, die verwendet werden können, um das Netz zu positionieren, werden diskutiert. Schließlich ist das Verhältnis der Arme oder Trokare zu angrenzenden anatomischen Strukturen, wie Schiffen und Nerven, aS sowie potenzielle intraoperative Komplikationen sind auch beschrieben.
Protokoll
Ethische Zulassung für dieses Experiment wurde vom Ethikausschuss für Tierversuche der KU Leuven (P065 / 2013) erhalten. Die Tiere wurden gemäß den geltenden nationalen Richtlinien für den Tierschutz behandelt.
1. Material und das Experimentaltier
- Chirurgie Vorbereitung
- Im chirurgischen Theater decken Sie einen Tisch mit einem sterilen Tuch ab und bereiten einen sterilen gekrümmten Trokar vor ( Abb. 1 , Tafel A), sterile chirurgische Instrumente, Nähte und sterile Gaze. Führen Sie die gesamte chirurgische Prozedur in sterilen Bedingungen, wenn das Experiment umfasst Follow-up. Legen Sie alle Instrumente auf den Tisch, um für den Einsatz während der Operation bereit zu sein.
- Entfernen Sie ein steriles, rechteckiges Implantat und / oder ein Implantat mit Verankerungsarmen aus der sterilen Verpackung und legen Sie sie auf den mit sterilen Abdeckung bedeckten Tisch ( Abbildung 1B , C und D ).
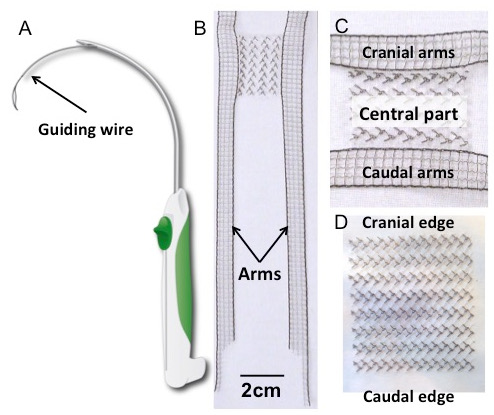
Abbildung 1: Trokar und Implantate. ( A ) Schematische Zeichnung des Trokars ( B ) H-förmiges Polyvinylidenfluorid (PVDF) Implantat mit einem Detail des zentralen Teils (Tafel C ). Seine Form wurde von den vierarmigen Maschen, die derzeit für die transvaginalen Prolapsreparatur zur Verfügung stehen, inspiriert. Der rechteckige Körper (30 x 40 mm 2 ) wird seitlich durch vier ausgestreckte Arme (150 x 10 mm 2 ) verlängert. Die Abmessungen der Arme sind so ausgelegt, dass sie lang genug sind, um die relevanten Aufhängungsstrukturen auf der Grundlage früherer anatomischer Studien zu durchstechen 17 . ( D ) Das rechteckige Implantat (30 x 40 mm 2 ). Beide Implantate wurden aus Polyvinylidenfluorid hergestellt; Textilmerkmale und Eigenschaften sind in Tabelle 1 aufgeführt .
- Experimentelles Tier (EwE, 45-60 kg)
- Die Prämedikation von 1 ml 15 mg / ml Atropinsulfat und 1 ml / 50 kg Xylazin HCl intramuskulär (im) 30 min vor dem chirurgischen Eingriff verabreichen.
- Nach 30 min, stellen Sie sicher, dass die Prämedikation die Schafe lethargisch und schläfrig gemacht hat.
- Setzen Sie einen intravenösen Katheter in die Vena jugularis ein und verabreichen Sie 0,075 ml / kg Ketamin 100 mg / ml HCl. Bestätigen Sie tiefe Anästhesie, indem Sie den Mangel an Reaktion auf schmerzhafte Reize beobachten.
- Bewegen Sie das Tier auf den chirurgischen Tisch und sichern Sie seine Atemwege durch Intubation. Die Anästhesie mit 2,5% Isofluran in 5 l / min Sauerstoff aufbewahren.
- Halten Sie die intravenöse Linie in die Vena jugularis eingelegt und liefern Sie 500 ml Salzlösung mit einer Durchflussrate von 150 ml / h.
- Verabreichung von prophylaktischen Antibiotika im (Amoxicillinclavulanat, 7 mg / kg) und postoperativen Analgetika (Buprenorfin und Chlorkresol, 1 ml) oder dem Äquivalent nach lokalen Protokollen.
- Lege das Tier in leuchtenHotomy Position am Ende des chirurgischen Tisches und sichern ihre Gliedmaßen, mit den Hüften in Hyper-Flexion, mit Seilen ( Abbildung 2 , Panel A).
- Manuell leeren Sie die Blase und das Rektum, indem Sie sie trans-vaginal anstoßen.
- Rasieren Sie den Damm, den medialen Teil des Oberschenkels und der Schwanz faltet und desinfiziert mit Polyvidon-Iodium 7,5% ( Abbildung 2 , Tafel B und C).
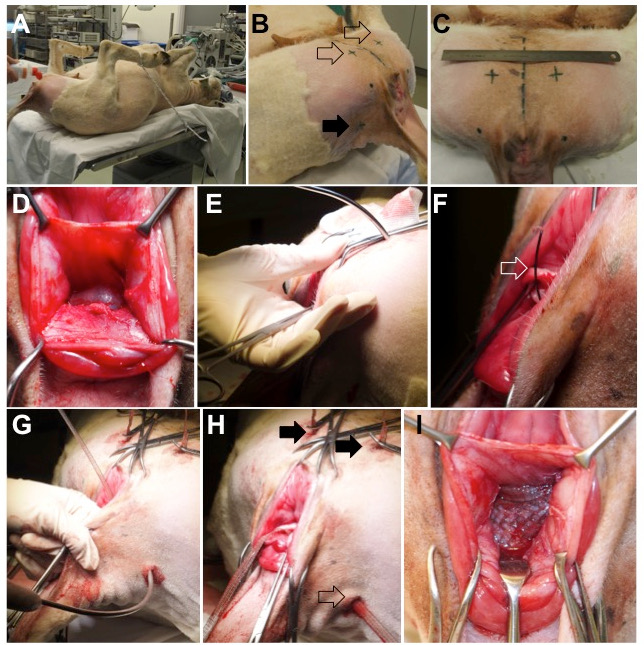
Abbildung 2: Tierchirurgie. ( A ) Ein Schaf platziert in der Rückenlage, mit den Hüften hyper-gebeugt durch die Sicherung der unteren Gliedmaßen. ( B ) Die äußeren Eintrittspunkte für die Trokareinführung befinden sich auf der ventralen Seite (leerer Pfeil) und dorsal an den seitlichen Schwanzfalten (Pfeil). ( C ) Position der ventralen Einführungspunkte; Die gestrichelte Linie in der Mitte repräsentiertDie midsagittale Ebene des Tieres. ( D ) Dissected rectovaginal septum ( E ) Insertion des ventralen Trokars durch die Muskeln auf der medialen Seite des Oberschenkels, des Foramen des Obturators und des paravaginalen Raumes. Die Trajektorie des Piercing-Trokars wird mit dem Finger gesteuert. ( F und G ) Sobald der Trokar vorhanden ist, wird die Drahtschlinge (offener Pfeil) vorgerückt und mit dem Arm des Vaginalgitters beladen. ( H ) Endposition der ventralen (Vollpfeile) und dorsalen (leeren Pfeil) Arme. ( I ) Der zentrale Teil ist spannungsfrei zwischen der Vaginalwand und der rektalen Adventitia platziert.
- Bereiten Sie das Personal für eine Operation in sterilen Bedingungen vor. Setzen Sie auf eine chirurgische Mütze und Mund Maske, waschen Hände für Chirurgie, und setzen Sie auf ein chirurgisches Kleid und sterile Handschuhe.
- Decken Sie das Tier mit einem sterilen Tuch ab und machen Sie eine Öffnung über dem GenitalHiatus.
2. Chirurgisches Verfahren
- Vorbereitung des rectovaginalen Septums
- Fassen Sie die dorsale Vaginalwand 3 cm kranial an den hymenischen Ring mit Allis Pinzette.
- Nehmen Sie eine Spritze mit 10 ml Salzlösung und mit einer 22 G-Nadel ausgestattet. Setzen Sie es durch das Vaginalepithel (ca. 3 - 4 mm tief) und in die Mittellinie des rectovaginalen Septums, 1,5 cm kranial zum hymenischen Ring.
- Führen Sie "Aqua-Dissektion" durch Injektion von Salzlösung im rectovaginalen Septum 11 durch .
- Machen Sie eine 3 cm lange Mittellinie auf das Vaginalepithel, beginnend kaudal zur Allis-Pinzette (Schritt 2.1.1) und enden am hymenischen Ring mit einem Skalpell. Geben Sie den Recto-Vaginalraum durch diesen Schnitt ein.
- Legen Sie den selbsthaltenden Retraktor (siehe Tabelle der Materialien ) über den Damm und legen Sie vier scharfe Haken in den vaginalen Schnitt, um ihn offen zu halten.
- Mit dem Finger zerlegen Sie die Recto-Vaginal-Faszie aus der Scheidenwand seitlich in Richtung der Becken-Seitenwände und kranial bis zum kaudalen Aspekt der Sackgasse. Stellen Sie einen geeigneten Platz für den 30 x 40 mm 2 zentralen Teil des Gitters her ( Abbildung 2 , Tafel D).
- Führen Sie die Hämostase mit hämostatischer Pinzette oder eine kreuzweise hämostatische Ligatur, wenn nötig.
HINWEIS: Kleine Bluter können mit der hämostatischen Zange geklemmt werden. Das zerkleinert das Gefäß und leitet die natürliche Koagulationskaskade ein. Für stärkere Blutungen, fassen Sie den Blutgefäß mit Pinzette und legen Sie eine kreuz und quer ligatur, sichern sie mit einem quadratischen Knoten. An dieser Stelle kann man entweder das rechteckige Implantat einsetzen (Schritt 2.2) oder mit der Dissektion fortfahren, um das Implantat mit Verankerungsarmen einzusetzen (Schritt 2.3).
- Flachmascheneinführung
- Setzen Sie den vaginalen Retraktor in die vaginale Inzision ein, um eine bessere Sicht zu ermöglichenDer kraniale Teil des zerlegten Gebietes.
- Naht die linke und rechte Schädel-Ecke des Implantats mit einer einfachen unterbrochenen 3/0 Polypropylen-Naht auf der linken und rechten Seite des kranialen Aspekts des zergliederten Rekto-Vaginalraumes. Schneiden Sie das restliche Nahtmaterial. Halten Sie die Naht weg vom Vaginallumen ( dh nicht in die Scheidenwand eindringen).
HINWEIS: Das Implantat wird immer an das Bindegewebe, das das Recto-Vaginalseptum umfasst, vernäht. Die Vaginalwand wird nicht durchdrungen, wenn das Nahtmaterial nicht in der Vagina zu sehen ist. - Fügen Sie eine zusätzliche einfache unterbrochene Naht auf halbem Weg entlang der kranialen Aspekt des Implantats.
- Naht die Seitenkanten des Implantats auf halbem Weg auf das umgebende Bindegewebe mit einem einfachen unterbrochenen 3/0 Polypropylen. Halten Sie das Implantat so flach wie möglich und spannungsfrei.
- Naht die linke und rechte kaudale Ecke mit einfach unterbrochenen 3/0 Polypropylennähten links und rechtsSeiten des kaudalen Aspekts des rectovaginalen Raumes.
- Fügen Sie eine zusätzliche einfache unterbrochene Naht auf halbem Weg entlang der kaudalen Aspekt des Implantats.
- Schließen Sie die vaginalen Einschnitte mit einer laufenden 3/0 Polyglactin Naht.
- Insertion und Verankerung von Implantaten mit Armen (Trokar-geführte Technik).
- Fortsetzen Sie die Zerlegung des Rekto-Vaginalraumes, der in Schritt 2.1 kreisförmig erzeugt wurde, um den medialen Aspekt des Obturator-Foramen zu erreichen, der leicht palpiert werden kann.
- Zerlegen Sie den Raum caudo-lateral, um den kaudalen Aspekt des sakrotuberösen Ligaments und des kaudal gelegenen Coccygeus-Muskels zu erreichen.
- Mit einem nein 24 Klinge, machen vier 1 cm breite Einschnitte auf der Vulvarseite, schneiden durch die Haut und oberflächliche muskuläre Faszie ( Abbildung 2 , Tafel B und C).
- Machen Sie zwei "ventrale" Einschnitte auf den medialen Aspekt des Oberschenkels, in der Nähe von 4 cm Schädel von der kaudalen Grenze oF der Sciatic-Bogen ( dh der untere Rand der Symphyse) und 3 cm lateral von der Mittellinie ( Abbildung 2 , Panel C).
- Machen Sie zwei "dorsale" Einschnitte auf der Ebene der Einfügung der Schwanzfalten, 2 cm medial zum Knollen ischiadicum, die leicht palpiert werden kann ( Abbildung 2 , Panel B).
- Lege einen gebogenen Trokar durch einen der ventralen Einschnitte ( Abbildung 2 , Tafel E).
- Führen Sie den Trokar durch den adductor magnus Muskel, den äußeren Obturator und den medialen Aspekt des Foramen des Obturators.
- Kontrolliere das Fortschreiten des Trokars mit einem Finger, der durch den vaginalen Schnitt eingeführt wurde. Führen Sie seine Spitze zum Sehnenbogen des Levator-Ani-Muskels ( Abbildung 2 , Tafel E).
- Setzen Sie den Führungsdraht in den Vaginalwandeinschnitt ein und laden Sie ihn mit dem entsprechenden ipsilateralen Schädelarm ( Abbildung 2 , Paneel F).
- Ziehen Sie den mit dem m geladenen TrokarEsh Arm durch die oben genannten Strukturen. Halten Sie den Arm spannungsfrei.
- Wiederholen Sie den Vorgang mit dem zweiten Schädelarm durch den ventralen Schnitt auf der anderen Seite des Tieres.
- Durch einen der dorsalen Einschnitte, passieren Sie den Trokar durch den Steißbein Muskel, nur distal zum sakrotuberösen Band ( Abbildung 2 , Panel G).
- Setzen Sie den Führungsdraht durch den vaginalen Einschnitt aus, fassen Sie den dorsalen Arm des Netzes an und ziehen Sie ihn heraus. Halten Sie den Arm spannungsfrei und wiederholen Sie auf der anderen Seite.
- Passen Sie die Position des Gitters an, indem Sie sie abwälzen und die Arme anziehen, aber das Netz spannungsfrei halten ( Abbildung 2, Tafel I, Abbildung 3 ).
- Fixieren Sie den Körper des Netzes mit einer einfachen unterbrochenen 3/0 Polypropylen Naht in der Mitte seiner kaudalen Grenze und sichern sie an das umgebende Bindegewebe.
- Schneiden Sie die Arme auf der Ebene der Haut und schließen Sie alle Hautinzisionen mit einfach unterbrochenen 3/0 polyglEcaprone Nähte ( Abbildung 2 , Panel H).
- Schließen Sie den vaginalen Schnitt mit einer laufenden 3/0 polyglecaprone Naht.
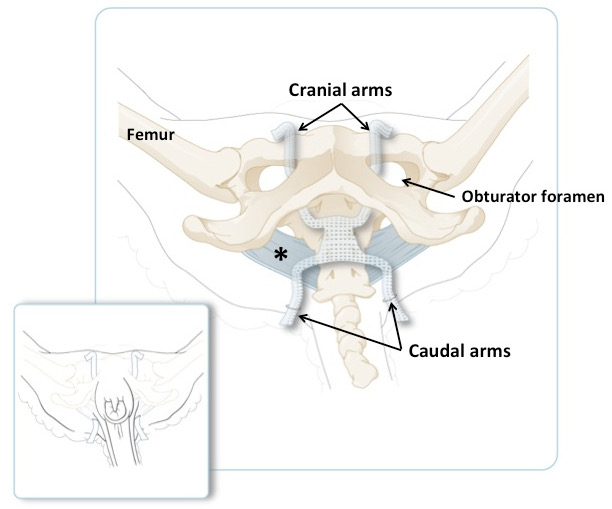
Abbildung 3: Schematische Darstellung des Schafbeckens, wobei die Schädelwaffen durch das Obturator-Foramen und die Caudal-Arme durch die Schwanzfalten hindurchgehen. Das breite sakrotuberöse Band ist blau. Die kleinere Tafel zeigt die Position der Arme auf einem Tier in liegenden Position, kurz vor Verkürzung der übermäßigen Menge an Material. Das Hauptpanel zeigt das gleiche, aber mit der Haut und Muskeln entfernt.
Ergebnisse
Management in einer längeren Observation Setup
Nach dem chirurgischen Eingriff kann eine vaginale Packung (ein in die Vagina unmittelbar nach der Operation eingefügtes salzlösungsgetrocknetes Gazepaket für 24 h eingefügt werden, um die Implantatposition zu sichern. Die Schafe sollten in einen Erholungskäfig gestellt werden und ihre Atemfunktion bis zur vollständigen Erholung folgen. Später ist es mögl...
Diskussion
Hier beschreiben wir ein experimentelles Verfahren bei Schafen, das darauf abzielt, die vaginale Dissektion und die transvaginale Mascheneinführung eines Implantats mit oder ohne Verankerungsarme nachzuahmen. Die nachfolgenden Schritte und Instrumente wurden durch chirurgische Eingriffe für POP und Stress Harninkontinenz 15 , 16 , 19 , 20 inspiriert. Nach anfänglichen anatomischen Sektionen...
Offenlegungen
Dieses Forschungsprogramm auf dem Schafmodell wurde durch einen bedingungslosen Stipendium von Medri und Blasingame, Burch, Garrard und Ashley (Atlanta GA, USA) unterstützt. Vereinbarungen werden über das Leuven Research and Development Transferbüro abgewickelt. Die Sponsoren störten nicht die Planung, Durchführung oder Berichterstattung dieses Experiments, noch besitzen sie die Ergebnisse. NS und LH sind Empfänger eines Zuschusses aus der EG im Rahmen des RP7-Rahmens (Bip-Upy-Projekt, NMP3-LA-2012-310389). AF wurde durch einen Zuschuss aus der EG im branchenwissenschaftlichen Partnerschaftsprogramm (251356) unterstützt.
Danksagungen
Wir danken Ivan Laermans, Rosita Kinart, Ann Lissens (Zentrum für Chirurgische Technologien, KU Leuven, Leuven, Belgien). Jo Verbinnen und Kristof Reyniers (Vesalius Institut für Anatomie, Medizinische Fakultät, KU Leuven, Leuven, Belgien) lieferten während des Experiments technische Unterstützung. Wir danken Leen Mortier für die Hilfe bei der Daten- und Manuskriptverwaltung. Wir danken FEG Textiltechniken für die Herstellung von Prototypenmasten, sterilisieren sie und spenden sie bedingungslos für die Forschung.
Materialien
| Name | Company | Catalog Number | Comments |
| Animals: | |||
| parous female sheep (45 - 65 kg) | Zoötechnical Institute of the KU Leuven | NA | experimetnal animal |
| Sterile clothing: | |||
| sterile drape 45 x 75 cm | Lohmann & Rauscher, Regensdorf, Germany | 33002 | other material |
| sterile OR drape 150 x 180 cm | Lohmann & Rauscher, Regensdorf, Germany | 33009 | other material |
| sterile glowes 2x | Lohmann & Rauscher, Regensdorf, Germany | 16652 | other material |
| sterile surgical gown 2x | Lohmann & Rauscher, Regensdorf, Germany | 19342 | other material |
| surgical head cap 2x | Lohmann & Rauscher, Regensdorf, Germany | 17427 | other material |
| surgical face mask 2x | Lohmann & Rauscher, Regensdorf, Germany | 11983 | other material |
| Other surgical material | |||
| implant | FEG Textiltechnik GmbH, Aachen, Germany | NA | purposely designed implant |
| 3/0 polypropylene suture | Prolene, Ethicon, Diegem, Belgium | 8762H | suture material |
| 3/0 polygecaprone suture | Vicryl, Ethicon | J311H | suture material |
| gauze swabs 10 x 10 cm 10x, 12-ply | Lohmann & Rauscher, Regensdorf, Germany | 11574 | other material |
| syringe 20 mL | Becton Dickinsosn S.A., Madrid, Spain | 300613 | aqua-dissection |
| needle 16 gauge | Terumo, Leuven, Belgium | NN-2238R | aqua-dissection |
| Surgical equipment: | |||
| blade no.22 | Fine science isntruments, Heidelberg, Germany | 10022-00 | surgical instruments |
| Allis tissue forceps 1x | Fine science isntruments, Heidelberg, Germany | 11091-15 | surgical instruments |
| Standart pattern forceps 1x2 theeth 1x | Fine science isntruments, Heidelberg, Germany | 11023-14 | surgical instruments |
| Standart pattern forceps straight serrated 1x | Fine science isntruments, Heidelberg, Germany | 11000-14 | surgical instruments |
| Scalpel handle 1x | Fine science isntruments, Heidelberg, Germany | 10004-13 | surgical instruments |
| Halstead-Mosquito forceps 2x | Fine science isntruments, Heidelberg, Germany | 13008-12 | surgical instruments |
| Standart pattern scissors 1x | Fine science isntruments, Heidelberg, Germany | 14001-14 | surgical instruments |
| Metzenbaum scissors 1x | Fine science isntruments, Heidelberg, Germany | 14016-18 | surgical instruments |
| Crile Wood needle holder 1x | Fine science isntruments, Heidelberg, Germany | 12003-15 | surgical instruments |
| Kell forceps 1x | Fine science isntruments, Heidelberg, Germany | 13018-14 | surgical instruments |
| Long Starr Self-Retaining Retractor with eight 5mm sharp stay hooks | Cooper Surgical, Tumbull, USA | 3704 | surgical instruments |
| Heaney Simon Vaginal Retractor | Medical supplies & equipments co., Katy, Texas, USA | 403-129FSI | surgical instruments |
| Trocar (Insnare) | Bard, West Sussex, United Kingdom | NA | any trocar on market for transvaginal mesh implantation |
| Medication: | |||
| amoxilicilline clavulanate 1000mg / 300 mL (Ampiciline) | GSK, Wavre, Belgium | NA | antibiotics |
| buprenorfin 0.3 mg/mL + chlorocresol 1.35 mg/mL (Vetregesic) | Ecuphar, Oostkamp, Belgium | NA | analgesia |
| ketamin HCL 100mg/mL (Ketamine 1000) | Ceva Sante Animale, Brussels, Belgium | NA | anesthesia |
| isoflurane (IsoFlo) | Abbott Laboratories Ltd, Maidenhead, Berkshire, UK | NA | anesthesia |
| polyvidone iodium 7.5% (Braunol) | B. Braun Medical, Machelen, Belgium | NA | local desinfection |
| saline solution 500ml | B. Braun Medical, Machelen, Belgium | NA | aqua-dissection |
| Xxylazine HCl , 1 mL/50 kg | Vexylan, Ceva Sante Animale, Belgium | NA | premedication |
| atropine Sulfate 15 mg/ml (), | Viatris, Belgium | NA | premedication |
Referenzen
- Glazener, C., et al. Childbirth and prolapse: Long-term associations with the symptoms and objective measurement of pelvic organ prolapse. BJOG An Int. J. Obstet. Gynaecol. 120 (2), 161-168 (2013).
- Jia, X., et al. Efficacy and safety of using mesh or grafts in surgery for anterior and/or posterior vaginal wall prolapse: systematic review and meta-analysis. BJOG. 115 (11), 1350-1361 (2008).
- Maher, C., et al. Transvaginal mesh or grafts compared with native tissue repair for vaginal prolapse. Review. 2 (2), 10-13 (2016).
- Nieminen, K., et al. Outcomes after anterior vaginal wall repair with mesh: a randomized, controlled trial with a 3 year follow-up. Am. J. Obstet. Gynecol. 203 (3), e1-e8 (2010).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: a review. Eur. J. Obstet. Gynecol. Reprod. Biol. 144, S146-S158 (2009).
- Couri, B., Lenis, A., Borazjani, A., Paraiso, M. F. R., Damaser, M. S. Animal models of female pelvic organ prolapse: lessons learned. Expert Rev. Obs. Gynecol. 7 (3), 249-260 (2012).
- Deprest, J., et al. The biology behind fascial defects and the use of implants in pelvic organ prolapse repair. Int. Urogynecol. J. Pelvic Floor Dysfunct. 17, S16-S25 (2006).
- Ozog, Y., Mazza, E., De Ridder, D., Deprest, J. Biomechanical effects of polyglecaprone fibers in a polypropylene mesh after abdominal and rectovaginal implantation in a rabbit. Int. Urogynecol. J. 23 (10), 1397-1402 (2012).
- Manodoro, S., et al. Graft-related complications and biaxial tensiometry following experimental vaginal implantation of flat mesh of variable dimensions. BJOG. 120 (2), 244-250 (2013).
- Endo, M., et al. Cross-linked xenogenic collagen implantation in the sheep model for vaginal surgery. Gynecol. Surg. , 113-122 (2015).
- Feola, A., et al. Host reaction to vaginally inserted collagen containing polypropylene implants in sheep. Am. J. Obstet. Gynecol. 212 (4), e1-e474 (2015).
- Barnhart, K. T., et al. Baseline dimensions of the human vagina. Hum. Reprod. 21 (6), 1618-1622 (2006).
- Tayrac, R., Alves, A., Thérin, M. Collagen-coated vs noncoated low-weight polypropylene meshes in a sheep model for vaginal surgery. A pilot study. Int. Urogynecol. J. Pelvic Floor Dysfunct. 18 (5), 513-520 (2007).
- Sobiraj, A., Busse, G., I, H. B. O. S. E. D. Ivastigation into the blood plasma profiles progesterone in sheep sufferingform vaignal inversion and prolapse. Br. Vet. J. 142 (142), 218-223 (1986).
- Reisenauer, C., Kirschniak, A., Drews, U., Wallwiener, D. Anatomical conditions for pelvic floor reconstruction with polypropylene implant and its application for the treatment of vaginal prolapse. Eur. J. Obstet. Gynecol. Reprod. Biol. 131, 214-225 (2007).
- Carey, M., Slack, M., Higgs, P., Wynn-Williams, M., Cornish, A. Vaginal surgery for pelvic organ prolapse using mesh and a vaginal support device. BJOG An Int. J. Obstet. Gynaecol. 115 (3), 391-397 (2008).
- Urbankova, I., et al. Comparative anatomy of the ovine and female pelvis. Gynecol. Obstet. Invest. , (2016).
- Maurer, M. M., Röhrnbauer, B., Feola, a., Deprest, J., Mazza, E. Mechanical biocompatibility of prosthetic meshes: A comprehensive protocol for mechanical characterization. J. Mech. Behav. Biomed. Mater. 40, 42-58 (2014).
- Leval, J. Novel Surgical Technique for the Treatment of Female Stress Urinary Incontinence. Transobturator Vaginal Tape Inside-Out. Eur. Urol. 44 (6), 724-730 (2003).
- Reisenauer, C., Kirschniak, A., Drews, U., Wallwiener, D. Transobturator vaginal tape inside-out. Eur. J. Obstet. Gynecol. Reprod. Biol. 127 (1), 123-129 (2006).
- Bafghi, A., et al. Bowel perforation as late complication of tension-free vaginal tape. J Gynecol Obs. Biol Reprod. 34 (6), 606-607 (2005).
- Hinoul, P., Vanormelingen, L., Roovers, J. P., de Jonge, E., Smajda, S. Anatomical variability in the trajectory of the inside-out transobturator vaginal tape technique (TVT-O). Int. Urogynecol. J. Pelvic Floor Dysfunct. 18 (10), 1201-1206 (2007).
- Schaller, O., et al. . Illustrated Veterinary Anatomical Nomenclature. , (2007).
- . Serious Complications Associated with Transvaginal Placement of Surgical Mesh for Pelvic Organ Prolapse. FDA Safety Communication. , (2016).
- Reinier, M., Groep, G. Final Opinion on the use of meshes in urogynecological surgery. SCENIHR- European Commission. , (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten