需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
经阴道网格插入在牛模型中
摘要
该方案描述了使用单一阴道切口技术在羊直肠阴道隔膜中进行网状植入,有无套管针引导插入锚固臂。
摘要
该方案描述了使用单一的阴道切口技术将丝网插入到绵羊的直肠阴道隔膜中,在有和没有针刺引导下插入锚固臂。可汗绵羊进行直肠阴道隔膜的解剖,然后插入有或没有四个锚定臂的植入物,两者设计成适合羊的解剖结构。使用套管针和"外在"技术将锚固臂放置在适当位置。颅臂通过闭孔器,小腿肌和内收肌肌肉。尾部臂固定在骶骨韧带附近,通过尾骨肌肉。这种技术允许模仿在患有盆腔器官脱垂的妇女中进行的外科手术。解剖空间和元素容易识别。手术最关键的部分是插入颅内套管针,可以很容易地穿透腹膜腔或周围的盆腔器官。氏可以通过更广泛的腹膜后解剖和更多侧向引导套管针来避免。这种方法仅用于大型动物模型中的新型植入物的实验测试,因为临床上目前没有使用针灸引导插入。
引言
盆腔器官脱垂在一半以上的妇女临床诊断,至少有一名阴道分娩,但从主观上讲,其中一半的女性整体感染1例 。治疗的主要是使用任一天然组织或植入材料手术重建,但每一种方法都有其局限性,包括复发或局部并发症2,3,4。理想的植入物尚未确定;因此,在向市场推出新产品和技术之前,对产品创新的持续需求以及开发临床前实验的适当管道。一个在此轨道中的步骤是在合适的动物模型5实验评估,6。理想情况下,它们应该模仿解剖,生物力学和生物环境。当谈到th对新型植入物的实验评估,通常在较小的模型中首先测试,用于生物相容性或重建腹壁缺陷。这种类型的实验受到批评,因为植入物没有插入感兴趣的区域( 即阴道) 7 。阴道手术模型更为稀缺,当实验的目标是记录外植体的生物力学特征时,肯定是这样。因此,有一只兔从兔子移到了羊8 。成年母羊是大型动物模型,具有相当大小和可及的阴道。它们可被用于新的植入物的中期评估,并且能够再现阴道暴露与某些材料9,10,11,12,13。不仅尺寸和解剖学的阴道和盆底与人类相当,但也发生在发生在15%的母羊中的脱垂的自发性发生。脱出的危险因素是重叠的( 即,multiparity,POP的既往史,增加更高的体重引起的腹内压或丘陵,且(植物)的雌激素效果可比放牧时)6,14。在欧洲,羊是唯一合理的选择,因为对非人灵长类动物的研究几乎完全被禁止。在这里,通过模拟使用套管针和导向器的植入物的经阴道插入,将网格进一步放置到正阴 - 阴道隔膜中,进一步模型。这之后,通过固定用带通过肌肉的韧带,其可以被认为等同于临床实践15,16臂锚定植入物。到目前为止,这种技术虽然许多人认为由于使用这些较长的条和/或解剖结构的刺穿可能会发生特定的并发症。
在早期详细的解剖学研究中,将卵巢盆底与女性骨盆17进行了比较。当涉及到植入物的锚固时,羊不具有骶棘状韧带,但它们确实具有非常发达和广泛的骶骨韧带。阴部神经在其上方运行,使得这个地标作为悬浮点不安全。相反,尾骨肌及其筋膜以及闭孔膜可通过直肠阴道空间进入。这里提出了用于固定锚固臂的解剖结构的进入和位置。讨论了可用于定位网格的仪器。最后,武器或套管针对相邻解剖结构(如血管和神经)的关系,a也有潜在的术中并发症。
研究方案
该实验的伦理批准是从鲁汶大学动物实验伦理委员会(P065 / 2013)获得的。根据现行国家动物福利准则处理动物。
材料与实验动物
- 手术准备
- 在外科手术室中覆盖一张无菌悬垂的桌子,并准备一个无菌弯曲的套管针( 图1 , 图 A),无菌手术器械,缝合线和无菌纱布。如果实验包括随访,则在无菌条件下进行整个外科手术。将所有仪器放在桌子上,准备在手术期间使用。
- 从无菌包装中取出一个无菌的矩形植入物和/或具有锚固臂的植入物,并将它们放在用无菌悬垂覆盖的桌子上( 图1B , C和D )。
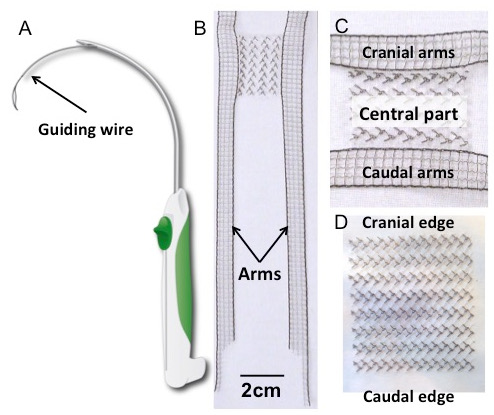
图1:套管针和植入物。 ( 一 )套管针示意图。 ( B )H型聚偏二氟乙烯(PVDF)植入物,具有中心部分的细节(图C )。其形状受到目前可用于经阴道脱垂修复的四臂网格的启发。矩形体(30×40mm 2 )通过四个伸出的臂(150×10mm 2 )横向延伸。武器的尺寸设计得足够长,刺破相关悬架结构的基础上,早期的解剖学研究17。 ( D )矩形植入物(30×40mm 2 )。两种植入物均为聚偏氟乙烯;纺织品特性和性能见表1 。
- 实验动物(Ewe,45-60公斤)
- 在外科手术前30分钟,管理1毫升15毫克/毫升硫酸阿托品和1毫升/ 50公斤肌内(im)的甲苯噻嗪。
- 30分钟后,确保预防措施使羊昏昏欲睡。
- 将静脉内导管插入颈静脉,给予0.075 mL / kg氯胺酮100mg / mL HCl。通过观察对疼痛刺激的反应缺乏确认深度麻醉。
- 将动物移动到手术台上,并通过插管固定其气道。用5%异氟烷在5 L / min氧气中维持麻醉。
- 将静脉管线插入颈静脉,并以150 mL / h的流速供应500 mL盐水溶液。
- 根据当地方案,管理预防性抗生素(阿莫西林克拉维酸,7 mg / kg)和术后镇痛药(丁丙诺啡和氯甲酚,1 mL)或等效抗生素。
- 把动物放在灯光下髋关节位置在手术台的末端,并使用绳索( 图2 , 图 A)固定其四肢,臀部处于超屈曲状态。
- 通过阴道推动膀胱和直肠手术。
- 剃视会阴部,大腿的中间部分,尾部折叠并用聚维酮7.5%消毒( 图2 , 图 B和C)。
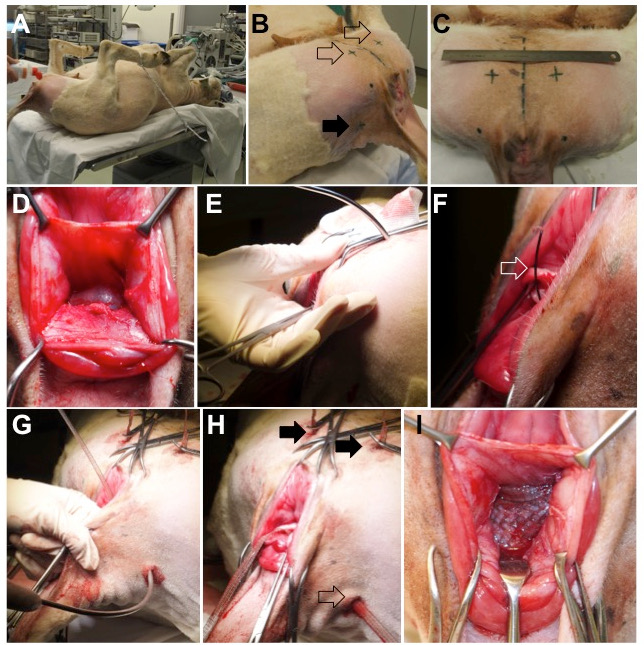
图2:动物手术。 ( A )放置在仰卧位的羊,臀部通过固定下肢而弯曲。 ( B )套管针插入的外部入口点位于腹侧(空箭头),侧背侧折叠(全箭头)。 ( C )腹侧插入点的位置;中间的虚线代表动物的正中飞机。 ( D )解剖直肠阴道隔膜。 ( E )腹侧套管穿过大腿内侧,闭孔和阴道空间的肌肉插入。穿刺套管针的轨迹由手指控制。 ( F和G )一旦套针针就位,电线吊带(打开箭头)前进,并加载阴道网的臂。 ( H )腹侧(全箭头)和背部(空箭头)臂的最终位置。 ( 一 )中央部位在阴道壁与直肠外膜之间无张力放置。
- 准备在无菌条件下进行手术的人员。戴上手术帽和口罩,手洗手术,并穿上手术衣和无菌手套。
- 用无菌悬垂覆盖动物,并在生殖器上方开一个开口裂孔。
外科手术
- 直肠阴道隔膜的制备
- 使用Allis镊子将背侧阴道壁3厘米颅骨到hymeneal环。
- 取一个装有10mL盐水的注射器,并装上22 G针头。将其穿过阴道上皮(约3-4mm深)并插入直肠阴道隔膜的中线,1.5厘米颅骨至阴沟。
- 通过在阴道隔膜11注射盐水进行"水解"。
- 在阴道上皮做一个3厘米长的中线切口,开始尾部到Allis镊子(步骤2.1.1),并使用手术刀在hymeneal戒指结束。通过这个切口进入正阴阴道。
- 将自固位牵开器(见材料表 )放置在会阴上,并将四个尖锐的钩钩放在阴道切口中以保持开口。
- 用你的手指,将阴道筋膜从阴道壁向侧面朝向盆腔侧壁直肠解剖,并直到头部的尾部。为网格的30 x 40 mm 2中心部分创建合适的空间( 图2 , 图 D)。
- 必要时用止血钳或十字形止血结扎器进行止血。
注意:小排气管可以用止血钳钳住。这破坏了血管并启动了自然凝血级联。为了更强的出血,用镊子抓住出血血管并放置十字交叉扎结,用方形结固定。在这一点上,可以插入矩形植入物(步骤2.2)或继续进行解剖,以用固定臂插入植入物(步骤2.3)。
- 平面网格插入
- 将阴道牵开器插入阴道切口,以便更好地观察解剖区域的头部。
- 在解剖的阴道阴道空间的最颅侧面的左侧和右侧,用简单的中断的3/0聚丙烯缝合线缝合植入物的左右颅角。切割残留的缝合材料。保持缝合线远离阴道腔( 即不渗透阴道壁)。
注意:植入物总是缝合到包括直肠阴道隔膜的结缔组织。如果缝线材料不能在阴道中看到,阴道壁就不会渗透。 - 沿着植入物的颅骨部位中途添加一个额外的简单中断缝合线。
- 用简单的中断3/0聚丙烯将植入物的侧边缘缝合到周围的结缔组织上。保持植入物尽可能平坦,无张力。
- 在左侧和右侧用简单的3/0聚丙烯缝合线缝合左右尾角直肠阴道空间最尾端的两侧。
- 沿着植入物的尾部方向,在中途添加一个简单的中断缝合线。
- 用运行中的3/0聚乳酸酶缝线闭合阴道切口。
- 植入物插入和锚定(套管针引导技术)。
- 继续解剖步骤2.1中创建的正阴阴部空间,以达到闭孔孔的内侧,这可以很容易触发。
- 解剖空间caudo横向到达骶骨韧带和尾部定位的尾骨肌肉的尾部。
- 没有。 24叶片,在外阴四侧切开1厘米宽的切口,穿过皮肤和浅层肌筋膜( 图2 , 图 B和C)。
- 在大腿的内侧形成两个"腹侧"切口,距离尾部边界近4厘米颅骨f坐标系( 即联合下边界)和距离中线3厘米( 图2 , 图 C)。
- 在插入尾部褶皱的水平上进行两个"背侧"切口,其中可以容易触摸到块茎的2厘米内侧( 图2 , 图 B)。
- 将一个弯曲的套管穿过其中一个腹侧切口( 图2 , 图 E)。
- 通过套管针穿过内收肌肉肌肉,外部闭孔和封闭孔的内侧。
- 用插入阴道切口的手指控制套管针的进展。将其尖端指向提肌肛肌的腱弧( 图2 , 图 E)。
- 将引导线暴露在阴道壁切口中,并用相应的同侧颅网臂( 图2 , 图 F)装载。
- 拉起套管针,装上m通过上述结构。保持手臂无张力。
- 通过第二个颅臂通过动物另一侧的腹侧切口重复该过程。
- 通过背部切口之一,将套管针穿过尾骨肌肉,仅在骶骨韧带的远端( 图2 , 图 G)。
- 将导丝穿过阴道切口,抓住网状物的背部手臂,将其拉出。保持手臂无张力和重复在另一边。
- 通过使其平坦化并对臂施加张力来调整网格的位置,但保持网格无张力( 图2, 图 I; 图3 )。
- 用一个简单的中断的3/0聚丙烯缝合线固定在网状物的尾部中部,将其固定在周围的结缔组织上。
- 将手臂切开皮肤水平,并用简单中断的3/0 polygl关闭所有皮肤切口ecaprone缝线( 图2 , 图 H)。
- 用跑步的3/0聚吡咯胶缝合阴道切口。
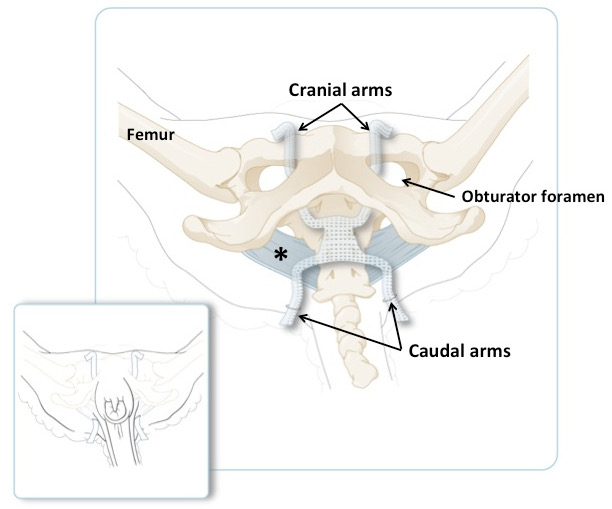
图3:桡骨穿过闭孔器和穿过尾部折叠的尾部的桡骨的示意图。广泛的骶骨韧带呈蓝色。更小的面板在缩短过量的材料之前说明了臂在放置位置的动物上的位置。主面板显示相同但皮肤和肌肉被去除。
结果
管理在更长的观察设置
在外科手术之后,可以插入阴道包装(在手术后立即插入阴道中的盐水溶液浸泡的纱布包装)24小时以固定植入物位置。羊应该放在恢复笼中,其呼吸功能直到完全恢复。后来,它可以放置在稳定的羊,并允许其自由移动和喝酒, 自由进食 。阴道包装,如果存在,必须在手术后24小?...
讨论
在这里,我们描述了羊的实验过程,旨在模拟具有或不具有锚固臂的植入物的阴道解剖和经阴道网插入。后续的步骤和仪器通过POP和压力性尿失禁15,16,19,20进行的外科手术的启发。在初步的解剖学解剖之后,在实验中插入网孔时仍然存在一些问题。在第一只动物中,发现了一个穿孔在腹腔内的脱?...
披露声明
这项关于羊模型的研究计划得到了Medri和Blasingame,Burch,Garrard和Ashley(美国亚特兰大GA)的无条件补助。协议由鲁汶研发中心办公室处理。赞助商没有干扰本实验的规划,执行或报告,也没有拥有结果。 NS和LH是FP7框架(Bip-Upy项目; NMP3-LA-2012-310389)中EC的拨款的接收者。 AF获得了欧盟委员会在行业 - 学术合作伙伴计划(251356)的资助。
致谢
感谢Ivan Laermans,Rosita Kinart,Ann Lissens(外科技术中心,比利时鲁汶KU Leuven)。 Jo Verbinnen和Kristof Reyniers(比利时鲁汶KU Leuven医学院Vesalius解剖学研究所)在实验过程中提供了技术支持。感谢Leen Mortier对数据和手稿管理的帮助。我们感谢FEG Textiltechniken制造原型网格,对其进行消毒,并无条件捐赠给研究机构。
材料
| Name | Company | Catalog Number | Comments |
| Animals: | |||
| parous female sheep (45 - 65 kg) | Zoötechnical Institute of the KU Leuven | NA | experimetnal animal |
| Sterile clothing: | |||
| sterile drape 45 x 75 cm | Lohmann & Rauscher, Regensdorf, Germany | 33002 | other material |
| sterile OR drape 150 x 180 cm | Lohmann & Rauscher, Regensdorf, Germany | 33009 | other material |
| sterile glowes 2x | Lohmann & Rauscher, Regensdorf, Germany | 16652 | other material |
| sterile surgical gown 2x | Lohmann & Rauscher, Regensdorf, Germany | 19342 | other material |
| surgical head cap 2x | Lohmann & Rauscher, Regensdorf, Germany | 17427 | other material |
| surgical face mask 2x | Lohmann & Rauscher, Regensdorf, Germany | 11983 | other material |
| Other surgical material | |||
| implant | FEG Textiltechnik GmbH, Aachen, Germany | NA | purposely designed implant |
| 3/0 polypropylene suture | Prolene, Ethicon, Diegem, Belgium | 8762H | suture material |
| 3/0 polygecaprone suture | Vicryl, Ethicon | J311H | suture material |
| gauze swabs 10 x 10 cm 10x, 12-ply | Lohmann & Rauscher, Regensdorf, Germany | 11574 | other material |
| syringe 20 mL | Becton Dickinsosn S.A., Madrid, Spain | 300613 | aqua-dissection |
| needle 16 gauge | Terumo, Leuven, Belgium | NN-2238R | aqua-dissection |
| Surgical equipment: | |||
| blade no.22 | Fine science isntruments, Heidelberg, Germany | 10022-00 | surgical instruments |
| Allis tissue forceps 1x | Fine science isntruments, Heidelberg, Germany | 11091-15 | surgical instruments |
| Standart pattern forceps 1x2 theeth 1x | Fine science isntruments, Heidelberg, Germany | 11023-14 | surgical instruments |
| Standart pattern forceps straight serrated 1x | Fine science isntruments, Heidelberg, Germany | 11000-14 | surgical instruments |
| Scalpel handle 1x | Fine science isntruments, Heidelberg, Germany | 10004-13 | surgical instruments |
| Halstead-Mosquito forceps 2x | Fine science isntruments, Heidelberg, Germany | 13008-12 | surgical instruments |
| Standart pattern scissors 1x | Fine science isntruments, Heidelberg, Germany | 14001-14 | surgical instruments |
| Metzenbaum scissors 1x | Fine science isntruments, Heidelberg, Germany | 14016-18 | surgical instruments |
| Crile Wood needle holder 1x | Fine science isntruments, Heidelberg, Germany | 12003-15 | surgical instruments |
| Kell forceps 1x | Fine science isntruments, Heidelberg, Germany | 13018-14 | surgical instruments |
| Long Starr Self-Retaining Retractor with eight 5mm sharp stay hooks | Cooper Surgical, Tumbull, USA | 3704 | surgical instruments |
| Heaney Simon Vaginal Retractor | Medical supplies & equipments co., Katy, Texas, USA | 403-129FSI | surgical instruments |
| Trocar (Insnare) | Bard, West Sussex, United Kingdom | NA | any trocar on market for transvaginal mesh implantation |
| Medication: | |||
| amoxilicilline clavulanate 1000mg / 300 mL (Ampiciline) | GSK, Wavre, Belgium | NA | antibiotics |
| buprenorfin 0.3 mg/mL + chlorocresol 1.35 mg/mL (Vetregesic) | Ecuphar, Oostkamp, Belgium | NA | analgesia |
| ketamin HCL 100mg/mL (Ketamine 1000) | Ceva Sante Animale, Brussels, Belgium | NA | anesthesia |
| isoflurane (IsoFlo) | Abbott Laboratories Ltd, Maidenhead, Berkshire, UK | NA | anesthesia |
| polyvidone iodium 7.5% (Braunol) | B. Braun Medical, Machelen, Belgium | NA | local desinfection |
| saline solution 500ml | B. Braun Medical, Machelen, Belgium | NA | aqua-dissection |
| Xxylazine HCl , 1 mL/50 kg | Vexylan, Ceva Sante Animale, Belgium | NA | premedication |
| atropine Sulfate 15 mg/ml (), | Viatris, Belgium | NA | premedication |
参考文献
- Glazener, C., et al. Childbirth and prolapse: Long-term associations with the symptoms and objective measurement of pelvic organ prolapse. BJOG An Int. J. Obstet. Gynaecol. 120 (2), 161-168 (2013).
- Jia, X., et al. Efficacy and safety of using mesh or grafts in surgery for anterior and/or posterior vaginal wall prolapse: systematic review and meta-analysis. BJOG. 115 (11), 1350-1361 (2008).
- Maher, C., et al. Transvaginal mesh or grafts compared with native tissue repair for vaginal prolapse. Review. 2 (2), 10-13 (2016).
- Nieminen, K., et al. Outcomes after anterior vaginal wall repair with mesh: a randomized, controlled trial with a 3 year follow-up. Am. J. Obstet. Gynecol. 203 (3), e1-e8 (2010).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: a review. Eur. J. Obstet. Gynecol. Reprod. Biol. 144, S146-S158 (2009).
- Couri, B., Lenis, A., Borazjani, A., Paraiso, M. F. R., Damaser, M. S. Animal models of female pelvic organ prolapse: lessons learned. Expert Rev. Obs. Gynecol. 7 (3), 249-260 (2012).
- Deprest, J., et al. The biology behind fascial defects and the use of implants in pelvic organ prolapse repair. Int. Urogynecol. J. Pelvic Floor Dysfunct. 17, S16-S25 (2006).
- Ozog, Y., Mazza, E., De Ridder, D., Deprest, J. Biomechanical effects of polyglecaprone fibers in a polypropylene mesh after abdominal and rectovaginal implantation in a rabbit. Int. Urogynecol. J. 23 (10), 1397-1402 (2012).
- Manodoro, S., et al. Graft-related complications and biaxial tensiometry following experimental vaginal implantation of flat mesh of variable dimensions. BJOG. 120 (2), 244-250 (2013).
- Endo, M., et al. Cross-linked xenogenic collagen implantation in the sheep model for vaginal surgery. Gynecol. Surg. , 113-122 (2015).
- Feola, A., et al. Host reaction to vaginally inserted collagen containing polypropylene implants in sheep. Am. J. Obstet. Gynecol. 212 (4), e1-e474 (2015).
- Barnhart, K. T., et al. Baseline dimensions of the human vagina. Hum. Reprod. 21 (6), 1618-1622 (2006).
- Tayrac, R., Alves, A., Thérin, M. Collagen-coated vs noncoated low-weight polypropylene meshes in a sheep model for vaginal surgery. A pilot study. Int. Urogynecol. J. Pelvic Floor Dysfunct. 18 (5), 513-520 (2007).
- Sobiraj, A., Busse, G., I, H. B. O. S. E. D. Ivastigation into the blood plasma profiles progesterone in sheep sufferingform vaignal inversion and prolapse. Br. Vet. J. 142 (142), 218-223 (1986).
- Reisenauer, C., Kirschniak, A., Drews, U., Wallwiener, D. Anatomical conditions for pelvic floor reconstruction with polypropylene implant and its application for the treatment of vaginal prolapse. Eur. J. Obstet. Gynecol. Reprod. Biol. 131, 214-225 (2007).
- Carey, M., Slack, M., Higgs, P., Wynn-Williams, M., Cornish, A. Vaginal surgery for pelvic organ prolapse using mesh and a vaginal support device. BJOG An Int. J. Obstet. Gynaecol. 115 (3), 391-397 (2008).
- Urbankova, I., et al. Comparative anatomy of the ovine and female pelvis. Gynecol. Obstet. Invest. , (2016).
- Maurer, M. M., Röhrnbauer, B., Feola, a., Deprest, J., Mazza, E. Mechanical biocompatibility of prosthetic meshes: A comprehensive protocol for mechanical characterization. J. Mech. Behav. Biomed. Mater. 40, 42-58 (2014).
- Leval, J. Novel Surgical Technique for the Treatment of Female Stress Urinary Incontinence. Transobturator Vaginal Tape Inside-Out. Eur. Urol. 44 (6), 724-730 (2003).
- Reisenauer, C., Kirschniak, A., Drews, U., Wallwiener, D. Transobturator vaginal tape inside-out. Eur. J. Obstet. Gynecol. Reprod. Biol. 127 (1), 123-129 (2006).
- Bafghi, A., et al. Bowel perforation as late complication of tension-free vaginal tape. J Gynecol Obs. Biol Reprod. 34 (6), 606-607 (2005).
- Hinoul, P., Vanormelingen, L., Roovers, J. P., de Jonge, E., Smajda, S. Anatomical variability in the trajectory of the inside-out transobturator vaginal tape technique (TVT-O). Int. Urogynecol. J. Pelvic Floor Dysfunct. 18 (10), 1201-1206 (2007).
- Schaller, O., et al. . Illustrated Veterinary Anatomical Nomenclature. , (2007).
- . Serious Complications Associated with Transvaginal Placement of Surgical Mesh for Pelvic Organ Prolapse. FDA Safety Communication. , (2016).
- Reinier, M., Groep, G. Final Opinion on the use of meshes in urogynecological surgery. SCENIHR- European Commission. , (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。