このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヒツジモデルにおける経膣メッシュの挿入
要約
このプロトコルは、固定アームのトロカール誘導挿入の有無にかかわらず、単一の膣切開技術を使用して、ヒツジの直腸膣中隔のメッシュ移植を記述する。
要約
このプロトコルは、単一の膣切開技術を用いて、固定アームのトロカール誘導挿入の有無にかかわらず、ヒツジの直腸膣中隔へのメッシュ挿入を記述する。羊の羊は、直腸膣中隔の切開を行い、続いて、両方とも卵の解剖学的構造に適合するように設計された4つのアンカーアームの有無にかかわらずインプラントを挿入した。アンカーアームは、トロカールおよび「外部イン」技術を用いて適所に置かれた。頭蓋腕は、閉鎖具、グラシリス、および内転筋の筋肉を通過した。尾側腕は、尾骨筋を介して、仙骨靭帯の近くに固定された。この技術は、骨盤臓器脱を患っている女性で行われる外科手術の模倣を可能にする。解剖学的空間および要素は容易に識別される。処置の最も重要な部分は、腹腔または周囲の骨盤臓器に容易に浸透することができる頭蓋トロカールの挿入である。ティより広範な後腹膜切開およびトロカールをより横方向に誘導することによって避けることができる。このアプローチは、トロカールガイド挿入が現在臨床的に使用されていないため、大きな動物モデルにおける新規インプラントの実験的試験のためにのみ設計されている。
概要
骨盤臓器脱は、少なくとも1回の膣分娩を経験した女性の半分で臨床的に診断されるが、主観的には、女性全体の半分が煩わしい1 。治療の主力は、天然の組織またはインプラント材料のいずれかを使用して外科的再建であり、これらの方法のそれぞれは、再発または局所合併症2、3、4を含むその限界を有します。理想的なインプラントはまだ同定されていません。したがって、新製品および技術が市場に導入される前に、製品革新および前臨床実験のための適切なパイプラインの開発が継続的に求められています。このトラックのステップの一つは、適切な動物モデル5,6に実験的評価です。理想的には、解剖学的、生体力学的、および生物学的環境を模倣すべきである。それはthになると新規インプラントの実験的評価では、生体適合性のために、または腹壁欠陥の再構築のために、より小さいモデルで最初に試験される。そのタイプの実験は、インプラントが関心のある領域( すなわち、膣)に挿入されないために批判されている7 。膣手術モデルは、実験の目的が外植片の生体力学的特徴を記録することである場合は確かに、より希少である。このため、ウサギから羊への移動がありました8 。大人の雌は、合理的な大きさと接近可能な膣を有する大動物モデルである。彼らは、新規なインプラントの中間評価のために使用することができ、特定の材料9、10、11、12、13を膣露光を再現することが可能です。寸法と解剖学だけでなく卵の膣および骨盤底のレベルは、ヒトのレベルに匹敵するだけでなく、卵の15%に生じる脱出の自発的発生もある。脱出の危険因子が重なっている6、14( すなわち、multiparity、POPの既往歴は、より高い体重ときや丘に放牧、及び(フィト)エストロゲンの同等の効果によって誘導される腹腔内圧を増加させました)。ヨーロッパでは、非ヒト霊長類に関する研究がほぼ完全に禁止されているため、羊は唯一の合理的な選択肢です。ここでは、モデルは、トロカールとガイドを使用してインプラントの経膣挿入を模倣することによってさらに一歩踏み出され、メッシュが直腸 - 膣中隔に配置される。これは、臨床実践15、16に等しいと考えることができる筋肉の靭帯を介して腕を固定使用してインプラントを固定することにより追跡しました。これまでのところ、この技術これらのより長いストリップの使用および/または解剖学的構造の貫通に起因して、特定の合併症が起こると多くは信じているが、研究されていない。
以前の詳細な解剖学的研究では、ヒツジ骨盤底を女性骨盤17と比較した。インプラントを固定することに関しては、ヒツジは仙棘靭帯を持たないが、非常によく発達した広範な仙棘靱帯を有する。陰部神経は胸骨の上を通っており、このランドマークを吊り点として使用することは危険です。逆に、尾骨筋およびその筋膜ならびに閉鎖膜は、直腸膣腔からアクセス可能である。ここでは、アンカーアームの固定のための解剖学的構造のアクセスおよび位置が提案される。メッシュの配置に使用できる器具について説明します。最後に、血管または神経などの隣接する解剖学的構造に対する腕またはトロカールの関係潜在的な術中合併症と同様に、記載されている。
プロトコル
この実験の倫理的承認は、KUルーベンの動物実験倫理委員会(P065 / 2013)から得られたものです。動物は、現在の動物福祉に関する全国ガイドラインに従って治療された。
材料と実験動物
- 手術準備
- 外科手術用劇場では、滅菌ドレープを備えたテーブルを覆い、1つの滅菌湾曲したトロカール( 図1 、パネルA)、滅菌手術器具、縫合糸、および無菌ガーゼを準備する。実験にフォローアップが含まれている場合は、無菌状態で全手術を実施してください。手術中に使用できるように、テーブル上のすべての器具を準備します。
- 無菌長方形インプラントおよび/または固定アームを有するインプラントを無菌パッケージから取り出し、無菌ドレープで覆われたテーブル上に置く( 図1B 、 CおよびD )。
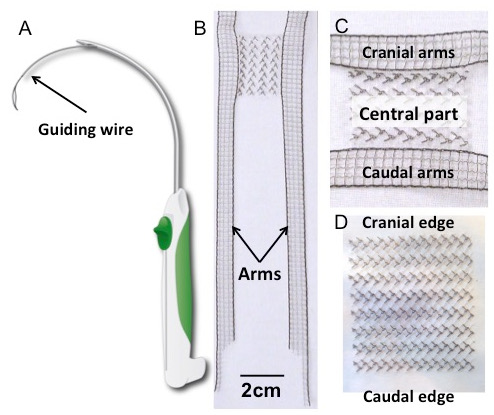
図1:トロカールとインプラント ( A )トロカールの模式図。 ( B )H型のポリフッ化ビニリデン(PVDF)インプラント、中央部の詳細(パネルC )。その形状は、経膣膣脱毛修復のために現在利用可能な4つの腕のメッシュによって鼓舞された。長方形の本体(30×40mm 2 )は、4本の伸長アーム(150×10mm 2 )によって側方に伸長される。アームの寸法は、以前の解剖学的研究に基づいて、関連するサスペンション構造を穿孔するのに十分長いように設計されている17 。 ( D )長方形インプラント(30×40mm 2 )。両方のインプラントはポリフッ化ビニリデンでできていた。繊維特性および特性を表1に示す 。
- 実験動物(Ewe、45~60kg)
- 手術手技の30分前に15mg / mLの硫酸アトロピンおよび1mL / 50kgのキシラジンHClの1mLを筋肉内(筋肉内)に前投与する。
- 30分後、前投薬によって羊が眠気となり、眠気になることを確認します。
- 静脈内カテーテルを頸静脈に挿入し、0.075mL / kgのケタミン100mg / mL HClを投与する。痛みを伴う刺激に対する反応の欠如を観察することにより、深い麻酔を確認する。
- 動物を手術台に移動し、挿管によって気道を確保する。 5L /分の酸素で2.5%のイソフルランで麻酔を維持する。
- 静脈ラインを頸静脈に挿入し、150mL / hの流速で生理食塩水500mLを供給する。
- 局所プロトコールに従って、予防的抗生物質(アモキシシリンクラブラン酸塩、7mg / kg)および術後鎮痛剤(ブプレノルフィンおよびクロロクレゾール、1mL)または同等物を投与する。
- 動物を点灯させる断熱テーブルの端に断熱的な位置を決め、ヒープを過屈曲状態にして肢をロープを用いて固定する( 図2 、パネルA)。
- 経膣的に膀胱および直腸を押すことによって、手動で空にする。
- 会陰部、大腿部の内側部分、および尾部のひだを剃り、7.5%のポリビドンで消毒する( 図2 、パネルBおよびC)。
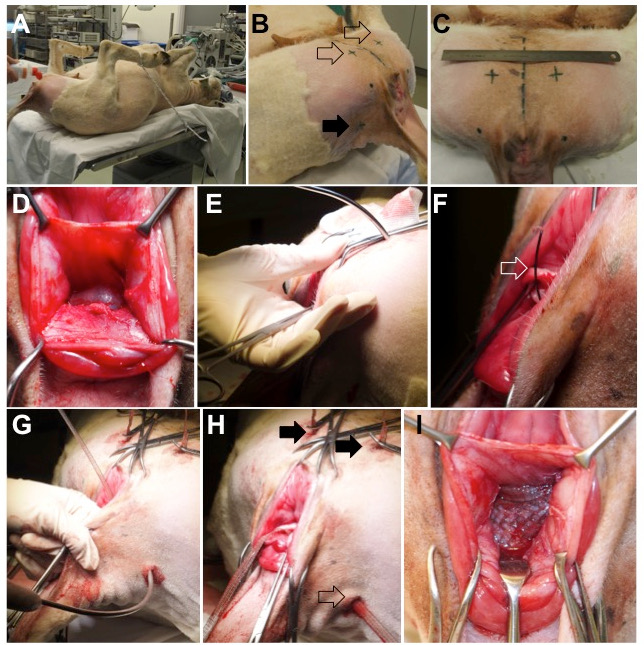
図2:動物の手術。 ( A )羊は仰臥位に置かれ、下肢を固定することによって股関節が過度に屈曲される。 ( B )トロカールの挿入のための外部入口点は、腹側(空の矢印)にあり、側方の尾のひだ(全矢印)上にある。 ( C )腹側挿入点の位置;中央の破線は、動物の中緯度面。 ( D )解剖された直腸膣中隔。 ( E )大腿内側、閉鎖孔、および膣腔内の筋肉を通して腹側トロカールを挿入する。穿刺トロカールの軌道は指で制御されます。 ( FおよびG )トロカールが所定の位置に置かれると、ワイヤースリング(開いた矢印)が前進し、膣メッシュの腕で装填される。 ( H )腹側(全矢印)および背側(空の矢印)の腕の最終位置。 ( I )中央部分は、膣壁と直腸外膜の間に緊張のない状態で配置される。
- 無菌状態で手術のための人員を準備する。外科用キャップと口マスクを着用し、手術のために手を洗い、手術用ガウンと無菌手袋を着用する。
- 動物を滅菌ドレープで覆い、生殖器の上に開口部を作ります中断。
2.外科手術
- 直腸膣中隔の調製
- Allisの鉗子を使用して、hymenealリングに頭蓋骨3cm背部の膣壁をつかむ。
- 10mLの生理食塩水を入れ、22Gの針を装着したシリンジを取る。それを膣上皮(約3〜4mmの深さ)および直腸膣中隔に挿入し、1.5cmの頭蓋骨を腎臓リングに挿入する。
- 直腸膣中隔11に生理食塩水を注入することにより、「アクア解剖」を行う。
- Allisの鉗子(ステップ2.1.1)の尾を始め、メスを使用してhymenealリングで終わる、膣上皮上の3センチメートルの正中線の切開を行います。この切開を通して膣 - 膣のスペースに入る。
- 会陰の上に自己保持型リトラクター( 表の表を参照)を置き、4つの鋭いステーフックを膣切開部に置き、開いたままにします。
- あなたの指で、鈍的に膣の筋膜を膣壁から側方に骨盤の側壁に向かって鋭く切開し、頭蓋骨上で盲嚢の尾側の面まで鋭く切開する。メッシュの30 x 40 mm 2中央部分に適切なスペースを作成します( 図2 、パネルD)。
- 必要に応じて、止血鉗子または十字止血結紮で止血を行う。
注:小さなブリーダーは、止血鉗子で締め付けることができます。これにより血管が圧壊され、自然凝固カスケードが開始される。より強い出血のために、出血血管を鉗子で把握し、十字結紮で十字結紮糸を固定する。この時点で、長方形のインプラントを挿入する(ステップ2.2)か、アンカリングアームをインプラントに挿入するために切開を続けることができる(ステップ2.3)。
- フラットメッシュ挿入
- 膣切開部に膣リトラクターを挿入して、解剖された領域の頭蓋部分。
- 切開直腸膣腔の最も頭蓋側の側面の左右に単純な中断3/0ポリプロピレン縫合糸を用いて、インプラントの左右頭頂部を縫合する。残留縫合材料を切断する。縫合糸を膣内腔から遠ざける( すなわち、膣壁を貫通させない)。
注:インプラントは、常に、直腸 - 膣中隔を構成する結合組織に縫合される。膣内に縫合材料が見えない場合、膣壁は貫通されない。 - インプラントの頭蓋骨様相に沿って途中でさらに1つの追加の単純な中断縫合糸を追加します。
- インプラントの中間の縁を包囲している3/0ポリプロピレンで周りの結合組織に縫合します。可能であれば、インプラントは平らな状態に保ち、テンションフリーにしてください
- 左右のシンプルな中断3/0ポリプロピレン縫合糸で左右の尾側隅を縫合する直腸膣腔の最も尾側の側面の側面。
- インプラントの尾側の面に沿って途中で途切れた縫合糸を追加してください。
- 実行中の3/0ポリグラクチン縫合糸で膣切開部を閉じる。
- インプラントの腕への挿入と固定(トロカールガイド技術)。
- ステップ2.1で作成した直腸 - 膣腔の解剖を頭蓋 - 腹側に継続して、容易に触診することができる閉鎖孔の内側面に到達させる。
- 嚢胞性靱帯および尾側に位置する尾骨筋の尾側に達するように、尾側 - 側方に空間を解剖する。
- いいえ。 24枚の刃で外陰部に1cm幅の切開部を4つ作り、皮膚と表在筋肉筋膜を切開する( 図2 、パネルBおよびC)。
- 太ももの内側の部分に2つの「腹部」切開部を形成し、坐骨弓( すなわち 、交配の下縁)および正中線から3cmの側方( 図2 、パネルC)。
- 簡単に触診することができる塊茎のischiadicum( 図2 、パネルB)に内側の2cm、尾のひだの挿入のレベルで2つの "背面"切開を行います。
- 湾曲したトロカールを腹側切開部の1つに配置する( 図2 、パネルE)。
- トロカールを内転筋、外部閉鎖具、および閉鎖孔の内側孔に通す。
- 膣切開を通して挿入された指で套管針の進行を制御する。その先端を肛門挙筋の腱弓にガイドする( 図2 、パネルE)。
- ガイドワイヤーを膣壁切開部に露出させ、対応する同側の頭蓋メッシュアーム( 図2 、パネルF)でそれを負荷する。
- mでロードされたトロカールを引っ張りなさい上記の構造を介してeshの腕。アームを緊張させないでください。
- 動物の反対側の腹側切開を通して第2の頭蓋腕を用いてこのプロセスを繰り返す。
- 背側の切開部の1つを通して、甲状腺筋を通って甲状腺靱帯の遠位に套管針を通す( 図2 、パネルG)。
- ガイドワイヤーを膣切開を通して露出させ、メッシュの背側の腕をつかみ、引き出します。腕を緊張のない状態に保ち、反対側で繰り返します。
- 平らにし、アームに張力をかけることでメッシュの位置を調整しますが、メッシュにはテンションフリーを保ちます ( 図2、パネルI、 図3 )。
- 尾骨の境界の中央にある簡単な中断3/0ポリプロピレン縫合糸でメッシュ本体を固定し、それを周囲の結合組織に固定する。
- 簡単な中断3/0 polyglで皮膚のレベルで腕をカットし、すべての皮膚切開を閉じるエカプロン縫合( 図2 、パネルH)。
- 実行中の3/0 polyglecaprone縫合で膣切開を閉じる。
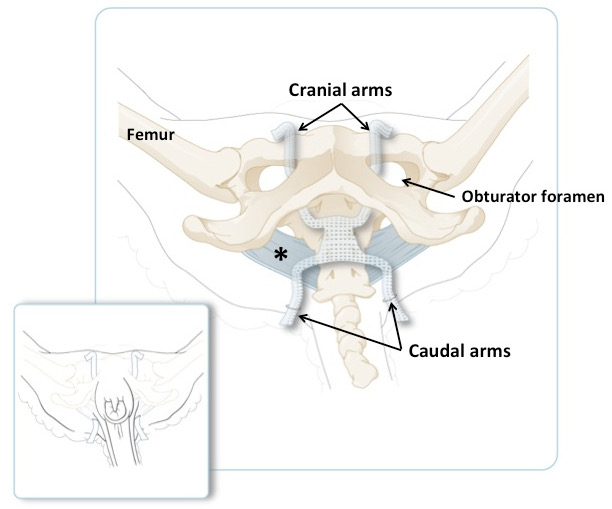
図3:卵管骨盤の模式図。卵管穿孔器を通過する頭蓋腕および尾襞を通る尾枝を含む。幅広い仙骨靱帯は青色である。より小さいパネルは、過剰量の物質を短くする直前に、横臥位にある動物の腕の位置を示す。メインパネルには同じことが示されていますが、皮膚と筋肉が除去されています。
結果
より長い観測設定での管理
外科的処置の後、膣のパッキング(手術直後に膣内に挿入された生理食塩水浸されたガーゼパッケージ)を24時間挿入して、インプラントの位置を固定することができる。ヒツジは回復ケージに入れ、呼吸機能は回復するまで続きます。その後、羊を安定した場所に置くことができ...
ディスカッション
ここでは、アンカーアームの有無にかかわらずインプラントの膣切開および経膣メッシュ挿入を模倣することを目的としたヒツジの実験手順について説明します。その後の工程及び器具はPOPおよび腹圧性尿失禁15、16、19、20に対して行う外科的処置に触発されました。最初の解剖解剖の後、実験?...
開示事項
ヒツジモデルに関するこの研究プログラムは、MedriとBlasingame、Burch、GarrardとAshley(Atlanta GA、USA)の無条件補助金によって支えられました。契約は、ルーベン研究開発譲渡拠点を通じて処理されます。スポンサーは、この実験の計画、実行、または報告に干渉したり、結果を所有したりしていませんでした。 NSとLHは、FP7-フレームワーク(Bip-Upyプロジェクト; NMP3-LA-2012-310389)のECからの助成金の受領者です。 AFは、産学協同プログラム(251356)でECからの助成金によって支援された。
謝辞
我々はIvan Laermans、Rosita Kinart、Ann Lissens(外科技術センター、KU Leuven、Leuven、Belgium)に感謝します。 Jo VerbinnenおよびKristof Reyniers(ベルサールの解剖学、医学部、KU Leuven、Leuven、ベルギー)は、実験中に技術的支援を提供した。データと原稿管理の助けを借りて、Leen Mortierに感謝します。プロトタイプのメッシュを製造し、殺菌し、無条件で研究に寄付するFEG Textiltechnikenに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Animals: | |||
| parous female sheep (45 - 65 kg) | Zoötechnical Institute of the KU Leuven | NA | experimetnal animal |
| Sterile clothing: | |||
| sterile drape 45 x 75 cm | Lohmann & Rauscher, Regensdorf, Germany | 33002 | other material |
| sterile OR drape 150 x 180 cm | Lohmann & Rauscher, Regensdorf, Germany | 33009 | other material |
| sterile glowes 2x | Lohmann & Rauscher, Regensdorf, Germany | 16652 | other material |
| sterile surgical gown 2x | Lohmann & Rauscher, Regensdorf, Germany | 19342 | other material |
| surgical head cap 2x | Lohmann & Rauscher, Regensdorf, Germany | 17427 | other material |
| surgical face mask 2x | Lohmann & Rauscher, Regensdorf, Germany | 11983 | other material |
| Other surgical material | |||
| implant | FEG Textiltechnik GmbH, Aachen, Germany | NA | purposely designed implant |
| 3/0 polypropylene suture | Prolene, Ethicon, Diegem, Belgium | 8762H | suture material |
| 3/0 polygecaprone suture | Vicryl, Ethicon | J311H | suture material |
| gauze swabs 10 x 10 cm 10x, 12-ply | Lohmann & Rauscher, Regensdorf, Germany | 11574 | other material |
| syringe 20 mL | Becton Dickinsosn S.A., Madrid, Spain | 300613 | aqua-dissection |
| needle 16 gauge | Terumo, Leuven, Belgium | NN-2238R | aqua-dissection |
| Surgical equipment: | |||
| blade no.22 | Fine science isntruments, Heidelberg, Germany | 10022-00 | surgical instruments |
| Allis tissue forceps 1x | Fine science isntruments, Heidelberg, Germany | 11091-15 | surgical instruments |
| Standart pattern forceps 1x2 theeth 1x | Fine science isntruments, Heidelberg, Germany | 11023-14 | surgical instruments |
| Standart pattern forceps straight serrated 1x | Fine science isntruments, Heidelberg, Germany | 11000-14 | surgical instruments |
| Scalpel handle 1x | Fine science isntruments, Heidelberg, Germany | 10004-13 | surgical instruments |
| Halstead-Mosquito forceps 2x | Fine science isntruments, Heidelberg, Germany | 13008-12 | surgical instruments |
| Standart pattern scissors 1x | Fine science isntruments, Heidelberg, Germany | 14001-14 | surgical instruments |
| Metzenbaum scissors 1x | Fine science isntruments, Heidelberg, Germany | 14016-18 | surgical instruments |
| Crile Wood needle holder 1x | Fine science isntruments, Heidelberg, Germany | 12003-15 | surgical instruments |
| Kell forceps 1x | Fine science isntruments, Heidelberg, Germany | 13018-14 | surgical instruments |
| Long Starr Self-Retaining Retractor with eight 5mm sharp stay hooks | Cooper Surgical, Tumbull, USA | 3704 | surgical instruments |
| Heaney Simon Vaginal Retractor | Medical supplies & equipments co., Katy, Texas, USA | 403-129FSI | surgical instruments |
| Trocar (Insnare) | Bard, West Sussex, United Kingdom | NA | any trocar on market for transvaginal mesh implantation |
| Medication: | |||
| amoxilicilline clavulanate 1000mg / 300 mL (Ampiciline) | GSK, Wavre, Belgium | NA | antibiotics |
| buprenorfin 0.3 mg/mL + chlorocresol 1.35 mg/mL (Vetregesic) | Ecuphar, Oostkamp, Belgium | NA | analgesia |
| ketamin HCL 100mg/mL (Ketamine 1000) | Ceva Sante Animale, Brussels, Belgium | NA | anesthesia |
| isoflurane (IsoFlo) | Abbott Laboratories Ltd, Maidenhead, Berkshire, UK | NA | anesthesia |
| polyvidone iodium 7.5% (Braunol) | B. Braun Medical, Machelen, Belgium | NA | local desinfection |
| saline solution 500ml | B. Braun Medical, Machelen, Belgium | NA | aqua-dissection |
| Xxylazine HCl , 1 mL/50 kg | Vexylan, Ceva Sante Animale, Belgium | NA | premedication |
| atropine Sulfate 15 mg/ml (), | Viatris, Belgium | NA | premedication |
参考文献
- Glazener, C., et al. Childbirth and prolapse: Long-term associations with the symptoms and objective measurement of pelvic organ prolapse. BJOG An Int. J. Obstet. Gynaecol. 120 (2), 161-168 (2013).
- Jia, X., et al. Efficacy and safety of using mesh or grafts in surgery for anterior and/or posterior vaginal wall prolapse: systematic review and meta-analysis. BJOG. 115 (11), 1350-1361 (2008).
- Maher, C., et al. Transvaginal mesh or grafts compared with native tissue repair for vaginal prolapse. Review. 2 (2), 10-13 (2016).
- Nieminen, K., et al. Outcomes after anterior vaginal wall repair with mesh: a randomized, controlled trial with a 3 year follow-up. Am. J. Obstet. Gynecol. 203 (3), e1-e8 (2010).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: a review. Eur. J. Obstet. Gynecol. Reprod. Biol. 144, S146-S158 (2009).
- Couri, B., Lenis, A., Borazjani, A., Paraiso, M. F. R., Damaser, M. S. Animal models of female pelvic organ prolapse: lessons learned. Expert Rev. Obs. Gynecol. 7 (3), 249-260 (2012).
- Deprest, J., et al. The biology behind fascial defects and the use of implants in pelvic organ prolapse repair. Int. Urogynecol. J. Pelvic Floor Dysfunct. 17, S16-S25 (2006).
- Ozog, Y., Mazza, E., De Ridder, D., Deprest, J. Biomechanical effects of polyglecaprone fibers in a polypropylene mesh after abdominal and rectovaginal implantation in a rabbit. Int. Urogynecol. J. 23 (10), 1397-1402 (2012).
- Manodoro, S., et al. Graft-related complications and biaxial tensiometry following experimental vaginal implantation of flat mesh of variable dimensions. BJOG. 120 (2), 244-250 (2013).
- Endo, M., et al. Cross-linked xenogenic collagen implantation in the sheep model for vaginal surgery. Gynecol. Surg. , 113-122 (2015).
- Feola, A., et al. Host reaction to vaginally inserted collagen containing polypropylene implants in sheep. Am. J. Obstet. Gynecol. 212 (4), e1-e474 (2015).
- Barnhart, K. T., et al. Baseline dimensions of the human vagina. Hum. Reprod. 21 (6), 1618-1622 (2006).
- Tayrac, R., Alves, A., Thérin, M. Collagen-coated vs noncoated low-weight polypropylene meshes in a sheep model for vaginal surgery. A pilot study. Int. Urogynecol. J. Pelvic Floor Dysfunct. 18 (5), 513-520 (2007).
- Sobiraj, A., Busse, G., I, H. B. O. S. E. D. Ivastigation into the blood plasma profiles progesterone in sheep sufferingform vaignal inversion and prolapse. Br. Vet. J. 142 (142), 218-223 (1986).
- Reisenauer, C., Kirschniak, A., Drews, U., Wallwiener, D. Anatomical conditions for pelvic floor reconstruction with polypropylene implant and its application for the treatment of vaginal prolapse. Eur. J. Obstet. Gynecol. Reprod. Biol. 131, 214-225 (2007).
- Carey, M., Slack, M., Higgs, P., Wynn-Williams, M., Cornish, A. Vaginal surgery for pelvic organ prolapse using mesh and a vaginal support device. BJOG An Int. J. Obstet. Gynaecol. 115 (3), 391-397 (2008).
- Urbankova, I., et al. Comparative anatomy of the ovine and female pelvis. Gynecol. Obstet. Invest. , (2016).
- Maurer, M. M., Röhrnbauer, B., Feola, a., Deprest, J., Mazza, E. Mechanical biocompatibility of prosthetic meshes: A comprehensive protocol for mechanical characterization. J. Mech. Behav. Biomed. Mater. 40, 42-58 (2014).
- Leval, J. Novel Surgical Technique for the Treatment of Female Stress Urinary Incontinence. Transobturator Vaginal Tape Inside-Out. Eur. Urol. 44 (6), 724-730 (2003).
- Reisenauer, C., Kirschniak, A., Drews, U., Wallwiener, D. Transobturator vaginal tape inside-out. Eur. J. Obstet. Gynecol. Reprod. Biol. 127 (1), 123-129 (2006).
- Bafghi, A., et al. Bowel perforation as late complication of tension-free vaginal tape. J Gynecol Obs. Biol Reprod. 34 (6), 606-607 (2005).
- Hinoul, P., Vanormelingen, L., Roovers, J. P., de Jonge, E., Smajda, S. Anatomical variability in the trajectory of the inside-out transobturator vaginal tape technique (TVT-O). Int. Urogynecol. J. Pelvic Floor Dysfunct. 18 (10), 1201-1206 (2007).
- Schaller, O., et al. . Illustrated Veterinary Anatomical Nomenclature. , (2007).
- . Serious Complications Associated with Transvaginal Placement of Surgical Mesh for Pelvic Organ Prolapse. FDA Safety Communication. , (2016).
- Reinier, M., Groep, G. Final Opinion on the use of meshes in urogynecological surgery. SCENIHR- European Commission. , (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved