È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Inserimento del tessuto transvaginale nel modello ovino
In questo articolo
Riepilogo
Questo protocollo descrive l'impianto di mesh nella sepoltura retto-vaginale ovina usando una singola tecnica di incisione vaginale, con e senza l'inserimento guidato in trocchie di bracci di ancoraggio.
Abstract
Questo protocollo descrive l'inserimento della mesh nel setto rettovaginale delle pecore utilizzando una singola tecnica di incisione vaginale, con e senza l'inserimento guidato in trocchie di bracci di ancoraggio. Le pecorelle parose subirono la dissezione del setto rettovaginale, seguita dall'inserimento di un impianto con o senza quattro bracci di ancoraggio, entrambi progettati per adattarsi all'anatomia ovina. Le braccia di ancoraggio sono state messe in atto usando un trocar e una tecnica "fuori-in". Le braccia del cranio furono passate attraverso i muscoli dell'otturatore, del gracilis e del adductor magnus. Le braccia caudali erano fissate vicino al legamento sacrotubero, attraverso i muscoli del coccige. Questa tecnica consente di imitare le procedure chirurgiche eseguite in donne affette da prolasso dell'organo pelvico. Gli spazi e gli elementi anatomici sono facilmente identificabili. La parte più critica della procedura è l'inserimento del trocar cranico, che può penetrare facilmente nella cavità peritoneale o negli organi pelvici circostanti. ThiS può essere evitato da una più estesa dissezione retroperitoneale e guidando il trocar più lateralmente. Questo approccio è stato progettato solo per il test sperimentale di nuovi impianti in grandi modelli animali, in quanto l'inserzione guidata con trocar non è attualmente utilizzata clinicamente.
Introduzione
Il prolasso dell'organo pelvico è clinicamente diagnosticato in metà delle donne che avevano almeno una consegna vaginale, ma soggettivamente, mette in pericolo la metà delle donne in generale 1 . La base della terapia è la ricostruzione chirurgica utilizzando tessuti naturali o materiali per l'impianto, ma ognuno di questi metodi ha le sue limitazioni, tra cui ricorrenza o complicazioni locali 2 , 3 , 4 . L'impianto ideale non è ancora stato identificato; Pertanto, esiste una continua domanda di innovazione di prodotto e lo sviluppo di una corretta pipeline per la sperimentazione preclinica prima dell'introduzione sul mercato di nuovi prodotti e tecniche. Uno dei passaggi in questa traccia è la valutazione sperimentale su modelli animali appropriati 5 , 6 . Idealmente, dovrebbero imitare gli ambienti anatomici, biomeccanici e biologici. Quando si tratta di thE valutazione sperimentale di nuovi impianti, essi vengono tipicamente testati in modelli più piccoli, sia per la biocompatibilità che per la ricostruzione di difetti della parete addominale. Quel tipo di esperimenti è stato criticato, perché gli impianti non sono inseriti nell'area di interesse ( cioè la vagina) 7 . I modelli di chirurgia vaginale sono più scarsi, certamente quando l'obiettivo dell'esperimento è quello di documentare le caratteristiche biomeccaniche degli esplanti. Per questo motivo, ci sono stati movimenti da conigli a pecora 8 . Le pecore adulte sono modelli animali di grandi dimensioni con una vagina ragionevolmente dimensionata e accessibile. Possono essere utilizzati per la valutazione a medio termine di nuovi impianti, ed è possibile riprodurre esposizioni vaginali con alcuni materiali 9 , 10 , 11 , 12 , 13 . Non solo le dimensioni e l'anatomiaDella vagina ovina e del pavimento pelvico sono paragonabili a quelle dell'uomo, ma anche la comparsa spontanea del prolasso, che si verifica nel 15% delle pecore. I fattori di rischio del prolasso sono sovrapposti ( cioè, multiparità, storia precedente del POP, pressione intra-addominale aumentata indotta da un peso corporeo maggiore o quando pascolano sulle colline e effetti comparabili degli estrogeni (fito) 6 , 14) . In Europa, le pecore sono l'unica alternativa ragionevole, poiché la ricerca sui primati non umani è stata quasi completamente vietata. Qui il modello è stato fatto un passo avanti imitando l'inserzione transvaginale degli impianti usando trocars e guide per il posizionamento senza tensione delle maglie nel setto recto-vaginale. Questo è stato seguito da fissare l'impianto utilizzando l'ancoraggio con le braccia attraverso i legamenti dei muscoli, che può essere considerato equivalente alla pratica clinica 15 , 16 . Finora, questa tecnicaNon è stato studiato, anche se molti ritengono che possono verificarsi complicazioni specifiche a causa dell'uso di queste strisce più lunghe e / o del piercing delle strutture anatomiche.
In un precedente studio anatomico dettagliato, il pavimento pelvico ovino è stato confrontato con il bacino femminile 17 . Quando si tratta di ancorare l'impianto, le pecore non hanno il legame sacrospinoso, ma hanno un legame molto ben sviluppato e ampio sacrotubero. Il nervo pudendale corre ventralmente su di esso, rendendo ingiustificato l'utilizzo di questo punto di riferimento come punto di sospensione. Al contrario, il muscolo coccigeo e la sua fascia, così come la membrana dell'otturatore, sono accessibili attraverso lo spazio rettovaginale. Qui si propone l'accesso e la posizione delle strutture anatomiche per la fissazione delle armi di ancoraggio. Gli strumenti che possono essere utilizzati per posizionare la maglia sono discussi. Infine, il rapporto tra le braccia o trocars ad strutture anatomiche adiacenti, quali vasi e nervi, aE come possibili complicazioni intraoperatorie, sono anche descritte.
Protocollo
L'approvazione etica per questo esperimento è stata ottenuta dal Comitato Etico sulla sperimentazione animale del KU Leuven (P065 / 2013). Gli animali sono stati trattati in conformità alle attuali norme nazionali in materia di benessere degli animali.
1. Materiale e animale sperimentale
- Preparazione chirurgica
- Nel teatro chirurgico coprire un tavolo con un drappo sterile e preparare un sterile triangolo curvo ( figura 1 , pannello A), sterili strumenti chirurgici, suture e garza sterile. Eseguire l'intera procedura chirurgica in condizioni sterili se l'esperimento include il follow-up. Posizionare tutti gli strumenti sul tavolo per essere pronti per l'uso durante l'intervento chirurgico.
- Rimuovere un impianto rettangolare sterile e / o un impianto con bracci di ancoraggio dal pacchetto sterile e metterli sul tavolo coperto di drappo sterile ( Figura 1B , C e D ).
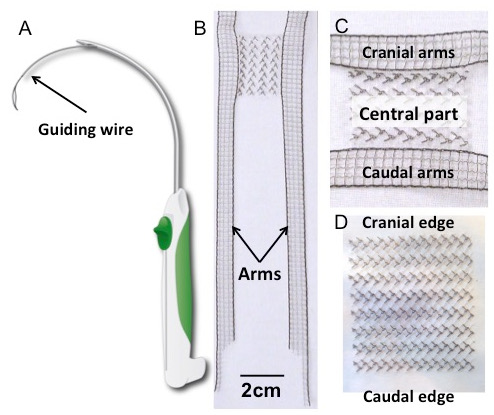
Figura 1: Trocar e impianti. ( A ) Schema del trocar. ( B ) Impianto a polivinilide fluoruro a forma di H (PVDF), con un particolare della parte centrale (pannello C ). La sua forma è stata ispirata dalle mesh a quattro bracci attualmente disponibili per la riparazione delle prolasse transvaginali. Il corpo rettangolare (30 x 40 mm 2 ) è esteso lateralmente da quattro braccia distese (150 x 10 mm 2 ). Le dimensioni delle braccia sono progettate per essere sufficientemente lunghe per forare le relative strutture di sospensione, basate su precedenti studi anatomici 17 . ( D ) L'impianto rettangolare (30 x 40 mm 2 ). Entrambi gli impianti erano fatti di polivinilidene fluoruro; Le caratteristiche e le proprietà tessili sono riportate nella tabella 1 .
- Animale sperimentale (EwE, 45-60 kg)
- Amministrare la premedicazione di 1 ml di solfato di atropina da 15 mg / mL e di 1 ml / 50 kg di xilazina HCl per via intramuscolare (im) 30 minuti prima della procedura chirurgica.
- Dopo 30 minuti, assicurati che la premedicazione abbia fatto delle pecore letargiche e sonnecchie.
- Inserire un catetere per via endovenosa nella vena jugulare e somministrare 0,075 ml / kg di ketamina 100 mg / ml HCl. Confermare l'anestesia profonda osservando la mancanza di reazione a stimoli dolorosi.
- Spostare l'animale sul tavolo chirurgico e proteggere le vie aeree per intubazione. Mantenere l'anestesia con 2,5% di isoflurano in 5 L / min di ossigeno.
- Tenere la linea endovenosa inserita nella vena jugulare e fornire 500 ml di soluzione salina a una portata di 150 ml / h.
- Amministrare antibiotici profilattici im (amoxicillin clavulanate, 7 mg / kg) e analgesici postoperatori (buprenorfina e clorocresolo, 1 mL) o l'equivalente secondo protocolli locali.
- Posizionare l'animale in illuminatoPosizione calda sulla parte inferiore del tavolo chirurgico e fissare le membra, con i fianchi in iper-flessione, utilizzando le funi ( figura 2 , pannello A).
- Rimuovere manualmente la vescica e il retto facendoli trascinare vaginalmente.
- Rasare il perineo, la parte mediale della coscia e le pieghe di coda e disinfettare con il polyvidone iodio 7,5% ( Figura 2 , pannello B e C).
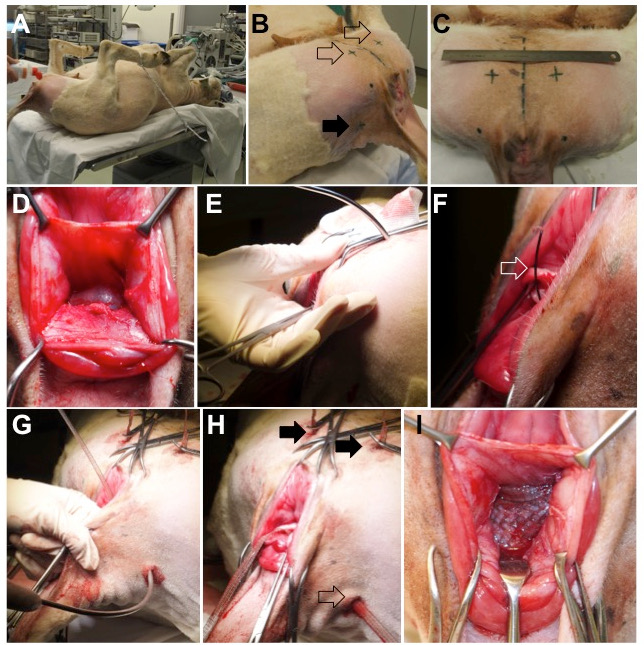
Figura 2: Chirurgia animale. ( A ) Una pecora posta in posizione supina, con i fianchi iper-flessibili fissando gli arti inferiori. ( B ) I punti di ingresso esterni per l'inserimento del trocar si trovano sul lato ventrale (freccia vuota) e dorsalmente sulle pieghe laterali (freccia piena). ( C ) Posizione dei punti di inserimento ventrale; La linea tratteggiata al centro rappresentaIl piano midsagittale dell'animale. ( D ) setto rectovaginal dissezione. ( E ) Inserimento del trocar ventrale attraverso i muscoli sul lato mediale della coscia, l'oblò dell'otturatore e lo spazio paravaginale. La traiettoria del trocar piercing è controllata con il dito. ( F e G ) Una volta che il trocar è in posizione, la fionda del filo (freccia aperta) è avanzata e caricata con il braccio della maglia vaginale. ( H ) Posizione finale delle braccia ventrale (frecce complete) e dorsale (freccia vuota). ( I ) La parte centrale è posta senza tensione tra la parete vaginale e l'adventite rettale.
- Preparare il personale ad un intervento chirurgico in condizioni sterili. Mettete un cappuccio e una maschera bocca chirurgica, lavi le mani per la chirurgia e metta un abito chirurgico e guanti sterili.
- Coprire l'animale con un drappo sterile e fare un'apertura sopra il genitaleiato.
2. Procedura chirurgica
- Preparazione del setto rettrodaginale
- Afferrare la parete vaginale dorsale 3 cm cranica all'anello di allenamento usando le pinze Allis.
- Prendere una siringa caricata con 10 ml di soluzione salina e dotata di un ago da 22 G. Inserirlo attraverso l'epitelio vaginale (circa 3 - 4 mm di profondità) e nella mediana del setto rettovaginale, 1,5 cm cranico all'anello hymeneal.
- Eseguire la "dissezione aqua" iniettando salina nel setto rettrodaginale 11 .
- Effettuare una incisione mediana di 3 cm lungo l'epitelio vaginale, iniziando caudale alla pinza Allis (punto 2.1.1) e termina all'anello hineale utilizzando un bisturi. Entra nello spazio retto-vaginale attraverso questa incisione.
- Posizionare il retrattore di ritenuta (vedere la tabella dei materiali ) sopra il perineo e posizionare quattro ganci di taglio appuntiti nell'incisione vaginale per mantenerlo aperto.
- Con il dito sbatte leggermente la fascia recto-vagina dalla parete vaginale lateralmente verso le pareti laterali pelviche e cranialmente fino all'aspetto caudale del cul-de-sac. Creare uno spazio adeguato per la parte centrale della maglia di 30 x 40 mm 2 ( Figura 2 , pannello D).
- Effettuare l'emostasi con pinze emostatiche o una legatura emostatica crisscross ogni volta che sia necessario.
NOTA: Piccoli sfiati possono essere bloccati con le pinze emostatiche. Questo frantuma il vaso e inizia la naturale cascata di coagulazione. Per sanguinamento più forte, afferrare il vaso sanguinante con le pinze e posizionare una legatura crisscross, assicurandola con un nodo quadrato. A questo punto si può inserire l'impianto rettangolare (punto 2.2) oppure continuare con la dissezione per inserire l'impianto con bracci di ancoraggio (punto 2.3).
- Inserimento in rete piatta
- Inserire il retrattore vaginale nell'incisione vaginale per consentire una migliore visioneLa parte cranica dell'area dissected.
- Sutura l'angolo cranico sinistro e destro dell'impianto con una semplice sutura in polipropilene 3/0 interrotta sui lati sinistro e destro dell'aspetto più cranico dello spazio retato-vaginale dissected. Tagliare il materiale residuo di sutura. Tenere la sutura lontana dal lumen vaginale ( cioè non penetrare nella parete vaginale).
NOTA: L'impianto è sempre suturato al tessuto connettivo che comprende il setto retto-vaginale. La parete vaginale non è penetrata se il materiale di sutura non può essere visto nella vagina. - Aggiungere un'altra semplice sutura interrotta a metà lungo l'aspetto cranico dell'impianto.
- Sutura i bordi laterali dell'impianto a metà strada sul tessuto connettivo circostante con un semplice polipropilene 3/0 interrotto. Mantenere l'impianto più piatto possibile e privo di tensione.
- Sutura gli angoli caudali sinistro e destro con semplici suture in polipropilene 3/0 interrotte a sinistra ea destraLati dell'aspetto più caudale dello spazio rettovaginale.
- Aggiungere un'altra semplice sutura interrotta a metà lungo l'aspetto caudale dell'impianto.
- Chiudere le incisioni vaginali con una sutura da 3/0 di poliglatta.
- Inserimento e ancoraggio dell'impianto con le braccia (tecnica guidata da trocar).
- Continuare la dissezione dello spazio recto-vaginale creato nel passo 2.1 cranio-ventrally per raggiungere l'aspetto mediale del foramen dell'otturatore, che può facilmente essere palpato.
- Dissectare lo spazio caudo-lateralmente per raggiungere l'aspetto caudale del legamento sacrotuberoso e del muscolo coccigeo caudale.
- Con un no. 24, fanno quattro incisioni di 1 cm sul lato vulvo, tagliando la pelle e la fascia muscolare superficiale ( Figura 2 , pannello B e C).
- Fare due incisioni "ventrali" sull'aspetto mediale della coscia, circa 4 cm dal cranio caudale oL'arco sciatico ( cioè il bordo inferiore della sinfisi) e 3 cm laterali dalla linea mediana ( Figura 2 , pannello C).
- Effettuare due incisioni "dorsali" a livello di inserimento delle pieghe di coda, mediali di 2 cm al ischiadicum del tubero, facilmente palpabili ( Figura 2 , pannello B).
- Posizionare un trocar curvo attraverso una delle incisioni ventrali ( figura 2 , pannello E).
- Passare il trocar attraverso il muscolo adductor magnus, l'otturatore esterno e l'aspetto mediale dell'otturatore dell'otturatore.
- Controlla la progressione del trocar con un dito inserito attraverso l'incisione vaginale. Guida la sua punta all'arco tendinoso del muscolo levator ani ( figura 2 , pannello E).
- Esporre il filo di guida nell'incisione della parete vaginale e caricarla con il corrispondente braccio della rete cranica ipsilaterale ( figura 2 , pannello F).
- Tirare il trocar caricato con il mBraccio attraverso le strutture di cui sopra. Mantenere il braccio senza tensione.
- Ripetere il processo con il secondo braccio cranico attraverso l'incisione ventrale sull'altro lato dell'animale.
- Attraverso una incisione dorsale, passare il trocar attraverso il muscolo coccige, appena distale al legamento sacrotubero ( Figura 2 , pannello G).
- Esporre il filo di guida attraverso l'incisione vaginale, afferrare il braccio dorsale della maglia e tirarlo fuori. Tenere il braccio senza tensione e ripetere l'altro lato.
- Regolare la posizione della maglia appiattendola e applicando tensione alle braccia, ma mantenga la tensione senza tensione ( Figura 2, pannello I, Figura 3 ).
- Fissare il corpo della maglia con una semplice sutura in polipropilene 3/0 interrotta al centro del suo bordo caudale, fissandola al tessuto connettivo circostante.
- Tagliare le braccia al livello della pelle e chiudere tutte le incisioni cutanee con un semplice 3/0 polygl interrottoSuture ecaprone ( figura 2 , pannello H).
- Chiudere l'incisione vaginale con una sutura a croce 3/0.
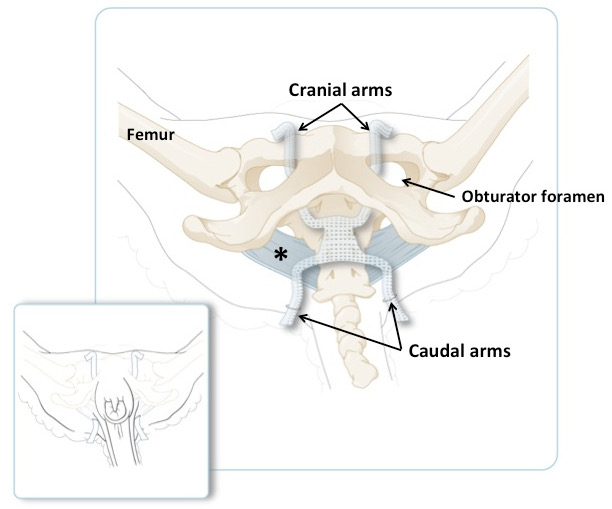
Figura 3: Illustrazione schematica del pelvi ovine, con le braccia craniche che attraversano il Foramen dell'otturatore e le braccia caudali che attraversano le pieghe di coda. Il largo legamento sacrotubero è in blu. Il pannello più piccolo illustra la posizione delle braccia su un animale in posizione di recupero, poco prima di accorciare l'eccessiva quantità di materiale. Il pannello principale mostra lo stesso ma con la pelle ei muscoli rimossi.
Risultati
Gestione in un programma di osservazione più lunga
Dopo la procedura chirurgica, l'imballaggio vaginale (un pacchetto di garza imbevuto di soluzione salina-inserito nella vagina subito dopo l'intervento) può essere inserito per 24 h per assicurare la posizione dell'impianto. Le pecore dovrebbero essere collocate in una gabbia di recupero e la sua funzione respiratoria è seguita fino al completo ...
Discussione
Qui descriviamo una procedura sperimentale in pecora, mirata a simulare la dissezione vaginale e l'inserimento della maglia transvaginale di un impianto con o senza bracci di ancoraggio. I passi e gli strumenti successivi sono stati ispirati alle procedure chirurgiche effettuate per il POP e l'incontinenza urinaria da stress 15 , 16 , 19 , 20 . Dopo le dissezioni anatomiche iniziali, c...
Divulgazioni
Questo programma di ricerca sul modello ovino è stato sostenuto da una sovvenzione incondizionata da Medri e Blasingame, Burch, Garrard e Ashley (Atlanta GA, USA). Gli accordi sono gestiti tramite l'ufficio di trasferimento Leuven Research and Development. Gli sponsor non hanno interferito con la pianificazione, l'esecuzione o la segnalazione di questo esperimento, né hanno i risultati. NS e LH sono destinatari di una sovvenzione della CE nel quadro FP7 (progetto Bip-Upy, NMP3-LA-2012-310389). AF è stato sostenuto da una sovvenzione della CE nel programma di partenariato industria-accademico (251356).
Riconoscimenti
Ringraziamo Ivan Laermans, Rosita Kinart, Ann Lissens (Centro per le tecnologie chirurgiche, KU Leuven, Leuven, Belgio). Jo Verbinnen e Kristof Reyniers (Vesalius Institute of Anatomy, Facoltà di Medicina, KU Leuven, Leuven, Belgio) hanno fornito supporto tecnico durante l'esperimento. Ringraziamo Leen Mortier per l'aiuto con i dati e la gestione del manoscritto. Ringraziamo FEG Textiltechniken per la produzione di maglie prototipali, sterilizzandole e donandole incondizionatamente per la ricerca.
Materiali
| Name | Company | Catalog Number | Comments |
| Animals: | |||
| parous female sheep (45 - 65 kg) | Zoötechnical Institute of the KU Leuven | NA | experimetnal animal |
| Sterile clothing: | |||
| sterile drape 45 x 75 cm | Lohmann & Rauscher, Regensdorf, Germany | 33002 | other material |
| sterile OR drape 150 x 180 cm | Lohmann & Rauscher, Regensdorf, Germany | 33009 | other material |
| sterile glowes 2x | Lohmann & Rauscher, Regensdorf, Germany | 16652 | other material |
| sterile surgical gown 2x | Lohmann & Rauscher, Regensdorf, Germany | 19342 | other material |
| surgical head cap 2x | Lohmann & Rauscher, Regensdorf, Germany | 17427 | other material |
| surgical face mask 2x | Lohmann & Rauscher, Regensdorf, Germany | 11983 | other material |
| Other surgical material | |||
| implant | FEG Textiltechnik GmbH, Aachen, Germany | NA | purposely designed implant |
| 3/0 polypropylene suture | Prolene, Ethicon, Diegem, Belgium | 8762H | suture material |
| 3/0 polygecaprone suture | Vicryl, Ethicon | J311H | suture material |
| gauze swabs 10 x 10 cm 10x, 12-ply | Lohmann & Rauscher, Regensdorf, Germany | 11574 | other material |
| syringe 20 mL | Becton Dickinsosn S.A., Madrid, Spain | 300613 | aqua-dissection |
| needle 16 gauge | Terumo, Leuven, Belgium | NN-2238R | aqua-dissection |
| Surgical equipment: | |||
| blade no.22 | Fine science isntruments, Heidelberg, Germany | 10022-00 | surgical instruments |
| Allis tissue forceps 1x | Fine science isntruments, Heidelberg, Germany | 11091-15 | surgical instruments |
| Standart pattern forceps 1x2 theeth 1x | Fine science isntruments, Heidelberg, Germany | 11023-14 | surgical instruments |
| Standart pattern forceps straight serrated 1x | Fine science isntruments, Heidelberg, Germany | 11000-14 | surgical instruments |
| Scalpel handle 1x | Fine science isntruments, Heidelberg, Germany | 10004-13 | surgical instruments |
| Halstead-Mosquito forceps 2x | Fine science isntruments, Heidelberg, Germany | 13008-12 | surgical instruments |
| Standart pattern scissors 1x | Fine science isntruments, Heidelberg, Germany | 14001-14 | surgical instruments |
| Metzenbaum scissors 1x | Fine science isntruments, Heidelberg, Germany | 14016-18 | surgical instruments |
| Crile Wood needle holder 1x | Fine science isntruments, Heidelberg, Germany | 12003-15 | surgical instruments |
| Kell forceps 1x | Fine science isntruments, Heidelberg, Germany | 13018-14 | surgical instruments |
| Long Starr Self-Retaining Retractor with eight 5mm sharp stay hooks | Cooper Surgical, Tumbull, USA | 3704 | surgical instruments |
| Heaney Simon Vaginal Retractor | Medical supplies & equipments co., Katy, Texas, USA | 403-129FSI | surgical instruments |
| Trocar (Insnare) | Bard, West Sussex, United Kingdom | NA | any trocar on market for transvaginal mesh implantation |
| Medication: | |||
| amoxilicilline clavulanate 1000mg / 300 mL (Ampiciline) | GSK, Wavre, Belgium | NA | antibiotics |
| buprenorfin 0.3 mg/mL + chlorocresol 1.35 mg/mL (Vetregesic) | Ecuphar, Oostkamp, Belgium | NA | analgesia |
| ketamin HCL 100mg/mL (Ketamine 1000) | Ceva Sante Animale, Brussels, Belgium | NA | anesthesia |
| isoflurane (IsoFlo) | Abbott Laboratories Ltd, Maidenhead, Berkshire, UK | NA | anesthesia |
| polyvidone iodium 7.5% (Braunol) | B. Braun Medical, Machelen, Belgium | NA | local desinfection |
| saline solution 500ml | B. Braun Medical, Machelen, Belgium | NA | aqua-dissection |
| Xxylazine HCl , 1 mL/50 kg | Vexylan, Ceva Sante Animale, Belgium | NA | premedication |
| atropine Sulfate 15 mg/ml (), | Viatris, Belgium | NA | premedication |
Riferimenti
- Glazener, C., et al. Childbirth and prolapse: Long-term associations with the symptoms and objective measurement of pelvic organ prolapse. BJOG An Int. J. Obstet. Gynaecol. 120 (2), 161-168 (2013).
- Jia, X., et al. Efficacy and safety of using mesh or grafts in surgery for anterior and/or posterior vaginal wall prolapse: systematic review and meta-analysis. BJOG. 115 (11), 1350-1361 (2008).
- Maher, C., et al. Transvaginal mesh or grafts compared with native tissue repair for vaginal prolapse. Review. 2 (2), 10-13 (2016).
- Nieminen, K., et al. Outcomes after anterior vaginal wall repair with mesh: a randomized, controlled trial with a 3 year follow-up. Am. J. Obstet. Gynecol. 203 (3), e1-e8 (2010).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: a review. Eur. J. Obstet. Gynecol. Reprod. Biol. 144, S146-S158 (2009).
- Couri, B., Lenis, A., Borazjani, A., Paraiso, M. F. R., Damaser, M. S. Animal models of female pelvic organ prolapse: lessons learned. Expert Rev. Obs. Gynecol. 7 (3), 249-260 (2012).
- Deprest, J., et al. The biology behind fascial defects and the use of implants in pelvic organ prolapse repair. Int. Urogynecol. J. Pelvic Floor Dysfunct. 17, S16-S25 (2006).
- Ozog, Y., Mazza, E., De Ridder, D., Deprest, J. Biomechanical effects of polyglecaprone fibers in a polypropylene mesh after abdominal and rectovaginal implantation in a rabbit. Int. Urogynecol. J. 23 (10), 1397-1402 (2012).
- Manodoro, S., et al. Graft-related complications and biaxial tensiometry following experimental vaginal implantation of flat mesh of variable dimensions. BJOG. 120 (2), 244-250 (2013).
- Endo, M., et al. Cross-linked xenogenic collagen implantation in the sheep model for vaginal surgery. Gynecol. Surg. , 113-122 (2015).
- Feola, A., et al. Host reaction to vaginally inserted collagen containing polypropylene implants in sheep. Am. J. Obstet. Gynecol. 212 (4), e1-e474 (2015).
- Barnhart, K. T., et al. Baseline dimensions of the human vagina. Hum. Reprod. 21 (6), 1618-1622 (2006).
- Tayrac, R., Alves, A., Thérin, M. Collagen-coated vs noncoated low-weight polypropylene meshes in a sheep model for vaginal surgery. A pilot study. Int. Urogynecol. J. Pelvic Floor Dysfunct. 18 (5), 513-520 (2007).
- Sobiraj, A., Busse, G., I, H. B. O. S. E. D. Ivastigation into the blood plasma profiles progesterone in sheep sufferingform vaignal inversion and prolapse. Br. Vet. J. 142 (142), 218-223 (1986).
- Reisenauer, C., Kirschniak, A., Drews, U., Wallwiener, D. Anatomical conditions for pelvic floor reconstruction with polypropylene implant and its application for the treatment of vaginal prolapse. Eur. J. Obstet. Gynecol. Reprod. Biol. 131, 214-225 (2007).
- Carey, M., Slack, M., Higgs, P., Wynn-Williams, M., Cornish, A. Vaginal surgery for pelvic organ prolapse using mesh and a vaginal support device. BJOG An Int. J. Obstet. Gynaecol. 115 (3), 391-397 (2008).
- Urbankova, I., et al. Comparative anatomy of the ovine and female pelvis. Gynecol. Obstet. Invest. , (2016).
- Maurer, M. M., Röhrnbauer, B., Feola, a., Deprest, J., Mazza, E. Mechanical biocompatibility of prosthetic meshes: A comprehensive protocol for mechanical characterization. J. Mech. Behav. Biomed. Mater. 40, 42-58 (2014).
- Leval, J. Novel Surgical Technique for the Treatment of Female Stress Urinary Incontinence. Transobturator Vaginal Tape Inside-Out. Eur. Urol. 44 (6), 724-730 (2003).
- Reisenauer, C., Kirschniak, A., Drews, U., Wallwiener, D. Transobturator vaginal tape inside-out. Eur. J. Obstet. Gynecol. Reprod. Biol. 127 (1), 123-129 (2006).
- Bafghi, A., et al. Bowel perforation as late complication of tension-free vaginal tape. J Gynecol Obs. Biol Reprod. 34 (6), 606-607 (2005).
- Hinoul, P., Vanormelingen, L., Roovers, J. P., de Jonge, E., Smajda, S. Anatomical variability in the trajectory of the inside-out transobturator vaginal tape technique (TVT-O). Int. Urogynecol. J. Pelvic Floor Dysfunct. 18 (10), 1201-1206 (2007).
- Schaller, O., et al. . Illustrated Veterinary Anatomical Nomenclature. , (2007).
- . Serious Complications Associated with Transvaginal Placement of Surgical Mesh for Pelvic Organ Prolapse. FDA Safety Communication. , (2016).
- Reinier, M., Groep, G. Final Opinion on the use of meshes in urogynecological surgery. SCENIHR- European Commission. , (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon